Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Visualisierung der mitochondrialen Atmungskette Funktion mit Cytochrom C Oxidase / Succinat-Dehydrogenase (COX / SDH) Double-Kennzeichnung Histochemie
In diesem Artikel
Zusammenfassung
Die Cytochrom-c-Oxidase / Natrium-Dehydrogenase (COX / SDH) Doppel-Kennzeichnung Methode erlaubt die direkte Visualisierung der mitochondrialen Atmungskette Enzymmangel in frisch-gefrorenen Gewebeschnitten. Dies ist eine einfache histochemische Technik und ist nützlich bei der Untersuchung mitochondrialer Krankheiten, Alterung und altersbedingte Erkrankungen.
Zusammenfassung
Mitochondriale DNA (mtDNA) Mängel sind eine wichtige Ursache von Krankheit und kann zugrunde liegen, Alterung und altersbedingte Veränderungen 1,2. Die mitochondrialen Theorie des Alterns legt eine Rolle für die Mutationen der mtDNA, die Bioenergetik Homöostase und zelluläre Funktion zu ändern, in dem Alterungsprozess 3 können. Eine Fülle von Beweisen zur Stützung dieser Theorie 1,4, ein Beispiel ist die mtDNA Mutator Maus 5 zusammengestellt worden, jedoch ist die genaue Rolle von mtDNA Schaden in alternden nicht ganz verstanden 6,7.
Die Beobachtung der Tätigkeit der Atemwege Enzyme ist ein einfacher Ansatz für die Untersuchung mitochondriale Dysfunktion. Komplex IV, oder Cytochrom c Oxidase (COX), ist essentiell für die Funktion der Mitochondrien. Die katalytischen Untereinheiten der COX durch mtDNA codiert und sind für die Montage der Anlage (Abbildung 1) von wesentlicher Bedeutung. So sind richtige Synthese und Funktion weitgehend auf mtDNA Integrität 2.Obwohl auch andere respiratorische Komplexe untersucht werden konnte, sind Komplexe IV und II die meisten zugänglich histochemische Untersuchung 8,9. Complex II oder Succinat-Dehydrogenase (SDH), ist vollständig von Kern-DNA (Abbildung 1) kodiert, und seine Aktivität ist in der Regel nicht durch eine Störung der mtDNA betroffen, obwohl ein Anstieg mitochondrialen Biogenese 10-12 hindeuten könnten. Die gestörte mtDNA beobachtet in der mitochondrialen Krankheiten, Alterung und altersbedingter Krankheiten führt oft auf die Anwesenheit von Zellen mit geringer oder fehlender COX-Aktivität 2,12-14. Obwohl COX-und SDH-Aktivitäten einzeln untersucht werden können, hat die sequentielle Doppel-Kennzeichnung Methode 15,16 erwies sich bei der Suche nach Zellen mit mitochondriale Dysfunktion 12,17-21 vorteilhaft.
Viele der optimalen Verfassung des Assays ermittelt worden sind, wie Substratkonzentration, Elektronen-Akzeptoren / Geber-, Zwischen-Elektronen-Carrier, Einfluss von pH-Wert, und die Reaktion time 9,22,23. 3,3 '-Diaminobenzidin (DAB) ist eine effektive und zuverlässige Elektronendonator 22. In Zellen mit funktionierendem COX, wird die braune Indamin Polymerprodukt in der mitochondrialen Cristae lokalisieren und zu sättigen Zellen 22. Diejenigen Zellen, die mit dysfunktionalen COX wird daher nicht von der DAB Produkt gesättigt sein, so dass für die Visualisierung von SDH-Aktivität durch Reduktion von Nitroblautetrazolium (NBT), einen Elektronenakzeptor, zu einem blauen Formazan Endprodukt 9,24. Cytochrom c und Natriumsuccinat Substrate werden hinzugefügt, um endogene Werte zwischen Steuerung und kranken / mutierten Gewebe 9 normalisieren. Katalase ist als Vorsichtsmaßnahme, um mögliche Verunreinigung Reaktionen von Peroxidaseaktivität 9,22 vermeiden aufgenommen. Phenazinmethosulfat (PMS), einem Zwischenprodukt Elektronen-Carrier, wird in Verbindung mit Natriumazid, eine Atmungskette Inhibitor, der zur Bildung des endgültigen Reaktionsprodukte 9,25 zu erhöhen. Trotz dieser KenntnisATION, einige wichtige Details, die die Folge dieser schicklich einfache Test, zusätzlich zur Spezifität Kontrollen und Fortschritte in der Technik, noch nicht vorgestellt worden.
Protokoll
1. Tissue Vorbereitung Kryoschneiden
- Sacrifice das Tier entweder durch Genickbruch oder Enthauptung, im Einklang mit den verfügbaren ethischen ermöglichen.
- Schnell sammeln Gewebe von Interesse (zB. Gehirn), und schnell auf Trockeneis (Gewebe kann Einfrieren in Isopentan oder Propan mit flüssigem Stickstoff gekühlt, um eine optimale Morphologie zu erhalten benötigen) einfrieren. Shop Gewebe in Aluminiumfolie bei -80 ° C bis zu seiner Sektion.
- Embed gefrorenen Gewebe in Vorbereitung Kryoschneiden.
- Sammeln Sie 14-um Kryostatschnitte bei -21 ° C (Möglicherweise müssen Temperatur einstellen ± 1-2 ° C). Thaw Schnitte auf Objektträger mit Heizblock, und speichern Sie gleitet ohne Deckglas bei -20 ° C bis zur Verwendung.
2. COX Histochemie
- Lassen Sie die Objektträger bei Raumtemperatur für 1 Stunde trocknen lassen. Legen Sie Folien in einer Dia-Färbung Kammer mit feuchtem Filterpapier, in Streifen schneiden. Um consistent Ergebnisse in jedem Experiment ist es empfehlenswert, maximal zehn Folien pro Experiment Prozess zu zeitlichen Verzögerungen zu minimieren.
- Bereiten Sie unter einer chemischen hood 1X DAB, Cytochrom c 100 pM in 0,1 M PBS pH = 7,0. Vortex schnell.
- Add 2 pg Rinder Catalase (2 pg ml -1 oder ungefähr 4 IU ml -1). Gut mischen durch Vortexen zu brechen alle Körner von Katalase.
- Anwenden von 150 bis 200 ul des Inkubationsmedium zu jeder Folie, verwenden Pipettenspitze gleichmäßig auf alle Bereiche verteilt.
- Inkubieren Sie die Objektträger für 40 Minuten bei 37 ° C.
- Entfernen Sie überschüssige Lösung von den Folien. Waschen Sie die Objektträger 4-mal, jeweils 10 Minuten in 0,1 M PBS pH = 7,0.
- Zurück Dias Dia-Färbung Kammer mit nassen Papierstreifen.
3. SDH Histochemie
- Bereiten Sie unter einer chemischen Haube 1,5 mM NBT, 130 mM Natrium-Succinat, 0,2 mM PMS, und 1,0 mM Natriumazid in 0,1 M PBS pH = 7,0. Seien Sie vorsichtig mit dem SchirmPMS vor Licht. Vortex schnell.
- Apply 150-200 ul Inkubationsmedium zu jeder Folie, verwenden Pipettenspitze gleichmäßig auf alle Bereiche verteilt.
- Inkubieren Sie die Objektträger für 40 Minuten bei 37 ° C.
- Entfernen Sie überschüssige Lösung von den Folien. Waschen Sie die Objektträger 4-mal, jeweils 10 Minuten in 0,1 M PBS pH = 7,0.
- Entwässern der Objektträger für 2 Minuten in den folgenden Konzentrationen von Ethanol: 70%, 70%, 95%, 95%, 99,5%. Dann lassen Sie 10 Minuten in einer zusätzlichen 99,5% fort.
- Die Objektträger in Xylol für 10 Minuten. Mit Entellan und Deckglas. Lassen Sie die Dias über Nacht oder mindestens 1-2 Stunden in einem gut belüfteten Ort trocknen lassen.
4. Bestimmung der mitochondrialen Dysfunktion
- Die Höhe der mitochondriale Dysfunktion wird durch die Menge der zellulären-Blau-Färbung dargestellt. Um halb quantifizieren diese Beträge sollten Dias codiert und visualisiert werden unter Hellfeld-Mikroskopie. Semi-Quantifizierung sollte bei einem Blind durchgeführt werden Basis unter Verwendung einer Skala, zB 0-4 (0, keine blaue Färbung; 4, nur blaue Färbung). Am besten ist es, diese Art von Semi-Quantifizierung auf mehreren Abschnitten aus einem bestimmten Thema / Tier durchführen, um einen Mittelwert für jeden Probanden / Tier berechnen.
- Statistik sollte mit einem nicht-parametrischen Test, wie Mann-Whitney-oder Kruskal-Wallis werden.
5. Entsprechende Spezifität Kontrollen
- Für Spezifität Kontrollen für COX-Aktivität, repeat "COX Histochemie" Schritte, und fügen 2,5 mM Natriumazid, ein Terminal Atmungskette Inhibitor.
- Für Spezifität Kontrollen für SDH-Aktivität, repeat "SDH Histochemie" Schritte mit der Entfernung von Natriumsuccinat und die Zugabe von 50 mM Malonat, ein kompetitiver Inhibitor der SDH.
- Waschen und dehydrieren Abschnitte in einem Ethanol-Serie, und dann montieren und Deckglas die Folien wie in den Schritten 3.4 beschrieben - 3,6.
6. Repräsentative Ergebnisse:
tent "> Das Gesamtkonzept der COX / SDH Doppel-Kennzeichnung histochemischen Assay ist in Abbildung 2 dargestellt. Repräsentative Beispiele für geeignete COX / SDH Doppel-Kennzeichnung Histochemie in Hirnschnitten von Wildtyp-und vorzeitig alternde mtDNA Mutator Mäuse sind in Abbildung 3. Die dunkelbraune Färbung in Wildtyp-Mäusen (Abbildung 3, links) zeigten normale COX-Aktivität. Cells mit Atmungskette Mängel, durch die blaue Färbung angegeben, wurden in 12 Wochen alten mtDNA Mutator Mäusen zeigten, und diese Mängel wurde weiter verbreitet als mtDNA Mutator Mäuse im Alter bis 46 Wochen (Abbildung 3, Mitte und rechts).Beispiele für unangemessene COX / SDH Doppel-Kennzeichnung in Hirnschnitten von Wildtyp-Mäusen aufgrund unzureichender COX Kennzeichnung sind in Abbildung 4 dargestellt. Unzureichende Inkubationszeit für den Nachweis der COX-Aktivität oder die Verringerung der Verfügbarkeit von molekularem Sauerstoff durch Eindecken der Folie während der Inkubation führte zu einer verminderten Ablagerung der DAB reagierenIonenprodukt und damit für die Bildung des blauen Formazan Endprodukt während der SDH Inkubation erlaubt.
COX-und SDH-Aktivitäten können auch separat untersucht werden (Abb. 5, links und Mitte), jedoch ist die sequenzielle Kennzeichnung hilfreich bei der Identifizierung Zellen mit COX Mängel, aufgrund der Bildung des blauen Niederschlag während der SDH Inkubationszeit (Abbildung 3, Mitte und rechts). Spezifität Kontrollen für COX-und SDH-Aktivitäten kann auch (Abbildung 5, rechts).
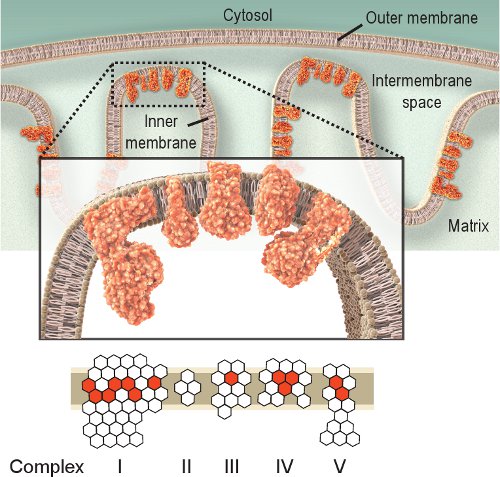
Abbildung 1. Mitochondrialen Atmungskette Komplexe IV. Die mitochondrialen Atmungskette ist in der inneren Membran lokalisiert und umfasst fünf Komplexe. Der Zweck der Atmungskette ist, um Elektronen aus Complex Transport I bis IV und damit es einen Protonengradienten über die innere Membran durch Complex V (ATPase) verwendet werden, um ATP zu produzieren schafft. Red Sechsecke represent-Untereinheiten durch mtDNA codiert. Weiß Sechsecke stellen Untereinheiten von Kern-DNA (beachten Sie, dass Complex II vollständig aus dem Kern-Genom kodiert) kodiert. So könnten Mutationen in der mitochondrialen Genoms verursacht Dysfunktion der Atmungskette durch Mutationen in den Untereinheiten der Atmungskette Komplexe.
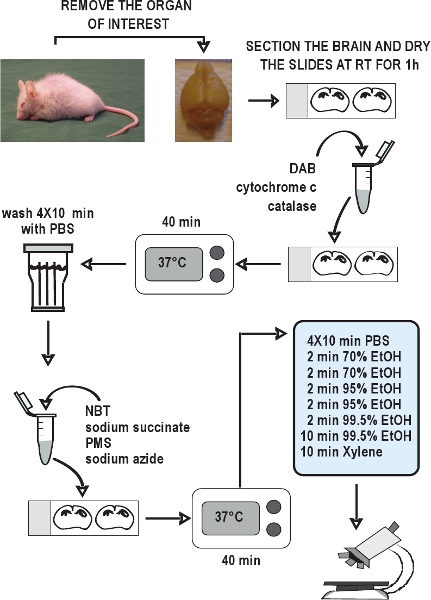
Abbildung 2. Flussdiagramm der COX / SDH Doppel-Kennzeichnung histochemischen Assay. Präparieren Sie die Organe von Interesse, schnell frieren die Gewebe auf Trockeneis, und lagern Sie sie bei - 80 ° C. Sammeln Kryostatschnitte und halten bei - 20 ° C bis zur Verwendung. Lassen Abschnitte an der Luft trocknen bei Raumtemperatur für 1 Stunde. Bereiten Sie das Inkubationsmedium für COX Histochemie, wenden Sie es auf den Rutschen, und inkubieren für 40 Minuten bei 37 ° C. Waschen Sie die Schnitte in PBS 4 mal für jeweils 10 Minuten zu waschen. Bereiten Sie das Inkubationsmedium für SDH Histochemie, es auf die slides, und wieder für 40 Minuten bei 37 ° C inkubieren Waschen Sie die Teile wieder in PBS, in einer Ethanol-Reihe dehydrieren, und dann montieren und Deckglas den Folien. Die COX / SDH doppelt markierten Abschnitte sind bereit, unter Hellfeld-Mikroskopie innerhalb von 1-2 Stunden zu sehen.

Abbildung 3. Repräsentative Beispiele von COX / SDH Doppel-Kennzeichnung. Hirnschnitten von Wildtyp-und vorzeitig alternde mtDNA Mutator Mäuse wurden nacheinander für COX-und SDH-Aktivitäten gekennzeichnet. (Maßstab:. 200 pm) Normal COX-Aktivität (dargestellt durch dunkelbraune Farbe) wurde im Hippocampus von Wildtyp-Mäusen (links) dargestellt. COX Mängel (angedeutet durch blaue Farbe) wurden im Hippocampus von Mäusen mtDNA Mutator (Mitte und rechts) enthüllt. Es war ein weiterer Rückgang der COX-Aktivität um 46 Wochen alt in mtDNA Mutator Mäusen, was auf weit verbreitete Verschlimmerung der Atmungskette Dysfunktion. Die beobachteten mitomitochondriale Dysfunktion in mtDNA Mutator Mäusen 12 ist durch ein hohes Maß an mtDNA Punktmutationen sowie erhöhte lineare Streichungen 5 verursacht.

Abbildung 4. Beispiele für unangemessene COX / SDH Doppel-Kennzeichnung. Hirnschnitten von Wildtyp-Mäusen wurden nacheinander für COX-und SDH-Aktivitäten gekennzeichnet. (Maßstab:. 200 um) Unzureichende Inkubationszeiten (10 und 25 Minuten) für den Nachweis der COX-Aktivität führte zu einer reduzierten Abscheidung der braunen DAB Reaktionsprodukt, im Vergleich zu den 40-minütigen Inkubationszeit (links und Mitte). Die verkürzte Inkubationszeiten für die Bildung des blauen Formazan Endprodukt während der SDH Inkubation erlaubt, irreführend was auf das Vorhandensein von Zellen mit COX Mängel. Eindecken der Objektträger während der COX Inkubation führte auch zu ungenau Bildung und Ablagerung des DAB reagierenIonenprodukt (rechts).
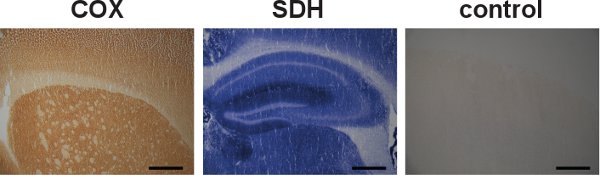
Abbildung 5. Ich ndividuelle COX-und SDH-Kennzeichnung und Spezifität zu steuern. Hirnschnitten von Wildtyp-Mäusen wurden getrennt für die COX-und SDH-Aktivitäten, durch die dunkelbraune Farbe und die blaue Farbe, bzw. (links und Mitte) gekennzeichnet sind. Obwohl COX-und SDH-Aktivitäten individuell beschriftet werden können, hat die sequenzielle Kennzeichnung erwies sich bei der Suche nach Zellen mit mitochondriale Dysfunktion vorteilhaft. Ein Beispiel für eine Spezifität Steuerung für COX-und SDH-Aktivitäten im Gehirn von einem Wildtyp-Mäusen zeigte keine Kennzeichnung (rechts). (Maßstab:. 200 um)
Diskussion
Die kombinierte COX / SDH histochemische Methode ermöglicht die Visualisierung von Zellen mit mitochondriale Dysfunktion. Diese Technik, die mit früheren Studien aus dem Jahr 1968, nach wie vor beliebt, mit vielen bedenkt es den "Goldstandard" zur Erkennung mitochondrialer Erkrankungen bei Patienten, 14,19,26,27. Es ist jetzt häufig verwendet, um mtDNA-Mutation-driven Altern und altersbedingte Erkrankungen 12,13,18,20,21,24 untersuchen. Die COX / SDH Doppel-Kennzeichnung wird häufig p...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde vom National Institute of Aging (AG04418), National Institute on Drug Abuse, National Institute of Health-Karolinska Institutet Graduate Partnerships Program, Karolinska Institutet, Schweden Research Council, Schwedisch Brain Power und Schwedisch Brain Foundation unterstützt. Vielen Dank an Mattias Karlen und Dr. Giuseppe Coppotelli für kreative Unterstützung bei der Abbildung 1 und 2 zeigen; Karin Pernold für technische Hilfe und Drs. Barry J. Hoffer, Lars Olson, und Nils-Göran Larsson für viele hilfreiche Ratschläge und Diskussion.
Materialien
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Dry Ice | AGA Gas AB | Blockform | |
| Isopentan (2-Methyl-butan) | Sigma-Aldrich | 277258 CAS: 78-78-4 | |
| Cyrostat Einbettung Lösung | Sakura Finetek | Tissue Tek 4583 | |
| Kryostat | Microm | Microm Modell HM 500M | |
| Slides | Thermo Scientific | Super Frost Plus- Menzel Gläser J1800AMWZ | |
| Deckgläser Borosilikatglas | VWR International | 16004-098 | 24 x 50 mm |
| Filter Paper | Munktell Filter AB | Qualität: 1350 ArtikelAnzahl: 242 001 | 430 x 430 mm |
| 3,3 '-Diaminobenzidintetrahydrochlorid (DAB) | Sigma-Aldrich | Sigma flüssiges Substrat System, D7304 | |
| Cytochrom c (Typ III, von Pferden Herz) | Sigma-Aldrich | C2506 CAS: 9007-43-6 | |
| Bovine Katalase (aus Leber) | Sigma-Aldrich | C9322 CAS: 9001-05-2 | |
| Nitroblautetrazolium (NBT) | Sigma-Aldrich | N6876 CAS: 298-83-9 | |
| Natriumsuccinat | Sigma-Aldrich | S2378 CAS: 6106-21-4 | |
| Phenazinmethosulfat (PMS) | Sigma-Aldrich | P9625 CAS: 299-11-6 | PMS ist lichtempfindlich. Schild aus Licht. |
| Natriumazid | Sigma-Aldrich | S8032 CAS: 26628-22-8 | |
| Xylol | VWR International | EM-XX0060-4 | |
| Entellan | VWR International | 100503-870 | |
| Malonat (Malonsäure) | Sigma-Aldrich | M1296 CAS: 141-82-2 |
Referenzen
- Larsson, N. G. Somatic mitochondrial DNA mutations in mammalian aging. Annu. Rev. Biochem. 79, 683-706 (2010).
- Cottrell, D. A. Role of mitochondrial DNA mutations in disease and aging. Ann. NY Acad. Sci. 908, 199-207 (2000).
- Harman, D. The biologic clock: the mitochondria. J. Am. Geriatr. Soc. 20, 145-147 (1972).
- Wallace, D. C. Mitochondrial genetics - a paradigm for aging and degenerative diseases. Science. 256, 628-632 (1992).
- Trifunovic, A. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 429, 417-423 (2004).
- Ameur, A. Ultra-deep sequencing of mouse mitochondrial DNA: mutational patterns and their origins. PLoS Genet. 7, e1002028-e1002028 (2011).
- Safdar, A. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc. Natl. Acad. Sci. U. S. A. 108, 4135-4140 (2011).
- DiMauro, S., Bonilla, E., Zeviani, M., Nakagawa, M., DeVivo, D. C. Mitochondrial myopathies. Ann. Neurol. 17, 521-538 (1985).
- Old, S. L., Johnson, M. A. Methods of microphotometric assay of succinate dehydrogenase and cytochrome c oxidase activities for use on human skeletal muscle. Histochem. J. 21, 545-555 (1989).
- Chaturvedi, R. K. Impaired PGC-1alpha function in muscle in Huntington's disease. Hum. Mol. Genet. 18, 3048-3065 (2009).
- Edgar, D. Random point mutations with major effects on protein-coding genes are the driving force behind premature aging in mtDNA mutator mice. Cell. Metab. 10, 131-138 (2009).
- Ross, J. M. High brain lactate is a hallmark of aging and caused by a shift in the lactate dehydrogenase A/B ratio. Proc. Natl. Acad. Sci. U. S. A. 107, 20087-20092 (2010).
- Crugnola, V. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch. Neurol. 67, 849-854 (2010).
- Nonaka, I. Muscle pathology in cytochrome c oxidase deficiency. Acta. Neuropathol. 77, 152-160 (1988).
- DiMauro, S. Mitochondrial encephalomyopathies. Neurol. Clin. 8, 483-506 (1990).
- Bonilla, E. New morphological approaches to the study of mitochondrial encephalomyopathies. Brain. Pathol. 2, 113-119 (1992).
- Brierley, E. J., Johnson, M. A., Lightowlers, R. N., James, O. F., Turnbull, D. M. Role of mitochondrial DNA mutations in human aging: implications for the central nervous system and muscle. Ann. Neurol. 43, 217-223 (1998).
- Borthwick, G. M., Johnson, M. A., Ince, P. G., Shaw, P. J., Turnbull, D. M. Mitochondrial enzyme activity in amyotrophic lateral sclerosis: implications for the role of mitochondria in neuronal cell death. Ann. Neurol. 46, 787-790 (1999).
- Gellerich, F. N. Mitochondrial respiratory rates and activities of respiratory chain complexes correlate linearly with heteroplasmy of deleted mtDNA without threshold and independently of deletion size. Biochim. Biophys. Acta. 1556, 41-52 (2002).
- Larsson, N. G. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice. Nat. Genet. 18, 231-236 (1998).
- Ekstrand, M. I. Progressive parkinsonism in mice with respiratory-chain-deficient dopamine neurons. Proc. Natl. Acad. Sci. U. S. A. 104, 1325-1330 (2007).
- Seligman, A. M., Karnovsky, M. J., Wasserkrug, H. L., Hanker, J. S. Nondroplet ultrastructural demonstration of cytochrome oxidase activity with a polymerizing osmiophilic reagent, diaminobenzidine (DAB). J. Cell. Biol. 38, 1-14 (1968).
- Dubowitz, V., Brooke, M. Muscle Biopsy: A Modern Approach. , (1973).
- Cottrell, D. A. Cytochrome c oxidase deficient cells accumulate in the hippocampus and choroid plexus with age. Neurobiol. Aging. 22, 265-272 (2001).
- Blanco, C. E., Sieck, G. C., Edgerton, V. R. Quantitative histochemical determination of succinic dehydrogenase activity in skeletal muscle fibres. Histochem. J. 20, 230-243 (1988).
- Moraes, C. T., Ricci, E., Bonilla, E., DiMauro, S., Schon, E. A. The mitochondrial tRNA(Leu(UUR)) mutation in mitochondrial encephalomyopathy, lactic acidosis, and strokelike episodes (MELAS): genetic, biochemical, and morphological correlations in skeletal muscle. Am. J. Hum. Genet. 50, 934-949 (1992).
- Petruzzella, V. Extremely high levels of mutant mtDNAs co-localize with cytochrome c oxidase-negative ragged-red fibers in patients harboring a point mutation at nt 3243. Hum. Mol. Genet. 3, 449-454 (1994).
- Tulinius, M. H., Holme, E., Kristiansson, B., Larsson, N. G., Oldfors, A. Mitochondrial encephalomyopathies in childhood. I. Biochemical and morphologic investigations. J. Pediatr. 119, 242-250 (1991).
- Haas, R. H. The in-depth evaluation of suspected mitochondrial disease. Mol. Genet. Metab. 94, 16-37 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten