A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القولون والمستقيم سطح الخلية السرطانية باستخدام بروتين التنميط ميكروأري جسم والمتعدد الإسفار
In This Article
Erratum Notice
Summary
صفنا إجراء لتفصيل سرطان القولون والمستقيم (CRC) لإنتاج خلايا واحدة قابلة للحياة ، والتي استولت بعد ذلك على الضد ميكروأرس مخصصة الاعتراف المستضدات السطحية (CRC DotScan ميكروأري). ويمكن لمحة عن المجموعات الفرعية من السكان من الخلايا منضمة إلى مضاعفة من قبل ميكروأري مضان باستخدام الاجسام المضادة الموسومة مع الأصباغ الفلورية.
Abstract
The current prognosis and classification of CRC relies on staging systems that integrate histopathologic and clinical findings. However, in the majority of CRC cases, cell dysfunction is the result of numerous mutations that modify protein expression and post-translational modification1.
A number of cell surface antigens, including cluster of differentiation (CD) antigens, have been identified as potential prognostic or metastatic biomarkers in CRC. These antigens make ideal biomarkers as their expression often changes with tumour progression or interactions with other cell types, such as tumour-infiltrating lymphocytes (TILs) and tumour-associated macrophages (TAMs).
The use of immunohistochemistry (IHC) for cancer sub-classification and prognostication is well established for some tumour types2,3. However, no single ‘marker’ has shown prognostic significance greater than clinico-pathological staging or gained wide acceptance for use in routine pathology reporting of all CRC cases.
A more recent approach to prognostic stratification of disease phenotypes relies on surface protein profiles using multiple 'markers'. While expression profiling of tumours using proteomic techniques such as iTRAQ is a powerful tool for the discovery of biomarkers4, it is not optimal for routine use in diagnostic laboratories and cannot distinguish different cell types in a mixed population. In addition, large amounts of tumour tissue are required for the profiling of purified plasma membrane glycoproteins by these methods.
In this video we described a simple method for surface proteome profiling of viable cells from disaggregated CRC samples using a DotScan CRC antibody microarray. The 122-antibody microarray consists of a standard 82-antibody region recognizing a range of lineage-specific leukocyte markers, adhesion molecules, receptors and markers of inflammation and immune response5, together with a satellite region for detection of 40 potentially prognostic markers for CRC. Cells are captured only on antibodies for which they express the corresponding antigen. The cell density per dot, determined by optical scanning, reflects the proportion of cells expressing that antigen, the level of expression of the antigen and affinity of the antibody6.
For CRC tissue or normal intestinal mucosa, optical scans reflect the immunophenotype of mixed populations of cells. Fluorescence multiplexing can then be used to profile selected sub-populations of cells of interest captured on the array. For example, Alexa 647-anti-epithelial cell adhesion molecule (EpCAM; CD326), is a pan-epithelial differentiation antigen that was used to detect CRC cells and also epithelial cells of normal intestinal mucosa, while Phycoerythrin-anti-CD3, was used to detect infiltrating T-cells7. The DotScan CRC microarray should be the prototype for a diagnostic alternative to the anatomically-based CRC staging system.
Protocol
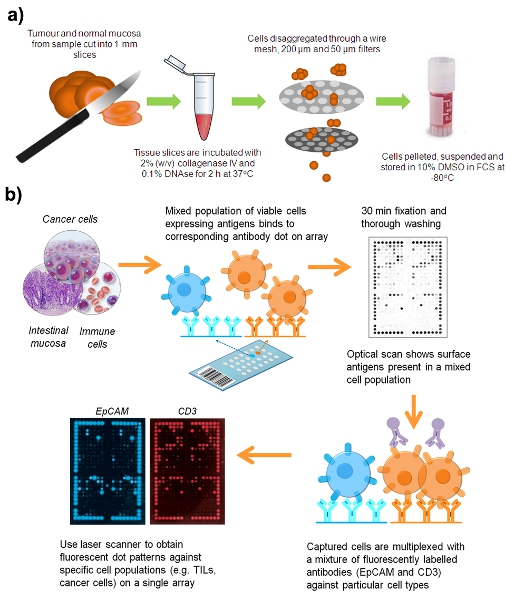
تدفق العمل الرقم 1. لإعداد تعليق الخلايا الحية من عينة جراحية من اتفاقية حقوق الطفل.
1. عينة سريرية التفكيك
وقد تم جمع عينات من كل من مستشفى رويال الامير ألفريد (Camperdown ، نيو ساوث ويلز ، أستراليا) ، ومستشفى كونكورد العودة إلى الوطن (كونكورد الغربية ، نيو ساوث ويلز ، أستراليا) مع الموافقة المسبقة بموجب البروتوكول رقم X08 - 164.
- جمع سرطان القولون والمستقيم الطازجة (CRC) أو عينات غدي ، والغشاء المخاطي المعوي العادي لا يقل عن 10 سم من الورم. عينات من متجر في هانك المتوازنة الملح الحل الحموضة 7.3 (HBSS) في 4 درجات مئوية لمدة تصل إلى 12 ساعة بعد بتر.
- اتباع قواعد السلامة لمسببات الأمراض البشرية ، ومعالجة كافة العينات السريرية في سلامة البيولوجية مجلس الوزراء من الدرجة الثانية. تشريح عينات إلى مكعبات 2 مم في طبق بتري باستخدام اثنين شفرات المشرط.
- احتضان الورم والأنسجة الطبيعية في أنابيب إيبندورف منفصلة مع خلط أحيانا لطيف لمدة 60 دقيقة عند 37 درجة مئوية مع حجم مساو من المتوسط 1640 RPMI تحتوي على 2 ٪ (V / V) كولاجيناز نوع 4 (رثينجتون ، يكوود بولاية نيوجيرسي ، الولايات المتحدة) و 0.1 ٪ (W / V) وأنا من ديوكسي ريبونيوكلياز pancrease البقري (الدناز الأول ؛ سيغما الدريخ).
- قوة شبه هضم الأنسجة من خلال مصفاة سلكية غرامة باستخدام المكبس من الحقنة 10 مل ، من خلال غسل الخلايا مع HBSS.
- تمرير الناتجة تعليق الخلية من خلال 200 ميكرون و 50 ميكرون مرشحات Filcon دينار بحريني (العلوم البيولوجية) لإزالة الركام الخلية. تتم إزالة معظم الركام الحمض النووي ، والمخاط والخلايا في هذه السلسلة من الفلترة.
- تعليق الطرد المركزي في 400 خلية XG عند 20 درجة لمدة 5 دقائق.
- خلية الكريات Resuspend في الحرارة المعطل FCS sulphoxide تحتوي على ثنائي ميثيل 10 ٪ (DMSO) ، وتجميد ببطء في cryovials وتخزينها في -80 درجة. عملية تجميد يميل للحد من مخاط في العينة وlyses خلايا الدم الحمراء.
2. إعداد نموذج لالتقاط الخلية
- ذوبان الجليد من العينات بسرعة في حمام المياه 37 درجة و الخلايا resuspend في 10 مل من HBSS لغسل خارج DMSO.
- تعليق الطرد المركزي في الخلية 410 XG عند 20 درجة لمدة 5 دقائق.
- صب وطاف وresuspend الكرية الخلية في 500 ميليلتر من HBSS.
- علاج العينة بنسبة 0.1 ٪ (W / V) الدناز الأول لمدة 20 دقيقة في درجة حرارة الغرفة.
- 10 ميكرولتر مزيج من كل تعليق الخلية مع حجم مساو من التريبان الأزرق وتحميل 10 ميكرولتر من الخليط في عدادة الكريات. باستخدام مجهر الضوء عند 100 مرات التكبير ، عد خلايا قابلة للحياة ، والتي تظهر واضحة بسبب الاستبعاد التريبان الأزرق ، في حين أن الخلايا الميتة بتناول صبغة. مطلوب كحد أدنى 4 × 10 6 خلايا قابلة للحياة لالتقاط الخلايا على ميكروأري.
- بعد العلاج الدناز ، resuspend تعليق خلية في 10 مل HBSS والطرد المركزي في 410 XG عند 20 درجة لمدة 5 دقائق.
- صب في supernatants وكريات الخلية resuspend RPMI في 1640 إلى وحدة تخزين النهائي من 200 ميكرولتر.
3. القبض على خلية جسم [ميكروأري
- يبلل [ميكروأري] DotScan بواسطة غمس في المقطع النيتروسليلوز الفوسفات مخزنة المالحة (PBS) لحوالي 20 ثانية. يمسح بعناية حواف الزجاج من ميكروأري مع Kimwipes مطوية ، وتجنب لمس الجزء النيتروسليلوز.
- يضاف الماء إلى علبة حضانة ميكروأري لتوفير غرفة رطبة. ضع ميكروأري في الغرفة وماصة للتعليق خلية في RPMI 1640 على القسم النيتروسليلوز رطبة. ماصة قطرات في كل ركن من أركان النيتروسليلوز لضمان انتشار حتى من الخلايا.
- لاحتضان ميكروأرس في 37 درجة مئوية لمدة 1 ساعة. تفريخ الخلايا يسمح لتسوية وتأتي في اتصال مع الأضداد على ميكروأري. وسوف يتم القبض على الخلايا معربا عن المستضدات السطحية المقابلة لأنهم الأضداد على الأرض.
- بعد مرور فترة الحضانة ، وتراجع في ميكروأرس بلطف ورأسيا إلى ثلاثة أحواض تحتوي على ما لا يقل عن 15 مل PBS ليغسل خلايا غير منضم (20 ثانية لكل غسل).
- إعداد 3.7 ٪ (ث / ت) الفورمالديهايد في برنامج تلفزيوني لإصلاح الخلايا والأجسام المضادة التي عبر الارتباط. ماصة بلطف حوالي 1 مل لتغطية قسم من ميكروأري النيتروسليلوز. احتضان لمدة 20 دقيقة في درجة حرارة الغرفة.
- تراجع ميكروأرس المقبل الى 3 تغييرات في برنامج تلفزيوني (15 مل ، 30 ثانية لكل منهما) لغسل الفورمالدهايد الزائد.
- مسح الحواف والخلفي من شريحة زجاجية مع Kimwipes وتفحص ميكروأري استخدام الماسح الضوئي في حين DotScan ، المقطع النيتروسليلوز رطبة. المسح الضوئي ويوفر نمط التعبير مستضد للسكان الخلية المختلطة الخلايا لجنة حقوق الطفل على سبيل المثال ، الكريات البيضاء وخلايا انسجة أخرى من الورم.
4. مضان مضاعفة
- إزالة ميكروأري من الماسح الضوئي وتطبيق 200 ميكرولتر من حجب العازلة (2 ٪ وزن / حجم جيش صرب البوسنة ، و 2 ٪ للحرارة الإنسان المعطل AB المصل ، برنامج تلفزيوني ، ودرجة الحموضة 7.3). احتضان ذلك في علبة ميكروأري في درجة حرارة الغرفة لمدة 20 دقيقة.
- إعداد multiplexing الحل في أنبوب إيبندورف مغطاة رقائق الألومنيوم : 20 ميكرولتر فيكوإيريترين مكافحة - CD3 (بيكمان كولتر ، Gladesville ، نيو ساوث ويلز ، أستراليا ، # IM12824 ؛ 1/7.5 التخفيف النهائي) ، و 10 ميكرولتر اليكسا فلور - 647 المضادة للEpCAM (Biolegend ، سان دييغو ، كاليفورنيا ، الولايات المتحدة الأمريكية ؛ 15/01 تمييع) ، و 2 ميكرولتر من الحرارة المعطل المصل AB الإنسان (سيغما الدريخ ، كاسل هيل ، نيو ساوث ويلز ، أستراليا) و 118 ميكرولتر من العازلة حظر.
- تصريف الفائض عازلة تمنع من وميكروأري ماصة الحل مضاعفة على المقطع النيتروسليلوز ، ونشر موحد. احتضان لمدة 30 دقيقة في الظلام في درجة حرارة الغرفة.
- يغمس ميكروأري رأسيا إلى ثلاثة أحواض من 15 برنامج تلفزيوني جديد مل ؛ (30 ق لكل منهما).
- السماح للميكروأرس الجافة في الظلام وتخزينها في 4 درجات مئوية في خانة الشريحة. ويمكن تخزين ميكروأري في الظلام لمدة تصل إلى 3 أشهر دون فقدان مضان.
- مسح ميكروأري الجافة باستخدام الماسح الضوئي FLA اعصار 9000 (GE للرعاية الصحية ، Rydalmere ، نيو ساوث ويلز ، أستراليا) لقرار لتعيين 50 (532 نانومتر ليزر ، 580 BP30 الانبعاثات لتصفية شركات القطاع العام. الليزر 633 نانومتر و 670 BP30 الانبعاثات لتصفية اليكسا 647). يتم تفحص ميكروأرس مع الجانب النيتروسليلوز أسفل على زجاج الماسحة الضوئية صينية.
- حفظ الصور كملفات TIFF الفلورسنت ، واستخدام الصور Photoshop لتعيين حجم 17 × 25 سم ، والقرار إلى 72 بكسل / سم. استيراد الصورة في برامج التحليل DotScan لتحليل كثافة من النقاط.
- وDotReader يلتقط صورة رقمية للنمط نقطة الربط الكمي وكثافة ملزم خلية في جسم كل نقطة على نطاق greyness 8 بت (1-256 U). وكان طرح في بعض الأحيان السيطرة isotype غير محددة وملزمة من قيم ملزمة للأضداد الغلوبولين المناعي مع isotypes المقابلة. تم تطبيع كثافة مضان نقطة لكل ميكروأري ضد ألمع النقطة التي وضعت في كثافة 100 ٪. إشارة / بقعة وسجلت القوة في ملف xml (البيانات الأولية) أو تمثيل ك مخطط شريطي في ملف. pdf (التقرير النهائي)
- أجريت ميكروأري heatsmaps المجموعات الهرمية وباستخدام MultiExperiment عارض (إلكترون فولت) الإصدار 4.4 من حزمة برمجيات TM4 ميكروأري ( http://www.tm4.org/mev.html ). تم تنفيذ المجموعات الهرمية على خلفية البيانات المعدلة باستخدام إلكترون فولت مع تحليل الربط الكامل. كان يستخدم لقياس المسافة الإقليدية التشابه. تم استخدام طالبة في الذيل 2 - T - اختبار مع الفرق متساوية لتحديد الدلالة الإحصائية للنتائج.
5. ممثل النتائج :
وينبغي أن ينتج عن ميكروأري DotScan تظهر أنماط الخلية متسقة الربط بين صفائف مكررة. محاذاة نقطة قوية ملزمة (CD44/CD29) تمكن الشبكة إلى وضعها فوق منطقة الصفيف. ويبين الشكل 2 مثالا على التقاط الخلية الأمثل والمتعدد. ويبين الشكل 3 بعض المشاكل المشتركة التي تواجه أثناء التقاط الخليوي ، والحلول الممكنة.
ويمكن قياس نتائج الخلية ميكروأري ملزمة من خلال قياس كثافة نقطة وأعرب على نطاق وgreyness تتراوح بين 1 إلى 256. ويبين الشكل 4 بيانات رقمية لجنة حقوق الطفل من 58 عينات الجراحية ، ملطخة الضد - 647 EpCAM اليكسا ، بوصفها heatmap مع المجموعات الهرمية. على الرغم من أن عدد العينات غير محدودة ، ومراكز التأهيل المجتمعي للمرحلة نفسها تميل إلى التجمع في نفس المجموعة.
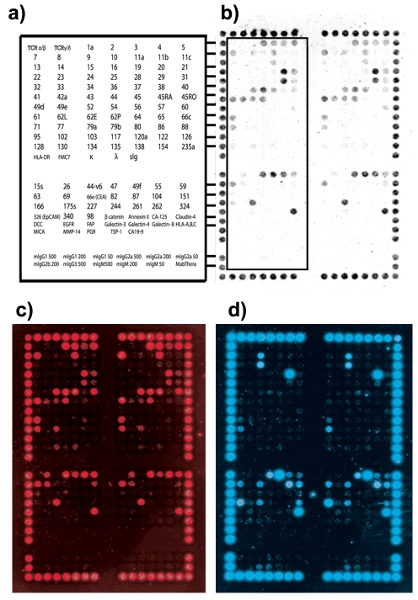
الشكل 2. نمط الخلية السرطانية السريرية الملزمة للسرطان القولون والمستقيم (استراليا عيادة - الباثولوجية التدريج ، ACP المرحلة B1). (أ) مفتاح الضد يظهر DotScan مواقع الأجسام المضادة للنصف الأيسر من ميكروأري مكررة (المذكورة). القسم العلوي يحتوي على الأجسام المضادة الأصلي 82 من ميكروأري DotScan اللوكيميا. العثور على مبلغ إضافي 40 الأضداد ، المطابقة لمستضدات سطح محددة إلى أن يصل التنظيم في الأدب ، كما أضيفت ميكروأري 'الفضائية' إلى لجنة حقوق الطفل. يتكون القسم السفلي من أجسام تحكم isotype (ب) من الخلايا الضوئية صورة ملزما للجنة حقوق الطفل ميكروأري. (ج) صورة مضان CD3 تظهر الخلايا التائية. (د) صورة مضان EpCAM تظهر الخلايا لجنة حقوق الطفل.

الشكل 3. أمثلة للنتائج DotScan الفقراء والحلول الممكنة. (أ) خلية قليلة ملزمة ؛ الحل : تأكد على الأقل 4x106 هي خلايا قابلة للحياة على مجموعة (ب) Isotype خلية مراقبة الملزمة وغير الملزمة محددة ؛ الحل : إضافة للحرارة الإنسان المعطل لعينة مصل AB قبل الحضانة على ميكروأري للحد من isotype السيطرة ملزمة. في بعض الأحيان ، وهو مبلغ صغير من المنظمات غير محددة وملزمة من الخلايا إلى النيتروسليلوز يحدث مع اتفاقية حقوق الطفل وعينات لا يؤثر بشكل كبير على النتائج. (ج) النتروسليلوز تجفيف خلال الحضانة ؛ الحل : تأكد من عينة يغطي القسم النيتروسليلوز كله والمحتضنة ميكروأري على سطح مستو. (د) التحف خلفية عالية ؛ الحل : التأكد منيتم غسلها جيدا ميكروأري حضانة التالية.
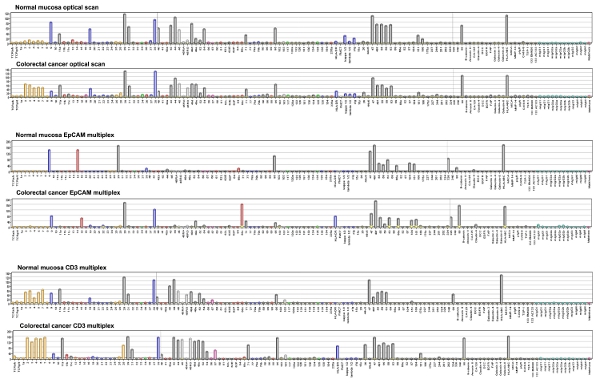
الشكل 4. DotScan برمجيات تحليل الرسوم البيانية ولدت شريط يمثل كثافة الخلية ملزم على نطاق greyness تتراوح بين 1 إلى 256. الأرقام على محور الرجوع إلى مستضدات CD. الاختصارات الأخرى TCR ، تي مستقبلات الخلية ؛ κ ، λ ضوء المناعي ، وسلاسل ، سيج ، المناعي السطح ؛ DCC ، حذف البروتين في سرطان القولون والمستقيم ؛ EGFR ، البشرة مستقبلات عامل النمو ؛ FAP ، البروتين الليفية التنشيط ؛ HLA - A ، B ، HLA - C DR ، الكريات البيض البشرية DR مستضدات و A ، B ، C على التوالي ؛ ميكا ، MHC الصف الأول سلسلة متصلة من البروتين A ؛ MMP - 14 ، مصفوفة metallopeptidase 14 ؛ PIGR ، مستقبلات المناعي البوليمرية ؛ TSP - 1 ، thrombospondin - 1 ؛ Mabthera ، البشرية : مكافحة CD20. انقر هنا لعرض صورة أكبر .
Discussion
في هذا الفيديو ، ونظهر كيف يمكن استخدام الأجسام المضادة ميكروأري DotScan بطريقة بسيطة نصف الكمية ، لدراسة ملامح سطح المستضد للسكان خلية من أنسجة لجنة حقوق الطفل.
الحصول على تعليق خلية واحدة قابلة للحياة من الأنسجة أمر حاسم لنجاح الت...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر العاملين في مختبرات علم الأمراض التشريحية لألفريد الملكي الأمير المستشفيات والعودة إلى الوطن كونكورد لجمع عينات جديدة من اتفاقية حقوق الطفل والغشاء المخاطي في الأمعاء طبيعية. وقد تم تمويل العمل من قبل معهد السرطان نيو ساوث ويلز برنامج المنح بالحركة.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف أو المعدات | شركة | فهرس العدد | تعليقات |
|---|---|---|---|
| هانكس "محلول ملحي متوازن | سيغما الدريخ | H6136 - 10X1L | Hepes مخزنة مع 25 ملم (سيغما # H3375) |
| Airpure السلامة البيولوجية لمجلس الوزراء من الدرجة الثانية | يستنغهاوس | 1687-2340/612 | |
| شفرات جراحية | ليفينغستون | 090609 | حزمة من 100 |
| RPMI 1640 مع 2 ملي Hepes | سيغما الدريخ | R4130 - 10X1L | |
| كولاجيناز اكتب 4 | ورثينجتون | 4188 | |
| ديوكسي ريبونيوكلياز 1 | سيغما الدريخ | DN25 - 1G | |
| Terumo الحقنة (10 مل) | Terumo | SS L +10 | المربع من 100 |
| Filcon تصفية (200 ميكرون) | العلوم البيولوجية دينار بحريني | 340615 | |
| Filcon تصفية (50 ميكرون) | Filcon تصفية (50 ميكرون) | Filcon تصفية (50 ميكرون) Filcon تصفية (50 ميكرون) 340603 | |
| الجنين مصل العجل | Gibco / Invitrogen | 10099-141 | |
| الطرد المركزي R 5810 | إيبندورف | 7017 | |
| ثنائي ميثيل sulphoxide | سيغما الدريخ | D2650 | |
| زرقة التريبان | سيغما الدريخ | T8154 | |
| Hemocymeter Technocolor Neubar | Hirschmann | غير متوفرة | |
| ضوء المجهر | نيكون | نيكون TMS | |
| Cyrovial أنابيب | غرينر الحيوي واحد | 121278 | |
| البرد تجميد contrainer | Nalgene | 5100-0001 | |
| DotScan الضد ميكروأري طقم | Medsaic | غير متوفرة | |
| DotScan علبة غسل ميكروأري | Medsaic | غير متوفرة | |
| KimWipes | كيمبرلي كلارك | 4103 | |
| الفورمالديهايد بنسبة 37 ٪ | سيغما الدريخ | F1635 - 500ML | |
| DotReaderTM | Medsaic | غير متوفرة | |
| ألبومين المصل البقري | سيغما الدريخ | A9418 - 10G | |
| الحرارة المعطل AB المصل 2 ٪ | Invitrogen | 34005100 | |
| فيكوإيريترين - مترافق CD3 | بيكمان كولتر | ET386 | |
| AlexaFluor647 - مترافق EpCAM | BioLegend | 324212 | |
| الاعصار FLA 9000 | جنرال إلكتريك للرعاية الصحية | 28-9558-08 | 532 نانومتر ليزر ، 580 BP30 الانبعاثات لتصفية شركات القطاع العام. 633 نانومتر ليزر و 670 BP30 الانبعاثات لتصفية Alexa647 |
| MultiExperiment عارض v4.4 | TM4 ميكروأري مجموعة برامج | فتح -- برمجيات المصدر (المرجع 11) |
References
- Steinert, R., Buschmann, T., vander Linden, M., Fels, L. M., Lippert, H., Reymond, M. A. The role of proteomics in the diagnosis and outcome prediction in colorectal cancer. Technol. Cancer. Res. Treat. 1, 297 (2002).
- Eifel, P., Axelson, J. A., Costa, J., Crowley, J., Curran, W. J., Deshler, A., Fulton, S., Hendricks, C. B., Kemeny, M., Kornblith, A. B., Louis, T. A., Markman, M., Mayer, R., Roter, D. National Institutes of Health Consensus Development Conference Statement: adjuvant therapy for breast cancer. J. Natl. Canc. Inst. 93, 979 (2001).
- Swerdlow, S. H., Campo, E., Harris, H. L., Jaffe, E. S., Pileri, S. A., Stein, H., Thiele, J., Vardiman, J. W. WHO classification of tumour of haematopoietic and lymphoid tissues. IARC WHO Classification of Tumours. 2, (2008).
- Xiao, G. G., Recker, R. R., Deng, H. W. Recent advances in proteomics and cancer biomarker discovery. Clin. Med. Oncol. , (2008).
- Belov, L., Mulligan, S. P., Barber, N., Woolfson, A., Scott, M., Stoner, K., Chrisp, J. S., Sewell, W. A., Bradstock, K. F., Bandall, L., Pascovici, D. S., Thomas, M., Erber, W., Huang, P., et al. Analysis of human leukaemias and lymphomas using extensive immunophenotypes from an antibody microarray. Br. J. Haematol. 135, 184 (2006).
- Belov, L., Huang, P., Barber, N., Mulligan, S. P., Christopherson, R. I. Identification of repertories of surface antigens on leukemias using an antibody microarray. Proteomics. 3, 2147 (2003).
- Zhou, J., Belov, L., Huang, P. Y., Shin, J., Solomon, M. J., Chapuis, P. H., Bokey, L., Chan, C., Clarke, C., Clarke, S. J., Christopherson, R. I. Surface antigen profiling of colorectal cancer using antibody microarrays with fluorescence multiplexing. J. Immunol. Methods. 355 (1-2), 40-51 (2010).
- Ellmark, P., Belov, L., Huang, P., Lee, C. S., Solomon, M. J., Morgan, D. K., Christopherson, R. I. Multiplex detection of surface molecules on colorectal cancers. Proteomics. 6, 1791 (2006).
- Pearson, J. P., Allen, A., Hutton, D. A. Rheology of mucin. Methods Mol. Biol. 125, 99 (2000).
- Yang, Y. H., Dudoit, S., Luu, P., Lin, D. M., Peng, V., Ngai, J., Speed, T. P. Normalization for cDNA microarray data: a robust composite method addressing single and multiple slide systematic variation. Nucleic Acids Res. 30, 15 (2002).
- Al Saeed, ., et al. TMA: A free, open-source system for microarray data management and analysis. BioTechniques. 34, 374-378 (2003).
Erratum
Formal Correction: Erratum: Colorectal Cancer Cell Surface Protein Profiling Using an Antibody Microarray and Fluorescence Multiplexing
Posted by JoVE Editors on 7/03/2015. Citeable Link.
The author's email has been corrected in the publication of Colorectal Cancer Cell Surface Protein Profiling Using an Antibody Microarray and Fluorescence Multiplexing. There was an error with the author, Jerry Zhou's, email. The author's email has been updated to:
j.zhou@uws.edu.au
from:
jzho7551@mail.usyd.edu.au
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved