A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
على نطاق واسع التسجيل من الخلايا العصبية بواسطة مجسات سيليكون المنقول في يتصرفون القوارض
In This Article
Summary
ونحن تصف طرق واسعة النطاق من تسجيل واحد وحدات متعددة والمحلية المحتملة في مجال التصرف القوارض مع تحقيقات السيليكون. ويوضح محرك تلفيق، المرفق مسبار إلى محرك وعمليات زرع التحقيق في تفاصيل كافية لتكرارها سهل.
Abstract
ويتمثل التحدي الرئيسي في علم الأعصاب وربط سلوك للنشاط الجماعي للجمعيات العصبية. فهم المدخلات والمخرجات العلاقات بين الخلايا العصبية ودوائر يتطلب أساليب مع الانتقائية المكانية والزمانية القرار المناسب لتحليل الآلي من الفرق العصبية في الحيوانات تتصرف، أي تسجيل لعينات كبيرة من الخلايا العصبية تمثيلي واحد معزول. وقد أحرز تقدم في رصد الفرقة من نشاط الخلايا العصبية بشكل ملحوظ في العقد الماضي في الحيوانات الصغيرة والكبيرة على حد سواء دماغ، بما في ذلك البشر 1-11. متعددة موقع تسجيل مع السليكون المستندة إلى أجهزة فعالة بشكل خاص بسبب قابلية بهم، صغيرة الحجم، والتصميم الهندسي.
هنا، نحن تصف وسائل لتسجيل الخلايا العصبية واحدة متعددة والمحلية المحتملة في مجال التصرف القوارض، وذلك باستخدام المتاحة تجاريا تحقيقات السيليكون الصغيرة تشكيله مع مكونات التبعي حسب الطلب. و هناك نوعان من الخيارات الأساسيةأو التواصل تحقيقات السيليكون لpreamplifiers: لوحات الدوائر المطبوعة والكابلات المرنة. شركات توريد مسبار ( http://www.neuronexustech.com/ ؛ http://www.sbmicrosystems.com/ ؛ http://www.acreo.se/ ) عادة ما توفر خدمة الربط وتقديم تحقيقات المستعبدين لوحات الدوائر المطبوعة أو الكابلات المرنة. هنا، نحن تصف غرس مسبار 4-32-عرقوب موقع، تعلق على كابل بوليميد مرنة، والتي شنت على microdrive المنقولة. كل خطوة من إعداد التحقيق، ويتضح microdrive البناء والجراحة حتى يتسنى للمستخدم النهائي ويمكن بسهولة تكرار هذه العملية.
Protocol
1. بناء microdrive
كلها مصنوعة من محركات العناصر الأساسية نفسها: جزء متحرك، والذي يحمل القطب وجزء ثابت، والتي ترتكز على الجمجمة. وmicrodrive مثالي يسمح السفر بما فيه الكفاية على نحو سلس ولكن طويلة من القطب في خطوات صغيرة متعددة، هو قوي بما فيه الكفاية لمنع حركة عرضية من قطب كهربائي، من السهل التلاعب بها مجرب دون التدخل في سلوك الحيوان، صغير الحجم وخفيف الوزن. نتيجة لهذه المتطلبات المتنافسة، محركات مختلفة تناسب مختلف التطبيقات.
وهناك حاجة إلى 4 أجزاء فقط من أجل بناء توجهنا الأساسي: لولب النحاس رئيس شقة، جوزة مطابقة، جسرا من البلاستيك المعدة من رأس دبوس صف واحد واثنين من لوحات نحاسية مخصصة المعالم.
- كسر قطعة 3-دبوس من رأس
- برفق خارج دبوس الأوسط.
- تكبير من خلال حفر حفرة من خلال ذلك مع تدريبات حجم # 55 بت.
- قطع القراءة باستخدام الحنفية 00-90.
- قطع قطعتين من لوحة نحاسية.
- رفع حواف الصفائح مع Dremmel.
- حفر حفرة في وسط كل قطعة باستخدام حجم مثقاب # 65.
- تجميع القطع بحيث محرك لوحات نحاسية ولمس دبابيس. لتحقيق هذا، تضاف المسمار النحاس من خلال، على التوالي، لوحة من النحاس الأصفر، رأس دبوس حفرة مترابطة، لوحة من النحاس الأصفر الثاني، والجوز و. تشديد المسمار ذلك بلطف أن الجمعية تصبح مستقرة.
- جندى ينتهي إلى دبوس لوحات نحاسية.
- ملف نهاية جاحظ من المسمار.
- اللحام الجوز على المسمار. يجب الحرص على عدم اللحام الجوز على لوحة نحاسية.
- اختبار حركة الدفع: تحويل المسمار مدار الساعة من الحكمة رفع الجسر من البلاستيك.
2. تستعد لجنة التحقيق السيليكون
قبل تحديد مسبار إلى محرك، إضافة إلى العزل خارج منطقة الرابطة لجنة التحقيق لمنع cerebrospinal السائل (CSF) أو الرطوبة من إنتاج قصيرة الدوائر:
- وزن وخلط المكونات المرنة Sylgard في نسبة 10:01.
- باستخدام قضيب من القطن شحذ، تطبيق Sylgard إلى نهاية العلوي من لجنة التحقيق.
- اتركها لتجف في فرن محمى على حرارة 60 درجة مئوية لمدة 2 ساعة.
للتأكد من أن مواقع تسجيل خالية من أي حطام، ونصائح مسبار هناك حاجة الى تنظيف:
- إعداد وتخفيف نسبة 4٪ من المنظفات Contrad.
- السماح للمسبار نقع في المنظفات في 63 درجة مئوية على الأقل 2 ساعة.
- شطف المنظفات قبالة عن طريق غمس التحقيق مرارا في الماء المقطر.
قبل تحديد مسبار إلى محرك، ينبغي التحقق من مقاومة من كل موقع التسجيل:
- تراجع لجنة التحقيق في المياه المالحة 0.9٪، وتوصيله إلى متر ومقاومة. إذا تسجيل مواقع كثيرة جدا لديها مقاومة غير صحيح، كرر الخطوات من 2،4-2،6 أو النظر في استخدام مسبار مختلفة.هنا نستخدم وحدة تكييف الممانعة من الحائر فريدريك، شركة (FHC)، جنبا إلى جنب مع محدد قناة محلية الصنع. بدلا من ذلك، وهو niPOD بواسطة NeuroNexus، وشركة أو NanoZ بواسطة Neuralynx، وشركة تسمح للرصد مقاومة من جميع القنوات التحقيق في وقت واحد.
3. الالصاق لجنة التحقيق إلى microdrive
- باستخدام شفرة حلاقة، وقطع الأخاديد متعددة في الجسر لخلق سطح وعر.
- يعترض على التحقيق الى جسر لمحرك الأقراص. من الأفضل القيام بهذا الإجراء تحت مجهر التشغيل، من خلال عقد محرك مع المشبك وتعديل لجنة التحقيق من قبل micromanipulator بحيث السيقان تكون موازية تماما مع محرك المسمار. وهذا يضمن أنه خلال تقدم، هذه الخطوة السيقان التحقيق في أنسجة المخ بدون 'قطع' من خلال ذلك. وينبغي أن تحدد عمق الدقيق للنصائح تحقيق نسبة إلى قاعدة للحملة في هذه المرحلة، مع الأخذ في الاعتبار عمق بنية الهدف من سطحالجمجمة.
- تم إصلاح ثم لجنة التحقيق إلى الجسر مع الاسمنت قبضة.
- اختياري: لتصور مسار التحقيق في الدماغ، ويمكن تطبيق حل الجاذبة (1-2٪ مخففة في الإيثانول) إلى الجزء الخلفي من لجنة التحقيق في هذه المرحلة.
4. إعداد الجمجمة
قبل الجراحة، وتعد الأقطاب المرجعية والأرض، وأجزاء من قفص فاراداي على رأسه:
- قطع قطعتين 2 "طويلة من الأسلاك النحاسية، واللحام واحدة من نهاية كل الأسلاك النحاسية المعزولة عن 1 ملم تقريبا.
- باستخدام إبرة، كشط رأس 00-90، قطعة واحدة 1/8 "برغي الفولاذ المقاوم للصدأ وجندى من الأسلاك النحاسية لذلك. لحام هذه الأرض الفولاذ المقاوم للصدأ المسمار الأقطاب يتطلب وجود تدفق مناسب (على سبيل المثال، N-3 جميع الأغراض تدفق من La المشارك) وارتفاع درجات الحرارة في تلميح لحام. منع بعناية أي جندى من التي تصب في أخدود من المسمار. سيتم استخدام هذا مثل القطب الأرض. كرر مع آخر مسمار والأسلاك النحاسية لإعدادالمرجع الكهربائي.
- قطع قطعة من trapeziodal شبكة النحاس. وسيتم تجميع هذه القطع لحماية headstage.
الأدوات الجراحية والتحضير هي نفسها المستخدمة في العديد من العمليات الجراحية الحيوانات الصغيرة. الجراحة تتم تحت تخدير كامل isoflurane عميق، وذلك باستخدام ظروف معقمة، وفقا للمبادئ التوجيهية المعتمدة المعاهد الوطنية للصحة. تجدر الإشارة إلى أن جراحة (وهمية) في هذا الفيديو هو لأغراض العرض التوضيحي فقط. لأغراض الرؤية والتصوير المناسبة، والخطوات التحضيرية عدة، والاحتياطات والإجراءات الجراحية بعد العملية الجراحية التي لا تظهر / مرئية أو مناقشتها.
قبل الجراحة، يجب تعقيم جميع مكونات واللوازم، وبعد تنفيذ إجراءات ملائمة (انظر المبادئ التوجيهية لجراحة القوارض البقاء على قيد الحياة؛ http://oacu.od.nih.gov/ARAC/surguide.pdf). أثناء الجراحة، ويتم إعداد حقل معقمة على الجمجمة ومعزولة من قبل الستائر العقيمة. في نهاية العملية الجراحية، والمضادات الحيوية واسعة هيpplied محليا ويعطى مسكنات للألم طويل المفعول عضليا (على سبيل المثال، البوبرينورفين، [Buprenex] 0.05 مغ / كغ). وبالإضافة إلى ذلك، مسكن للألم (على سبيل المثال، ايبوبروفين) يتم توفيرها في مياه الشرب في ما يقرب من 60 ساعة mg/kg/24 لمدة 5 أيام. عن المناسبة من العمليات الجراحية والتخدير، والتشاور مصادر مناسبة 12.
- تثبيت الحيوان في جهاز التجسيمي، حلاقة وتنظيف فروة الرأس 13.
- قطع الجلد على طول خط الوسط ودفع جانبا من فروة الرأس. إزالة السمحاق، نظيفة وجافة في الجمجمة.
- قياس المسافة بين الموقع وbregma وامدا، وتحديد الإحداثيات x و y من لجنة التحقيق وفقا لذلك باستخدام موقع غرس أطلس التجسيمي 14. بمناسبة موقع عن طريق كشط الصليب على جمجمة مع مشرط.
- حفر الجمجمة باستخدام الحفر جولة رئيس بت (حجم ربع)، ومسامير دعم حملة (الفولاذ المقاوم للصدأ، 000-120، 1/16 ") في منتصف الطريق في العظام، وعلى لوحات مختلفة على عظم الأعلىعلى الجانب الثاني من الجمجمة. وسوف توفر المراسي الخناق على أغطية الرأس بشكل آمن السندات في الجمجمة.
- حفر ثقوب فوق المخيخ وتضاف الأرض وأقطاب المرجعية أعدت في الخطوة 4.2. لتسجيل الإمكانات الميدانية على الصعيد المحلي (LFP)، واختيار موقع مرجع أمر بالغ الأهمية. يتم اختيار هذا الموقع لLFP المخيخ هو أصغر من جميع المناطق القشرية والتحف العضلات تكاد تكون معدومة في هذا الموقع خط الوسط.
- تطبق عاج المنشط (Metabond عدة) باستخدام فرشاة صغيرة على سطح كامل من الجمجمة. شطفه مع المياه المالحة بنسبة 0.9٪.
- تطبق الاسمنت الأسنان (Metabond عدة، اتبع تعليمات الشركة الصانعة للخلط) في الجمجمة، وتغطي بعناية براغي مرساة، وأرض وأقطاب المرجعية، ولكن ترك موقع غرس مسبار واضح.
- تأمين شبكة النحاس 4 اللوحات (المعد في الخطوة 4.3) في الجمجمة. لهذا، وتدعيم قاعدة ضيقة من كل واحد منهم على الجانبين، الأمامية اليسار واليمين، والخلفي من الجمجمة. الوينبغي أن النحاس ه أبدا أن يكون على اتصال مباشر مع العظم لكن يفصل دائما بطبقة من الاسمنت.
5. إعداد سطح الدماغ
- استخدام القليل رأس الحفر جولة، حفر حول موقع غرس في مراحل متعددة، في حين لري في كثير من الأحيان مع عظم المالحة.
- إزالة بعناية رفرف العظام ولري سطح الدماغ.
- لإدخال مسبار متعددة عرقوب، يتم إزالة الشريط واسعة من بلدة دورا. وهناك حاجة إلى اثنين من الأدوات لإزالة الجافية: المبضع، وربط المعدة من إبرة الحشرة (بدلا من ذلك، وهو microelectrode التنغستن قياسي). ثني رأس الإبرة من خلال دفع ضد سطح صلب (مثل شريحة زجاجية)، ونعلق عليه إلى مقبض (هنا، وقطعة من الخشب Q-طرف؛ بدلا من حامل إبرة microdissecting).
- رفع الجافية مع ورطتها، وقطع عليه مع مشرط. وتولى عناية خاصة لتجنب إتلاف الحنون والسفن وعلى سطح القشرة المخية الحديثة. لا يمكن حلها نزف صغيربواسطة الري المالحة. إذا كان النزيف يحدث الكبرى أو تضعف القشرة المخية الحديثة بأي شكل من الأشكال، وينبغي للمرء أن ينظر إنهاء عملية جراحية، وإعداد حيوان آخر.
6. غرس مسبار
في هذه المرحلة، يتم تقييمها بدقة وكثافة واتجاه السفن السطحية القشرية. وينبغي تعديل إحداثيات التجسيمي، وذلك لأن لجنة التحقيق لديه على اختراق الدماغ في منطقة خالية من السفن الكبيرة.
لغرس، ويمكن عقد الجمعية محرك مع مقطع التمساح المعلقة على حامل التجسيمي. رؤية غير منقطعة من سطح الدماغ ونصائح لجنة التحقيق بالغة الأهمية بالنسبة لاختراق ناجح.
- خفض ببطء لجنة التحقيق وصولا الى ما يقرب من 1 مم فوق الهدف المقصود، في حين ري باستمرار حج القحف مع المياه المالحة. للتسجيل القشرة المخية الحديثة، وخفض نصائح التحقيق في القشرة حوالي 0.5 مم ورفع الظهر بالقرب من السطح.
- ختم حج القحف عن طريق تطبيق مزيج دافئ ذاب الشمع وزيت البارافين من خلال إبرة (10-20G من الشمع في 10 مل زيت البارافين، تسخينها عند 65 درجة مئوية). قبل تطبيق، يبرد المزيج إلى 30 درجة مئوية واختبار كثافة. يجب أن تكون لينة بما يكفي للسماح سهل حركة التحقيق). لتسهيل تغطية كاملة، قد يكون ذاب الخليط في الموقع من الاقتراب من الشمع صلابة مع غيض من cauterizer الدقيقة.
- نعلق الجزء السفلي من حملة لالجمجمة مع الاسمنت قبضة، والحرص على مغادرة الجوز الحرة لتحويل. فإنه من الأهمية بمكان تجنب أي عرضي "عثرة" للحملة في هذه المرحلة، وإلا فإن لجنة التحقيق إلى تلف قشرة. بعد أن يتم تأمين محرك الأقراص في الجمجمة، ينبغي التحقق من حركة السلس للمسبار.
- تدعيم جزء موصل من لجنة التحقيق في الجمجمة.
7. بناء على رأسه قفص فاراداي
- سحب وتجميع اللوحات شبكة النحاس في اسطوانة وقائية حول التحقيق وDRIهاء. الاسطوانة أيضا بمثابة درع الكهربائية ضد الضوضاء البيئية والقطع الأثرية موجة بطيئة التي تنتجها شعيرات اتهم في الحيوان يتصرف.
- ضبط ارتفاع الاسطوانة بعيدا عن طريق خفض المواد الزائدة وبالتالي فإن شبكة النحاس هو مستوى أعلى من الرابط التحقيق.
- لحام أسلاك من مرجع ومسامير الأرض لدبابيس مناسبة للموصل. لحام أيضا شبكة النحاس المجاورة اللوحات معا لضمان استمرارية التيار الكهربائي، واللحام والأسلاك الأرضية لشبكة النحاس.
- تطبيق طبقة من الاسمنت قبضته على شبكة النحاس لتعزيزه، ومنع أي اتصال مباشر بين المعدن والجلد الحيوان. اختياريا، وتطبيق طبقة من راتنجات الايبوكسي وذلك لتعزيز وأغطية الرأس.
- اختبار حركة المسمار محرك.
- تغطية الجزء العلوي من غطاء الرأس مع قطع قطعة من القفازات المطاطية.
8. تسجيل في الحيوان التحرك بحرية
- بعد اعتماداتأكلت الرعاية اللاحقة للعمليات الجراحية، وربط الحيوان إلى نظام تسجيل باستخدام headstage مقاومة عالية وخفيفة الوزن، وultraflexible كابل متعدد حبلا. موازنة ثقل أغطية الرأس.
- اختبار جودة من تسجيل كل يوم في homecage. الحكم على الموقف من المواقع تسجيل من قبل كل من أنماط اطلاق وحدة وشكل الإمكانات الميدانية على الصعيد المحلي. خفض المسبار تدريجيا من خلال تحويل المسمار بزيادات صغيرة (عادة 1/8 الى 1/4 بدوره في اليوم الواحد، أي 35-70 ميكرومتر) حتى يتم الوصول إلى هيكل الهدف.
9. ممثل النتائج
الإشارات الكهربية (المحلية المحتملة الميدانية ونشاط وحدة) تختلف تبعا للهيكل سجلت والسلوك الحالي للحيوان. ويوضح الشكل 1 أمثلة من تسجيلات CA1 32 قناة قرن آمون في حين أن الفئران وتستكشف حقل مفتوح. لاحظ بارز 8 هرتز (ثيتا عصابة) التذبذب من إمكانيات حقل المحلية خلال استكشاف مع سوبerimposed ارتفاعه على السيقان ومواقع متعددة (أمثلة من المسامير المشار إليها النصال). لتحليل نشاط الخلايا العصبية وحدة، يتم الكشف عن طفرات وفرزها الى وحدات واحد باستخدام تحليل مجموعة من الطول الموجي من 15-16.
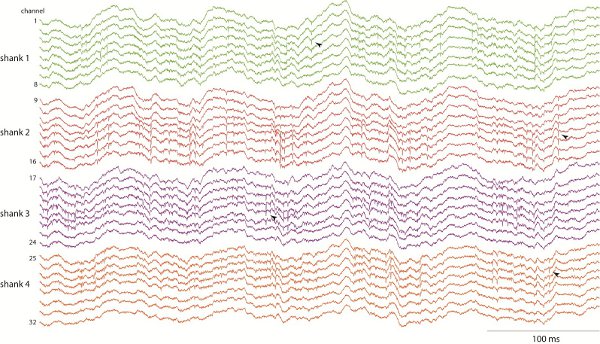
الشكل 1. CA1 التسجيلات قرن آمون في الفئران تتصرف باستخدام السيقان 4 × 8 مواقع مسبار السيليكون. التسجيلات والاتساع، وأخذ عينات في 20 000 هرتز، والذي يسمح لدراسة كل مجال التذبذبات المحلية المحتملة (على سبيل المثال "ثيتا" الفرقة 8 هرتز إيقاع)، والعصبية نشاط التشويك.
Discussion
هذا الفيلم يوضح إجراء زرع السيليكون تحقيقات للتسجيلات واسعة النطاق المزمنة في الفئران يتصرف. خطوات حاسمة لضمان جودة التسجيلات من نشاط الخلايا العصبية تنتج عن هشاشة كلا البيولوجية (أنسجة المخ)، والمواد التقنية (السيليكون التحقيق). وينبغي إيلاء عناية خاصة أثناء التعا...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
ماري كوري الزمالة الدولية الصادر (في الاتحاد الاوروبي FP/2007-2013 اتفاقيات المنح # 221834 و 254780) دنانير، ماكدونيل مؤسسة، جبهة الخلاص الوطني جرانت SBE 0542013، المعاهد الوطنية للصحة جرانت NS034994، المعهد الوطني للصحة العقلية MH5467 جرانت ومعهد هوارد هيوز الطبي (Janelia مزرعة أبحاث الحرم الجامعي منحة).
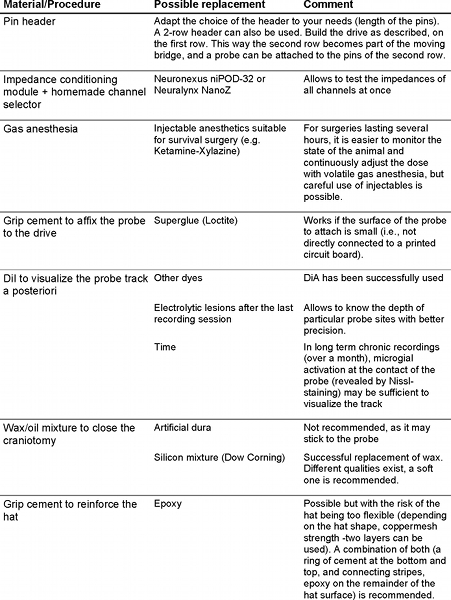
Materials
| Name | Company | Catalog Number | Comments | |
| اسم | نوع | شركة | فهرس العدد | تعليقات |
| السيليكون مسبار Buzsaki32، 4 السيقان × 8 مواقع. التعبئة والتغليف: مرن كابل البولياميد | مادة | NeuroNexus | تحقيق: buzsaki32 التعبئة والتغليف: HC32 | تسجيل مسبار |
| جولة برغي النحاس الأصفر، 00-90 × 1/2 المسامير النحاسية المستديرة | مادة | JIMorris | R0090B500 | محرك جزء |
| النحاس عرافة الجوز، 00-90 | مادة | JIMorris | N0090B | محرك جزء |
| النحاس C260 قطاع، ASTM-B36 سمك: 0.025 "، الطول: 12"، العرض: 1/2 " | مادة | أجزاء صغيرة | B000FMYU72 | محرك جزء |
| موصل رأس، 2mm في الملعب، ممزر، صف واحد، straigt، 36 مناصب | مادة | Digikey | 2163S-36-ND | محرك جزء |
| 2-جزء إلاستومر Sylgard السيليكون | مادة | الآلات الدقيقة العالم | SYLG184 | من خارج عزل التحقيق |
| Contrad التطهير 70 المنظفات السائلة | الكاشف | فيشر العلمية | 04-355 التطهير مختبرات رقم: 1002 | لتنظيف المواقع تسجيل |
| مقاومة وحدة تكييف | معدات | FHC المؤتمر الوطني العراقي. | 55-70-0 | مقاومة متر |
| niPOD - 32 قنوات | معدات | Neuronexus | niPOD -32 | مقاومة متر |
| الصف قبضة اسمنت الصناعي | مادة | يسد DENTSPLY | 675571 (بودرة) 675572 (المذيب) | قبضة ممنة |
| 1،1 '-dioctadecyl-3، 3،3'، 3'-tetramethylindocarbocyanine بيركلورات ('الجاذبة'؛ DiIC18 (3)) | الكاشف | إينفيتروجن | D282 | وصمة عار على مسار التحقيق في الدماغ |
| غير القابل للصدأ برغي آلة الصلب، رئيس تجليد الكتب، محرك مشقوق، # 00-90، 1/8 " | مادة | أجزاء صغيرة | MX-0090-02B | الأرض ومسامير مرجع |
| سلك المغناطيس، 20G، والنايلون، البولي يوريثين طلاء، MW80 | مادة | أجزاء صغيرة | B000IJYRP2 | الأرض والأسلاك إشارة |
| غير القابل للصدأ برغي آلة الصلب، رئيس ملزم مشقوق محرك، # 000-120، 1/16 " | مادة | أجزاء صغيرة | MX-000120-01B | مرساة البراغي |
| N-3 كل غرض السائل الجريان | الكاشف | لا المشارك (ماركال) | 23512 | يسمح لحام الفولاذ المقاوم للصدأ |
| موسع MicroGrid الدقة النحاس | مادة | Dexmet | 3 CU6-050 FA | شبكة النحاس للقفص فاراداي في الرأس |
| C & B-METABOND سريع! الاسمنت النظام - عاج المنشط | مادة | Parkell | S380 | |
| C & B-METABOND سريع! نظام الاسمنت - الاسمنت الأسنان | مادة | Parkell | S380 | |
| إبرة حادة التنغستن نقطة وحامل | أداة | الأدوات الجراحية Roboz | RS-6064 و RS-6061 | لجعل هوك لرفع الجافية |
| كربيد بر HP 1/4 | أداة | هنري شين | 9990013 | |
| البارافين (حبيبات) | مادة | فيشر العلمية | P31-500 | |
| الزيوت المعدنية، والضوء (NF / لجنة الاتصالات الفدرالية) | مادة | فيشر العلمية | O121-1 | |
| GC الكترونيات 10-114 لاصق الايبوكسي 2-الجزء | مادة | نيوارك | 00Z416 | |
| اكتب 1 LITZ 21 AWG 40/36 واحدة من مادة البولي يوريثين الأحمر، نايلون (MW80-C) ل0،041 "+ / -0.002" OD | مادة | نيو انغلاند سلك تكنولوجيز كوربوريشن | N28-36E-400-2 | لجعل كابل بين headstage ومكبر للصوت لل |
| 32 قناة التكامل نطاق واسع جدا headstage، 20X مكسب | معدات | Plexon | HST/32V-G20 | Headstage |
References
- Buzsáki, G. High-frequency network oscillation in the hippocampus. Science. 256, 1025-1027 (1992).
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261, 1055-1058 (1993).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat. Neurosci. 7, 446-451 (2004).
- Buzsáki, G. Visualizing Large-Scale Patterns of Activity in the Brain: Optical and Electrical Signals. Society for Neuroscience. , (2004).
- Nicolelis, M. A. L. . Methods for Neural Ensemble Recordings. , (2008).
- Hatsopoulos, N. G., Donoghue, J. P. The science of neural interface systems. Annu. Rev. Neurosci. 32, 249-266 (2009).
- Battaglia, F. P. The Lantern: an ultra-light micro-drive for multi-tetrode recordings in mice and other small animals. J. Neurosci. Methods. 178, 291-300 (2009).
- Kloosterman, F., Davidson, T. J. Micro-drive Array for Chronic in vivo Recording: Drive Fabrication. J. Vis. Exp. 26, e1094-e1094 (2009).
- Nguyen, D. P., Layton, S. P. Micro-drive Array for Chronic in vivo Recording: Tetrode Assembly. J. Vis. Exp. (26), e1098-e1098 (2009).
- Haiss, F., Butovas, S., Schwarz, C. A miniaturized chronic microelectrode drive for awake behaving head restrained mice and rats. J. Neurosci. Methods. 187, 67-72 (2010).
- Cerf, M. On-line, voluntary control of human temporal lobe neurons. Nature. 467, 1104-1108 (2010).
- Kohn, D. F. Anesthesia and Analgesia in Laboratory Animals. American College of Laboratory Animal Medicine. series, (1997).
- Schjetnan, A. G. P., Luczak, A. Recording Large-scale Neuronal Ensembles with Silicon Probes in the Anesthetized Rat. J. Vis. Exp. (56), e3282-e3282 (2011).
- Paxinos, G., Watson, C. The Rat Brain. Stereotaxic Coordinates. , (1982).
- Harris, K. D. Accuracy of tetrode spike separation as determined by simultaneous intracellular and extracellular measurements. J. Neurophysiol. 84, 401-414 (2000).
- Hazan, L., Zugaro, M., Buzsáki, G. Klusters, NeuroScope, NDManager: a Free Software Suite for Neurophysiological Data Processing and Visualization. J. Neurosci. Methods. 155, 207-216 (2006).
- Kipke, D. R. Advanced neurotechnologies for chronic neural interfaces: new horizons and clinical opportunities. J. Neurosci. 28, 11830-11838 (2008).
- Csicsvari, J. Massively parallel recording of unit and local field potentials with silicon-based electrodes. J. Neurophysiol. 90, 1314-1323 (2003).
- Sodagar, A. M., Wise, K. D., Najafi, K. A fully integrated mixed-signal neural processor for implantable multichannel cortical recording. IEEE Trans. Biomed. Eng. 54, 1075-1088 (2007).
- O'Connor, D. H., Huber, D., Svoboda, K. Reverse engineering the mouse brain. Nature. 461, 923-929 (2009).
- Boyden, E. S. Millisecond-timescale, genetically targeted optical control of neural activity. Nat. Neurosci. 8, 1263-1268 (2005).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nat. Rev. Neurosci. 8, 577-581 (2007).
- Royer, S. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. Eur. J. Neurosci. 31, 2279-2291 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved