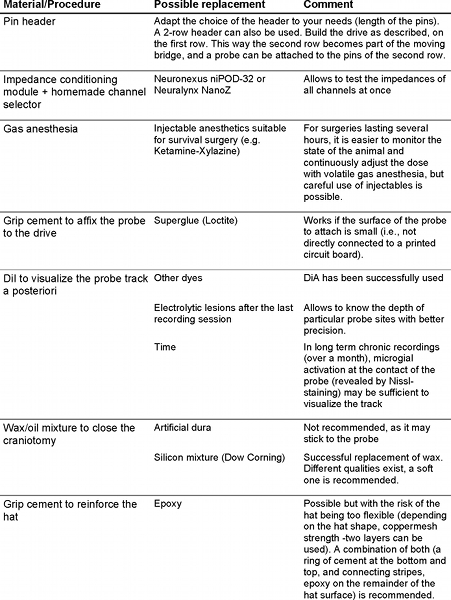
A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בקנה מידה גדול הקלטה של הנוירונים על ידי בדיקות מטלטלין סיליקון מתנהג מכרסמים
In This Article
Summary
אנו מתארים שיטות הקלטה בקנה מידה גדול של יחידות בודדות מרובות פוטנציאל בתחום המקומית מתנהג מכרסמים עם בדיקות סיליקון. כונן ייצור, מצורף בדיקה לכונן ואת ההשתלה תהליכי בדיקה באים לידי ביטוי מספיק פרטים עבור שכפול קל.
Abstract
אתגר גדול במדעי המוח מקשרת התנהגות לפעילות הקולקטיבית של מכלולים עצביים. הבנה של קלט פלט יחסים של נוירונים ומעגלים דורש שיטות עם סלקטיביות מרחבי ברזולוציה הזמני המתאים לניתוח מכניסטית של הרכבים עצביים בעלי חיים מתנהגים, כלומר הקלטה של דגימות גדולות representatively של נוירונים בודדים. אנסמבל ניטור של הפעילות העצבית התקדמה במידה ניכרת אצל בעלי חיים קטנים וגדולים כאחד בעל המוח, כולל בבני אדם 1-11 בעשור האחרון. מרובת אתרים עם הקלטה מבוססי סיליקון מכשירים יעילים במיוחד הודות ליכולת ההרחבה שלהם, נפח קטן עיצוב גיאומטרי.
כאן, נתאר שיטות הקלטה נוירונים בודדים מרובים פוטנציאליים בתחום המקומית מתנהג מכרסמים, תוך שימוש זמינים מסחרית מיקרו מכונות בדיקות סיליקון עם מחוייט רכיבים אביזר. יש 2 אפשרויות בסיסיות ואו התממשקות בדיקות סיליקון preamplifiers: מעגלים מודפסים, כבלים גמישים. חברות המספקות בדיקה ( http://www.neuronexustech.com/ ; http://www.sbmicrosystems.com/ ; http://www.acreo.se/ ) בדרך כלל לספק את השירות מליטה לספק בדיקות מלוכדות מעגלים מודפסים או כבלים גמישים. כאן, אנו מתארים את ההשתלה של החללית 4-32-שוק באתר, מצורף כבל polyimide גמיש, רכוב על Microdrive מטלטלין. כל שלב בהכנת בדיקה, בנייה Microdrive ניתוח מתוארת כך משתמש הקצה יכול בקלות לשכפל את התהליך.
Protocol
1. בניית Microdrive
כל הכוננים עשויים אלמנטים בסיסיים: החלק המרגש, אשר נושא את האלקטרודה וחלק קבוע, המעוגן אל הגולגולת. Microdrive האידיאלי מאפשר נסיעה די חלקה אבל ארוכה של האלקטרודה בצעדים קטנים מרובים, הוא יציב מספיק כדי למנוע תנועה מקרית של האלקטרודה, קל לתמרן על ידי הנסיין בלי להפריע את התנהגותו של בעל חיים קטן בגודל קלים במשקל. בעקבות דרישות אלה מתחרות, חבילת כוננים שונים ליישומים שונים.
רק 4 חלקים יש צורך לבנות כונן הבסיסית שלנו: בורג שטוח פליז ראש, אגוז התאמה, גשר פלסטיק מוכנים מן הכותרת סיכה אחת בשורה ושני אישית לחתוך לוחות פליז.
- לשבור חתיכה 3 פינים מכותרת
- משוך בעדינות את הסיכה התיכון.
- להגדיל את החור על ידי קידוח דרכו עם גודל התרגיל קצת # 55.
- גזור הלקריאה באמצעות ברז 00-90.
- חותכים שתי חתיכות מתוך צלחת נחושת.
- להגיש את הקצוות של הצלחות עם Dremmel.
- לקדוח חור באמצע של שני חלקים באמצעות גודל המקדח # 65.
- להרכיב את החלקים כונן כך צלחות נחושת נוגעים הפינים. לשם כך, הכנס את הבורג באמצעות כלי נשיפה, ברציפות, צלחת נחושת, סיכת הליכי הכותרת חור, צלחת נחושת 2, ואת אגוז. הדקו את הבורג בעדינות כך הרכבה הופך יציב.
- הלחמה סיכה מסתיים ללוחות נחושת.
- להגיש את הקצה הבולט של הבורג.
- לרתך את האום על הבורג. להיזהר לא לרתך את האום לצלחת פליז.
- בדוק את התנועה של הכונן: להפוך את הבורג השעון מבחינת לרומם את הגשר מפלסטיק.
2. הכנת בדיקה סיליקון
לפני תיקון בדיקה לכונן, להוסיף בידוד נוסף באזור מליטה של החללית כדי למנוע cerebrospinal נוזל (CSF) או לחות מלייצר לקצר:
- לשקול לערבב את המרכיבים אלסטומר Sylgard ביחס 10:01.
- באמצעות המוליך כותנה חידד, החל את Sylgard עד הסוף גבי החללית.
- תנו לו להתייבש בתנור שחומם מראש ב 60 מעלות צלזיוס למשך 2 שעות.
על מנת להבטיח כי האתרים הקלטה הם ללא פסולת מקום, טיפים בדיקה יש לנקות:
- הכן דילול 4% של חומר ניקוי Contrad.
- בואו בדיקה לטבול בחומר ניקוי על 63 מעלות צלזיוס לפחות 2 שעות.
- יש לשטוף את חומר הניקוי על ידי טבילה בדיקה שוב ושוב במים מזוקקים.
לפני תיקון בדיקה על הכונן, העכבה של כל אתר ההקלטה יש לבדוק:
- טובלים את החללית של מי מלח 0.9%, ולחבר אותו מטר עכבה. אם אתרי הקלטה יותר מדי יש עכבה שגוי, חזור על שלבים 2.4-2.6 או לשקול שימוש בדיקה שונים.כאן אנו משתמשים מודול מיזוג התנגדות של פרדריק Haer, ושות (fhc), בשילוב עם בורר ערוצים תוצרת בית. לחלופין, niPOD ידי NeuroNexus, Inc או NanoZ ידי Neuralynx, Inc מאפשר ניטור של עכבה של כל ערוצי בדיקה בו זמנית.
3. הדבקת בדיקה כדי Microdrive
- באמצעות סכין גילוח, לחתוך חריצים מרובים לתוך הגשר כדי ליצור משטח מחוספס.
- Appose בדיקה לגשר של הכונן. הליך זה נעשה הכי טוב תחת מיקרוסקופ ההפעלה, על ידי לחיצה על הכונן עם מהדק והתאמת בדיקה על ידי micromanipulator כך שאנקס את מקבילים באופן מושלם עם בורג הכונן. זה מבטיח כי במהלך קידום, צעד שאנקס בדיקה לתוך רקמת המוח ללא "חיתוך" דרכו. עומק מדויק של טיפים בדיקה ביחס לבסיס של הכונן יש לקבוע בשלב זה, לוקח בחשבון את עומק של מבנה היעד מפני השטח שלהגולגולת.
- בדיקה קבועה ואז לגשר במלט אחיזה.
- אופציונלי: המאפשר הדמיה מסלול בדיקה במוח, פתרון DiI (1-2% אתנול מדולל) יכול להיות מיושם על החלק האחורי של החללית בשלב זה.
4. מכינים את הגולגולת
לפני הניתוח, התייחסות הקרקע אלקטרודות, ואת חלקי כלוב פאראדיי על הראש, מוכנים:
- חותכים שתי חתיכות 2 "באורך של חוטי נחושת, ואת הקצה הלחמה אחת כל חוט נחושת מבודדים מ"מ על 1.
- באמצעות מחט, לגרד את הראש של פיסת 00-90, 1 1/8 "בורג פלדה אל חלד הלחמה של חוט נחושת אליו. הלחמה כאלה חלד הקרקע פלדה עם הברגה אלקטרודות דורש השטף המתאים (למשל, N-3 לכל מטרה השטף של La-CO) בטמפרטורות גבוהות קצה הלחמה. בזהירות למנוע הלחמה לזרום לתוך החריץ של בורג. זה ישמש האלקטרודה לקרקע. חזור עם בורג אחר חוטי נחושת כדי להכיןאלקטרודה השוואתית.
- חותכים חתיכות trapeziodal של רשת נחושת. חלקים אלו להרכיב כדי להגן על headstage.
מכשירי ניתוח והכנת זהים המשמשים ניתוחים רבים של בעלי חיים קטנים. הניתוח כולו מתבצע תחת הרדמה isoflurane עמוק, באמצעות תנאים אספטיים, על פי הנחיות NIH מאושרות. יש לציין כי הניתוח (מדומה) רואים בסרט זה הוא למטרות הדגמה בלבד. לצורך ניראות הצילומים המתאימים, מדרגות הכנה, אמצעי זהירות כמה ניתוחים ופרוצדורות לאחר הניתוח לא מוצגים / גלויה או לדיון.
לפני הניתוח, כל הרכיבים וציוד יש לעקר, בעקבות נהלים מתאימים (ראה הנחיות לניתוח מכרסמים הישרדות; http://oacu.od.nih.gov/ARAC/surguide.pdf~~HEAD=NNS). במהלך הניתוח, שדה סטרילי על הגולגולת מוכן ומבודדים על ידי וילונות סטריליים. בתום הניתוח, כמה אנטיביוטיקה ספקטרום רחב הואpplied מקומית רוצח ארוך טווח הכאב ניתנת לשריר (כגון עצירות, [Buprenex] 0.05 מ"ג / ק"ג). בנוסף, משכך כאבים (כגון איבופרופן) מסופק במי השתייה על כ 60 mg/kg/24 שעות במשך 5 ימים. עבור פרוצדורות כירורגיות בהרדמה של ממש, להתייעץ המקורות המתאימים 12.
- התקן את החיה במנגנון stereotaxic, להתגלח ולנקות את הקרקפת 13.
- חותכים את העור לאורך קו האמצע ולדחוף הצידה את הקרקפת. הסר את periosteum, נקי ויבש הגולגולת.
- למדוד את המרחק בין המיקום גבחת ו למבדה, ולקבוע את x ו-y של האתר בדיקה ההשתלה בהתאם באמצעות אטלס stereotaxic 14. סמן את האתר על ידי גירוד צלב על הגולגולת עם סכין מנתחים.
- מקדחה הגולגולת באמצעות ראש עגול תרגיל קצת (גודל ¼) ותמיכה ברגים כונן (נירוסטה, 000-120, 1/16 ") באמצע הדרך לתוך העצם, על צלחות עצם שונים על גביND בצד הגולגולת. הברגים תספק עוגנים כדי הקסדה באופן מאובטח בונד לגולגולת.
- לקדוח חורים מעל המוח הקטן והכנס את הקרקע אלקטרודות התייחסות שהוכנו בשלב 4.2. להקלטת פוטנציאלים שדה מקומיות (LFP), הבחירה של האתר הפניה היא קריטית. אתר זה נבחר בשל LFP cerebellar היא הקטנה מבין כל האזורים בקליפת המוח וממצאים שרירים הן מינימליות במיקום זה קו האמצע.
- החל דנטין activator (Metabond הערכה) בעזרת מברשת קטנה על כל פני השטח של הגולגולת. יש לשטוף אותו עם מי מלח 0.9%.
- החל דבק דנטלי (Metabond ערכת; אחר הוראות היצרן לערבוב) על הגולגולת, בזהירות כיסוי ברגים העוגן הקרקע ואלקטרודות ייחוס, אבל לעזוב את האתר ההשתלה בדיקה ברורה.
- לאבטח את הרשת ארבע נחושת דשי (מוכן בשלב 4.3) לגולגולת. לשם כך, לחזק את הבסיס הצר של כל אחד מהם, על הצדדים הקדמי שמאלה, ימינה, ואת האחורי של הגולגולת. הנחושת ה לא צריך להיות בקשר ישיר עם העצם אבל תמיד בנפרד על ידי שכבה של מלט.
5. הכנת השטח המוח
- שימוש קצת ראש עגול מקדחה, לקדוח מסביב לאתר ההשתלה בשלבים רבים, לעתים קרובות תוך כדי להשקות את העצם עם מי מלח.
- מוציאים בזהירות את דש עצם להשקות את פני השטח המוח.
- להוספת בדיקה שוק מרובה, רצועה גדולה של דורה מוסר. שני הכלים הדרושים כדי להסיר את דורה: אזמל וו מוכנים מהמחט חרק (לחלופין, microelectrode טונגסטן רגילה). לכופף את קצה המחט על ידי לחיצה על משטח קשה (למשל שקופיות מיקרוסקופ זכוכית), וצרף אותו לידית (כאן, חתיכת עצה-Q עץ, לחילופין בעל מחט microdissecting).
- הרם את דורה עם וו, לחתוך אותו עם סכין מנתחים. טיפול מיוחד נלקח כדי למנוע נזק פיא, כלי ואת פני השטח של הניאוקורטקס. דימום קטן ניתן לפתורעל ידי השקיה מליחים. אם הדימום משמעותי מתרחש או הניאוקורטקס נפגעת בדרך כלשהי, יש לשקול הפסקת ניתוח והכנת חיה אחרת.
6. השתלת בדיקה
בשלב זה, צפיפות והכיוון של ספינות שטח קליפת המוח מוערכות בזהירות. קואורדינטות Stereotaxic צריך להיות מותאם, כי בדיקה יש לחדור למוח באזור ללא כלי גדול יותר.
להשתלה, הרכבה הכונן ניתן לערוך קליפ עם תנין קשור לבעל stereotaxic. החשיפה של פני השטח ללא הפרעה מוחית קצות החללית הן קריטיות עבור חדירה מוצלחת.
- לאט לאט להוריד את החללית עד כ 1 מ"מ מעל ליעד המיועד, בעוד כל הזמן להשקות craniotomy עם מי מלח. להקלטת הניאוקורטקס, העצות בדיקה יורדו אל קליפת המוח כ 0.5 מ"מ והרים חזרה קרוב לפני השטח.
- לאטום craniotomy על ידי יישום תערובת מותכת חמה של שמן שעווה פרפין באמצעות מחט (10-20 גר 'של שעווה בשמן פרפין 10 מ"ל, מחומם על 65 מעלות צלזיוס). לפני היישום, לקרר את התערובת עד 30 ° C ולבדוק את צפיפות. זה צריך להיות רך מספיק כדי לאפשר תנועה קלה בדיקה). כדי להקל על כיסוי מלא, תערובת ניתן נמס באתרו על ידי מתקרבת שעווה קשוח עם קצה cauterizer מיקרו.
- צרף את החלק התחתון של הכונן לגולגולת במלט אחיזה, נזהר לצאת אגוז חופשי לפנות. זה הוא בעל חשיבות עליונה, כדי למנוע כל "בליטה" מקרית של הכונן בשלב זה, אחרת בדיקה יפגע קליפת המוח. לאחר נסיעה מאובטח לגולגולת, תנועה חלקה של החללית צריך להיות מאומת.
- לחזק את החלק המחבר של החללית אל הגולגולת.
7. בונים את הראש על כלוב פאראדיי
- להרים ולהרכיב את רשת הנחושת דשי לגליל מגן סביב החללית ו DRIיש. גליל משמש גם כמגן חשמל נגד רעש סביבתי, והממצאים גלים איטיים המיוצר על ידי שפם טעונים ב בעלי חיים מתנהגים.
- להתאים את גובה גליל על ידי חיתוך משם חומר עודף אז רשת הנחושת הוא בגובה החלק העליון של מחבר בדיקה.
- לרתך את החוטים מתוך התייחסות ברגים קרקעיים את הפינים המתאימים של המחבר. הלחמה גם סמוכים רשת נחושת דשי יחד כדי להבטיח המשכיות החשמל שלהם, הלחמה חוט הקרקע רשת נחושת.
- למרוח שכבה של מלט אחיזה על רשת נחושת כדי לחזק אותו כדי למנוע מגע ישיר בין המתכת והעור של בעל החיים. לחלופין, למרוח שכבה של שרף אפוקסי כדי להמשיך ולחזק את הקסדה.
- בדוק את התנועה של בורג הכונן.
- תכסה את חלקו העליון של הקסדה עם חתך חתיכה מן כפפת גומי.
8. ההקלטה החיה נעה בחופשיות
- לאחר המתאימהאכלו שלאחר הניתוח טיפול, חבר חיה למערכת ההקלטה באמצעות headstage עכבה גבוהה, קל משקל, רב גדיל כבל ultraflexible. לאזן את משקל הקסדה.
- לבדוק את איכות ההקלטה בכל יום homecage. המיקום של אתרי הקלטה נשפטת על ידי שני דפוסי ירי היחידה ואת הצורה של פוטנציאל שדה מקומיים. מנמיכים את החללית בהדרגה על ידי סיבוב בורג במרווחים קטנים (בדרך כלל 1/8 כדי סיבוב 1/4 ליום, כלומר 35-70 מיקרומטר) עד המבנה היעד הוא הגיע.
9. נציג תוצאות
אותות אלקטרו (הפוטנציאל המקומי בתחום פעילות היחידה) משתנים בהתאם למבנה הקליט את ההתנהגות הנוכחית של בעלי חיים. איור 1 מציג דוגמאות של ערוץ 32-CA1 בהיפוקמפוס תוך כדי הקלטות החולדה בוחנת שדה פתוח. הערה בולטת 8 הרץ (תטא הלהקה) תנודה של הפוטנציאל בתחום המקומי במהלך החקירה עם לסעודerimposed להתחדד על שאנקס מרובים ואתרים (דוגמאות של קוצים שמציינים ראשי חץ). לנתח פעילות יחידת העצבית, קוצים מזוהים מיון ליחידות בודדות באמצעות ניתוח אשכולות של צורות גל שלהם 15-16.
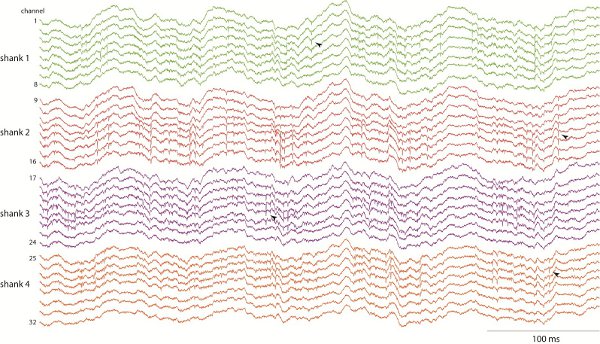
באיור 1. CA1 בהיפוקמפוס הקלטות של עכברוש מתנהג באמצעות מספר 4 שאנקס x 8 אתרי בדיקה סיליקון. הקלטות הן wideband ו שנדגמו ב 20 000 הרץ, המאפשר ללמוד את שתי תנודות בשדה המקומי פוטנציאליים (למשל "תטא" להקת הקצב 8 הרץ) ופעילות סימנים מחודדים העצבית.
Access restricted. Please log in or start a trial to view this content.
Discussion
סרט זה ממחיש את ההליך השתלת סיליקון עבור בדיקות בקנה מידה גדול הקלטות כרוניות בחולדה מתנהג. שלבים קריטיים כדי להבטיח הקלטות באיכות של הפעילות העצבית נובעים השבריריות של שניהם ביולוגי (רקמת המוח) ו טכניים (סיליקון בדיקה) חומרים. זהירות יש לנקוט בזמן הטיפול בדיקה כדי ל?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
מארי קירי International Fellowship יוצא (FP/2007-2013 של האיחוד האירופי הסכמי גרנט # 221834 ו - 254780), JD קרן מקדונל, NSF גרנט SBE 0542013, המכונים הלאומיים לבריאות גרנט NS034994, המכון הלאומי לבריאות הנפש MH5467 גרנט לבין הווארד יוז רפואי במכון (Janelia חוות מחקר קמפוס המענק).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments | |
| שם | סוג | חברה | מספר קטלוגי | תגובות |
| הסיליקון בדיקה Buzsaki32, 4 ובמוטות מושחזים x 8 אתרים. אריזה: כבל גמיש פוליאמיד | חומר | NeuroNexus | בדיקה: buzsaki32 אריזה: HC32 | הקלטה בדיקה |
| בורג נחושת עגול, 00-90 x 1/2 ברגי פליז עגול | חומר | JIMorris | R0090B500 | כונן חלק |
| הקס אגוזים פליז, 00-90 | חומר | JIMorris | N0090B | כונן חלק |
| פליז C260 עזה, ASTM-B36 עובי: 0.025 ", אורך: 12", רוחב: 1/2 " | חומר | חלקים קטנים | B000FMYU72 | כונן חלק |
| מחבר כותרת, גובה 2 מ"מ, מ 'אייל, שורה אחת, straigt, 36 עמדות | חומר | Digikey | 2163S-36-ND | כונן חלק |
| 2 חלקים Sylgard אלסטומר סיליקון | חומר | Precision של מכשירים בעולם | SYLG184 | כדי לבודד במיוחד בדיקה |
| Decon Contrad 70 בנוזל כביסה | מגיב | פישר סיינטיפיק | 04-355 Decon מעבדות מספר: 1002 | כדי לנקות את האתרים הקלטה |
| מיזוג עכבה מודול | ציוד | Fhc בע"מ | 55-70-0 | עכבה מטר |
| niPOD - 32 ערוצים | ציוד | Neuronexus | niPOD -32 | עכבה מטר |
| מלט גריפ תעשייתי כיתה | חומר | קולק Dentsply | 675,571 (אבקה) 675,572 (ממס) | גריפ לספירהment |
| 1,1 ", dioctadecyl-3, 3,3", 3'-tetramethylindocarbocyanine פרכלורט ("DiI '; DiIC18 (3)) | מגיב | Invitrogen | D282 | להכתים את המסלול בדיקה במוח |
| מכונת נירוסטה בורג פלדה, ראש איגוד, כונן מחוררת, # 00-90, 1/8 " | חומר | חלקים קטנים | MX-0090-02B | הקרקע ברגים התייחסות |
| חוט מגנט, 20 גר ', ניילון, פוליאוריטן ציפוי, MW80 | חומר | חלקים קטנים | B000IJYRP2 | הקרקע חוט התייחסות |
| מכונת נירוסטה בורג פלדה, ראש איגוד מחוררת דרייב, # 000-120, 1/16 " | חומר | חלקים קטנים | MX-000120-01B | עוגן ברגים |
| N-3 כל נוזלי שטף מטרה | מגיב | La-Co (Markal) | 23512 | מאפשר לרתך נירוסטה |
| MicroGrid Precision מורחב נחושת | חומר | Dexmet | 3 CU6 FA-050 | נחושת רשת עבור על ראש כלוב פאראדיי |
| C & B-METABOND מהר! מלט מערכת - דנטין Activator | חומר | Parkell | S380 | |
| C & B-METABOND מהר! מערכת מלט - צמנט שיניים | חומר | Parkell | S380 | |
| נקודה חדה טונגסטן המחט בעל | כלי | Roboz מכשירי ניתוח | RS-6064 ו-RS-6061 | כדי להפוך את הקרס להרים את דורה |
| קרביד Bur HP 1/4 | כלי | הנרי שיין | 9990013 | |
| פרפין (גרגרי) | חומר | פישר סיינטיפיק | P31-500 | |
| שמן מינרלי, אור (NF / FCC) | חומר | פישר סיינטיפיק | O121-1 | |
| GC אלקטרוניקה 10-114 2 חלקים דבק אפוקסי | חומר | ניוארק | 00Z416 | |
| 1 סוג LITZ 21 AWG 40/36 אדומה אחת פוליאוריתן, ניילון (MW80-C) .041 "+ / -0.002" OD | חומר | ניו אינגלנד Wire Technologies Corporation | N28-36E-400-2 | כדי להפוך את הכבל בין headstage ו מגבר |
| 32 ערוצים הגדול מאוד שילוב headstage קנה מידה, 20x רווח | ציוד | Plexon | HST/32V-G20 | Headstage |
References
- Buzsáki, G. High-frequency network oscillation in the hippocampus. Science. 256, 1025-1027 (1992).
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261, 1055-1058 (1993).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat. Neurosci. 7, 446-451 (2004).
- Buzsáki, G. Visualizing Large-Scale Patterns of Activity in the Brain: Optical and Electrical Signals. Society for Neuroscience. , Washington, DC. (2004).
- Nicolelis, M. A. L. Methods for Neural Ensemble Recordings. , 2nd edition, CRC Press. Boca Raton, FL. (2008).
- Hatsopoulos, N. G., Donoghue, J. P. The science of neural interface systems. Annu. Rev. Neurosci. 32, 249-266 (2009).
- Battaglia, F. P. The Lantern: an ultra-light micro-drive for multi-tetrode recordings in mice and other small animals. J. Neurosci. Methods. 178, 291-300 (2009).
- Kloosterman, F., Davidson, T. J. Micro-drive Array for Chronic in vivo Recording: Drive Fabrication. J. Vis. Exp. 26, e1094-e1094 (2009).
- Nguyen, D. P., Layton, S. P. Micro-drive Array for Chronic in vivo Recording: Tetrode Assembly. J. Vis. Exp. (26), e1098-e1098 (2009).
- Haiss, F., Butovas, S., Schwarz, C. A miniaturized chronic microelectrode drive for awake behaving head restrained mice and rats. J. Neurosci. Methods. 187, 67-72 (2010).
- Cerf, M. On-line, voluntary control of human temporal lobe neurons. Nature. 467, 1104-1108 (2010).
- Kohn, D. F. Anesthesia and Analgesia in Laboratory Animals. American College of Laboratory Animal Medicine. series, (1997).
- Schjetnan, A. G. P., Luczak, A. Recording Large-scale Neuronal Ensembles with Silicon Probes in the Anesthetized Rat. J. Vis. Exp. (56), e3282-e3282 (2011).
- Paxinos, G., Watson, C. The Rat Brain. Stereotaxic Coordinates. , Elsevier Academic. Amsterdam. (1982).
- Harris, K. D. Accuracy of tetrode spike separation as determined by simultaneous intracellular and extracellular measurements. J. Neurophysiol. 84, 401-414 (2000).
- Hazan, L., Zugaro, M., Buzsáki, G. Klusters, NeuroScope, NDManager: a Free Software Suite for Neurophysiological Data Processing and Visualization. J. Neurosci. Methods. 155, 207-216 (2006).
- Kipke, D. R. Advanced neurotechnologies for chronic neural interfaces: new horizons and clinical opportunities. J. Neurosci. 28, 11830-11838 (2008).
- Csicsvari, J. Massively parallel recording of unit and local field potentials with silicon-based electrodes. J. Neurophysiol. 90, 1314-1323 (2003).
- Sodagar, A. M., Wise, K. D., Najafi, K. A fully integrated mixed-signal neural processor for implantable multichannel cortical recording. IEEE Trans. Biomed. Eng. 54, 1075-1088 (2007).
- O'Connor, D. H., Huber, D., Svoboda, K. Reverse engineering the mouse brain. Nature. 461, 923-929 (2009).
- Boyden, E. S. Millisecond-timescale, genetically targeted optical control of neural activity. Nat. Neurosci. 8, 1263-1268 (2005).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nat. Rev. Neurosci. 8, 577-581 (2007).
- Royer, S. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. Eur. J. Neurosci. 31, 2279-2291 (2010).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved