Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Großflächige Aufnahme von Neuronen durch Movable Silicon Probes in Behaving Nagetiere
In diesem Artikel
Zusammenfassung
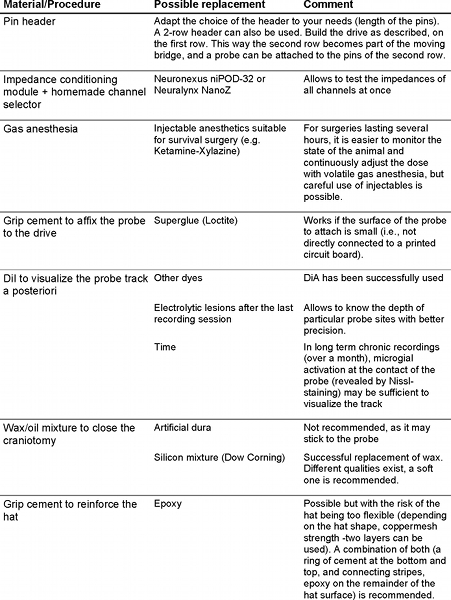
Wir beschreiben Methoden zur großflächigen Erfassung von mehreren Einzelgeräten und lokalen Bereich Potential in Nagetieren verhalten mit Silizium-Sonden. Antrieb Fertigung, Sonde Befestigung an der Antriebs-und Sonde Implantation Prozesse sind in ausreichender Details für eine einfache Replikation dargestellt.
Zusammenfassung
Eine große Herausforderung in den Neurowissenschaften ist die Verknüpfung mit dem kollektiven Verhalten Aktivität neuronaler Baugruppen. Verständnis der Input-Output-Beziehungen von Neuronen und Schaltungen erfordert Methoden, mit der räumlichen Selektivität und zeitlicher Auflösung geeignet für mechanistische Analyse von neuronalen Ensembles in der Tier verhält, dh die Aufnahme von großen Proben repräsentativ isolierter einzelner Neurone. Ensemble Überwachung der neuronalen Aktivität hat sich in den vergangenen zehn Jahren in kleinen und mit großem Gehirn Tiere, einschließlich der menschlichen Probanden 1-11 fortgeschritten ist. Multiple-Ort-Aufnahme mit Silizium-basierten Geräte sind besonders effektiv, da sie hochgradig skalierbar, kleines Volumen und geometrisches Design.
Hier beschreiben wir mehrere Methoden zur Erfassung einzelner Neurone und lokale Feld Potential in Nagetieren zu verhalten, mit handelsüblichen mikrobearbeiteten Silizium-Sonden mit maßgeschneiderten Zubehör-Komponenten. Es gibt zwei grundlegende Optionen foder die Anbindung an Silizium-Sonden-Vorverstärker: Leiterplatten und flexiblen Kabeln. Probe Zulieferfirmen ( http://www.neuronexustech.com/ ; http://www.sbmicrosystems.com/ ; http://www.acreo.se/ ) bieten in der Regel die Bonding-Service und liefern Sonden gebunden an Leiterplatten oder flexible Leitungen. Hier beschreiben wir die Implantation eines 4-Schaft, 32-Seite Sonde an flexiblen Polyimid-Kabel und an einem beweglichen Microdrive. Jeder Schritt der Sonde Vorbereitung wird Microdrive Konstruktion und Operation dargestellt, so dass der Endanwender kann problemlos replizieren Sie den Vorgang.
Protokoll
1. Der Bau des Microdrive
Ein bewegliches Teil, der die Elektrode und einen festen Teil, der am Schädel befestigt wird trägt: Alle Laufwerke werden aus den gleichen Grundelementen. Ein idealer Microdrive erlaubt glatt, aber lang genug, Reisen von der Elektrode in mehreren kleinen Schritten, ist robust genug, um versehentliche Bewegung der Elektrode, einfach durch den Experimentator ohne Eingriff in das Verhalten des Tieres, klein und leicht im Gewicht manipulieren zu verhindern. Als ein Ergebnis dieser konkurrierenden Anforderungen, verschiedene Antriebe jeweils unterschiedliche Anwendungen.
Nur 4 Teile sind nötig, um unsere grundlegenden Antrieb zu bauen: ein Messing-Senkkopfschraube, eine passende Mutter, eine Kunststoff-Brücke aus einer einzigen Zeile Pin-Header und zwei benutzerdefinierte-cut Messingplatten vorbereitet.
- Brechen Sie ein 3-Pin-Stück aus dem Header
- Ziehen Sie die mittlere Pin.
- Vergrößern Sie das Loch durch das Bohren durch sie mit einem Bohrer Größe # 55.
- Schneiden Sie ein thLesen mit dem 00-90 Leitungswasser.
- Schneiden Sie zwei Stücke aus der Messingplatte.
- Sie die Kanten der Platten mit einer Dremmel.
- Bohren Sie ein Loch in der Mitte der beiden Stücke mit einer Bohrkrone Größe # 65.
- Bauen Sie die Festplatte Stücke, so dass die Messingplatten sind die Stifte zu berühren. Um dies zu erreichen, legen Sie die Messing-Schraube durch Nacheinander die Messingplatte, der Gewindestift Header-Loch, der zweite Messingplatte, und die Mutter. Ziehen Sie die Schraube vorsichtig, so dass die Montage stabil wird.
- Löten Sie den Stift endet mit den Messingplatten.
- Datei das vorstehende Ende der Schraube.
- Löten Sie die Mutter mit der Schraube. Achten Sie darauf, löten Sie die Mutter auf der Messingplatte.
- Testen Sie die Bewegung des Antriebs: Drehen Sie die Schraube im Uhrzeigersinn, um die Kunststoff-Brücke zu heben.
2. Vorbereiten des Silizium-Sonde
Vor der Befestigung der Sonde an den Antrieb, fügen Sie zusätzliche Isolierung zur Bindung der Sonde zu verhindern cerebrospinal Flüssigkeit (CSF) oder Feuchtigkeit aus der Produktion Kurzschlüsse:
- Wiegen und Mischen der Komponenten Sylgard Elastomer in einem Verhältnis von 10:1.
- Mit einem geschärften Watteträger, gelten die Sylgard mit dem oberen Ende der Sonde.
- Lassen Sie es trocken in einem Ofen bei 60 ° C für 2 Stunden vorgeheizt.
Um sicherzustellen, dass die Aufnahme Seiten frei von Rückständen sind, müssen die Sondenspitzen gereinigt werden:
- Bereiten Sie eine Verdünnung von 4% contrad Reinigungsmittel.
- Lassen Sie die Sonde in der Waschmittel einweichen bei 63 ° C für mindestens 2 Stunden.
- Spülen Sie das Reinigungsmittel durch Eintauchen der Sonde mehrfach in destilliertem Wasser.
Vor der Befestigung der Sonde an den Antrieb, sollte die Impedanz jeder Aufnahme vor Ort überprüft werden:
- Tauchen Sie die Sonde in 0,9% iger Kochsalzlösung, und verbinden Sie es mit einer Impedanz-Meter. Wenn zu viele Aufzeichnung Seiten haben falsche Impedanz, wiederholen Sie die Schritte 2,4-2,6 oder zu prüfen, mit einer anderen Sonde.Hier verwenden wir eine Impedanz Konditionierungsmodul von Frederick Haer, Co. (FHC), mit einem hausgemachten Kanalwähler kombiniert. Alternativ kann ein niPOD von NeuroNexus, Inc. oder NanoZ von Neuralynx, Inc., das die Überwachung der Impedanz der Sonde alle Kanäle gleichzeitig.
3. Anbringung der Sonde mit dem Microdrive
- Mit Hilfe einer Rasierklinge geschnitten mehrere Rillen in die Brücke, um eine raue Oberfläche zu schaffen.
- Appose die Sonde auf die Brücke des Antriebs. Dieses Verfahren ist am besten unter einem Operationsmikroskop durchgeführt, indem das Laufwerk mit einer Schelle und das Einstellen der Sonde durch einen Mikromanipulator, so dass die Schenkel vollkommen parallel mit der Antriebsspindel sind. Dies gewährleistet, dass während der Vorwärtsbewegung, die Sonde Schäfte Umzug ins Hirngewebe ohne "Schneiden" durch sie. Die genaue Tiefe der Sondenspitzen relativ zu der Basis des Antriebs ist zu diesem Zeitpunkt bestimmt werden, unter Berücksichtigung der Tiefe der Zielstruktur von der Oberfläche derSchädel.
- Die Sonde wird auf der Brücke mit Griff Zement fixiert.
- Optional zur Visualisierung der Sonde Spur im Gehirn, DiI Lösung (1-2% in Ethanol verdünnt) auf der Rückseite der Sonde zu diesem Zeitpunkt angewendet werden.
4. Vorbereiten des Schädels
Vor der Operation werden die Referenz und Erdungselektroden und die Teile der auf dem Kopf Faraday-Käfig hergestellt:
- Schneiden Sie zwei 2 "-lange Stücke aus Kupferdraht und Lötzinn ein Ende jedes isoliertem Kupferdraht für etwa 1 mm.
- Mit Hilfe einer Nadel, kratzen Sie den Kopf eines 00 bis 90, 1/8 "Schraube aus rostfreiem Stahl und löten ein Stück Kupferdraht dazu. Löten wie Edelstahl Erdungsschraube-Elektroden erfordert eine geeignete Flussmittel (zB N-3 All Zweck Fluss von La-Co) und hohen Lötspitzentemperaturen. vorsichtig verhindern Lot fließt in die Nut der Schnecke. Dies ist als Masseelektrode verwendet. Wiederholen mit einem anderen Schraube und Kupferdraht zur Herstellungdie Referenzelektrode.
- Schneiden Sie Trapezoid Stücke aus Kupfergeflecht. Diese Stücke werden zusammengebaut, um die headstage zu schützen.
Chirurgische Instrumente und Herstellung sind die gleichen wie in viele kleinere Operationen verwendet. Die gesamte Operation wird unter tiefe Isofluran-Narkose durchgeführt, unter Verwendung aseptischen Bedingungen, nach NIH-Richtlinien geprüft. Bitte beachten Sie, dass die (Schein-) Operation in diesem Video gezeigt zu Demonstrationszwecken ist nur. Für eine angemessene Außenwirkung und Filmaufnahmen Zwecke, mehrere vorbereitende Schritte, chirurgische Vorsichtsmaßnahmen und postoperativen Verfahren werden nicht angezeigt / sichtbar oder diskutiert.
Vor der Operation sollten alle Komponenten und Zubehör sterilisiert, nach geeigneten Verfahren (siehe Leitfaden für Survival-Nager Chirurgie; http://oacu.od.nih.gov/ARAC/surguide.pdf) werden. Während der Operation wird ein steriles Feld auf dem Schädel hergestellt und sterilen Tüchern isoliert. Am Ende der Operation wird ein breites Spektrum Antibiotika einlokal und ngewandte ein lang wirkendes Schmerzmittel wird intramuskulär (zB Buprenorphin, [Buprenex] 0,05 mg / kg) angegeben. Darüber hinaus, Schmerzmittel (zB Ibuprofen) in das Trinkwasser bei etwa 60 Uhr mg/kg/24 für 5 Tage vorgesehen. Für die richtige OP-und Anästhesie-Verfahren, wenden Sie geeigneten Quellen 12.
- Installieren Sie das Tier in der stereotaktischen Apparat, rasieren und reinigen die Kopfhaut 13.
- Schneiden Sie die Haut entlang der Mittellinie und beiseite schieben die Kopfhaut. Entfernen Sie die Knochenhaut, reinigen und trocknen den Schädel.
- Messen der Lage und Abstand zwischen Bregma und lambda, und bestimmen die x und y-Koordinaten der Sonde Implantationsstelle entsprechend unter Verwendung eines stereotaktischen Atlas 14. Markieren Sie die Stelle durch Kratzen ein Kreuz auf den Schädel mit einem Skalpell.
- Bohren Sie den Schädel mit einem runden Kopf Bohrer (Größe ¼) und Laufwerk-Unterstützung Schrauben (Edelstahl, 000-120, 1/16 ") zur Hälfte in den Knochen, auf verschiedenen Knochenplatten auf der Spitze einerRunde auf der Seite des Schädels. Die Schrauben werden Anker sicher Bindung der Kopfbedeckung auf den Schädel geben.
- Die Bohrungen über dem Kleinhirn und legen Sie die Grund-und Referenz-Elektroden in Schritt 4.2 vorbereitet. Zur Erfassung von lokalen Feldpotentiale (LFP), ist die Wahl des Referenz-Website kritisch. Diese Website wird gewählt, weil Kleinhirn-LFP ist der kleinste von allen kortikalen Regionen und Muskel-Artefakte sind an diesem Standort Mittellinie minimal.
- Bewerben Dentin-Aktivator (Metabond Kit) mit einem winzigen Pinsel über die gesamte Oberfläche des Schädels. Spülen Sie ihn mit 0,9% iger Kochsalzlösung.
- Bewerben Zahnzement (Metabond Kit, folgen den Anweisungen des Herstellers zum Mischen) auf dem Schädel, sorgfältig abdecken Ankerschrauben und Boden-und Referenzelektrode, sondern verlässt die Sonde Implantationsstelle klar.
- Sichern Sie die vier Klappen Kupfergeflecht (hergestellt in Schritt 4.3) auf den Schädel. Dafür zementieren die schmale Basis eines jeden von ihnen auf den vorderen, linken, rechten und hinteren Seiten des Schädels. The Kupfer ist nie in direkten Kontakt mit dem Knochen, aber immer mit einer Schicht aus Zement getrennt.
5. Vorbereiten der Hirnoberfläche
- Mit einem runden Kopf Bohrer, rund um die Implantationsstelle in mehreren Stufen zu bohren, während häufig Bewässern des Knochens mit Kochsalzlösung.
- Entfernen Sie vorsichtig die Knochendeckel und bewässern die Hirnoberfläche.
- Zum Einfügen eines Mehrfach-Schaft-Sonde wird, eines Streifens von Dura entfernt. Zwei Werkzeuge sind nötig, um die Dura zu entfernen: ein Skalpell und einen Haken aus einem Insekt Nadel (alternativ eine Standard-Wolfram-Mikroelektrode) vorbereitet. Biegen Sie die Spitze der Nadel, indem Sie gegen eine harte Oberfläche (zB Glas-Objektträger), und verbinden Sie es mit einem Griff (hier, ein Stück Holz Q-Tip, alternativ ein microdissecting Nadelhalter).
- Heben Sie die Dura mit dem Haken, und schneiden Sie es mit einem Skalpell. Besondere Sorgfalt wird angewendet, um eine Beschädigung der Pia, Gefäße und die Oberfläche des Neokortex. Kleine Blutungen gelöst werden könnenKochsalzlösung durch Bewässerung. Wenn schwere Blutung auftritt oder der Neokortex ist in keiner Weise gefährdet ist, sollte man überlegen Beendigung der Operation und bereitet ein weiteres Tier.
6. Die Implantation der Sonde
In diesem Stadium sind die Dichte und Ausrichtung der kortikalen Oberfläche Schiffe sorgfältig untersucht. Stereotaktischen Koordinaten sollte so eingestellt werden, weil die Sonde hat, um das Gehirn in einem Gebiet frei von größeren Schiffen zu durchdringen.
Für die Implantation kann das Laufwerk mit einer Krokodilklemme an der stereotaktischen Halterung gehalten werden. Lückenlose Transparenz der Hirnoberfläche und die Spitzen der Sonde sind entscheidend für eine erfolgreiche Penetration.
- Langsam senken die Sonde bis auf ca. 1 mm über dem angestrebten Ziel, unter ständigem Bewässern des Kraniotomie mit Kochsalzlösung. Für neokortikalen Aufnahme werden die Messspitzen in die Rinde ca. 0,5 mm abgesenkt und angehoben Rücken nahe der Oberfläche.
- Dichtung des Schädels durch Anlegen einer warmen geschmolzenen Mischung aus Wachs und Paraffin durch eine Nadel (10-20g des Wachses in 10 ml Paraffinöl, erhitzt auf 65 ° C). Vor der Anwendung kühlen Sie die Mischung auf 30 ° C und testen Sie die Dichte. Es sollte weich genug, um leicht Sonde Bewegung zu ermöglichen). Um eine vollständige Abdeckung zu erleichtern, kann die Mischung in situ durch Annäherung an den gehärteten Wachs mit der Spitze eines Mikro-cauterizer geschmolzen werden.
- Befestigen Sie die Unterseite des Laufwerks an den Schädel mit Griff Zement, wobei darauf zu verlassen, die Mutter frei drehen. Es ist von größter Bedeutung, um einen versehentlichen "bump" des Laufwerks in diesem Stadium zu vermeiden, da sonst die Sonde beschädigen die Rinde. Wenn der Antrieb auf den Schädel befestigt ist, sollte eine glatte Bewegung der Sonde nachgewiesen werden.
- Zement das Verbindungsteil der Sonde an dem Schädel.
7. Aufbauend auf den Kopf-Faraday-Käfig
- Ziehen Sie nach oben und montieren die Kupfergeflecht Klappen in eine schützende Zylinder um die Sonde und drive. Der Zylinder dient auch als eine elektrische Abschirmung gegen Umgebungslärm und die Verzögerungswellenstruktur Artefakte, die durch den geladenen Whisker in dem Verhalten Tier produziert.
- Passen Sie die Zylinderhöhe durch Wegschneiden von überschüssigem Material, so dass die Cu-Geflecht, auf gleicher Höhe mit der Spitze der Sonde Anschluss.
- Löten Sie die Drähte von der Referenz-und Boden Schrauben an die entsprechenden Pins des Steckers. Auch Lot angrenzenden Kupfergeflecht Klappen zusammen, um sicherzustellen, dass ihre elektrische Kontinuität, und löten Sie den Erdungsleiter mit dem Kupfergeflecht.
- Tragen Sie eine Schicht Zement auf dem Griff Kupfergeflecht, um es zu verstärken und den direkten Kontakt zwischen dem Metall und der Haut des Tieres zu verhindern. Optional kann eine Schicht aus Epoxidharz zur weiteren Stärkung der Kopfbedeckungen.
- Testen Sie die Bewegung des Antriebs fest.
- Decken Sie die Oberseite der Kopfbedeckung mit einem Stück geschnitten aus einem Gummihandschuh.
8. Aufnahme in den frei beweglichen Tier
- Nach entspreaß post-operative Betreuung, verbinden Sie das Tier auf die Recording-System mit einer hohen Impedanz headstage und eine leichte, hochflexible mehradrige Kabel. Gegengewicht zu den Kopfbedeckungen.
- Testen Sie die Qualität der Aufzeichnung jeden Tag in der homecage. Die Position der Aufnahmestellen von beiden Einheit Brennen Muster und die Form der lokalen Feldpotentiale beurteilt. Senken Sie die Sonde schrittweise durch Drehen der Schraube in kleinen Schritten (in der Regel 1/8 bis 1/4 Umdrehung pro Tag, dh 35-70 Mikrometer), bis die Zielstruktur erreicht ist.
9. Repräsentative Ergebnisse
Elektrophysiologische Signale (Feldpotenzial und Einheit Aktivität) hängt von der Struktur aufgenommen und dem aktuellen Verhalten des Tieres abhängig. Abbildung 1 zeigt Beispiele von 32-Kanal-CA1 des Hippocampus-Aufnahmen, während die Ratte erforscht ein offenes Feld. Notieren Sie sich die prominenten 8 Hz (Theta-Band) Schwingung des lokalen Feldes potentielle während der Exploration mit superimposed Spiking auf mehreren Schäften und Websites (Beispiele für Spikes durch Pfeilspitzen markiert). Um neuronale Aktivität Einheit zu analysieren, sind Spikes erkannt und in einzelne Einheiten mit Cluster-Analyse ihrer Wellenformen 15-16 sortiert.
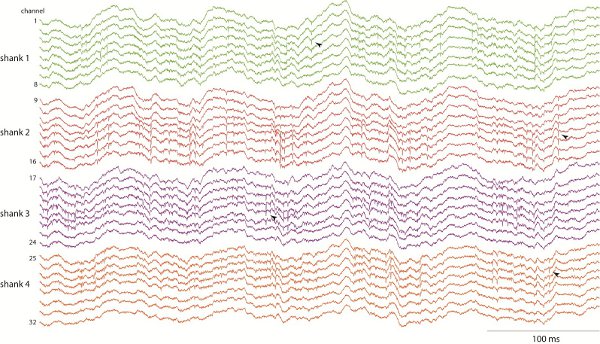
Abbildung 1. CA1 Hippocampale Aufnahmen in der Ratte verhalten mit einem 4 x 8 Schäfte Sites Silizium-Sonde. Aufnahmen sind Breitband-und beprobt 20 000 Hz, die sowohl lokale als Feldpotenzial Schwingungen (zB "Theta" Band 8 Hz-Rhythmus) und die neuronale Aktivität zu untersuchen Spikes erlaubt.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Dieser Film zeigt die Implantation von Silizium-Sonden für chronische großflächige Aufnahmen in der Ratte zu verhalten. Kritische Schritte, um hochwertige Aufnahmen der neuronalen Aktivität zu gewährleisten ergeben sich aus der Zerbrechlichkeit der sowohl biologische (Hirngewebe) und technische (Silizium-Sonde) Materialien. Besondere Vorsicht ist geboten beim Umgang mit der Sonde, um jeglichen Kontakt von Schäften mit jedem remote "harte" Oberfläche (zum Beispiel die Schäfte brechen würde, wenn man ve...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Marie Curie International Outgoing Fellowship (Europäischen Union FP/2007-2013 Finanzhilfevereinbarungen # 221834 und 254780), JD McDonnell Foundation, NSF Grant SBE 0542013, National Institutes of Health Grants NS034994, National Institute of Mental Health Grants MH5467 und das Howard Hughes Medical Institute (Janelia Farm Research Campus Finanzhilfe).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments | |
| Name | Typ | Firma | Katalog-Zahl | Kommentare |
| Silicon Sonde Buzsaki32, 4 Schäfte x 8 Seiten. Verpackung: flexible Polyamid-Kabel | Material | NeuroNexus | Probe: buzsaki32 Verpackung: HC32 | Recording-Sonde |
| Messing-Schraube, 00-90 x 1/2 Runde Messing Schrauben | Material | JIMorris | R0090B500 | Antriebsteil |
| Messing Sechskantmutter, 00-90 | Material | JIMorris | N0090B | Antriebsteil |
| Messing-Streifen C260, ASTM-B36 Dicke: 0.025 ", Länge: 12", Breite: 1/2 " | Material | Kleinteile | B000FMYU72 | Antriebsteil |
| Connector-Header, Raster 2mm, mAle, einreihig, geradeaus, 36 Positionen | Material | Digikey | 2163S-36-ND | Antriebsteil |
| 2-teilige Sylgard Silikonkautschuk | Material | World Precision Instruments | SYLG184 | Zum Extra-Isolierung der Sonde |
| Decon contrad 70 Flüssigwaschmittel | Reagens | Fisher Scientific | 04-355 Decon Laboratories Nr.: 1002 | Um die Aufzeichnung zu reinigen Sites |
| Impedanz Konditionierungsmodul | Ausrüstung | FHC Inc. | 55-70-0 | Impedanzmeterfunktion |
| niPOD - 32 Kanäle | Ausrüstung | Neuronexus | niPOD -32 | Impedanzmeterfunktion |
| Grip Cement Industrial Grade | Material | Dentsply Caulk | 675571 (Pulver) 675572 (Lösungsmittel) | Grip cement |
| 1,1 '-Dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyaninperchlorat ("Dil '; DiIC18 (3)) | Reagens | Invitrogen | D282 | Um die Sonde Spur im Gehirn Fleck |
| Stainless Steel Maschinenschraube, Binding Head, Schlitz-Drive, # 00-90, 1/8 " | Material | Kleinteile | MX-0090-02B | Grund-und Referenz-Schrauben |
| Magnet Draht, 20G, Nylon-Polyurethan-Beschichtung, MW80 | Material | Kleinteile | B000IJYRP2 | Grund-und Referenz-Draht |
| Stainless Steel Maschinenschraube, Binding mit Schlitz Drive, # 000-120, 1/16 " | Material | Kleinteile | MX-000120-01B | Ankerschrauben |
| N-3 Allzweck Flußmittelflüssigkeit | Reagens | La-Co (Markal) | 23512 | Ermöglicht zu löten Edelstahl- |
| MicroGrid Precision Expanded Kupfer | Material | Dexmet | 3 CU6-050 FA | Kupfergeflecht für an-Kopf-Faraday-Käfig |
| C & B-Metabond Schnell! Zement-System - Dentin Activator | Material | Parkell | S380 | |
| C & B-Metabond Schnell! Zement-System - Zahnzement | Material | Parkell | S380 | |
| Sharp Punkt Wolfram Nadel und Halter | Werkzeug | Roboz Chirurgische Instrumente | RS-6064 und RS-6061 | Um den Haken, um die Dura heben |
| Karbidbohrer HP 1/4 | Werkzeug | Henry Schein | 9990013 | |
| Paraffin (Granulat) | Material | Fisher Scientific | P31-500 | |
| Mineral Oil, Light (NF / FCC) | Material | Fisher Scientific | O121-1 | |
| GC ELECTRONICS 10-114 2-Komponenten-Epoxy-Kleber | Material | Newark | 00Z416 | |
| Typ 1 LITZ 21 AWG 40/36 Red Einzel Polyurethan-Nylon (MW80-C) 0,041 "+ / -0,002" OD | Material | New England Draht Technologies Corporation | N28-36E-400-2 | Um das Kabel zwischen dem headstage und dem Verstärker machen |
| 32-Kanal-Very Large Scale Integration headstage, 20x Gewinn | Ausrüstung | Plexon | HST/32V-G20 | Headstage |
Referenzen
- Buzsáki, G. High-frequency network oscillation in the hippocampus. Science. 256, 1025-1027 (1992).
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261, 1055-1058 (1993).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat. Neurosci. 7, 446-451 (2004).
- Buzsáki, G. Visualizing Large-Scale Patterns of Activity in the Brain: Optical and Electrical Signals. Society for Neuroscience. , Washington, DC. (2004).
- Nicolelis, M. A. L. Methods for Neural Ensemble Recordings. , 2nd edition, CRC Press. Boca Raton, FL. (2008).
- Hatsopoulos, N. G., Donoghue, J. P. The science of neural interface systems. Annu. Rev. Neurosci. 32, 249-266 (2009).
- Battaglia, F. P. The Lantern: an ultra-light micro-drive for multi-tetrode recordings in mice and other small animals. J. Neurosci. Methods. 178, 291-300 (2009).
- Kloosterman, F., Davidson, T. J. Micro-drive Array for Chronic in vivo Recording: Drive Fabrication. J. Vis. Exp. 26, e1094-e1094 (2009).
- Nguyen, D. P., Layton, S. P. Micro-drive Array for Chronic in vivo Recording: Tetrode Assembly. J. Vis. Exp. (26), e1098-e1098 (2009).
- Haiss, F., Butovas, S., Schwarz, C. A miniaturized chronic microelectrode drive for awake behaving head restrained mice and rats. J. Neurosci. Methods. 187, 67-72 (2010).
- Cerf, M. On-line, voluntary control of human temporal lobe neurons. Nature. 467, 1104-1108 (2010).
- Kohn, D. F. Anesthesia and Analgesia in Laboratory Animals. American College of Laboratory Animal Medicine. series, (1997).
- Schjetnan, A. G. P., Luczak, A. Recording Large-scale Neuronal Ensembles with Silicon Probes in the Anesthetized Rat. J. Vis. Exp. (56), e3282-e3282 (2011).
- Paxinos, G., Watson, C. The Rat Brain. Stereotaxic Coordinates. , Elsevier Academic. Amsterdam. (1982).
- Harris, K. D. Accuracy of tetrode spike separation as determined by simultaneous intracellular and extracellular measurements. J. Neurophysiol. 84, 401-414 (2000).
- Hazan, L., Zugaro, M., Buzsáki, G. Klusters, NeuroScope, NDManager: a Free Software Suite for Neurophysiological Data Processing and Visualization. J. Neurosci. Methods. 155, 207-216 (2006).
- Kipke, D. R. Advanced neurotechnologies for chronic neural interfaces: new horizons and clinical opportunities. J. Neurosci. 28, 11830-11838 (2008).
- Csicsvari, J. Massively parallel recording of unit and local field potentials with silicon-based electrodes. J. Neurophysiol. 90, 1314-1323 (2003).
- Sodagar, A. M., Wise, K. D., Najafi, K. A fully integrated mixed-signal neural processor for implantable multichannel cortical recording. IEEE Trans. Biomed. Eng. 54, 1075-1088 (2007).
- O'Connor, D. H., Huber, D., Svoboda, K. Reverse engineering the mouse brain. Nature. 461, 923-929 (2009).
- Boyden, E. S. Millisecond-timescale, genetically targeted optical control of neural activity. Nat. Neurosci. 8, 1263-1268 (2005).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nat. Rev. Neurosci. 8, 577-581 (2007).
- Royer, S. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. Eur. J. Neurosci. 31, 2279-2291 (2010).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten