É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Em larga escala de gravação de Neurônios por sondas de silicone móveis em Comportando Roedores
Neste Artigo
Resumo
Descrevemos os métodos de larga escala de gravação de várias unidades e potencial de campo local, comportando roedores com sondas de silício. Unidade de fabricação, o apego sonda para a unidade e os processos de implantação de teste são ilustrados em detalhes suficientes para a replicação fácil.
Resumo
Um dos grandes desafios da neurociência está ligando para o comportamento da atividade coletiva de montagens neurais. Entendimento de input-output relações de neurônios e circuitos requer métodos com a seletividade espacial e resolução temporal adequada para a análise mecanicista de conjuntos neurais em que o animal se comportar, ou seja, gravação de amostras representativas de grandes isolados neurônios individuais. Monitoramento conjunto da atividade neuronal tem progredido significativamente na última década em animais pequenos e grandes cérebros, incluindo seres humanos 1-11. De vários sites de gravação com dispositivos baseados em silício são particularmente eficazes graças à sua escalabilidade, volume pequeno e desenho geométrico.
Aqui, descrevemos métodos para gravar vários neurônios individuais e potenciais de campo locais em comportar-se de roedores, usando comercialmente disponíveis sondas micro-usinados de silicone com componentes feitos sob encomenda de acessórios. Existem duas opções de base fou interface sondas de silício para pré-amplificadores: placas de circuito impresso e cabos flexíveis. Empresas Sonda Abastecimento ( http://www.neuronexustech.com/ ; http://www.sbmicrosystems.com/ ; http://www.acreo.se/ ) geralmente oferecem o serviço de ligação e entregar sondas ligados a placas de circuito impresso ou cabos flexíveis. Aqui, nós descrevemos a implantação de uma haste 4, sonda 32-site ligado ao cabo de poliimida flexível, e montado sobre um microdrive móvel. Cada passo da preparação da sonda, microdrive construção e cirurgia é ilustrado de modo a que o utilizador final pode replicar facilmente o processo.
Protocolo
1. Construção do microdrive
Todas as unidades são feitos dos mesmos elementos básicos: uma parte móvel, que leva o eletrodo e uma parte fixa, que está ancorado ao crânio. Um microdrive ideal permite lisa mas longo de viagem suficiente do eléctrodo em múltiplos pequenos passos, é suficientemente robusta para impedir o movimento acidental do eléctrodo, fácil de manipular pelo experimentador, sem interferir com o comportamento do animal, de tamanho pequeno e um peso leve. Como um resultado destes requisitos concorrentes, Suite unidades diferentes aplicações diferentes.
Apenas 4 peças são necessárias para construir a nossa unidade básica: a de bronze parafuso de cabeça plana, uma porca de correspondência, uma ponte de plástico preparado a partir de um único cabeçalho linha pinos e duas placas de corte de metal personalizado.
- Quebre um pedaço de 3 pinos do cabeçalho
- Puxe o pino do meio.
- Ampliar o buraco perfurando-o com um tamanho de broca # 55.
- Corte um dialer usando a torneira 00-90.
- Corte dois pedaços da placa de bronze.
- Arquivar os bordos das placas com uma dremmel.
- Perfurar um furo no meio de ambas as peças, utilizando um tamanho de broca # 65.
- Monte as peças de unidade, para que as placas de latão estão tocando os pinos. Para conseguir isso, inserir o parafuso de bronze através, sucessivamente, a placa de latão, o furo roscado cabeçalho pino, a placa de latão segundo, ea porca. Aperte o parafuso com cuidado para que o conjunto se torna estável.
- O pino de solda termina às placas de latão.
- Ficheiro a extremidade saliente do parafuso.
- Solda a porca para o parafuso. Tenha cuidado para não soldar a porca para a placa de bronze.
- Testar o movimento da unidade: girar o parafuso dos ponteiros do relógio para elevar a ponte de plástico.
2. Preparação da sonda de silício
Antes de fixar a sonda para a unidade, adicionar isolamento extra para a área de ligação da sonda para evitar cerebrospinal fluido (CSF) ou umidade de produzir curto-circuitos:
- Pesar e misturar os componentes elastoméricos Sylgard numa proporção de 10:1.
- Usando um aplicador de algodão afiada, aplicar o Sylgard até a extremidade superior da sonda.
- Deixar secar num forno pré-aquecido a 60 ° C durante 2 horas.
Para garantir que os locais de gravação são desprovidos de quaisquer detritos, as pontas de prova necessitam de ser limpos:
- Prepara-se uma diluição de 4% de detergente Contrad.
- Deixe a sonda embeber no detergente a 63 ° C durante pelo menos 2 horas.
- Lavar o detergente fora por meio de imersão a sonda repetidamente em água destilada.
Antes de fixar a sonda para a unidade, a impedância de cada local de gravação devem ser verificados:
- Mergulhe a sonda em solução salina 0,9%, e conectá-lo a uma impedância metros. Se os sites de gravação muitos têm impedância incorreta, repita os passos de 2,4-2,6 ou considere o uso de uma sonda diferente.Aqui usamos um módulo de condicionamento de Impedância de Frederick Haer, Co. (FHC), combinado com um seletor de canais caseiro. Alternativamente, um niPOD por NeuroNexus, Inc. ou NanoZ por Neuralynx, Inc. permite a monitorização da impedância de todos os canais sonda simultaneamente.
3. Aposição da sonda para o microdrive
- Usando uma lâmina de barbear, cortar sulcos múltiplas na ponte para criar uma superfície áspera.
- Appose a sonda para a ponte da unidade. Este procedimento é melhor realizada sob um microscópio de operação, mantendo a unidade com uma pinça e ajustando a sonda por um micromanipulador de modo que as hastes são perfeitamente paralelo com o parafuso de accionamento. Isso garante que durante o avanço, a sonda movimento hastes no tecido do cérebro sem "cortar" por ele. A profundidade exacta das pontas de sonda em relação à base de a unidade deve ser determinada nesta fase, tendo em consideração a profundidade da estrutura de destino a partir da superfície docrânio.
- A sonda é então fixado à ponte com cimento aderência.
- Opcional: para a visualização da faixa sonda no cérebro, DiI solução (1-2% diluído em etanol) pode ser aplicado à parte de trás da sonda nesta fase.
4. Preparando o crânio
Antes da cirurgia, os eletrodos de referência e terra, e as partes da gaiola de Faraday head-on são preparados:
- Corte dois pedaços 2 "de comprimento de fio de cobre, e terminar uma solda de cada fio de cobre isolado por cerca de 1 mm.
- Utilizando uma agulha, raspar a cabeça de um 00-90, 1/8 "parafuso de aço inoxidável e solda um pedaço de fio de cobre a ele. Solda tais aço inoxidável de terra de parafuso-eléctrodos requer um fluxo adequado (por exemplo, N-3 Todas as finalidades fluxo de La-Co) e elevadas temperaturas ponta de solda. cuidadosamente evitar qualquer solda de fluir para dentro da ranhura do parafuso. Isto irá ser utilizado como o eléctrodo de terra. Repita com outro parafuso e um fio de cobre para prepararo eletrodo de referência.
- Corte pedaços trapeziodal de malha de cobre. Estas peças serão montados para proteger o headstage.
Os instrumentos cirúrgicos e preparação são o mesmo que o utilizado em muitas cirurgias de pequenos animais. Toda a cirurgia é feita sob anestesia isoflurano profunda, usando condições assépticas, de acordo com as diretrizes do NIH aprovados. Por favor, note que a cirurgia (falso) mostrado neste vídeo é apenas para demonstração. Para fins apropriados visibilidade e filmagem, várias etapas preparatórias, precauções e procedimentos cirúrgicos de pós-operatório não são mostradas / visível ou discutido.
Antes da cirurgia, todos os componentes e materiais devem ser esterilizados, seguindo procedimentos adequados (consulte Diretrizes para Cirurgia Rodent sobrevivência; http://oacu.od.nih.gov/ARAC/surguide.pdf~~HEAD=NNS). Durante a cirurgia, um campo esterilizado no crânio é preparado e isolado por cortinas estéreis. No final da cirurgia, um antibiótico de largo espectro é umapplied localmente e um analgésico de longa acção é administrado por via intramuscular (por exemplo, a buprenorfina, [Buprenex] 0,05 mg / kg). Além disso, analgésico (por exemplo, ibuprofeno) é fornecido na água de beber em cerca de 60 mg/kg/24 h durante 5 dias. Para próprios procedimentos cirúrgicos e de anestesia, consultar fontes adequadas 12.
- Instale o animal no aparelho estereotáxico, fazer a barba e limpar o couro cabeludo 13.
- Corte a pele ao longo da linha média e afastar o couro cabeludo. Retire o periósteo, limpar e secar o crânio.
- Medir a localização ea distância entre bregma e lambda, e determinar as coordenadas x e y do local de implantação da sonda de acordo com um atlas estereotáxico 14. Marcar o local raspando uma cruz no crânio com um bisturi.
- Perfurar o crânio com uma broca de cabeça redonda (tamanho ¼) e parafusos de apoio da unidade (de aço inoxidável, 000-120, 1/16 ") na metade do osso, em diferentes placas ósseas na parte superior umnd no lado do crânio. Os parafusos irá fornecer âncoras com segurança vínculo chapelaria até o crânio.
- Faça furos acima do cerebelo e inserir no chão e eletrodos de referência preparada no passo 4.2. Para a gravação locais potenciais de campo (LFP), a escolha do local de referência é crítica. Este site é escolhido porque LFP cerebelar é a menor de todas as regiões corticais e artefatos musculares são mínimas neste local na linha média.
- Aplicar dentina activador (Metabond kit) usando uma escova pequena sobre toda a superfície do crânio. Lavar com soro fisiológico a 0,9%.
- Aplique o cimento dental (Metabond kit; siga as instruções do fabricante para a mistura) no crânio, cobrindo cuidadosamente os parafusos de fixação e de terra e eletrodos de referência, mas deixando o local de implantação da sonda claro.
- Garantir as abas de cobre quatro malhas (preparado na Fase 4.3) para o crânio. Para isso, cimentar a estreita base de cada um deles para as anteriores, lados esquerdo, direito, e posterior do crânio. Thcobre e nunca deve estar em contacto directo com o osso, mas sempre separados por uma camada de cimento.
5. Preparação da superfície do cérebro
- Usando um pouco de cabeça redonda broca, perfure ao redor do local de implantação em múltiplos estágios, enquanto frequentemente o osso irrigando com soro fisiológico.
- Retire cuidadosamente o retalho ósseo e irrigar a superfície do cérebro.
- Para a inserção de uma sonda de haste múltipla, uma tira larga de dura é removido. Duas ferramentas são necessários para remover a dura-máter: um bisturi e um gancho preparado a partir de uma agulha de insectos (alternativamente, um microeléctrodo de tungsténio padrão). Dobre a ponta da agulha empurrando contra uma superfície dura (lâmina de microscópio por exemplo, vidro), e anexá-lo a uma alça (aqui, um pedaço de madeira Q-tip, alternativamente, um porta-agulha microdissecting).
- Levante a dura com o gancho, e cortá-lo com um bisturi. Cuidado especial é tomado para evitar danificar o pia, os vasos ea superfície do neocórtex. Pequeno sangramento pode ser resolvidopor irrigação salina. Se o sangramento ocorre maior ou o neocórtex é comprometida de qualquer forma, deve-se considerar terminar a cirurgia e preparando outro animal.
6. Implantar a sonda
Nesta fase, a densidade ea orientação dos vasos superfície cortical são cuidadosamente avaliada. Coordenadas estereotáxicas deve ser ajustada, porque a sonda tem de penetrar no cérebro em uma área livre de vasos maiores.
Para a implantação, a montagem da unidade pode ser realizada com um jacaré ligada ao titular estereotáxica. Visibilidade ininterrupta da superfície do cérebro e as pontas de sonda são críticos para a penetração de sucesso.
- Lentamente inferior a sonda para baixo a cerca de 1 mm acima do alvo pretendido, enquanto constantemente irrigando a craniotomia com solução salina. Para gravação neocortical, as pontas de prova são reduzidos para o córtex de aproximadamente 0,5 mm e levantada para trás perto da superfície.
- Selar a craniotomia pela aplicação de uma mistura quente fundida de óleo de cera de parafina e através de uma agulha (10-20g de cera em óleo de parafina 10 mL, aquecida a 65 ° C). Antes da aplicação, arrefecer a mistura para 30 ° C e testar a densidade. Ele deve ser suave o suficiente para permitir o movimento da sonda fácil). Para facilitar a cobertura completa, a mistura pode ser derretido in situ por se aproximar a cera endurecido com a ponta de uma micro-cauterizer.
- Fixe a parte inferior da unidade para o crânio com cimento aperto, tendo o cuidado de deixar a porca livre para girar. É de extrema importância para evitar qualquer "colisão" acidental da unidade, nesta fase, caso contrário, a sonda irá danificar o córtex. Depois que a unidade é fixada ao crânio, o movimento suave da sonda deve ser verificada.
- Cimentar a parte do conector da sonda ao crânio.
7. Construindo o cabeça-de gaiola de Faraday
- Puxe para cima e montar os retalhos de malha de cobre em um cilindro de proteção em torno da sonda e drive. O cilindro também serve como um escudo elétrico contra o ruído ambiente e os artefatos de ondas lentas produzidas pelos bigodes carregadas em que o animal se comportar.
- Ajustar a altura do cilindro cortando-se o excesso de material de modo a malha de cobre está nivelada com a parte superior do conector da sonda.
- Soldar os fios a partir da referência de terra e os parafusos aos pinos apropriados do conector. Também solda retalhos de malha de cobre adjacentes em conjunto para garantir a sua continuidade elétrica e solda o fio terra para a malha de cobre.
- Aplicar uma camada de cimento aderência à malha de cobre de o reforçar e para evitar qualquer contacto directo entre o metal ea pele do animal. Opcionalmente, aplicar uma camada de resina epóxi para reforçar ainda mais o arnês.
- Testar o movimento do parafuso de accionamento.
- Cobrir o topo do arnês com um corte peça a partir de uma luva de borracha.
8. Gravação no animal movimentando-se livremente
- Depois de aprocomeu cuidados pós-operatórios, conectar o animal ao sistema de gravação usando um headstage alta impedância e um leve, ultraflexible cabo multi-strand. Contrabalançar o peso do capacete.
- Teste a qualidade de gravação de cada dia na homecage. A posição dos sítios de gravação é julgado por ambos os padrões de unidade de queima ea forma dos locais potenciais de campo. Diminuir gradualmente a sonda, rodando o parafuso por pequenos incrementos (tipicamente 1/8 a 1/4 de volta por dia, isto é, 35-70 micrómetros) até que a estrutura alvo é atingido.
9. Os resultados representativos
Sinais electrofisiológicos (potencial de campo local e actividade da unidade) variam dependendo da estrutura gravada eo comportamento actual do animal. A Figura 1 mostra exemplos de gravações CA1 do hipocampo de 32 canais, enquanto o rato está explorando um campo aberto. Observe o proeminente 8 Hz oscilação (theta banda) do potencial de campo local durante a exploração, com apoioerimposed spiking em hastes múltiplas e Sítios (exemplos de pontos indicados por setas). Para analisar a atividade neuronal unidade, os picos são detectados e classificados em unidades individuais, utilizando análise de cluster da sua onda 15-16.
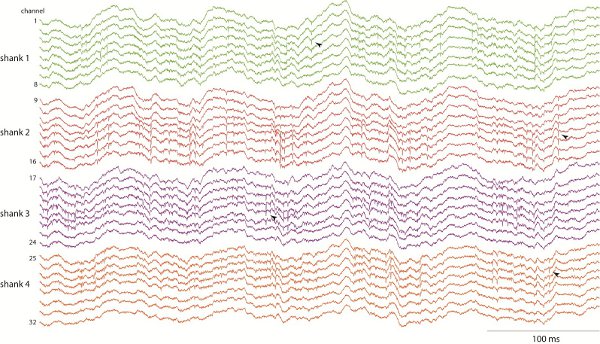
Figura 1. CA1 do hipocampo gravações no rato comportando usando um 4 hastes x 8 sítios de sonda de silício. As gravações são de banda larga e amostrados a 20 000 Hz, o que permite estudar as duas oscilações de campo locais potenciais (por exemplo, "teta" banda 8 ritmo Hz) e atividade spiking neuronal.
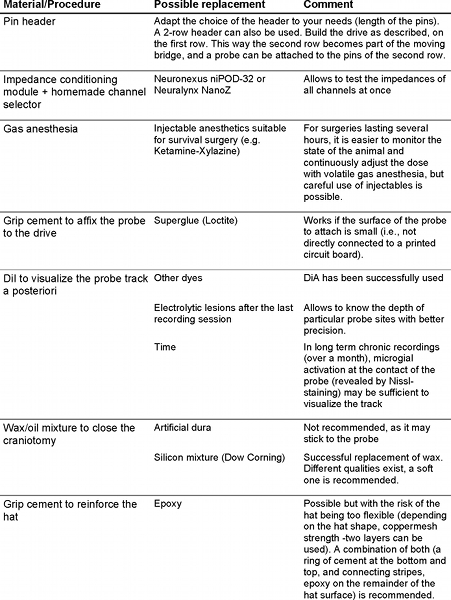
Tabela 1. Alternativas para reagentes e equipamento utilizados.
Discussão
Este filme ilustra o procedimento de implante de silicone de sondas para doenças crônicas de larga escala gravações no rato comportar. Passos essenciais para garantir qualidade gravações de atividade neuronal surgem a partir da fragilidade de ambos biológico (tecido cerebral) e silício (sonda) técnicas de materiais. Cuidados especiais devem ser tomados ao manusear a sonda para evitar qualquer contato de hastes com qualquer superfície remotamente "hard" (por exemplo, as canelas iria quebrar se alguém...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Marie Curie Fellowship International Outgoing (acordos da União Europeia FP/2007-2013 Grant # 221834 e 254780), JD McDonnell Foundation, NSF Grant SBE 0542013, National Institutes of Health Grant NS034994, National Institute of Mental Health Grant MH5467 e do Howard Hughes Medical Institute (Janelia Research Farm Campus de subvenção).
Materiais
| Name | Company | Catalog Number | Comments | |
| Nome | Tipo | Companhia | Número de Catálogo | Comentários |
| Silicon sonda Buzsaki32, 4 hastes x 8 sites. Embalagem: cabo de poliamida flexível | Material | NeuroNexus | Probe: buzsaki32 Embalagem: HC32 | Sonda de gravação |
| Parafuso de latão redondo, 00-90 x 1/2 Round parafusos de latão | Material | Jimorris | R0090B500 | Parte da unidade |
| Porca de bronze Hex, 00-90 | Material | Jimorris | N0090B | Parte da unidade |
| Latão C260 Strip, ASTM-B36 Espessura: de 0,025 ", Comprimento: 12", Largura: 1/2 " | Material | Peças pequenas | B000FMYU72 | Parte da unidade |
| Conector Header, campo de 2mm, male, única linha, straigt, 36 posições | Material | Digikey | 2163S-36-ND | Parte da unidade |
| 2 partes de elastômero de silicone Sylgard | Material | Instrumentos de precisão do mundo | SYLG184 | Para extra-isolar a sonda |
| Decon Contrad 70 Liquid Detergent | Reagente | Fisher Scientific | 04-355 Decon Laboratories N º: 1002 | Para limpar os locais de gravação |
| Módulo condicionado Impedância | Equipamento | FHC Inc. | 55-70-0 | Medidor de impedância |
| niPOD - 32 canais | Equipamento | NeuroNexus | niPOD -32 | Medidor de impedância |
| Punho de cimento classe industrial | Material | Caulk Dentsply | 675.571 (pó) 675572 (solvente) | Punho cemento |
| 1,1 '-dioctadecil-3, 3,3', 3'-tetramethylindocarbocyanine perclorato ('DiI'; DiIC18 (3)) | Reagente | Invitrogen | D282 | Para corar a faixa sonda no cérebro |
| Parafuso de aço inoxidável, cabeça redonda, Drive fenda, # 00-90, 1/8 " | Material | Peças pequenas | MX-0090-02B | Chão e parafusos de referência |
| Fio magnético, 20G, revestimento de nylon poliuretano, MW80 | Material | Peças pequenas | B000IJYRP2 | Terra e fio de referência |
| Parafuso de aço inoxidável, de cabeça redonda com fenda Drive, # 000-120, 1/16 " | Material | Peças pequenas | MX-000120-01B | Parafusos de ancoragem |
| N-3 todo o líquido Flux finalidade | Reagente | La-Co (Markal) | 23512 | Permite a solda de aço inoxidável |
| Microgrid Precision Expandido cobre | Material | Dexmet | 3 CU6-050 FA | Malha de cobre para a cabeça de gaiola de Faraday |
| C & B-METABOND Rápida! Cimento System - Dentina Activator | Material | Parkell | S380 | |
| C & B-METABOND Rápida! Sistema de Cimento - o cimento dental | Material | Parkell | S380 | |
| Agulha de tungstênio afiada ponto e titular | Ferramenta | Instrumentos cirúrgicos Roboz | RS-6064 e RS-6061 | Para fazer com que o gancho para levantar a dura-máter |
| Carbide Bur HP 1/4 | Ferramenta | Henry Schein | 9990013 | |
| Parafina (grânulos) | Material | Fisher Scientific | P31-500 | |
| Óleo Mineral, Light (NF / FCC) | Material | Fisher Scientific | O121-1 | |
| GC ELECTRONICS 10-114 adesivo epóxi 2-Part | Material | Newark | 00Z416 | |
| Tipo 1 Litz 21 AWG 40/36 Red Único de poliuretano Nylon-(MW80-C) para 0,041 "+ / -0,002" OD | Material | New England Fio Technologies Corporation | N28-36E-400-2 | Para fazer com que o cabo entre a headstage eo amplificador |
| 32-canal headstage Integração Very Large Scale, ganho de 20x | Equipamento | Plexon | HST/32V-G20 | Headstage |
Referências
- Buzsáki, G. High-frequency network oscillation in the hippocampus. Science. 256, 1025-1027 (1992).
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261, 1055-1058 (1993).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat. Neurosci. 7, 446-451 (2004).
- Buzsáki, G. Visualizing Large-Scale Patterns of Activity in the Brain: Optical and Electrical Signals. Society for Neuroscience. , (2004).
- Nicolelis, M. A. L. . Methods for Neural Ensemble Recordings. , (2008).
- Hatsopoulos, N. G., Donoghue, J. P. The science of neural interface systems. Annu. Rev. Neurosci. 32, 249-266 (2009).
- Battaglia, F. P. The Lantern: an ultra-light micro-drive for multi-tetrode recordings in mice and other small animals. J. Neurosci. Methods. 178, 291-300 (2009).
- Kloosterman, F., Davidson, T. J. Micro-drive Array for Chronic in vivo Recording: Drive Fabrication. J. Vis. Exp. 26, e1094-e1094 (2009).
- Nguyen, D. P., Layton, S. P. Micro-drive Array for Chronic in vivo Recording: Tetrode Assembly. J. Vis. Exp. (26), e1098-e1098 (2009).
- Haiss, F., Butovas, S., Schwarz, C. A miniaturized chronic microelectrode drive for awake behaving head restrained mice and rats. J. Neurosci. Methods. 187, 67-72 (2010).
- Cerf, M. On-line, voluntary control of human temporal lobe neurons. Nature. 467, 1104-1108 (2010).
- Kohn, D. F. Anesthesia and Analgesia in Laboratory Animals. American College of Laboratory Animal Medicine. series, (1997).
- Schjetnan, A. G. P., Luczak, A. Recording Large-scale Neuronal Ensembles with Silicon Probes in the Anesthetized Rat. J. Vis. Exp. (56), e3282-e3282 (2011).
- Paxinos, G., Watson, C. The Rat Brain. Stereotaxic Coordinates. , (1982).
- Harris, K. D. Accuracy of tetrode spike separation as determined by simultaneous intracellular and extracellular measurements. J. Neurophysiol. 84, 401-414 (2000).
- Hazan, L., Zugaro, M., Buzsáki, G. Klusters, NeuroScope, NDManager: a Free Software Suite for Neurophysiological Data Processing and Visualization. J. Neurosci. Methods. 155, 207-216 (2006).
- Kipke, D. R. Advanced neurotechnologies for chronic neural interfaces: new horizons and clinical opportunities. J. Neurosci. 28, 11830-11838 (2008).
- Csicsvari, J. Massively parallel recording of unit and local field potentials with silicon-based electrodes. J. Neurophysiol. 90, 1314-1323 (2003).
- Sodagar, A. M., Wise, K. D., Najafi, K. A fully integrated mixed-signal neural processor for implantable multichannel cortical recording. IEEE Trans. Biomed. Eng. 54, 1075-1088 (2007).
- O'Connor, D. H., Huber, D., Svoboda, K. Reverse engineering the mouse brain. Nature. 461, 923-929 (2009).
- Boyden, E. S. Millisecond-timescale, genetically targeted optical control of neural activity. Nat. Neurosci. 8, 1263-1268 (2005).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nat. Rev. Neurosci. 8, 577-581 (2007).
- Royer, S. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. Eur. J. Neurosci. 31, 2279-2291 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados