JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
설치류를 행동에 이동 가능한 실리콘 프로브에 의한 뉴런의 대규모 녹화
요약
우리는 대규모 다중 단일 단위 기록 및 실리콘 프로브와 설치류 동물 행동은 현지 필드 가능성에 대한 방법을 설명합니다. 드라이브 제조, 드라이브 및 프로브 주입 공정에 프로브 첨부 파일은 쉽게 복제에 대한 충분한 세부 사항에 그림하고 있습니다.
초록
신경 과학의 주요 과제는 신경 어셈블리의 집단 활동에 행동을 연결합니다. 뉴런과 회로의 입출력 관계의 이해는 공간적 선택성 및 행동 동물의 신경 ensembles, 분리된 하나의 뉴런의 representatively 대용량 샘플 즉, 녹음의 기계론의 분석을 위해 적절한 시간적 해상도를 가진 방법이 필요합니다. 의 연결 활동의 앙상블 모니터링은 인간 주제에 1-11를 포함하여 크고 작은 두뇌 모두 동물에서 지난 10 년 동안에 현저하게 진행되고있다. 실리콘 기반의 디바이스와 여러 현장 녹화 때문에 그들의 확장성, 작은 음량과 기하학적인 디자인에 특히 효과적입니다.
여기서는 여러 단일 뉴런과 맞춤 액세서리 구성 요소와 상용 마이크로 가공 실리콘 프로브를 사용하여 설치류 행동은 현지 필드 잠재력을 녹화하는 방법을 설명합니다. 두 가지 기본 옵션 바가 있습니다또는 preamplifiers에 실리콘 프로브 인터페이스 : 인쇄 회로 기판과 플렉시블 케이블. 프로브 공급 업체 ( http://www.neuronexustech.com/ , http://www.sbmicrosystems.com/ , http://www.acreo.se/가 ) 일반적으로 결합 서비스를 제공하고 인쇄 회로 기판에 보세 프로브를 제공합니다 또는 유연 케이블. 여기서는 유연한 polyimide 케이블에 연결된 4 생크 32 사이트 프로브의 주입을 설명하고, 이동의 microdrive에 장착된. 프로브 준비의 각 단계 microdrive 건설과 수술은 최종 사용자가 쉽게 프로세스를 복제할 수 있도록 삽화가있다.
프로토콜
1. microdrive 건설
전극과 두개골에 고정되는 고정 부분, 운반 움직이는 부분 : 모든 드라이브는 동일한 기본 요소로 만들어진다. 이상적인 microdrive는 여러 작은 단계에서 전극의 원활한지만 충분히 여행을 할 수 있도록 동물의 크기가 작은 행동, 그리고 무게가 가벼운 방해하지 않고 실험자에 의해 조작하기 쉬운 전극의 우발적인 움직임을 방지할 수있을만큼 견고합니다. 이러한 경쟁 조건의 결과로, 다른 드라이브 제품군 다른 어플 리케이션.
황동 민머리 나사, 일치 너트, 단일 행 핀 헤더와 두 맞춤 컷 황동 접시에서 준비한 플라스틱 다리 : 만 4 개로은 우리의 기본적인 드라이브를 구축할 필요합니다.
- 헤더에서 3 핀 조각을 부셔
- 부드럽게 중간 핀을 빼낸다.
- 드릴 비트 크기 # 55 뚫을 드릴로 구멍을 확대.
- 일 잘라00-90 수돗물을 사용하세요.
- 황동 판을 들락 거 렸고 두 조각을 잘라.
- Dremmel으로 접시의 가장자리를 꾸민다.
- 드릴 비트 크기에게 # 65로 두 조각의 중간에 구멍을 드릴 다운합니다.
- 놋쇠 접시가 핀을 만지시 있도록 드라이브 조각을 조립. 이것을 달성하기 위해, 연속 통해 황동 판, 스레드 핀 헤더 구멍, 두 번째 황동 접시와 너트 황동 나사를 삽입합니다. 부드럽게 때문에 어셈블리가 안정되어있는 나사를 조이십시오.
- 솔더 핀 황동 판에 끝납니다.
- 나사의 튀어나온 끝을 파일.
- 나사에 땜납 너트. 조심하지 솔더 황동 판에 너트를합니다.
- 드라이브의 움직임을 테스트 : 플라스틱 다리를 상승 시계 나사를 켜십시오.
2. 실리콘 프로브를 준비
드라이브에 프로브를 고정하기 전에 cerebr을 방지하기 위해 프로브의 결합 영역으로 별도 절연을 추가ospinal 유체 (CSF) 또는 짧은 회로를 생산에서 습도 :
- 무게와 10시 1분 비율에 Sylgard 엘라스토머 구성 요소를 섞는다.
- 날카롭게 면화 작은 주걱 사용하여 프로브의 맨 끝에 Sylgard를 적용합니다.
- 12 시간 동안 60 ° C에서 preheated 오븐에 말리도록.
녹화 사이트가 어떤 파편 찾아볼 수없는 것을 위해, 프로브 팁 세척해야합니다 :
- Contrad 세제의 4 % 희석을 준비합니다.
- 탐사선이 최소한 2 시간 동안 63 ° C에서 세제에 흠뻑 젖어 보자.
- 증류수로 반복 프로브를 찍기로 세제를 씻어.
드라이브에 프로브를 고정하기 전에 각 녹화 사이트의 임피던스가 확인하여야한다 :
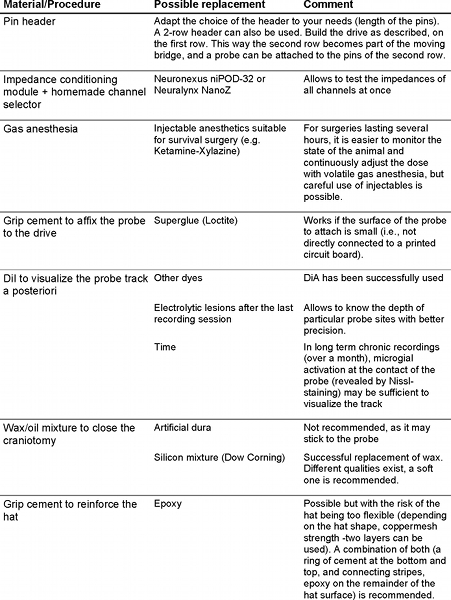
- 0.9 %의 식염수에 프로브를 찍어 및 임피던스 미터에 연결합니다. 너무 많은 음반 사이트는 잘못된 임피던스 단계를 반복 2.4-2.6이 있거나 다른 프로브를 사용하여 고려하십시오.여기 수제 채널 선택과 결합 프레더릭 Haer, 주식 회사 (FHC)에서 임피던스 컨디셔닝 모듈을 사용합니다. 또는, Neuralynx 주식 회사에 의해 NeuroNexus 주식 또는 NanoZ 의해 niPOD 동시에 모든 프로브 채널의 임피던스의 모니터링을 허용합니다.
3. microdrive에 프로브를 Affixing
- 면도날 사용하여 견고한 표면을 만들기 위해 다리에 여러 개의 홈을 했네요.
- 드라이브의 다리에 프로브를 Appose. 이 절차는 최고의 클램프로 드라이브를 개최하고 정강이가 드라이브 나사와 완벽하게 평행되도록 micromanipulator하여 프로브를 조정하여, 운영 현미경으로 이루어집니다. 이것이 발전하는 동안,없이 뇌 조직으로 프로브 정강이 움직이는가를 통해 '절단'것을 보장합니다. 드라이브의 기본에 대한 상대 프로브 팁 정확한 깊이는 표면에서 고려 대상 구조의 깊이를 복용,이 단계에서 결정되어야두개골.
- 프로브는 다음 그립 시멘트와 다리로 고정됩니다.
- 옵션 : 머리에 프로브 트랙을 시각화 위해 DiI 용액 (에탄올에 희석 1~2%)은이 단계에서 프로브의 뒷면에 적용할 수 있습니다.
4. 두개골을 준비
이전 수술로, 참조 및 접지 전극, 그리고 온 머리 패러데이 케이지의 부분이 준비가되어 있습니다 :
- 구리 와이어의 두 2 "길이 조각, 약 1mm 각 절연 구리선의 땜납 한쪽 끝을 잘라.
- 바늘을 사용하여, 거기에 구리 와이어의 00-90, 1 / 8 "스테인레스 스틸 스크류 및 솔더 한 조각의 머리를 다쳤어요. 납땜과 같은 스테인레스 스틸 접지 나사 전극은 적절한 유량 (예, N-3 모든 유형을 필요로 라 - 공동의 플럭스) 및 높은 납땜 팁 온도는. 조심스럽게 나사의 홈에 흐르는로부터 솔더되지 않습니다. 이것은 접지 전극으로 사용됩니다. 준비하는 또 다른 나사와 동선으로 반복기준 전극.
- 구리 메쉬에서 trapeziodal 조각을 잘라. 이러한 조각들은 headstage를 보호하기 위해 조립됩니다.
수술 도구와 준비는 많은 작은 동물의 수술에서 사용되는 것과 같은 있습니다. 전체 수술은 NIH 승인된 가이드라인에 의하면, 무균 조건을 사용하여, 깊은 isoflurane 마취하에 이루어집니다. 이 동영상에 표시된 (모의) 수술은 데모용으로만 사용된다는 점에 유의하시기 바랍니다. 적절한 가시성 및 촬영 목적, 여러 준비 단계, 수술주의 사항 및 수술 절차에 대해서만 표시 / 표시 또는 설명되지 않습니다.
수술에 앞서, 모든 부품 및 소모품은 적절한 절차 (; http://oacu.od.nih.gov/ARAC/surguide.pdf 서바이벌 설치류 외과 요강 참조)에 따라, 소독하여야한다. 수술 중에 두개골에 무균 필드 멸균 커튼으로 준비하고 격리합니다. 끝에 수술은 광범위한 스펙트럼 항생제입니다로컬 pplied과 오랜 연기 진통제 (예, buprenorphine, [Buprenex] 0.05 밀리그램 / ㎏) intramuscularly 제공됩니다. 또한, 진통제는 (예, 이부 프로펜) 5 일간 약 60 mg/kg/24시에서 식수로 제공됩니다. 적절한 수술과 마취 절차를 보려면 해당 소스에게 12 참조하십시오.
- stereotaxic 장치로 동물을 설치 면도하고 두피 13 닦아주십시오.
- 중간선을 따라 피부를 잘라 머리를 옆으로 밀어. , 골막을 제거 청소하고 두개골을 건조.
- bregma와 람다 간의 위치와 거리를 측정하고, 그에 따라 stereotaxic 아틀라스 14를 사용하여 프로브 주입 사이트의 x와 y 좌표를 결정합니다. 메스로 두개골에 십자가를 위해서 힘든하여 사이트를 표시합니다.
- 상단에 다른 뼈 접시에 중간 뼈로 둥근 헤드 드릴 비트 (크기 ¼)와 드라이브 지원 나사 (스테인리스, 000-120, 1 / 16 ")를 사용하여 두개골을 뚫을두개골의 측면에있는 차. 나사가 단단히 결합 헤드기어로 두개골에 앵커를 제공합니다.
- 소뇌 위의 구멍을 파악 및 구장과 단계 4.2에서 준비 레퍼런스 전극을 삽입합니다. 현지 필드 잠재력 (LFP)를 기록 내용 참조 사이트의 선택은 중요합니다. 소뇌 LFP이 중간선에 위치에 최소한의 모든 피질 영역과 근육 유물의 작은 있기 때문에이 사이트는 선택됩니다.
- 두개골의 전체 표면 위에 작은 브러시를 사용하여 상아질 활성제 (Metabond 키트)를 적용합니다. 0.9 %의 식염수로 씻어.
- 치과 시멘트 적용 (Metabond 키트를, 믹싱에 대한 제조 업체의 지시 사항을 따르십시오) 신중 앵커 볼트와 접지 및 참조 전극을 다루는 있지만 프로브 주입 사이트 맑은 떠나, 두개골에.
- 네 개의 구리 메쉬 펄럭 (4.3 단계에서 준비) 두개골로 고정합니다. 이 내용은 두개골의 앞부분은, 왼쪽, 오른쪽, 그리고 후부 측면에 각각의 좁은 기초를 돈독히. 일전자의 구리는 뼈와 직접 접촉이 없어도 항상 시멘트의 계층으로 구분해서는 안됩니다.
5. 뇌 표면을 준비
- 자주 식염수 뼈 물을 대는 동안 둥근 머리에 드릴 비트를 사용하여, 여러 단계의 주입 사이트 주위에 드릴 다운합니다.
- 조심스럽게 뼈 플랩을 제거하고 뇌 표면을 관개하다.
- 다중 생크 프로브를 삽입하는 경우, 경질의 대형 스트립이 제거됩니다. 메스와 곤충 바늘 (또는 표준 텅스텐 microelectrode)에서 준비 후크 : 두 도구는 경질을 제거할 필요합니다. 하드 표면 (예 : 유리 현미경 슬라이드)에 대해 밀어 바늘의 팁을 구부려, 그리고 (여기서, 나무 Q-팁 한 조각, 또는 microdissecting 바늘 홀더) 손잡이에 첨부해 주시기 바랍니다.
- 후크와 경질을 고양하고, 메스로 상처를 냈어. 특별한주의가 PIA, 혈관 네크로 텍스의 표면 손상을 방지하기 위해 가져옵니다. 작은 출혈을 해결할 수 있습니다식염수 관개에 의한. 주요 출혈이 발생하거나 네크로 텍스가 어떤 식으로든 손상되면, 하나는 수술을 종료하고 다른 동물을 준비하는 것이 좋습니다.
6. 프로브를 이온 주입
이 단계에서, 대뇌 피질의 표면 혈관의 밀도와 방향을 신중하게 평가합니다. 탐사선이 큰 혈관에서 무료로 지역에서 두뇌에 침투 있기 때문에 Stereotaxic 좌표가 조정되어야합니다.
이식의 경우 드라이브 어셈블리 stereotaxic 홀더에 부착된 악어 클립으로 개최 할 수 있습니다. 중단 뇌 표면의 가시성 및 프로브의 팁 성공적인 침투를 위해 중요합니다.
- 지속 식염수 craniotomy 물을 대는 동안 천천히, 의도된 목표 상기 약 1mm로 프로브를 내려. neocortical 녹음 내용 프로브 팁은 피질 약 0.5 mm로 인하되며 표면 근처에 다시 드러내기 시작 했어.
- 바늘 (10 ML의 파라핀 오일에 왁스의 10~20g, 65 ° C로 가열)를 통해 왁스와 파라핀 오일 따뜻하게 녹인 혼합물을 적용하여 craniotomy을 봉쇄해. 이전 응용 프로그램에, 30 ° C로 믹스를 냉각 및 밀도를 테스트합니다. 그것은) 쉬운 프로브의 움직임을 허용 정도로 부드럽게해야합니다. 완벽한 커버 리지를 촉진하기 위해서 혼합물은 마이크로 cauterizer의 일각으로 굳어진 왁스를 접근하여 현장에 녹아 수 있습니다.
- 회전하는 너트가 무료 말던 신중하다고, 그립 시멘트로 두개골에 드라이브의 하단을 첨부합니다. 그것은이 단계에서 드라이브의 모든 사고 '충돌'을 피하기 위해 가장 중요이고, 그렇지 않으면 프로브는 피질에 손상을 것입니다. 드라이브가 두개골에 고정되면 프로브의 원활한 움직임을 확인해야합니다.
- 두개골에 프로브의 커넥터 부분을 돈독히.
7. 온 - 머리 패러데이 케이지 구축
- 프로브 및 dri 주변 보호 실린더로 구리 메쉬 펄럭 띄워 및 조립같군. 실린더는 또한 환경 소음과 행동 동물의 부과 수염 제작한 느린 파도 유물에 대한 전기 보호막 역할을한다.
- 구리 메쉬는 프로브 커넥터의 상단과 수준 수 있도록 여분의 물질을 멀리 절단하여 원통 높이를 조정합니다.
- 솔더 참조 및 접지 나사에서 커넥터의 해당 핀에 전선. 또한 솔더 인접한 구리 메쉬 펄럭 함께 구리 메쉬에 접지 와이어를 자신의 전기적 연속성을 보장하고, 납땜합니다.
- 그것을 강화하고 금속과 동물의 피부 사이에 직접적인 접촉을 방지하기 위해 구리 메쉬에 그립 시멘트의 레이어를 적용합니다. 선택적으로 추가 헤드기어를 강화하기 위해 에폭시 수지의 레이어를 적용합니다.
- 드라이브 나사의 움직임을 테스트합니다.
- 고무 장갑의 조각 인하와 헤드기어의 상단을 커버.
8. 자유롭게 움직이는 동물의 녹화
- appropri 후수술 치료를 먹은, 높은 임피던스 headstage 및 경량 ultraflexible 멀티 스트랜드 케이블을 사용하여 레코딩 시스템에 동물을 연결합니다. 반대 급부 헤드기어의 무게.
- homecage에 매일 기록의 품질을 테스트합니다. 촬영 장소의 위치는 단위 연소 패턴 및 지방 현장 잠재력의 형태 모두에 의해 판단된다. 대상 구조에 도달할 때까지 작은 단위 (일반적으로 팔분의 일 하루 4분의 1 회전에, 즉 35-70 micrometers)의 나사를 설정하여 점차적으로 프로브를 낮춥니다.
9. 대표 결과
Electrophysiological 신호 (현지 필드 잠재력과 단위 활동) 기록된 구조와 동물의 현재 행동에 따라 다릅니다. 쥐가 오픈 필드를 탐험하는 동안 그림 1은 32 채널 CA1 hippocampal 레코딩의 예를 보여줍니다. 저녁을 먹다가있는 탐사시 현지 필드 잠재력 유수 8 Hz에서 (세타 밴드) 진동 참고여러 개의 정강이와 사이트 (화살촉으로 표시 스파이크의 예입니다)에 급상승 erimposed. 의 연결을 단위 활동을 분석하기 위해 스파이크들은 파형 15-16의 클러스터 분석을 사용하여 하나의 단위로 감지하고 정렬됩니다.
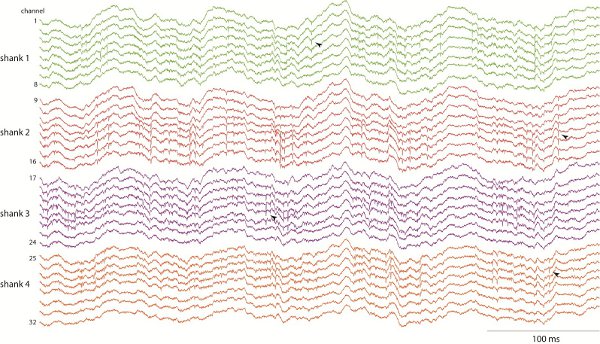
그림 1. 4 정강이 X 8 사이트 실리콘 프로브를 사용하여 행동 쥐의 CA1 Hippocampal 녹음. 녹음 광대역 및 지역 분야 잠재 oscillations (예 : "세타"밴드 8 Hz에서 리듬)와의 연결을 급상승 활동을 모두 공부할 수 있도록 20 000 Hz에서,에서 샘플입니다.
Access restricted. Please log in or start a trial to view this content.
토론
이 영화는 행동 쥐에서 만성 대규모 레코딩을위한 실리콘 프로브의 주입 절차를 보여줍니다. 의 연결 활동의 품질의 녹음을 보장하기위한 중요한 단계는 모두 생물 학적 (뇌 세포)와 기술 (실리콘 탐침) 재료의 취약성에서 발생합니다. 모든 원격으로 "하드"표면 (한 경질을 제거하지 않고 두뇌에서 그들을 이식하려한다면 예를 들어, 정강이가 부러지는 줄)와 정강이의 접촉을 피하기 위해 ?...
Access restricted. Please log in or start a trial to view this content.
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
마리 퀴리 국제 발신 원정대 (유럽 연합의 FP/2007-2013 부여 동의 # 221834 및 254780), JD 맥도넬 재단, NSF 그랜트 SBE 0542013, 건강 그랜트 NS034994 국립 연구소, 정신 건강 그랜트 MH5467의 국립 연구소와 하워드 휴즈 의학 연구소 (Janelia 팜 연구 캠퍼스 부여).
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments | |
| 이름 | 유형 | 회사 | 카탈로그 번호 | 댓글 |
| 실리콘 프로브 Buzsaki32, 4 정강이 X 8 사이트. 포장 : 유연한 폴리 아마 이드 케이블 | 자료 | NeuroNexus | 프로브 : buzsaki32 포장 : HC32 | 녹음 프로브 |
| 라운드 브래스 스크류, 00-90는 x 2분의 1 라운드 브래스 나사 | 자료 | JIMorris | R0090B500 | 드라이브 부품 |
| 경감 님 16 진 너트, 00-90 | 자료 | JIMorris | N0090B | 드라이브 부품 |
| 브래스 C260 스트립, ASTM-B36 두께 : 0.025 ", 길이 : 12", 폭 : 1 / 2 " | 자료 | 소형 부품 | B000FMYU72 | 드라이브 부품 |
| 커넥터 헤더, 2mm 피치, M에일, 단일 행, straigt, 36 순위 | 자료 | Digikey | 2163S-36-ND | 드라이브 부품 |
| 2 - 부분 Sylgard 실리콘 엘라스토머 | 자료 | 세계 정밀 계측기 | SYLG184 | 프로브를 추가 - 보온하려면 |
| 방사능 오염을 제거하는 70 액체 세제를 Contrad | 시약 | 피셔 과학 | 04-355 방사능 오염을 제거 연구소 번호 : 1002 | 녹음 장소를 청소하려면 |
| 임피던스 컨디셔닝 모듈 | 장비 | FHC 주식 회사 | 55-70-0 | 임피던스 측정기 |
| niPOD - 32 개 채널 | 장비 | Neuronexus | niPOD -32 | 임피던스 측정기 |
| 그립의 시멘트 산업 학년 | 자료 | 편자에 박는 뾰족한 징 Dentsply | 675571 (분말) 675572 (용매) | 그립 CE, 표준 |
| 1,1 '-dioctadecyl-3, 3,3', 퍼클로레이트을 (; DiIC18 (3) 'DiI') 3'-tetramethylindocarbocyanine | 시약 | Invitrogen | D282 | 두뇌에 프로브 트랙을 얼룩 |
| 스테인리스 기계 나사, 바인딩 헤드, 홈 붙이 드라이브, # 00-90, 1 / 8 " | 자료 | 소형 부품 | MX-0090-02B | 접지 및 참조 나사 |
| 마그넷 와이어, 20G, 나일론 - 폴리 우레탄 코팅, MW80 | 자료 | 소형 부품 | B000IJYRP2 | 접지 및 참조 선 |
| 스테인리스 기계 나사, 드라이브 홈 붙이 바인딩 책임자, # 000-120, 1 / 16 " | 자료 | 소형 부품 | MX-000120-01B | 앵커 나사 |
| N-3 모든 유형의 플럭스 액체에게 | 시약 | 라 - 공동 (Markal) | 23,512 | 솔더 스테인리스로 허용 |
| MicroGrid 정밀 구리 확대 | 자료 | Dexmet | 3 CU6-050 FA | 온 - 머리 패러데이 케이지에 대한 구리 메쉬 |
| C & B-METABOND 빠른! 시멘트 시스템 - 상아질 활성 | 자료 | Parkell | S380 | |
| C & B-METABOND 빠른! 시멘트 시스템 - 치과 시멘트 | 자료 | Parkell | S380 | |
| 샤프 포인트 텅스텐 바늘과 홀더 | 도구 | Roboz 외과 용구 | RS-6064 및 RS-6061 | 후크가 경질을들하려면 |
| 초경 규석엉 HP 4분의 1 | 도구 | 헨리 Schein | 9,990,013 | |
| 파라핀 (과립) | 자료 | 피셔 과학 | P31-500 | |
| 미네랄 오일, 라이트 (NF / FCC) | 자료 | 피셔 과학 | O121-1 | |
| GC 전자 10-114 2 - 부품 에폭시 접착제 | 자료 | 뉴어크 | 00Z416 | |
| 타입 1 LITZ 21 AWG 36분의 40 레드 0.041 TO (MW80-C) 폴리 우레탄-나일론 싱글 '+ / -0.002 "OD | 자료 | 뉴잉글랜드 와이어 기술 주식 회사 | N28-36E-400-2 | headstage와 앰프 사이의 케이블을 확인하려면 |
| 32 채널 매우 대규모 집적 headstage, 20x 이득 | 장비 | Plexon | HST/32V-G20 | Headstage |
참고문헌
- Buzsáki, G. High-frequency network oscillation in the hippocampus. Science. 256, 1025-1027 (1992).
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261, 1055-1058 (1993).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat. Neurosci. 7, 446-451 (2004).
- Buzsáki, G. Visualizing Large-Scale Patterns of Activity in the Brain: Optical and Electrical Signals. Society for Neuroscience. , Washington, DC. (2004).
- Nicolelis, M. A. L. Methods for Neural Ensemble Recordings. , 2nd edition, CRC Press. Boca Raton, FL. (2008).
- Hatsopoulos, N. G., Donoghue, J. P. The science of neural interface systems. Annu. Rev. Neurosci. 32, 249-266 (2009).
- Battaglia, F. P. The Lantern: an ultra-light micro-drive for multi-tetrode recordings in mice and other small animals. J. Neurosci. Methods. 178, 291-300 (2009).
- Kloosterman, F., Davidson, T. J. Micro-drive Array for Chronic in vivo Recording: Drive Fabrication. J. Vis. Exp. 26, e1094-e1094 (2009).
- Nguyen, D. P., Layton, S. P. Micro-drive Array for Chronic in vivo Recording: Tetrode Assembly. J. Vis. Exp. (26), e1098-e1098 (2009).
- Haiss, F., Butovas, S., Schwarz, C. A miniaturized chronic microelectrode drive for awake behaving head restrained mice and rats. J. Neurosci. Methods. 187, 67-72 (2010).
- Cerf, M. On-line, voluntary control of human temporal lobe neurons. Nature. 467, 1104-1108 (2010).
- Kohn, D. F. Anesthesia and Analgesia in Laboratory Animals. American College of Laboratory Animal Medicine. series, (1997).
- Schjetnan, A. G. P., Luczak, A. Recording Large-scale Neuronal Ensembles with Silicon Probes in the Anesthetized Rat. J. Vis. Exp. (56), e3282-e3282 (2011).
- Paxinos, G., Watson, C. The Rat Brain. Stereotaxic Coordinates. , Elsevier Academic. Amsterdam. (1982).
- Harris, K. D. Accuracy of tetrode spike separation as determined by simultaneous intracellular and extracellular measurements. J. Neurophysiol. 84, 401-414 (2000).
- Hazan, L., Zugaro, M., Buzsáki, G. Klusters, NeuroScope, NDManager: a Free Software Suite for Neurophysiological Data Processing and Visualization. J. Neurosci. Methods. 155, 207-216 (2006).
- Kipke, D. R. Advanced neurotechnologies for chronic neural interfaces: new horizons and clinical opportunities. J. Neurosci. 28, 11830-11838 (2008).
- Csicsvari, J. Massively parallel recording of unit and local field potentials with silicon-based electrodes. J. Neurophysiol. 90, 1314-1323 (2003).
- Sodagar, A. M., Wise, K. D., Najafi, K. A fully integrated mixed-signal neural processor for implantable multichannel cortical recording. IEEE Trans. Biomed. Eng. 54, 1075-1088 (2007).
- O'Connor, D. H., Huber, D., Svoboda, K. Reverse engineering the mouse brain. Nature. 461, 923-929 (2009).
- Boyden, E. S. Millisecond-timescale, genetically targeted optical control of neural activity. Nat. Neurosci. 8, 1263-1268 (2005).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nat. Rev. Neurosci. 8, 577-581 (2007).
- Royer, S. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. Eur. J. Neurosci. 31, 2279-2291 (2010).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유