このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
動作げっ歯類の可動シリコンプローブによるニューロンの大規模なレコーディング
要約
我々は、大規模な複数の単一ユニットの記録とシリコンプローブとげっ歯類を動作中のローカルフィールドポテンシャルの方法について説明します。ドライブ製造、ドライブとプローブ注入プロセスへのプローブの添付ファイルが簡単に複製するのに十分詳細に示されています。
要約
神経科学における主要な課題は、神経アセンブリの集団活動にビヘイビアをリンクしている。ニューロンと回路の入出力の関係の理解は、単離されたニューロンの代表的大規模なサンプルの動作動物、すなわち記録の神経アンサンブルのメカニズム解析のために適切な空間選択性と時間分解能を持つメソッドが必要になります。神経活動のアンサンブルの監視は、被験者1から11を含む小規模および大規模な脳が、両方の動物において過去10年間に著しく進展している。シリコンベースのデバイスで複数のサイトの記録があるため、そのスケーラビリティ、少量の、幾何学的デザインの特に有効である。
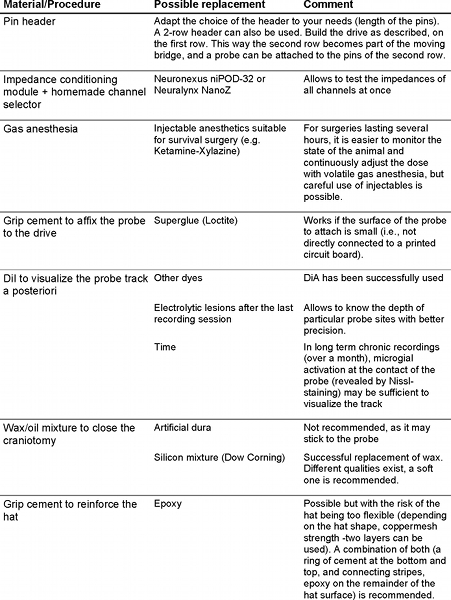
ここでは、カスタムメイドのアクセサリコンポーネントを使用して市販のマイクロマシンシリコンプローブを用いて、げっ歯類の動作で複数の単一ニューロンと局所電場電位を記録するための方法について説明します。二つの基本的なオプションfがあります。またはプリアンプにシリコンプローブをインターフェース:プリント回路基板とフレキシブルケーブル。プローブの供給会社( http://www.neuronexustech.com/ 。 http://www.sbmicrosystems.com/ 。 http://www.acreo.se/ )は、通常のボンディングサービスを提供し、プリント回路基板に接合プローブを提供するまたはフレキシブルケーブル。ここでは、柔軟なポリイミドケーブルに接続されている4シャンク、32サイトプローブの注入を記述し、可動マイクロドライブに搭載された。プローブ調製、マイクロドライブ、建設、手術の各ステップは、エンドユーザーが簡単にプロセスを複製することができるように図示されている。
プロトコル
1。マイクロドライブの構築
電極と頭蓋骨に固定されている固定部を運び可動部:すべてのドライブは、同じ基本的な要素から作られています。理想的なマイクロドライブは、複数の小さなステップの電極の平滑が十分に長い旅を可能にする電極の偶発的な動きを防ぐため、頑丈なことに、動物の行動に干渉することなく、実験者によって操作が簡単、重量の大きさと光の中で小さいです。これらの競合する要求の結果として、異なるドライブ·スイート様々なアプリケーション。
真鍮フラットヘッドネジ、マッチングナット、シングルロウピンヘッダー、2つのカスタムカット真鍮板から調製したプラスチック製のブリッジのみ:4部は、当社の基本的なドライブを構築するために必要とされている。
- ヘッダーから3ピンの部分を破る
- 静かに中央のピンを引き抜きます。
- ドリルビットサイズが#55とそれを介してドリルで穴を拡大します。
- 目をカット00から90のタップを使用してお読みください。
- 真鍮板二枚を切り取ります。
- Dremmelでプレートの端を提出してください。
- ドリルビットサイズ#65を使用して、両方の部分の真ん中に穴を開けます。
- 真鍮板がピンに触れているようにドライブの部分を組み立てる。これを達成するために、真鍮板、ねじピン·ヘッダ·ホール、第真鍮板、ナット、連続を通じて、真鍮のネジを挿入します。優しくそうアセンブリが安定になることをしているネジを締めます。
- はんだ端子は真鍮のプレートに終了します。
- ねじの突出末端を提出してください。
- ネジにナットをはんだ。ない真鍮板に半田付けナットを十分に注意してください。
- ドライブの動きをテストします。プラスチック製の橋を高めるために時計回りにネジを回します。
2。シリコンプローブを準備する
ドライブにプローブを固定する前に、cerebrを防ぐために、プローブのボンディング領域に余分な断熱材を追加するospinal液(CSF)または短絡を生産するから湿度:
- 10:1の比率でSylgardエラストマー成分を秤量し、混合します。
- シャープ綿棒を使用して、プローブの先端にSylgardを適用します。
- 2時間60℃に予熱したオーブンで乾燥させます。
記録部位は、任意の残骸を欠いていることを確認するために、プローブ·チップは、洗浄する必要があります。
- Contrad洗剤の4%の希釈を準備します。
- プローブは少なくとも2時間63℃で中性洗剤に浸しましょう。
- 蒸留水で繰り返しプローブを浸漬することにより、洗剤を洗い流してください。
ドライブにプローブを固定する前に、各記録部位のインピーダンスを確認する必要があります。
- 0.9%食塩水にプローブを浸し、インピーダンスメーターに接続します。あまりにも多くの記録部位が間違っインピーダンスは、手順2.4から2.6を持っているか、別のプローブを用いて検討してください。ここでは自家製のチャネルセレクタと組み合わせるフレデリックHaer、株式会社(FHC)からインピーダンス調整モジュールを使用しています。また、Neuralynx、Inc。のNeuroNexus、Inc。またはNanoZによってniPOD同時に、すべてのプローブ·チャネルのインピーダンスを監視することができます。
3。マイクロドライブにプローブを貼付
- かみそりの刃を使用して、堅牢な表面を作成するためにブリッジに複数の溝を切った。
- ドライブのブリッジにプローブを並べる。この手順は、最高のクランプでドライブを保持し、シャンクは、ドライブのネジで完全に平行になるように、マイクロマニピュレータでプローブを調整することにより、手術用顕微鏡下で行われます。これは、それを介して "切断"せずに脳組織にプローブシャンクの移動、前進時にそれを確実にします。ドライブのベースに相対的なプローブ·チップの正確な深さは表面から考慮ターゲット構造の深さを取って、この段階で決定されるべきである頭蓋骨。
- プローブは、その後グリップセメントでブリッジに固定されています。
- オプション:脳内のプローブのトラックを視覚化するため、DII溶液(エタノールで希釈した1から2パーセント)はこの段階では、プローブの背面に適用することができます。
4。頭蓋骨の準備
手術前には、基準とグランド電極と、上のヘッドファラデーケージの部品が用意されています。
- 銅線の2つの2 " - 長い部分と、約1 mmの各絶縁銅線のはんだ一方の端をカットします。
- 針を使用して、それへの銅線の00から90、1/8 "ステンレス製のネジと半田ワンピースの頭をこすり、はんだ付けなどのステンレス鋼の接地ネジ電極には、適切なフラックス(例えば、N-3のすべての目的を必要とするラ社からフラックス)と高いはんだごて先端温度。慎重にネジの溝に流れ込むから任意のはんだを防ぐことができます。これは、接地電極として使用されます。準備するために、別のネジと銅線で繰り返し参照電極。
- 銅メッシュからtrapeziodal部分を切り取ります。これらの作品は、ヘッドを保護するために組み立てられます。
多くの小さな動物の手術で使用されている手術器具と準備は同じです。全体の手術が承認されたNIHのガイドラインに従って、無菌条件を使用して、深いイソフルラン麻酔下で行われます。このビデオに示すように、(モック)手術は、デモンストレーションのみを目的としてあることに注意してください。適切な可視性と撮影の目的は、いくつかの準備手順、手術予防と術後の手順について示した/目に見えるか説明していません。
手術に先立ち、すべてのコンポーネントと電源は、適切な手順(; http://oacu.od.nih.gov/ARAC/surguide.pdfサバイバル齧歯類の手術のためのガイドラインを参照してください)に続いて、滅菌されるべきである。手術中、頭蓋骨の滅菌フィールドは、滅菌ドレープによって準備され、隔離されています。最後の手術では、広いスペクトルの抗生物質です。ローカルppliedと長時間作用型の鎮痛剤(例えば、ブプレノルフィン、[Buprenex] 0.05 mg / kg)を筋肉内に与えられます。加えて、鎮痛剤(例えば、イブプロフェン)は5日間で約60 mg/kg/24時間で飲料水に記載されています。適切な手術と麻酔の手順については、適切な情報源12を参照してください。
- 定位固定装置に動物をインストールし、剃ると頭皮13を清掃してください。
- 正中線に沿って皮膚を切って、頭皮を脇にプッシュします。 、骨膜を除去するクリーニングと頭蓋骨を乾燥させる。
- ブレグマとラムダとの間の位置との距離を測定し、それに応じて定位アトラス14を使用してプローブの注入部位のx座標とy座標を決定します。メスで頭蓋骨に十字架をこすることで、サイトをマークします。
- 上に別の骨プレート上に、途中で骨に丸頭のドリルビット(サイズ¼)とドライブのサポートネジ(ステンレス鋼、000から120、1/16 ")を使用して頭蓋骨をドリル頭蓋骨の側面を購入する。ネジがしっかりと結合ヘッドギアに頭蓋骨にアンカーを提供します。
- 小脳上の穴をドリルとグランドのステップ4.2で調製した参照電極を挿入します。ローカルフィールドポテンシャル(LFP)を記録するために、リファレンスサイトの選択は重要です。小脳LFPは、この正中線の位置で最小であるすべての皮質領域と筋肉アーティファクトの最小であるため、このサイトが選択されます。
- 頭蓋骨の表面全体に小さなブラシを使用して、象牙質活性化因子(Metabondキット)を適用します。 0.9%食塩水で洗ってください。
- 慎重にアンカーネジとアースと参照電極を覆うが、プローブ注入部位が明確に残して、頭蓋骨に、歯科用セメントを(混合については、製造元の指示に従ってくださいMetabondキット)を適用します。
- 4つの銅メッシュフラップ(ステップ4.3に調製)を頭蓋骨に固定します。このためには、頭蓋骨の前方、左、右、および後部の両側にそれぞれの狭い基盤を固める。番目のeの銅は、骨と直接接触しませんが、常にセメントの層で区切らないでください。
5。脳の表面を準備する
- 頻繁に生理食塩水で骨を潤しながら、丸頭のドリルビットを使用して、複数の段階で移植部位の周りにドリルダウンします。
- 慎重に骨弁を除去し、脳表面を灌漑。
- 複数のシャンクプローブを挿入するため、硬膜の大規模なストリップは削除されます。メスと昆虫針(あるいは、標準タングステン微小電極)から調製されたフック:2つのツールは、硬膜を除去するために必要とされている。硬い表面(例えばガラス顕微鏡スライド)に対して押すことにより、針の先端を曲げて、(ここでは、木製のQ-ティップの一部、あるいはmicrodissectingニードルホルダー)は、ハンドルに取り付けます。
- フックで硬膜を持ち上げて、メスでそれを切る。特別なケアは、PIA、船舶、新皮質の表面の損傷を防ぐために取られます。小さな出血が解決することができます生理食塩水灌漑による。大出血が発生した場合、または新皮質が何らかの方法で侵害された場合は、1つは、手術を終了し、別の動物の作製を検討する必要があります。
6。プローブを注入する
この段階では、皮質表面の血管の密度と配向性を慎重に評価されています。プローブは大きな血管からのフリーエリアでは、脳を貫通しているため、定位座標は、調整する必要があります。
注入は、ドライブ·アセンブリは、定位ホルダーに取り付けられたワニ口クリップで保持することができます。途切れない脳表面の可視性とプローブの先端は成功した侵入のために重要である。
- 常に生理食塩水で開頭術を潤しながら、ゆっくりと、目的のターゲット上で約1ミリメートルにプローブを下げる。新皮質の記録については、プローブ·チップは、皮質に約0.5ミリメートルを下げており、表面の近くに戻って持ち上げた。
- ニードル(10 mLのパラフィン油中のワックスの10 20G、65℃で加熱)を介してワックスとパラフィンオイルの温かい溶融混合物を適用することにより、開頭術をシールします。前のアプリケーションに、30°Cにミックスを冷却し、密度をテストします。それは)簡単なプローブの動きを可能にするために十分なソフトでなければなりません。完全なカバレッジを容易にするために、混合物をマイクロcauterizerの先端で硬化したワックスに近づくことによってその場で溶融することができます。
- オンにする無料のナットを残すように注意して、グリップセメントで頭蓋骨にドライブの底部を添付してください。それは、プローブが皮質に損傷を与えますそれ以外の場合は、この段階でドライブのいずれかの偶発的な "バンプ"を回避するために最も重要である。ドライブが頭蓋骨に固定された後、プローブの滑らかな動きを確認する必要があります。
- 頭蓋骨にプローブのコネクタ部分を固める。
7。上のヘッドファラデーケージを構築する
- プルアップ抵抗とプローブとDRI周りに保護シリンダーに銅メッシュフラップを組み立てるVE。シリンダーは、環境ノイズと動作動物中の荷電ウィスカによって生成された徐波の成果物に対して、電気シールドとして機能します。
- 銅メッシュがプローブコネクタの上部レベルですので、余分な材料を離れて切断することによってシリンダーの高さを調整します。
- はんだリファレンスとグランドのネジからコネクタの適切なピンへの配線。また、はんだ隣接する銅メッシュフラップが一緒に銅メッシュにアース線を電気的導通を確保し、はんだ付けします。
- それを強化するため、金属や動物の皮膚の間の任意の直接接触を防ぐために銅メッシュ上にグリップセメントの層を適用します。必要に応じて、さらにヘッドギアを強化するためのエポキシ樹脂の層を適用します。
- ドライブスクリューの動きをテストします。
- ゴム手袋からカット部分とヘッドギアの上部をカバーしています。
8。自由に動く動物の記録
- appropri後術後ケアを食べ、高インピーダンスヘッドステージと軽量、ultraflexibleマルチストランドケーブルを使用して記録システムに動物を接続します。カウンターヘッドギアの重量。
- homecageに毎日記録の品質をテストします。記録部位の位置は、ユニットの発火パターンとローカルフィールドポテンシャルの形状の両方によって判断される。ターゲット構造に達するまで少しずつ(通常は1月8日1日あたり1/4回転まで、すなわち35から70マイクロメートル)でネジを回して徐々にプローブを下げます。
9。代表的な結果
電気信号(ローカルフィールドポテンシャルとユニット活動)が記録された構造と動物の現在の動作に応じて異なります。ラットのオープンフィールドを探求している間に図1は、32チャンネルCA1海馬の録音の例を示します。 supの探査中にローカルフィールドポテンシャルの著名な8ヘルツ(シータバンド)発振に注意してください。複数のシャンクと部位(矢印で示されたスパイクの例)でスパイクerimposed。ニューロンユニットのアクティビティを分析するために、スパイクが検出され、その波形を15から16までのクラスター分析を使用して単一のユニットにソートされます。
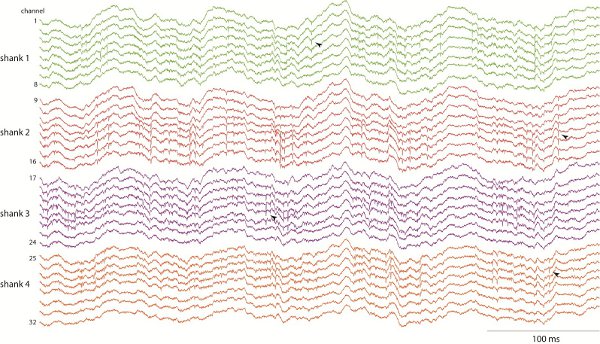
図1 4シャンクス×8サイトのシリコンプローブを用いて行動をラットCA1海馬の録音。録音は、広帯域とローカルフィールド電位振動(例えば "シータ"バンド8 Hzのリズム)とニューロンのスパイク活性の両方を勉強することができます20 000 Hzのサンプリングされます。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
この映画は動作ラットの慢性的な大規模なレコーディング用シリコンプローブの注入手順を示しています。ニューロンの活動の質の録音を確保するための重要なステップは、生物学(脳組織)と技術(シリコンプローブ)材料の両方の脆弱性から生じる。任意のリモート "ハード"面(1つは硬膜を除去せずに脳にそれらを移植しようとした場合、例えば、シャンクが壊れるだろう)と?...
Access restricted. Please log in or start a trial to view this content.
開示事項
利害の衝突が宣言されません。
謝辞
マリー·キュリー国際フェローシップ送信(欧州連合(EU)のFP/2007-2013グラント契約#221834と254780)、JDマクダネル財団、NSFグラントSBE 0542013、健康グラントNS034994の国立研究所、精神保健グラントMH5467、ハワードヒューズ医学研究所の国立研究所(Janeliaファームリサーチキャンパス助成金)。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments | |
| 名 | タイプ | 会社 | カタログ番号 | コメント |
| シリコンプローブBuzsaki32、4シャンク×8サイト。包装:柔軟なポリアミドケーブル | 材料 | NeuroNexus | プローブ:buzsaki32 包装:HC32 | 記録用プローブ |
| ラウンド真鍮ねじ、00から90×1/2ラウンド真鍮のネジ | 材料 | JIMorris | R0090B500 | 駆動部 |
| 真鍮六角ナット、00から90 | 材料 | JIMorris | N0090B | 駆動部 |
| 真鍮C260ストリップ、ASTM-B36 厚さ:0.025 "、長さ:12"幅:1/2 " | 材料 | スモールパーツ | B000FMYU72 | 駆動部 |
| コネクタヘッダ、ピッチ2mmのメートルエール、単一行、まっすぐ、36ポジション | 材料 | 閲覧 | 2163S-36-ND | 駆動部 |
| 2部Sylgardシリコンエラストマー | 材料 | 世界の精密機器 | SYLG184 | にプローブを外断熱 |
| ディーコンは70液体洗剤をContrad | 試薬 | フィッシャー·サイエンティフィック | 04から355 ディーコン研究所 番号:1002 | 記録部位をきれいにする |
| インピーダンス調整モジュール | 機器 | FHC(株) | 55-70-0 | インピーダンス計 |
| niPOD - 32チャンネル | 機器 | Neuronexus | niPOD -32 | インピーダンス計 |
| グリップセメント産業グレード | 材料 | コーキングDentsply | 675571(粉末) 675572(溶媒) | グリップCEメンター |
| 1,1 ' - ジオクタデシル-3,3,3'、3'-tetramethylindocarbocyanine過塩素酸塩( 'DiIを'; DiIC18(3)) | 試薬 | インビトロジェン | D282 | 脳内のプローブトラックを染色するために |
| ステンレス鋼の機械ねじ、バインド頭、スロットのドライブ、#00から90、1/8 " | 材料 | スモールパーツ | MX-0090-02B | グラウンドとリファレンスネジ |
| マグネットワイヤ、20G、ナイロンポリウレタンコーティング、MW80 | 材料 | スモールパーツ | B000IJYRP2 | 地面と基準線 |
| ステンレススチール製の小ネジ、ドライブスロット結合ヘッド、#000から120、1/16 " | 材料 | スモールパーツ | MX-000120-01B | アンカーのネジ |
| N-3のすべての汎用磁束液体 | 試薬 | ラ-CO(MARKAL) | 23512 | 半田ステンレス鋼にできます。 |
| マイクログリッドの精度拡張銅 | 材料 | Dexmet | 3 CU6-050 FA | 上のヘッドファラデーケージ用銅メッシュ |
| C&B-METABONDクイック!セメントシステム - 象牙質アクチベーター | 材料 | Parkell | S380 | |
| C&B-METABONDクイック!セメントシステム - 歯科用セメント | 材料 | Parkell | S380 | |
| 鋭いポイントタングステン針とホルダー | ツール | Roboz手術器具 | RS-6064とRS-6061 | 硬膜を持ち上げてフックを作成するには |
| カーバイドバーHP 1月4日 | ツール | ヘンリーシャイン | 9990013 | |
| パラフィン(顆粒) | 材料 | フィッシャー·サイエンティフィック | P31-500 | |
| ミネラルオイル、ライト(NF / FCC) | 材料 | フィッシャー·サイエンティフィック | O121-1 | |
| GC ELECTRONICS 10から114の2パートエポキシ接着剤 | 材料 | ニューアーク | 00Z416 | |
| タイプ1のリッツ21 AWG 36分の40レッド0.041 TO(MW80-C)ポリウレタンナイロンシングル "+ / -0.002" OD | 材料 | ニューイングランドワイヤー·テクノロジー株式会社 | N28-36E-400から2 | ヘッドとアンプ間のケーブルを作成するには |
| 32チャンネルの非常に大規模な統合のステージ、20倍のゲイン | 機器 | Plexon | HST/32V-G20 | ステージ |
参考文献
- Buzsáki, G. High-frequency network oscillation in the hippocampus. Science. 256, 1025-1027 (1992).
- Wilson, M. A., McNaughton, B. L. Dynamics of the hippocampal ensemble code for space. Science. 261, 1055-1058 (1993).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat. Neurosci. 7, 446-451 (2004).
- Buzsáki, G. Visualizing Large-Scale Patterns of Activity in the Brain: Optical and Electrical Signals. Society for Neuroscience. , Washington, DC. (2004).
- Nicolelis, M. A. L. Methods for Neural Ensemble Recordings. , 2nd edition, CRC Press. Boca Raton, FL. (2008).
- Hatsopoulos, N. G., Donoghue, J. P. The science of neural interface systems. Annu. Rev. Neurosci. 32, 249-266 (2009).
- Battaglia, F. P. The Lantern: an ultra-light micro-drive for multi-tetrode recordings in mice and other small animals. J. Neurosci. Methods. 178, 291-300 (2009).
- Kloosterman, F., Davidson, T. J. Micro-drive Array for Chronic in vivo Recording: Drive Fabrication. J. Vis. Exp. 26, e1094-e1094 (2009).
- Nguyen, D. P., Layton, S. P. Micro-drive Array for Chronic in vivo Recording: Tetrode Assembly. J. Vis. Exp. (26), e1098-e1098 (2009).
- Haiss, F., Butovas, S., Schwarz, C. A miniaturized chronic microelectrode drive for awake behaving head restrained mice and rats. J. Neurosci. Methods. 187, 67-72 (2010).
- Cerf, M. On-line, voluntary control of human temporal lobe neurons. Nature. 467, 1104-1108 (2010).
- Kohn, D. F. Anesthesia and Analgesia in Laboratory Animals. American College of Laboratory Animal Medicine. series, (1997).
- Schjetnan, A. G. P., Luczak, A. Recording Large-scale Neuronal Ensembles with Silicon Probes in the Anesthetized Rat. J. Vis. Exp. (56), e3282-e3282 (2011).
- Paxinos, G., Watson, C. The Rat Brain. Stereotaxic Coordinates. , Elsevier Academic. Amsterdam. (1982).
- Harris, K. D. Accuracy of tetrode spike separation as determined by simultaneous intracellular and extracellular measurements. J. Neurophysiol. 84, 401-414 (2000).
- Hazan, L., Zugaro, M., Buzsáki, G. Klusters, NeuroScope, NDManager: a Free Software Suite for Neurophysiological Data Processing and Visualization. J. Neurosci. Methods. 155, 207-216 (2006).
- Kipke, D. R. Advanced neurotechnologies for chronic neural interfaces: new horizons and clinical opportunities. J. Neurosci. 28, 11830-11838 (2008).
- Csicsvari, J. Massively parallel recording of unit and local field potentials with silicon-based electrodes. J. Neurophysiol. 90, 1314-1323 (2003).
- Sodagar, A. M., Wise, K. D., Najafi, K. A fully integrated mixed-signal neural processor for implantable multichannel cortical recording. IEEE Trans. Biomed. Eng. 54, 1075-1088 (2007).
- O'Connor, D. H., Huber, D., Svoboda, K. Reverse engineering the mouse brain. Nature. 461, 923-929 (2009).
- Boyden, E. S. Millisecond-timescale, genetically targeted optical control of neural activity. Nat. Neurosci. 8, 1263-1268 (2005).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nat. Rev. Neurosci. 8, 577-581 (2007).
- Royer, S. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. Eur. J. Neurosci. 31, 2279-2291 (2010).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved