A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تعيش خلية من خلايا التصوير تعرب عن ترحيل البروتينات Fluorescently الموسومة في مصفوفة ثلاثية الأبعاد
In This Article
Summary
وقد جرت العادة على العمليات الخلوية مثل الهجرة الخلية درس على السطوح ثنائية الأبعاد ، والبلاستيك شديدة. هذا التقرير وصفا لأسلوب لتصور مباشرة توطين البروتين وتحليل ديناميات البروتين في الخلايا المهاجرة في مصفوفة أكثر أهمية من الناحية الفسيولوجية ثلاثي الأبعاد.
Abstract
تقليديا ، وقد تمت دراسة الهجرة الخلية على اثنين من الأبعاد أسطح بلاستيكية صلبة. ومع ذلك ، خلال العمليات البيولوجية الهامة مثل التئام الجروح ، وترميم الأنسجة ، والانبثاث السرطان ، ويجب أن تنقل من خلال خلايا الأنسجة معقدة ثلاثية الأبعاد ، خارج الخلية. إلى فهم أفضل للآليات وراء هذه العمليات البيولوجية ، فمن المهم دراسة دور كل من البروتينات المسؤولة عن قيادة خلية الهجرة. هنا ، ونحن الخطوط العريضة لبروتوكول لدراسة آليات الهجرة الخلية باستخدام خط الخلايا الظهارية (MDCK) ، وثلاثية الأبعاد ، ليفي ، البلمرة مصفوفة الذاتي باعتباره النظام النموذجي. هذه المصفوفة خارج الخلية بصريا واضحة قابلة بسهولة للدراسات التصوير الخلية الحية وأفضل يحاكي الفسيولوجية ، والبيئة ، الأنسجة الرخوة. هذا التقرير يوضح تقنية لتصور مباشرة توطين البروتين وديناميكية ، وتشوه مصفوفة ثلاثية الأبعاد المحيطة.
امتحانination توطين البروتين وديناميكية خلال العمليات الخلوية توفر الفكرة الرئيسية في وظائف البروتين. به نيون المشفرة جينيا توفر طريقة فريدة من نوعها لرصد توطين البروتين وديناميكية. باستخدام هذه التقنية ، يمكننا تحليل تراكم التحت خلوية من المفتاح ، والقوة المولدة للمكونات هيكل الخلية في الوقت الحقيقي كما المناورات الخلية من خلال المصفوفة. بالإضافة إلى ذلك ، باستخدام به نيون متعددة مع أطوال موجية مختلفة ، يمكننا النظر في توطين بروتينات متعددة في وقت واحد ، مما يسمح لنا لاختبار ، على سبيل المثال ، إذا كان لديهم أدوار مختلفة من البروتينات مشابهة أو مختلفة. وعلاوة على ذلك ، يمكن كميا ديناميات بروتينات الموسومة fluorescently باستخدام الاسترداد بعد Photobleaching نيون (FRAP) التحليل. هذه المقايسات قياس البروتين التنقل وكيفية ستابلي ملزمة البروتينات هي لشبكة هيكل الخلية.
عن طريق الجمع بين الخلية الحية التصوير مع علاج من مثبطات البروتين وظيفة ،يمكننا النظر في التغييرات في الوقت الحقيقي في توزيع البروتينات ومورفولوجيا الخلايا المهاجرة. وعلاوة على ذلك ، ونحن أيضا دمج الخلايا الحية التصوير مع استخدام الجزيئات التتبع الفلورسنت المدمجة داخل المصفوفة لتصور تشوه مصفوفة أثناء الهجرة الخلية. وبالتالي ، لا يمكننا تصور كيف يمكن لخلية المهاجرة توزع القوة المولدة للبروتينات ، وحيث تبذل قوات الجر إلى المصفوفة المحيطة بها. من خلال هذه التقنيات ، يمكننا الحصول على معلومات قيمة حول دور كل من بروتينات معينة ومساهماتها في آليات الهجرة الخلية.
Protocol
1. جيل من خط الخلية مستقرة (خلايا MDCK مثلا)
- لوحة الخلايا في 80-90 ٪ confluency في صحن P35. لا تدع الخلايا شكل أحادي الطبقة متموجة 100 ٪ ، الأمر الذي سيقلل ترنسفكأيشن الكفاءة.
- Transfect الخلايا مع الاهتمام باستخدام البلازميد Lipofectamine 2000. تحسين ظروف ترنسفكأيشن باستخدام بروتوكول المصنعة.
- اليوم التالي ، والمرور على الخلايا إلى قسمين أطباق بتري P150. وأوصت صحن كبير بما يكفي للسماح للتباعد بين المستعمرات مستقرة.
- اليوم التالي ، وتغير وسائل الإعلام وإضافة 500 ميكروغرام / مل من G418 إلى كل طبق. وينبغي أن يكون الأمثل للتركيز G418 خطوط الخلايا الفردية.
- تغيير وسائل الاعلام كل يوم عن الآخر ما يقرب من 2 اسابيع. بعد 2 أسابيع ، ينبغي G418 المقاوم المستعمرات بدء شكل من الأشكال ، وسوف تكون مرئية بالعين المجردة.
- باستخدام المجهر المقلوب الفلورسنت ، وتحديد المستعمرات GFP إيجابية. بمناسبة هذه المستعمرات على لوحة باستخدام قلم sharpie.
- ليالييعرض للتريبسين electively المستعمرات من نسيج لوحة الثقافة ، نضح من وسائل الإعلام ، ويغسل خلايا مرتين مع برنامج تلفزيوني او حل التربسين. على غسل الثاني ، لا نضح بها كل حل. ترك طبقة رقيقة من السائل على الجزء السفلي من لوحة لمنع الخلايا من التجفيف.
- لكل مستعمرة ملحوظة : استخدام مسحة القطن المعقمة للقضاء أقرب وقت ممكن حول حافة مستعمرة. وهذا خلق جزيرة المنطقة الرطبة التي تحتوي على مستعمرة الخلية. ماصة 10 ميكرولتر من التربسين على المستعمرة. كرر لكل مستعمرة ، والمضي قدما بسرعة لتجنب حدوث جفاف. يمكن للباحث اختيار ذوي الخبرة عادة في مستعمرات ~ 12 لوحة P150.
- احتضان لوحة عند 37 درجة مئوية لمدة 5-10 دقائق حتى فصل من الخلايا وتظهر لوحة مستديرة.
- لكل مستعمرة : الماصة 10 ميكرولتر من التربسين على المستعمرة ، وماصة صعودا ونزولا بضع مرات لفصل الخلايا من اللوحة. ثم ماصة كافة الخلايا من مستعمرة في بئر واحدة في 24 طبق بشكل جيد. <لى> بعد استقرار المستعمرات قد نمت ، ويتم تحليل بروتين تعبير كل مستعمرة تستخدم طخة غربية القياسية والمناعي. توسيع هذه الخطوط الخلية لمزيد من التحليل.
2. تعديل سطح الطبق السفلي من الزجاج لربط الكولاجين الأمثل (اختياري)
- لsilanize الزجاج ، ماصة 300 ميكرولتر من 2 ٪ 3 - Aminopropyltrimethoxysilane على حل جزء من كل طبق زجاج P35 مع فتح 10 ملم. انظر الشكل (1) لsilanization وعبر ربط التخطيطي. غير المخفف 3 Aminopropyltrimethoxysilane في المياه التي تمت تصفيتها.
- احتضان لمدة 1 ساعة في درجة حرارة الغرفة.
- نضح من الحل 3 Aminopropyltrimethoxysilane ويغسل بالماء تصفية ثلاث مرات لمدة 10 دقيقة لكل منهما.
- نضح الماء من الأطباق ومكان على لوحة الساخن تعيين إلى 50 درجة مئوية لمدة 1.5 ساعة. قمم مكان الأطباق قليلا قبالة الصحن بحيث الرطوبة في صحن يمكن الفرار.
- إزالة الأطباق من الحرارة والسماح لسجعلتر.
- ماصة 300 ميكروليتر من محلول غلوتارالدهيد 2 ٪ على الجزء الزجاجي من كل طبق. وتضعف غلوتارالدهيد في برنامج تلفزيوني.
- احتضان لمدة 1 ساعة.
- نضح من الحل غلوتارالدهيد وغسل الأطباق مع ثلاث مرات في برنامج تلفزيوني لمدة 10 دقيقة لكل منهما.
- تعقيم الأطباق عن التعرض للأشعة فوق البنفسجية لمدة 1 ساعة. ويمكن تخزين الأطباق silanized في درجة حرارة الغرفة.
3. إعداد جيل 3D مع جزيئات الكولاجين التتبع
- يغسل الجسيمات الفلورية التتبع عن طريق الدوران بانخفاض 100 ميكروليتر من الجسيمات التتبع الأسهم (10 10 جزيئات / مل) في أجهزة الطرد المركزي في 15000 دورة في الدقيقة لمدة 5 دقائق ، ونضح من السائل ، وإضافة 500 ميكرولتر من وسائل الإعلام. كرر 5 مرات. بعد غسل الماضي ، والجسيمات resuspend في 30 ميكرولتر من وسائل الإعلام.
- يعرض للتريبسين GFP معربا عن الخلايا كالمعتاد.
- Resuspend الخلية بيليه إلى ما يقرب من 2 × 10 6 خلايا / مل.
- ماصة 240 ميكروليتر من وسائط النمو في أنبوب إيبندورف.
- إضافة 12.6 ميكرولتر من Hepes 1M ، 20 ميكروليتر من الماء المصفى ، 50 ميكروليتر من محلول الخلية ، ثم 10 ميكرولتر من الجسيمات الفلورية.
- أخيرا ، أضف 167 ميكروليتر من الكولاجين البقري الأدمة أنا الحل (للحصول على تركيز العمل من 1 ملغ / مل).
- مزيج حل شامل ، ثم ماصة 80 ميكرولتر من الحل على جزء من صحن الزجاج زجاج silanized القاع.
- صحن المكان الى حاضنة والسماح للهلام لتبلمر عند 37 درجة مئوية لمدة 30 دقيقة. انظر الشكل 1A للهلام الكولاجين نموذجية في صحن الزجاج السفلي P35.
- إضافة 2 مل من وسائط النمو بعناية إلى كل طبق.
4. إجراءات الحصول على الصور مرور الزمن
- بدوره على التحكم في درجة الحرارة من الضميمة المجهر ، والسماح للغرفة نطاق يوازن إلى درجة الحرارة إلى 37 حالة مستقرة درجة مئوية. انظر الشكل 2 مثالا لنظام التصوير الحية الخلية.
- تغيير وسائل الاعلام الى وسائل الاعلام الجديدة تستكمل مع 25 ملي Hepes للحفاظ على الرقم الهيدروجيني محايدة. إلىمدينة دبي للإنترنت والتصوير ، وتبادل الجزء العلوي من طبق واحد التي لديها أعلى الزجاج. باستخدام شريط رقيقة من parafilm ، وتغطية جانب من الطبق وسائل الاعلام لمنع التبخر.
- للحصول على النفط الهدف الغمر ، ضع قطرة واحدة من السائل الغمر على الهدف.
- وضع الجل التي تحتوي على الكولاجين طبق على خشبة المسرح المجهر ، وتأكد من أن الطبق يجعل الاتصال مع السائل الغمر.
- التركيز على عينة والبحث عن الخلايا التي تهم الصورة. للحد من الانجراف المرحلة ، والسماح لتسوية طبق لمدة 45 دقيقة قبل البدء في التقاط طويلة.
- تحديد معايير الحصول على الصور. تقليل التعرض ليزر ، والتي قد تضر الخلايا ، التي تحوير قوة الليزر ، ومدة التعرض ، وتواتر ومدة من الوقت الالتقاط. سوف المعلمات الفعلية تختلف مع نظام المجهر ونوع من الخلايا.
- خلال الوقت الفاصل بين شراء ، يمكن إضافة مثبط. مثبط للتجربة بالإضافة إلى ذلك ، لا ختم الطبق مع parafilm.
- الإعداديةوتستكمل Hepes وسائل الاعلام مع المخدرات على تركيز العمل المطلوب.
- عندما تصبح مستعدة لإضافة المخدرات إلى وسائل الإعلام ، وقفة لالتقاط الصور ، وإزالة بعناية أعلى الطبق من دون إزعاج الطبق.
- نضح من وسائل الإعلام في الطبق ، وماصة للدواء يحتوي على وسائل الاعلام الى الطبق. ثم ، بعناية استبدال أعلى الطبق.
- العينة قد تكون خارج نطاق التركيز نتيجة لإضافة وسائل جديدة ، تعدل التركيز.
- إعادة تشغيل الالتقاط ، ثم رصد اعتقال لمدة 30 دقيقة القادمة ، وتعديل التركيز عند الضرورة. انظر الشكل 4 للحصول على مثال تجربة إدمان المخدرات.
5. والتحليل الداخلي FRAP
- الإعداد FRAP يختلف بين الأنظمة ، اتبع تعليمات الشركة الصانعة.
- إعداد المعلمات للخلية الحية التصوير.
- إعداد المعلمات للphotobleaching. استخدام ما يكفي من الطاقة ليزر لphotobleach إشارة الفلورسنت دون الإضرار الخلية. اختبار هذه الاسميةameters على خلايا الممارسة.
- بدء التقاط الصور ، والسماح على الأقل 5 إطارات من التقاط الصور قبل photobleaching منطقة الفائدة.
- تواصل اعتقال ، والوقت الانتعاش ينبغي أن يكون كافيا لالتقاط الشفاء التام مضان. انظر الشكل (5) للحصول على مثال التجربة FRAP.
- تحليل مضان الانتعاش عن طريق قياس كثافة متوسط فلوري المنطقة photobleached (قبل وبعد photobleaching) مع مرور الوقت. باستخدام برنامج التحليل الإحصائي (مثل اكسل) ، تناسب منحنى الانتعاش إلى المعادلة الأسية : أنا = أنا و (1 - E - KT) ، حيث I هي الشدة ، وأنا و هو شدة النهائي ، t هو الوقت ، وτ ½ هو الوقت الذي تستغرقه للوصول إلى كثافة نصف القيمة النهائية : τ = ½ LN (2) / ك. في نصف الوقت هو مقياس لمعدل التنقل من البروتين.
- الحصول على المعلمات ، ونصف الوقت وكثافة النهائي من منحنى أسي - مناسبا. حساب اله جزء المتنقلة عن طريق اتخاذ نسبة النهائية لشدة مضان الأولي.
6. ممثل النتائج
ويرد مثال على التصوير الخلية الحية من الخلايا الظهارية صحية داخل المصفوفة في الشكل 3. الخلايا السليمة المعرض على نحو سلس ، غشاء مستمر ، ونواة متميزة ، في حين أن الخلايا غير صحية وغالبا ما يكون الغشاء تعطلت ، وعدد كبير من الفجوات. في مصفوفة 3D ، وتهاجر الخلايا الظهارية واحدة 1 ، وعلى مدى عدة أيام ، والخلايا الظهارية شكل ثلاثي الأبعاد ، كروية ، متعدد الكيسات الخلوية داخل المصفوفة 2. الخلايا هي أيضا ديناميكية للغاية ، والهجرة داخل الكيس (الشكل 3). ويتم تحليل مصفوفة تشوه نتيجة لقوى الجر التي تبذلها الخلايا المهاجرة عبر تهجير الجزيئات جزءا لا يتجزأ من التتبع في المصفوفة المحيطة (الشكل 4). يتم عرض حركات الجسيمات التتبع كصورة الإسقاط تختلف أقصىالنقاط الزمنية والأنف والحنجرة ، ولكل نقطة الساعة الزائفة ملونة للدلالة على الوقت (الشكل 4B). بدلا من ذلك ، يتم عرض الصور من الجسيمات التتبع الفردية والمونتاج لإظهار حركة الجسيمات التتبع على مر الزمن (الشكل 4C). وقد تم تحليل الصور باستخدام جميع ImageJ. هذه التقييمات النوعية من تشوه مصفوفة ، وبالتالي فإن القوى التي تبذلها الخلايا المهاجرة ، وترسم أولى مفيدة لتوزيع قوة الجر. تقدير كمي للقوات الجر التي تبذلها الخلايا المهاجرة في 3D هو خارج نطاق هذا البروتوكول ، ويوصف في أماكن أخرى 3،4.
ويرد نموذجي لاستعادة التألق بعد photobleaching التجربة في الشكل 5. يجب photobleached المنطقة ذات الاهتمام باستخدام الليزر الإعدادات الأمثل بحيث تقلص واضح في كثافة مضان مقارنة بمستويات الخلفية (لتعظيم إشارة إلى نسبة الضوضاء) ، مع الحفاظ على الخلايا السليمة وغير التالفة. ويجب الإعداد الأمثل به تحدد تجريبيا كما في كل الإعداد FRAP مختلفة (على سبيل المثال ، باستخدام الليزر FRAP نظام المسح مبائر).
يجب أن يكون التعرض والوقت الفاصل الزمني ، من الحصول على الصور بعد FRAP تسيطر عليها بعناية لتجنب photobleaching الخلفية. استخدام الليزر انخفاض القوة ، في وقت قصير التعرض ، واستخدام الكاميرا الحساسة والبصريات كفاءة عالية ضرورية لجودة عالية FRAP التصوير. إذا مضان تبيض خلال الحصول على الصور مهم ، يجب أن يكون كميا هذه الخلفية ، ويتلاشى تطبيع من الانتعاش كثافة مضان ملاحظتها. نظرا لطبيعة البيئة 3D ، قد ض مكون من الانتعاش كثافة مضان تصبح كبيرة. ولذلك ، فمن المهم لتحديد حجم photobleached عن طريق اتخاذ ما قبل وما بعد 3D كومة صور photobleached المنطقة. وتناقش مزيد من التحليل والنمذجة الانتعاش في أماكن أخرى 5،6 مضان.
مزيج فريد من ر التصوير الخلية الحيةechniques : GFP لمتابعة ديناميكية البروتينات هيكل الخلية ، مضان أحمر الجزيئات الكاشفة لرصد تشوه مصفوفة ، وإضافة مثبطات ، يمكن استخدامها في وقت واحد لتحليل ديناميات البروتين ، وقوة الجر والمسارات الجزيئية.
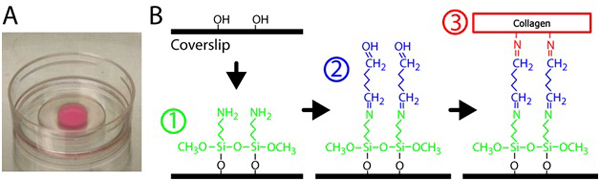
الشكل 1. تحضير هلام الكولاجين. أ) مادة الكولاجين بلمرة على طبق من الزجاج السفلي. اللون الوردي من هلام ومن المقرر أن الجسيمات الفلورية المدمجة. ب) إجراءات لمعالجة الأطباق أسفل الزجاج لتشعبي الجل الكولاجين على السطح الزجاجي. أولا ، يتم التعامل مع صحن أسفل الزجاج مع 3 - Aminopropyltrimethoxysilane الحل ، ثم حل غلوتارالدهيد أن crosslinks المصفوفة الكولاجين على الزجاج.
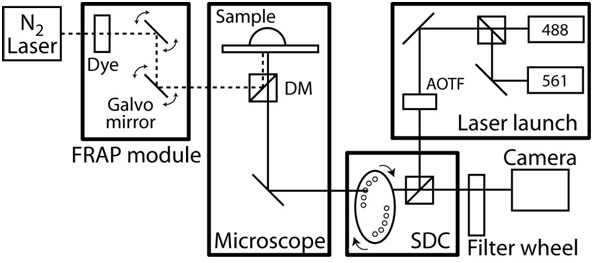
الشكل 2. مخططات الإعداد المجهر مبائر / FRAP. ومبائرويستند المجهر على AxioObserver زايس مع كاميرا CCD HQ CoolSnap الثاني ومؤتمتة بالكامل بواسطة برنامج Slidebook (الذكي ابتكارات التصوير). وحدة مبائر هو العرف مصممة على أساس وحدة ويوكوجاوا القرص الغزل CSU10 واثنين من الحالة الصلبة ليزر (488 نانومتر مع 50 ميغاواط و 561 ميغاواط مع 40 نانومتر) مع صوتية الضوئية تصفية الانضباطي (AOTF) للسماح ميلي التبديل بين اثنين من أشعة الليزر. المرشحات الانبعاثات نانومتر ونانومتر 525/50 620/60 (# 118661 و # 118085 ، كروما والتكنولوجيا) ومرآة مزدوج اللون هو 488-568 BrightLine الفرقة المزدوج (Semrock). الأهداف هي العمل لمسافات طويلة 40X C - NA لامزيغ موضوعية مع 1.1 و 0.62 بعد عمل ملم ، وخطة 63x - NA لامزيغ موضوعية مع 1.4 و العمل على مسافة من 0.19 ملم. المجهر يتضمن أيضا نظاما جذ بالضوء FRAP التي تتكون من الألياف ضخ صبغة الليزر بصريا ، وهو موقف شعاع الكمبيوتر الخاضعة للرقابة والكثافة ، وحجم الحيود بقعة محدودة. علاوة على ذلك ، تم تجهيز مع المجهرمرحلة بمحركات XY التي تضم 0.1 ميكرون الترميز الخطي على كل محور. أثناء تصوير مرور الزمن ، هو الحفاظ على درجة الحرارة البيئية عن طريق غرفة مخصصة المجهر تصميم وسخان مع ردود فعل التحكم في درجة الحرارة. لعزل أي ضوضاء والاهتزازات ، ونظام المجهر كله على طاولة اهتزاز الحرة.
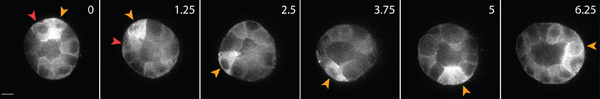
الشكل 3. التصوير الخلية الحية من الخلايا الظهارية معربا عن GFP - الأكتين. شكلت هذه الخلايا كيس بعد 4 أيام من الثقافة في مصفوفة 3D الكولاجين. بعض الخلايا تتحرك على طول سطح كيسة (رأس السهم الأصفر) ، والبعض الآخر يهاجر داخل كيس من الداخل (رأس السهم الأحمر). مقياس شريط 10 ميكرون ، والوقت في ساعات.
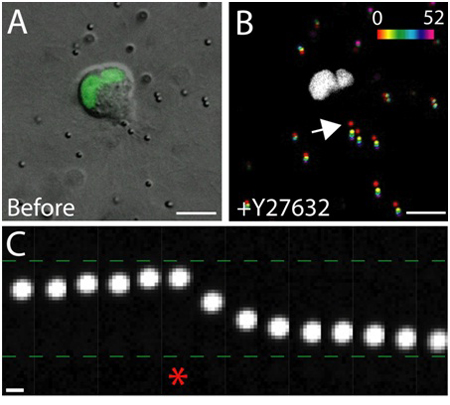
الشكل 4. تأثير رو - كيناز تثبيط على قوة الجر. أ) صورة من مدينة دبي للإنترنت خلية MDCK المهاجرة معربا عن GFP الموسومة علامة النووية. لقد التقطت الصورة فورا قبل العلاج رو مثبط كيناز - Y - 27632. مقياس شريط 10 ميكرون. ب) التشرد الجسيمات الناتجة من إضافة Y - 27632. مواقف الجسيمات في نقاط زمنية مختلفة (0 -- 52 دقيقة) كانت شبه الملونة وفقا لمقياس الشدة ، ثم المتوقعة على صورة واحدة. المنطقة البيضاء هي نواة GFP إيجابية في الخلايا المهاجرة. مقياس شريط 10 ميكرون. الوقت بالدقائق. C) وحركة الجسيمات على الحافة الخلفية للخلية (انظر السهم في باء). النجمة يدل على الإطار الأخير اعتقل قبل Y - 27632 بالإضافة إلى ذلك. نقل الجسيمات نحو التتبع وبعيدا عن حافة زائدة من الخلية المهاجرة قبل وبعد إضافة Y - 27632 على التوالي. شريط النطاق 1 ميكرومتر.
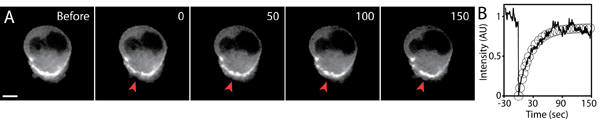
الشكل 5. تحليل FRAP من GFP - الأكتين معربا عن ترحيل الخلايا في مصفوفة ثلاثية الأبعاد. صور Timelapse ألف) من GFP -الأكتين معربا عن خلية من قبل وبعد photobleaching. وكان من منطقة صغيرة من أكتين - GFP المتراكمة في العمق الخلية photobleached (رأس السهم الأحمر) في timepoint 0. الوقت بالثواني ، نطاق شريط 5 ميكرون. ب) رسم متوسط كثافة مضان المنطقة photobleached (خط الصلب) ، وتناسب الأسي للانتعاش مضان (الدوائر) على مر الزمن. وكان تطبيع كثافة مضان إلى القيمة الأولية قبل photobleaching.
Discussion
نحن هنا وصف طريقة لاستخدام التصوير الخلية الحية لدراسة آليات الهجرة الخلية في مصفوفة ثلاثية الأبعاد. نجاح هذه التقنية يعتمد على الحصول على "جيدة" معربا عن استنساخ ستابلي GFP الموسومة البروتينات. وانخفاض مستوى البروتينات GFP تتطلب التعرض الإثارة الزائدة التي التن?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر الدكتور جرانت سوميدا لقراءة نقدية للمخطوطة. وأيد هذا العمل من قبل المحقق بيكمان جائزة الشباب (سي) ، وهي جائزة هيلمان العائلة كلية جديد (سي) ، وهو EUREKA المعاهد الوطنية للصحة ، وجامعة كاليفورنيا للسرطان جنة التنسيق البحوث.
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | فهرس العدد | تعليقات |
| الكولاجين البقري ، النوع الأول | العلوم البيولوجية دينار بحريني | 354231 | الاسهم حوالي 3 ملغ / مل |
| 3 aminopropyltrimethoxysilane | سيغما الدريتش | 281778 | المخفف في الماء |
| غلوتارالدهيد | سيغما الدريتش | 340855 | المخفف في برنامج تلفزيوني |
| 1M Hepes | Invitrogen | 15630-080 | |
| Fluospheres البوليسترين المجهرية 1 ميكرومتر ، مضان أحمر (580/605) | Invitrogen | F13083 | |
| Geneticin (G418) | Invitrogen | 11811-031 | |
| مكونات الثقافة وسائل الإعلام : | |||
| DMEM | Invitrogen | 31600-034 | |
| المصل البقري الجنين | اتلانتا البيولوجية | S115500 | |
| البنسلين / الستربتوميسين | Invitrogen | 15140-122 | |
| الكاناميسين | Invitrogen | 15160-054 | |
References
- Shih, W., Yamada, S., Myosin, . A dependent retrograde flow drives 3D cell migration. Biophys. J. 98 (8), L29-L31 (2010).
- O'Brien, L. E., Yu, W., Tang, K., Jou, T. S., Zegers, M. M., Mostov, K. E. Morphological and biochemical analysis of Rac1 in three-dimensional epithelial cell cultures. Methods Enzymol. 406, 676-691 (2006).
- Legant, W. R., Miller, J. S., Blakely, B. L., Cohen, D. M., Genin, G. M., Chen, C. S. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat. Methods. 7 (12), 969-971 (2010).
- Del Alamo, J. C., Meili, R., Alonso-Latorre, B., Rodriguez-Rodriguez, J., Aliseda, A., Firtel, R. A., Lasheras, J. C. Spatio-temporal analysis of eurkaryotic cell motility by improved force cytometry. Proc. Natl. Acad. Sci. U.S.A. 104 (33), 13343-13348 (2007).
- Lippincott-Schwartz, J., Snapp, E., Kenworthy, A. Studying protein dynamics in living cells. Nat. Rev. Mol. Cell Biol. 2 (6), 444-456 (2001).
- Phair, R. D., Misteli, T. Kinetic modeling approaches to in vivo imaging. Nat. Rev. Mol. Cell Biol. 2 (12), 898-907 (2001).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. Fluorescent toolbox for assessing protein location and function. Science. 312 (5771), 217-224 (2006).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved