需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
活细胞成像的移植细胞在一个三维矩阵表示荧光标记的蛋白质
摘要
传统的细胞过程,如细胞迁移研究二维的,僵硬的塑料表面上。本报告介绍了一个直接可视化蛋白定位和分析一个有关生理,立体矩阵的细胞迁移的蛋白质动力学的技术。
摘要
传统上,细胞迁移进行了研究二维的,僵硬的塑料表面上。然而,在伤口愈合,组织再生和癌症转移,如重要的生物过程,细胞必须通过复杂的,立体化的细胞外组织的导航。为了更好地理解这些生物过程背后的机制,重要的是要研究负责驱动细胞迁移的蛋白质的作用。在这里,我们勾勒出一个协议研究使用的上皮细胞株(MDCK)细胞迁移的机制,和一个立体的,纤维,作为一个模型系统的自我聚合矩阵。这透明的细胞外基质是活细胞成像研究容易服从和更好地模拟生理,软组织环境。这份报告展示了一个直接可视化蛋白定位和动态的技术,和周围的三维矩阵变形。
考试蛋白定位在细胞过程的动态ination到蛋白质的功能提供了关键的洞察力。基因编码的荧光标记提供了一个独特的方法观察蛋白定位和动态。使用这种技术,我们可以分析细胞内积累的关键,强行通过基质细胞演习实时生成细胞骨架的组成部分。此外,使用多个不同波长的荧光标记,我们可以研究多种蛋白质同时进行本地化,从而让我们来测试,例如,不同的蛋白质是否具有类似或不同的角色。此外,荧光标记的蛋白质的动态,可量化的使用荧光漂白后(FRAP)分析恢复。这种测量方法检测蛋白的流动性和稳定约束的蛋白质是细胞骨架网络。
通过与蛋白质功能抑制剂治疗相结合的活细胞成像,我们可以检查实时的蛋白质和细胞迁移形态的分布变化。此外,我们还结合使用荧光示踪粒子矩阵内的嵌入式可视化在细胞迁移的矩阵变形的活细胞成像。因此,我们可以想像如何迁移细胞分布力产生的蛋白质,以及牵引力施加到周围基质。通过这些技术,我们可以得到宝贵的见解,成特定的蛋白质和他们的贡献细胞迁移机制的角色。
研究方案
1。稳定细胞株的产生(如MDCK细胞)
- 板细胞在80-90%汇合在P35菜。不要让细胞形成100%汇合单层,这将降低转染效率。
- 细胞转染质粒用脂质体2000的利益。优化转染条件下,使用制造商的协议。
- 第二天,通过到两个P150皮氏培养皿中的细胞。大盘是建议允许足够的间距之间的稳定的殖民地。
- 第二天,改变媒体和500微克/毫升的G418添加到每一道菜。 G418浓度应优化个别的细胞株。
- 更改媒体隔日约2周。 2周后,G418抗性菌落应该开始形成,将肉眼可见。
- 使用倒置荧光显微镜,发现GFP阳性菌落。标记板使用sharpie笔这些殖民地。
- 到S选举trypsinize从组织培养板的殖民地,吸出媒体,并用PBS或胰蛋白酶液洗细胞两次。在第二次洗,不吸出所有的解决方案。板底部留下一层薄薄的液体,以防止细胞干燥。
- 对于每一个明显的殖民地:用消毒棉签擦拭周围的菌落边缘尽可能接近。这将创建一个含有细胞集落区湿岛。吸取10μL胰蛋白酶上的殖民地。重复每一个殖民地,并快速进行,以避免干燥。一个有经验的研究人员通常可以挑选每P150板〜12殖民地。
- 板在37 ° 5-10分钟,C直到细胞分离板,出现一轮。
- 对于每一个殖民地:吸取10μL到殖民地,胰蛋白酶和吸管上下几次分离板的细胞。然后吸管在24以及菜单井把所有的细胞从殖民地。 <李>稳定的殖民地长大后,每个殖民地蛋白表达是使用标准的免疫印迹和免疫荧光分析。展开作进一步分析这些细胞株。
2。表面改性玻璃底菜,以获得最佳的胶原蛋白结合(可选)
- silanize玻璃,加入300μL2%3 Aminopropyltrimethoxysilane解决方案到每一个10毫米的开放的P35菜的玻璃部分。硅烷交联示意图参见图1。 3 Aminopropyltrimethoxysilane是过滤后的水稀释。
- 1小时在室温下孵育。
- 吸出3 Aminopropyltrimethoxysilane解决方案,并用过滤水清洗三次,每次10分钟。
- 吸出热板的设置到50 ° C为1.5小时的水和地方菜。稍微偏离的菜菜肴的地方上衣,因此,在菜中的水分能逃脱。
- 起锅的菜,允许首席运营官L.
- 吸取300μL2%戊二醛溶液到每道菜的玻璃部分。戊二醛PBS稀释。
- 孵育1小时。
- 吸戊二醛溶液,用PBS洗3次,每次10分钟的菜肴。
- 1小时暴露于紫外灯消毒的菜肴。硅烷菜,可在常温下保存。
3。三维胶原凝胶的制备与示踪粒子
- 纺纱100μL股票示踪粒子在5分钟15000转的离心机(10 10颗粒/毫升)洗荧光示踪粒子,吸出液体,加入500μL媒体。重复5次。最后一次洗涤后,在30μL的媒体悬浮颗粒。
- 像往常一样Trypsinize GFP的表达。
- 重悬细胞沉淀约2 × 10 6细胞/ ml。
- 吸取240μL到Eppendorf管中生长介质。
- 添加1M HEPES 12.6μL,20μL过滤后的水,50μL细胞液,然后用10μL荧光颗粒。
- 最后,添加167μL牛真皮胶原我的解决方案(获得1毫克/毫升的浓度)。
- 彻底混合解决方案,然后滴入硅烷玻璃底菜的玻璃部分80μL的解决方案。
- 进入孵化器的地点菜,让凝胶聚合在37 ° C时30分钟。在P35玻璃底菜典型的胶原蛋白凝胶图1A。
- 仔细生长介质中加入2毫升每道菜。
4。时间推移图像采集程序
- 打开显微镜外壳的温度控制,让范围室平衡到一个稳定的状态温度为37 ° C一个活细胞成像系统的例子,参见图2。
- 媒体变化与25毫米的HEPES补充,以维持一个中性的pH值的新媒体。对于DIC成像,交流的菜之一,有一个玻璃顶的顶部。使用薄带钢的封口膜,覆盖的菜的一侧,防止媒体蒸发。
- 油浸物镜,将一个客观浸入流体下降。
- 将胶原凝胶含有显微镜下阶段的菜,并确保菜与浸入液体接触。
- 聚焦感兴趣的细胞图像的采样和搜索。为了尽量减少阶段漂移,让菜约45分钟才开始长捕获解决。
- 指定图像采集参数。激光照射,这可能会损害细胞,调节激光功率,照射时间,频率和持续时间捕捉时间最小化。显微镜系统和细胞类型的实际参数会有所不同。
- 在收购时间推移,一种抑制剂可能会增加。对于抑制剂此外实验,不要用封口膜密封盘。
- 预习HEPES补充在一个理想的工作浓度与药物的媒体。
- 当准备添加药物媒体,暂停图像采集,并仔细清除令人不安的菜盘上方。
- 吸出菜的媒体,和吸管含药入菜的媒体。然后,小心地更换盘上方。
- 样品可以出焦由于新媒体的另外,调整的重点。
- 重新启动捕获,然后在接下来的30分钟内捕获监视,并调整必要的重点。药物除了实验的例子,参见图4。
5。 FRAP程序和分析
- FRAP设置不同系统之间,按照制造商的指示。
- 设置参数为活细胞成像。
- 设置参数进行漂白。使用足够的激光功率,以不破坏细胞的光漂白的荧光信号。测试这些面值ameters上实践细胞。
- 启动图像采集,并允许漂白感兴趣的区域之前,至少5帧图像采集。
- 继续捕捉和恢复时间应足以捕捉到完整的荧光恢复。 FRAP实验的例子,参见图5。
- 分析测量的平均荧光强度的光漂白区(前和漂白后)随着时间的推移,荧光恢复。使用统计分析软件(如Excel),适合恢复曲线的指数方程为:I = I F(1 - E - KT),其中I是强度,I F是最后的强度,t是时间,和τ 半是,它的强度达到最终值的一半所需的时间 :τ½ = LN(2) / K。一半时间是衡量流动性的蛋白质率。
- 获取参数,一半时间和最终强度指数拟合曲线。计算日E Mobile公司的一小部分,最终比初始荧光强度。
6。代表性的成果
矩阵内的健康上皮细胞的活细胞成像的一个例子是如图3所示。健康的细胞表现平稳,连续的膜,和不同的原子核,而不健康的细胞往往有一个扰乱膜,数量过多的空泡。在一个三维矩阵,单一的上皮细胞迁移1,在数天的过程中,上皮细胞内形成矩阵2的立体,呈球形,多细胞囊肿。细胞也高度动态的,囊肿内(图3)迁移。通过嵌入周围基质(图4)中的示踪粒子的位移分析矩阵变形的细胞迁移施加的牵引力的结果。示踪粒子运动作为一个最大的不同投影图像显示耳鼻喉科时间点,每个时间点是伪彩色显示的时间(图4B)。另外,个人示踪粒子的图像显示为蒙太奇显示随着时间的推移示踪粒子的运动(图4C)。使用ImageJ完成所有图像分析。这些定性评估矩阵变形,因此细胞迁移施加的力量,是有用的牵引力分布近似。在三维细胞迁移施加牵引力的定量估计是超出了本协议的范围,并描述在别处3,4。
图5显示了一个典型的实验漂白后的荧光恢复。感兴趣的区域,必须使用激光优化设置,使荧光强度明显减弱相比,背景水平(以最大限度地提高信号的信噪比),同时保持健康和完好的细胞光漂白。最佳设置必须b发送凭经验确定每个FRAP设置是不同的(例如,FRAP使用激光扫描共聚焦系统)。
曝光后FRAP图像采集的时间间隔必须仔细控制,以避免背景光漂白。使用较低的激光功率,曝光时间短,和感光摄像头的使用和高效率的光学是必不可少的高品质FRAP成像。如果在图像采集的荧光漂白是显著的,这种背景下衰落必须加以量化,并从所观察到的荧光强度恢复正常化。由于3D的环境性质,Z -元件的荧光强度恢复可能成为显著。因此,重要的是定义一个光漂白卷,由前,后3D堆叠光漂白区域的图像。荧光恢复的进一步分析和建模是其他地方讨论 5,6 。
活细胞成像吨的独特组合echniques:绿色荧光蛋白细胞骨架蛋白,红色荧光示踪粒子动力学监测矩阵变形,抑制剂,可同时使用为蛋白质的动态,牵引力和分子途径分析。
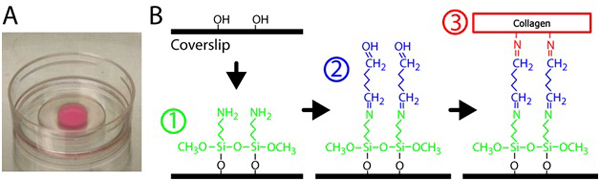
图1。胶原蛋白凝胶的制备。一)聚合在玻璃底菜胶原基质。粉红色的凝胶是由于嵌入的荧光颗粒。二)程序处理的玻璃底菜交联的胶原蛋白凝胶玻璃表面。首先,玻璃底菜是用3 Aminopropyltrimethoxysilane解决方案,然后戊二醛溶液交联的胶原基质玻璃。
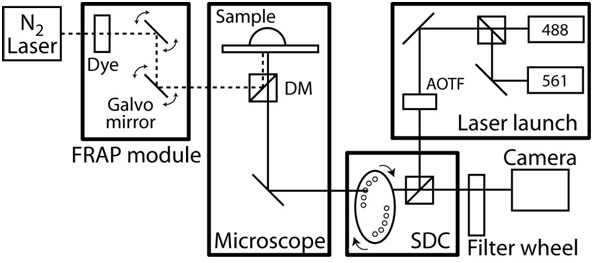
图2。焦/ FRAP显微镜设置示意图。共焦显微镜的基础上与一个CoolSnap HQ II CCD相机的蔡司AxioObserver Slidebook软件(智能成像创新)和完全自动化。共焦单位定制设计和横河电机旋转盘单位CSU10和两个固态激光器,声光可调谐滤波器(AOTF)(50兆瓦和40兆瓦与561纳米与488纳米)的基础上,让两束激光之间切换的毫秒。排放过滤器五十分之五百二十五纳米和六十分之六百二十零纳米(#118661和#118085,色度技术)和分色镜是488-568 BrightLine双频(Semrock)。的目标是:长工作距离的40X的C -复消色差透镜的目标与Na 1.1和0.62毫米的工作距离,和一个63X的计划,复消色差透镜的目标,与Na 1.4和0.19毫米的工作距离。该显微镜还包括一个FRAP photoablation系统,光纤光学,计算机控制光束位置和强度,泵浦染料激光器和衍射极限的光斑大小。此外,在显微镜配备XY机动阶段,其中包括0.1微米的每个轴的线性编码器。在时间推移成像,环境温度保持定制设计的显微镜室和反馈温度控制加热器。为了隔离噪音和振动,整个显微镜系统是无振动的表。
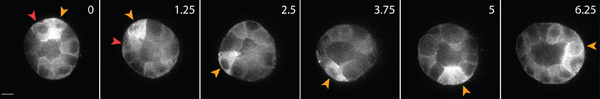
图3。上皮细胞表达GFP -肌动蛋白的活细胞成像。这些细胞经过4天的文化,在三维胶原基质形成囊肿。有些细胞沿着表面的囊肿(黄色箭头),而其他室内囊肿(红色箭头)内迁移。比例尺10微米,在小时的时间。
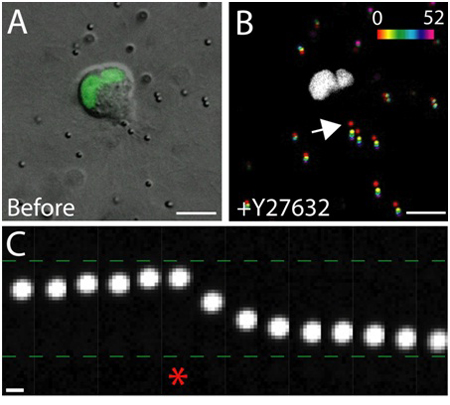
图4。Rho激酶的作用,抑制牵引力。一个迁移MDCK细胞表达G细胞)DIC的形象计划生育标签的核标记。立即采取的Rho激酶抑制剂Y - 27632治疗前的影像。比例尺10微米。 B)粒子的位移,此外Y - 27632。在不同时间点(0 - 52分钟)的粒子位置是根据强度等级的伪彩色,然后投射到一个单一的形象。白色区域是绿色荧光蛋白在细胞迁移正电的原子核。比例尺10微米。在几分钟的时间。 c)在粒子运动的细胞后缘(见箭头在B)。星号表示前Y - 27632除了捕获的最后一帧。走向和移植细胞后缘离前后此外Y - 27632,分别提出示踪粒子。比例尺1微米。
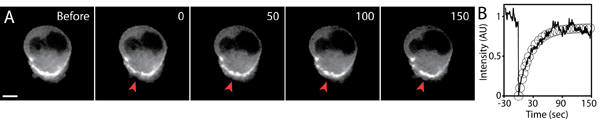
图5。FRAP GFP -肌动蛋白的分析,在一个三维矩阵表达的细胞迁移。一)Timelapse图像的GFP漂白前后的肌动蛋白表达细胞。绿色荧光蛋白,肌动蛋白的积累在细胞后部的一个小区域是光漂白(红色箭头),在时间点0。在几秒钟的时间,规模杆5微米。二)绘制的光漂白地区(实线),以及适合的荧光恢复指数(圆圈)的平均荧光强度随着时间的推移。荧光强度归漂白前的初始值。
Access restricted. Please log in or start a trial to view this content.
讨论
在这里,我们描述了一个用活细胞成像研究细胞迁移的机制,在一个三维矩阵的方法。这项技术的成功取决于获得“良好”的克隆稳定表达GFP标记的蛋白质。绿色荧光蛋白的水平低会损害细胞的健康,而过高GFP水平将有不良的副作用,对细胞需要一个多余的激励曝光。因此,转染到细胞中的基因的载体选择是很重要的(例如,子,荧光标记等)。有很多绿色荧光蛋白,包括红色荧光蛋白(RFP?...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
我们感谢手稿的关键读博士格兰特隅田川。这项工作是由一个贝克曼青年研究员奖“(SY),赫尔曼家庭新教师奖”(SY),美国国立卫生研究院尤里卡,加州大学癌症研究中心协调委员会的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 胶原蛋白,牛,I型 | BD公司 | 354231 | 股票约3毫克/毫升 |
| 3,aminopropyltrimethoxysilane | 西格玛爱秩序 | 281778 | 稀释水 |
| 戊二醛 | 西格玛爱秩序 | 340855 | 在PBS稀释 |
| 1M HEPES | Invitrogen公司 | 15630-080 | |
| Fluospheres聚苯乙烯微球1微米,红色荧光(六百〇五分之五百八十零) | Invitrogen公司 | F13083 | |
| Geneticin(G418) | Invitrogen公司 | 11811-031 | |
| 文化传媒组件: | |||
| DMEM培养液 | Invitrogen公司 | 31600-034 | |
| 胎牛血清 | 亚特兰大生物 | S115500 | |
| 青霉素/链霉素 | Invitrogen公司 | 15140-122 | |
| 卡那霉素 | Invitrogen公司 | 15160-054 | |
参考文献
- Shih, W., Yamada, S., Myosin, A dependent retrograde flow drives 3D cell migration. Biophys. J. 98 (8), L29-L31 (2010).
- O'Brien, L. E., Yu, W., Tang, K., Jou, T. S., Zegers, M. M., Mostov, K. E. Morphological and biochemical analysis of Rac1 in three-dimensional epithelial cell cultures. Methods Enzymol. 406, 676-691 (2006).
- Legant, W. R., Miller, J. S., Blakely, B. L., Cohen, D. M., Genin, G. M., Chen, C. S. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat. Methods. 7 (12), 969-971 (2010).
- Del Alamo, J. C., Meili, R., Alonso-Latorre, B., Rodriguez-Rodriguez, J., Aliseda, A., Firtel, R. A., Lasheras, J. C. Spatio-temporal analysis of eurkaryotic cell motility by improved force cytometry. Proc. Natl. Acad. Sci. U.S.A. 104 (33), 13343-13348 (2007).
- Lippincott-Schwartz, J., Snapp, E., Kenworthy, A. Studying protein dynamics in living cells. Nat. Rev. Mol. Cell Biol. 2 (6), 444-456 (2001).
- Phair, R. D., Misteli, T. Kinetic modeling approaches to in vivo imaging. Nat. Rev. Mol. Cell Biol. 2 (12), 898-907 (2001).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. Fluorescent toolbox for assessing protein location and function. Science. 312 (5771), 217-224 (2006).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。