Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Üç boyutlu Matrix floresan etiketli Proteinler ifade Geçiş Hücreler Canlı hücre Görüntüleme
Bu Makalede
Özet
Hücre göçü gibi hücresel süreçleri, geleneksel iki boyutlu, sert plastik yüzeyler üzerinde çalışılmıştır. Bu rapor doğrudan protein lokalizasyon görselleştirme ve daha fizyolojik ilgili üç boyutlu bir matris içinde göç eden hücrelerin protein dinamiklerini analiz etmek için bir teknik anlatılmaktadır.
Özet
Geleneksel olarak, hücre göçü, iki boyutlu, sert plastik yüzeyler üzerinde çalışılmıştır. Ancak, yara iyileşmesi, doku rejenerasyonu ve kanser metastazı gibi önemli biyolojik süreçleri sırasında, hücrelerin karmaşık, üç boyutlu ekstrasellüler doku ile dolaşmak gerekir. Bu biyolojik süreçlerin altında yatan mekanizmaları daha iyi anlamak için, hücre göçü sürüş için sorumlu proteinlerin rollerini incelemek için önemlidir. Burada, epitel hücre hattı (MDCK) kullanarak hücre göç mekanizmaları incelemek için bir protokol taslağı, ve üç boyutlu bir model sistem olarak, lifli, kendi kendine polimerize matris. Bu optik net ekstraselüler matriks, canlı hücre görüntüleme çalışmaları kolayca mükellef ve fizyolojik, yumuşak doku ortamı daha iyi taklit eder. Bu rapor doğrudan protein yerelleştirme ve dinamikleri görselleştirmek için tekniği ve çevresindeki üç boyutlu matris deformasyon gösterir.
Sınavhücresel süreçleri sırasında protein yerelleştirme ve dinamikleri ination protein fonksiyonları önemli bir fikir verir. Genetik olarak kodlanmış olan floresan etiketleri protein yerelleştirme ve dinamikleri gözlemlemek için benzersiz bir yöntem sağlar. Bu tekniği kullanarak, anahtar hücre içi birikimi analiz edebilir, kuvvet üreten matris yoluyla hücre manevraları gibi gerçek zamanlı sitoskeletal bileşenleri. Buna ek olarak, farklı dalga boylarına sahip birden fazla floresan etiketlerini kullanarak, biz, böylece bize farklı proteinler benzer veya birbirinden farklı rollere sahip olup olmadığını, örneğin, test etmek için izin proteinlerin aynı anda birden fazla lokalizasyonu inceleyebilirsiniz. Ayrıca, floresan tagged proteinleri (sıkı bağlamak) analizi Photobleaching sonra Floresan Recovery programını kullanarak dinamikleri belirlenebilir. Bu ölçüm testleri, protein hareketlilik ve nasıl stably proteinler bağlı iskelet ağ.
Canlı hücre görüntüleme protein fonksiyonu inhibitörlerinin tedavi ile birleştirerek,proteinleri ve göç eden hücrelerin morfolojisi dağıtım gerçek zamanlı değişiklikleri inceleyebilirsiniz. Ayrıca, biz de hücre göçü sırasında matris deformasyon görselleştirmek için matris içinde gömülü floresan tracer parçacıkların kullanımı ile canlı hücre görüntüleme birleştirir. Böylece, kuvvet üreten bir göç hücre proteinleri nasıl dağıttığını görselleştirmek, nerede ve çekiş güçleri çevreleyen matriks sarf edilir. Bu teknikler sayesinde, hücre göçü mekanizmaları spesifik proteinlerin ve onların katkılarını rolleri içine değerli bilgiler elde edebilirsiniz.
Protokol
1. Istikrarlı hücre hattı oluşturma (örneğin MDCK hücreleri)
- P35 çanak confluency% 80-90 Plaka hücreleri. Hücrelerin transfeksiyon verimliliği azaltacaktır% 100 konfluent tek tabaka oluşturur izin vermeyin.
- Lipofectamine 2000 kullanarak ilgi plazmid hücreleri Transfect. Transfeksiyon koşulları üreticinin protokolü kullanılarak optimize edin.
- Ertesi gün, geçit, iki P150 petri kutularının içine hücreler. Büyük bir çanak stabil kolonileri arasında yeterince boşluk izin tavsiye edilir.
- Ertesi gün, medya değiştirmek ve her yemek için 500 mg / ml G418 ekleyin. G418 konsantrasyonu ayrı hücre hatları için optimize edilmelidir.
- Yaklaşık 2 hafta boyunca her gün medya değiştirin. 2 hafta sonra, G418-dirençli koloniler oluşturmaya başlar, ve çıplak gözle görülebilir.
- Ters bir floresan mikroskop kullanarak, GFP pozitif koloniler tespit. Plaka üzerinde bir sharpie kalem kullanarak bu koloniler işaretleyin.
- Selektif, doku kültürü plakadan koloniler trypsinize, medya aspire ve hücreler iki kez PBS veya tripsin çözüm ile yıkayın. Ikinci yıkama, tüm çözüm aspire yok. Plakanın altındaki sıvı ince bir tabaka hücreleri kurumasını önlemek için bırakın.
- Her işaretli koloni için koloni kenarı etrafında temizlemek için mümkün olduğunca yakın steril bir pamuklu bir bez kullanın. Bu hücre koloni içeren ıslak alan bir ada yaratacaktır. Pipet 10 ul koloni üzerine tripsin. Her koloni için tekrarlayın ve kurutma önlemek için hızlı bir şekilde devam edin. Deneyimli bir araştırmacı genellikle ~ P150 plaka başına 12 koloniler alabilirsiniz.
- 37 o plaka ° C'de 5-10 dakika hücreleri ayırmak plaka ve yuvarlak görünene kadar.
- Her koloni için: Pipet 10 koloni üzerine tripsin ul ve plaka hücreleri ayırmak için birkaç kez aşağı ve yukarı pipetle. Sonra 24 iyi bir çanak tek bir kuyuya koloninin tüm hücreleri pipetle.
- stabil kolonileri büyüdü sonra, her koloninin protein ifade standart western blot ve immünofloresan kullanılarak analiz edilmektedir. Daha fazla analiz için bu hücre hatları genişletin.
2. En iyi kolajen bağlama (isteğe bağlı) cam alt çanağı yüzey modifikasyonu
- P35 10 mm açılması ile her yemeğin cam kısmı üzerine cam silanize için,% 2 pipet 300 ul 3-Aminopropyltrimethoxysilane çözüm. Silanization ve çapraz bağlama şematik Şekil 1'e bakınız. 3-Aminopropyltrimethoxysilane filtrelenmiş su ile seyreltilir.
- Oda sıcaklığında 1 saat inkübe edin.
- 3-Aminopropyltrimethoxysilane çözüm aspire edin ve her 10 dakika için filtrelenmiş su ile üç kez yıkayın.
- 50 ° C 1,5 saat, su ve sıcak plaka üzerinde yer yemekleri aspire. Yeri üstleri biraz çanak kapalı yemekleri tabak içinde bu nem kaçabilir.
- Isı yemekleri çıkarın ve coo izinl.
- Pipet 300 ul% 2 cam bölümü her yemeğin üzerine glutaraldehid çözüm. Glutaraldehid PBS içinde seyreltilir.
- 1 saat süreyle inkübe edin.
- Glutaraldehit solüsyonu aspire edin ve her biri 10 dakika PBS üç kez bulaşıkları yıkamak.
- 1 saat süreyle UV ışınlarına maruz kalma yemekler sterilize edin. Silanlanmış yemekler oda sıcaklığında saklanabilir.
3. Tracer parçacıkları ile 3D kollajen jel hazırlanması
- 5 dakika 15.000 rpm'de santrifüj stok tracer partiküller (parçacıklar: 10 10 / ml) 100 ul iplik floresan tracer parçacıklar yıkayın, sıvı dışarı aspirat ve 500 ul medya ekleyin . 5 kez tekrarlayın. Son yıkamadan sonra, medyanın 30 ul tekrar süspansiyon parçacıklar.
- GFP ifade hücrelerin her zamanki gibi Trypsinize.
- Yeniden süspanse hücre pelletini yaklaşık 2 x 10 6 hücre / ml.
- Pipet 240 ul Eppendorf tüpe büyüme medya.
- 1M HEPES 12.6 ul, 20 ul filtrelenmiş su, hücre çözüm 50 ul, sonra floresan parçacıklar 10 ul ekleyin.
- Son olarak, sığır dermis Kolajen I çözümü (1 mg / ml 'lik bir çalışma konsantrasyonunu elde etmek için) 167 ul ekleyin.
- Iyice çözüm karıştırın, daha sonra Silanlanmış cam alt çanağı cam kısmı üzerine çözüm pipetle 80 ul.
- Inkübatör içine yerleştirin çanağı ve jel 37 polimerize izin ° C de 30 dakika boyunca. P35 cam alt çanak tipik kollajen jel Şekil 1A bakın.
- Her çanak büyüme ortamı dikkatli bir şekilde 2 ml ekleyin.
4. Time-lapse görüntü elde etme Prosedürü
- Mikroskop muhafaza sıcaklık kontrolü açın ve 37 ° C kapsamında odasında bir kararlı durum sıcaklık dengelenmesi Canlı hücre görüntüleme sistemi bir örneği için Bkz: Şekil 2.
- , Nötr bir pH'ı korumak için 25 mM HEPES ile desteklenmiş yeni medya medya değiştirin. IçinDIC görüntüleme, tabak cam üst bir üst değişimi. Parafilm ince bir şerit kullanarak, medya buharlaşmasını önlemek için çanağı yan kapağı.
- Immersiyon yağı hedefi için, objektif bir damla immersiyon sıvısının yerleştirin.
- Mikroskop sahnede çanak içeren kollajen jel yerleştirin ve çanak daldırma sıvı ile temas edinceye emin olun.
- Örnek ve resme ilgi hücreleri aramak için odaklanın. Sahne kayma en aza indirmek için, bulaşık, uzun bir yakalama başlamadan önce yaklaşık 45 dakika boyunca yerleşmek için izin verir.
- Görüntü elde parametrelerini belirtin. Modüle lazer gücü, maruz kalma süresi, sıklığı ve süresi yakalama zaman, hücrelere zarar verebilir lazer pozlama, en aza indirin. Gerçek parametreler mikroskop sistemi ve hücre tipine göre değişir.
- Time-lapse satın alma sırasında, bir inhibitörü eklenebilir. Inhibitörü Ayrıca deney için, parafilm çanak mühür yoktur.
- HazırlıkHEPES istenen bir çalışma konsantrasyonu ilaç ile medya eklenmiştir.
- Duraklatmak görüntü yakalama, medya, ilaç ve dikkatli bir şekilde, çanak bozmadan çanak üst kaldırmak için ne zaman hazır.
- Çanak medya aspire, ve çanak içine medya içeren ilaç pipetle. Sonra, çanak üst dikkatli bir şekilde değiştirin.
- Örnek olabilir ek olarak yeni medya nedeniyle out-of-focus, odak ayar yapın.
- Yakalama yeniden başlatın, sonra sonraki 30 dakika için yakalama izlemek ve gerektiğinde odak yeniden ayarlamalıdır. Ilaç Ayrıca deney bir örneği için Bkz: Şekil 4.
5. Sıkı bağlamak prosedürü ve analizi
- Sıkı bağlamak kurulum sistemleri arasında, üreticinin talimatları takip edin değişir.
- Canlı hücre görüntüleme için parametreleri ayarlayın.
- Photobleaching için parametreleri ayarlayın. Hücrenin zarar vermeden floresan sinyal photobleach için yeterli lazer gücünü kullanın. Test bu paruygulama hücreleri üzerinde koşulları uygun olarak belirlenmelidir.
- Görüntü yakalama başlatın ve ilgi bölge photobleaching önce en az 5 kare görüntü yakalama izin verir.
- Yakalama devam edin ve kurtarma zamanı tam floresan kurtarma yakalamak için yeterli olmalıdır. Sıkı bağlamak deney bir örnek için Şekil 5'e bakınız.
- Floresan kurtarma photobleached alanının ortalama floresan yoğunluğu (önce ve photobleaching sonra), zamanla ölçerek analiz edin. Istatistiksel analiz yazılımı (örneğin Excel) kullanarak, üstel denklem için kurtarma eğrisi uyum: I = f (1-e-kt), ben ben f son şiddeti, yoğunluğu, t zamanı ve τ ½ yarım nihai değere ulaşmak için yoğunluk için gereken zamanı: τ ½ = ln (2) / k Yarı zamanlı, protein hareketlilik oranının bir ölçüsüdür.
- Parametreleri, yarı zamanlı ve uygun üstel eğri nihai yoğunluğu elde edin. Inci hesaplayıne final ilk floresan yoğunlukları oranı alarak mobil kesir.
6. Temsilcisi Sonuçlar
Matriks içinde sağlıklı epitel hücreleri canlı hücre görüntüleme bir örnek Şekil 3'te gösterilmiştir. Sağlıklı hücreler, düzgün, sürekli bir membran ve farklı çekirdeği sağlıksız hücrelerin sık sık kesintiye membran ve aşırı sayıda vakuol iken sergilerler. 3 boyutlu bir matris, tek epitel hücreleri 1 göç ve birkaç gün boyunca, epitel hücreleri içinde matris 2 üç boyutlu, küresel, çok hücreli kistler oluşturur. Hücreler de son derece dinamik ve kist içinde göç (Şekil 3). Çevresindeki matriks (Şekil 4), gömülü tracer parçacıkların yer değiştirme yoluyla göç eden hücreler tarafından uygulanan çekiş güçlerinin bir sonucu olarak matris deformasyon analiz edilir. Tracer parçacık hareketleri, farklı bir maksimum projeksiyon görüntü olarak görüntülenir.ent zaman noktalarında, ve her seferinde noktası (Şekil 4B) göstermek için sözde renkli. Alternatif olarak, bireysel bir tracer parçacık görüntüleri (Şekil 4C) zamanla izleme parçacık hareketi göstermek için bir montaj olarak görüntülenir. ImageJ Tüm görüntü analizi kullanılarak yapıldı. Bu matris deformasyon nitel değerlendirmeler ve bu nedenle göç eden hücreler tarafından uygulanan kuvvetler, çekiş kuvveti dağılımı faydalı ilk yaklaşımdır. 3D göçmen hücreler tarafından uygulanan çekiş güçleri kantitatif tahmini Bu protokol kapsamı dışında ve başka bir yerde 3,4 açıklanmıştır.
Deney photobleaching sonra tipik bir floresan kurtarma Şekil 5'te gösterilmiştir. Ilgi bölgesi floresan yoğunluğu gözle görülür sağlıklı ve bozulmamış hücrelerin korurken arka plan düzeyleri (sinyal-gürültü oranı en üst düzeye çıkarmak için) göre azalmış, böylece optimize edilmiş lazer ayarları kullanarak photobleached olmalıdır. En iyi ayar b gerekirHer sıkı bağlamak kurulum farklı olarak e deneysel olarak belirlenir (örneğin, sıkı bağlamak kullanarak lazer tarama konfokal sistem).
Maruz kalma sonrası sıkı bağlamak görüntü elde etme ve zaman aralığı dikkatle arka plan photobleaching önlemek için kontrol edilmelidir. Daha düşük lazer gücü, kısa maruz kalma süresi, ve duyarlı kamera kullanımı ve yüksek verimli optik kullanımı, yüksek kaliteli sıkı bağlamak görüntüleme için çok önemlidir. Floresan görüntü alımı sırasında beyazlatma önemli ise, bu arka plan solmaya sayısal ve gözlenen floresans yoğunluğu kurtarma gelen normalize edilmelidir. 3D çevre doğası nedeniyle, floresan kurtarma z bileşeni önemli hale gelebilir. Bu nedenle, photobleached bölgenin öncesi ve sonrası 3D yığın görüntüleri alarak photobleached hacmi tanımlamak için önemlidir. Daha fazla analiz ve modelleme floresan kurtarma, başka bir yerde 5,6 tartışılmıştır.
Canlı hücre görüntüleme t eşsiz kombinasyonuechniques: GFP matris deformasyon ve inhibitörlerinin yanı sıra izlemek için sitoskeletal proteinler, kırmızı floresans tracer parçacıklar dinamikleri takip etmek, protein dinamiği, çekiş gücü ve moleküler yollar analizi için aynı anda kullanılabilir.
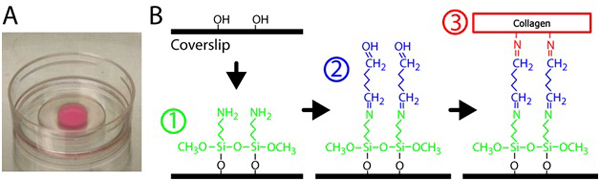
Şekil 1 kollajen jel hazırlanması. A) cam alt çanak Polimerize kollajen matriks. Pembe renkli jel gömülü floresan parçacıklar nedeniyle. B) Usulü cam yüzey kollajen jel çapraz bağ cam alt yemekleri tedavisinde. İlk olarak, cam alt çanak 3-Aminopropyltrimethoxysilane çözüm, cam kollajen matriks çapraz bağları glutaraldehid çözümü ile tedavi edilir.
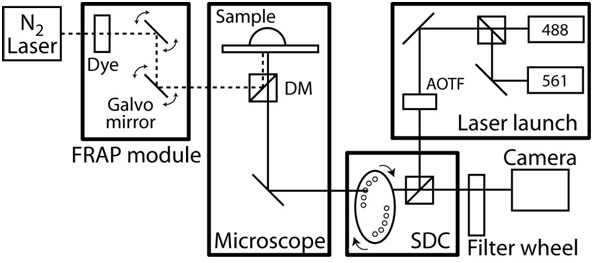
Şekil 2 sıkı bağlamak / konfokal mikroskop kurulum Şemalar. Konfokalmikroskop CoolSnap HQ II CCD kamera ile Zeiss AxioObserver dayalı ve tamamen Slidebook yazılımı (Akıllı Görüntüleme Yenilikler) tarafından otomatik. Konfokal birim özel tasarlanmış ve iki lazerler arasında geçiş milisaniye izin Yokogawa dönen disk ünitesi CSU10 Acousto Optik Ayarlanabilir Filtresi (AOTF) ile iki katı hal lazerleri (50 mW gücünde ve 40 mW ile 561 nm ile 488 nm) dayanmaktadır. Emisyon filtreleri (# 118.661 ve 118.085, Chroma Teknolojisi) 525 / 50 nm ve 620 / 60 nm ve dikroik ayna 488-568 BrightLine Çift bant (Semrock). Hedefleri NA 1.1 ve 0.62 mm çalışma mesafesi ile uzun bir çalışma mesafesi 40x C-Apochromat amacı, NA 1.4 ile 63x Plan-Apochromat amacı ve 0.19 mm çalışma mesafesi vardır. Mikroskobu, bir fiber optik dye lazer, bilgisayar kontrollü bir ışın konumu ve yoğunluğu ve kırınım sınırlı spot büyüklüğü pompalanır oluşan bir sıkı bağlamak photoablation sistemi içerir. Ayrıca, mikroskop ile donatılmıştır.her eksen üzerinde 0.1 mikron doğrusal kodlayıcılar içeren bir xy motorlu sahne. Time-lapse görüntüleme sırasında, çevre sıcaklığı, özel olarak tasarlanmış bir mikroskop odası ve bir geri bildirim sıcaklık kontrolü ile bir ısıtıcı tarafından yapılmaktadır. Herhangi bir gürültü ve titreşim izole etmek için, tüm mikroskop sistemi titreşimsiz bir masaya.
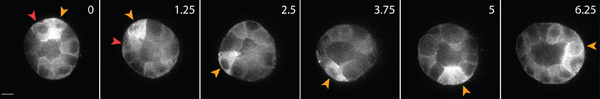
Şekil 3 GFP-aktin ifade epitel hücrelerinin hücre görüntüleme yaşayın. Bu hücreler kültür 3D kollajen matriks 4 gün sonra bir kist oluşmuş. Diğerleri (kırmızı ok ucu) içinde kist iç göç ederken bazı hücreler, kist (sarı ok ucu) yüzeyi boyunca hareket eder. Ölçek çubuğu 10 mm, saat zaman.
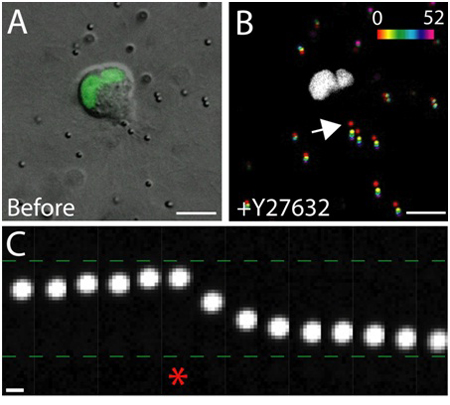
Şekil 4 çekiş kuvveti etkisi Rho-kinaz inhibisyonu. A) G ifade göç MDCK hücre DIC görüntüFP nükleer işaretleyici etiketli. Görüntü Rho-kinaz inhibitörü Y-27.632 tedavisi hemen önce çekildi. Ölçek çubuğu 10 mm. B) Parçacık deplasman Y-27.632 ek kaynaklanan. Parçacık konumları farklı zaman noktalarında (0 - 52 dakika) yoğunluğunu ölçeğine göre sözde renkli, daha sonra tek bir görüntü yansıtılıyor. Beyaz bölgeye göç eden hücreler, GFP pozitif çekirdeğini oluşturur. Ölçek çubuğu 10 mm. Saat dakika. C) hücre firar kenarında parçacık hareketi B (ok). Asterisk Y-27.632 ek önce çekilen son kare gösterir. Tracer parçacık sırasıyla, doğru ve önce uzağa göç hücre sondaki kenar ve Y-27.632 eklenmesinden sonra taşındı. Ölçek çubuğu 1 mikron.
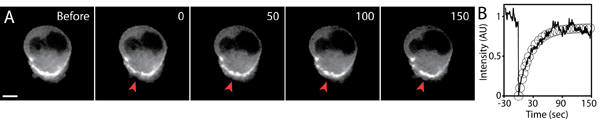
Şekil 5, üç-boyutlu bir matris hücre göç ifade GFP-aktin sıkı bağlamak analizi . A) Timelapse görüntüleri GFPaktin hücre photobleaching öncesi ve sonrası dile getirdi. GFP-aktin hücre arka tarafta biriken küçük bir bölge timepoint 0 (kırmızı ok ucu) photobleached. Saniye Saat, ölçek çubuğu 5 mikron. B) photobleached bölgesi (düz çizgi) ve floresan kurtarma (daireler) üstel uyum ortalama floresan yoğunluğu zamanla çizilir. Floresan yoğunluğu photobleaching önce başlangıç değeri normalize edildi.
Tartışmalar
Burada, üç boyutlu bir matris hücre göçü mekanizmaları çalışma canlı hücre görüntüleme kullanmak için bir yöntem açıklanmaktadır. Bu tekniğin başarı stably GFP-etiketli proteinlerin ifade "iyi" klonlar elde bağlıdır. GFP proteinlerin düşük seviyesi çok yüksek, GFP seviyesi hücrede istenmeyen yan etkileri var ise, hücre sağlığını tehlikeye atar aşırı uyarım pozlama gerektirir. Böylece, hücre içine genler transfect vektör seçim (örneğin, organizatörü, floresan e...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Biz yazının eleştirel okuma Dr. Grant Sumida teşekkür ederim. Bu çalışma, Beckman Genç Araştırmacı Ödülü (SY), Hellman Aile Yeni Fakülte Ödülü (SY), NIH EUREKA, University of California Kanser Araştırma Koordinasyon Komitesi tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifi Adı | Şirket | Katalog numarası | Yorumlar |
| Kollajen, sığır, Tip I | BD Biosciences | 354231 | Stok 3 mg / ml |
| 3-aminopropyltrimethoxysilane | Sigma Aldrich | 281778 | Suda sulandırınız |
| glutaraldehid | Sigma Aldrich | 340855 | PBS içinde seyreltin |
| 1M HEPES | Invitrogen | 15630-080 | |
| Fluospheres polistiren mikroküreler 1 mikron, kırmızı floresans (580/605) | Invitrogen | F13083 | |
| Geneticin (G418) | Invitrogen | 11811-031 | |
| Kültür medya bileşenleri: | |||
| DMEM | Invitrogen | 31600-034 | |
| Fetal sığır serumu | Atlanta Biyolojik | S115500 | |
| Penisilin / Streptomisin | Invitrogen | 15140-122 | |
| Kanamisin | Invitrogen | 15160-054 | |
Referanslar
- Shih, W., Yamada, S., Myosin, . A dependent retrograde flow drives 3D cell migration. Biophys. J. 98 (8), L29-L31 (2010).
- O'Brien, L. E., Yu, W., Tang, K., Jou, T. S., Zegers, M. M., Mostov, K. E. Morphological and biochemical analysis of Rac1 in three-dimensional epithelial cell cultures. Methods Enzymol. 406, 676-691 (2006).
- Legant, W. R., Miller, J. S., Blakely, B. L., Cohen, D. M., Genin, G. M., Chen, C. S. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat. Methods. 7 (12), 969-971 (2010).
- Del Alamo, J. C., Meili, R., Alonso-Latorre, B., Rodriguez-Rodriguez, J., Aliseda, A., Firtel, R. A., Lasheras, J. C. Spatio-temporal analysis of eurkaryotic cell motility by improved force cytometry. Proc. Natl. Acad. Sci. U.S.A. 104 (33), 13343-13348 (2007).
- Lippincott-Schwartz, J., Snapp, E., Kenworthy, A. Studying protein dynamics in living cells. Nat. Rev. Mol. Cell Biol. 2 (6), 444-456 (2001).
- Phair, R. D., Misteli, T. Kinetic modeling approaches to in vivo imaging. Nat. Rev. Mol. Cell Biol. 2 (12), 898-907 (2001).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. Fluorescent toolbox for assessing protein location and function. Science. 312 (5771), 217-224 (2006).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır