JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
3 차원 매트릭스에서 찬란 태그가 추가된 단백질을 표현 마이 그 레이션 전지의 라이브 세포 이미징
요약
이러한 세포 마이 그 레이션으로 세포 프로세스 전통적으로 2 차원, 딱딱한 플라스틱 표면에 연구하고 있습니다. 이 보고서는 직접 단백질 지방화를 시각화하고보다 생리학 관련, 3 차원 매트릭스에서 마이 그 레이션 세포의 단백질 역학을 분석하는 기술을 설명합니다.
초록
전통적으로, 세포 마이 그 레이션은 2 차원, 딱딱한 플라스틱 표면에서 연구되었습니다. 그러나, 상처 치료, 조직 재생 및 암 전이 중요한 생물 학적 과정 동안 세포는 복잡한, 3 차원 세포 조직을 통해 이동해야합니다. 더 나은 이러한 생물 학적 과정의 배후 메커니즘을 이해하기 위해서는 세포 마이 그 레이션을 운전을 담당하는 단백질의 역할을 검토하는 것이 중요합니다. 여기, 우리는 상피 세포 라인을 (MDCK)를 사용하여 셀 마이 그 레이션의 메커니즘을 연구하기위한 프로토콜을 개요 및 모델 시스템으로 3 차원, 섬유, 자기 polymerizing 매트릭스. 이 광학 명확 세포외 매트릭스는 라이브 세포 이미징 연구에 쉽게 의무가 있으며, 더 좋은 방법은 생리, 부드러운 조직 환경을 모방한 것이었 지요. 이 보고서는 직접 단백질 현지화 및 역학을 시각에 대한 기술, 그리고 주변의 세 차원 매트릭스의 변형을 보여줍니다.
시험세포 공정 중에 단백질 현지화 및 역학 ination 단백질의 기능에 중요한 통찰력을 제공합니다. 유전자 인코딩 형광 태그는 단백질 현지화 및 역학을 관찰에 대해 고유한 방법을 제공합니다. 이 기법을 사용하여 우리가 키 subcellular 축적을 분석할 수, 강제로 생성 매트릭스를 통해 세포 기동으로 실시간으로 cytoskeletal 구성 요소를. 또한, 서로 다른 파장 여러 형광 태그를 사용하여, 우리는 따라서 우리는 서로 다른 단백질이 비슷하거나 분기하는 역할을 가지고 있는지, 예를 들어, 테스트 수 있도록, 동시에 여러 단백질의 지방화를 검사할 수 있습니다. 또한, 찬란 태그 단백질의 역학은 (FRAP) 분석을 Photobleaching 후 형광 복구를 사용하여 계량하실 수 있습니다. 이 측정 assays는 단백질 이동성과 방법을 안정적으로 단백질을 구속은 cytoskeletal 네트워크에 있습니다.
단백질 기능 억제제의 치료와 함께 라이브 세포 이미징을 결합함으로써,우리는 단백질과 마이 그 레이션 세포의 형태의 배포판에 실시간으로 변경 확인할 수 있습니다. 또한, 우리는 셀 마이 그 레이션하는 동안 행렬 변형을 시각화하기 위해 매트릭스 내에 포함된 형광 추적 입자의 사용과 라이브 세포 이미징을 결합하여. 따라서, 우리는 마이 그 레이션 세포는 강제로 생성 단백질을 배포하는 방법 시각화 수 있으며, 어디 견인 세력은 주변 매트릭스 끼쳤다 있습니다. 이러한 기술을 통해, 우리는 세포 이주의 메커니즘에 특정 단백질과 공헌의 역할에 가치있는 통찰력을 얻을 수 있습니다.
프로토콜
1. 안정적인 세포주의 생성 (예 : MDCK 세포)
- p35 접시에 confluency 80~90%에서 플레이트 세포. 세포 transfection 효율을 줄일 수 백퍼센트 합류 monolayer를 형성하게하지 마십시오.
- Lipofectamine 2000을 사용하는 관심의 플라스미드와 세포 Transfect. 제조 업체의 프로토콜을 사용하여 transfection 조건을 최적화합니다.
- 다음날,이 통로 p150 배양 접시에 세포. 큰 접시는 안정적인 식민지 사이에 충분한 간격을 허용하는 것이 좋습니다.
- 다음날, 미디어를 변경하고 각각의 접시 500 μg / G418의 ML을 추가합니다. G418의 농도는 각각의 세포 라인에 최적화된해야합니다.
- 약 2 주 동안 매일 미디어를 변경합니다. 이주 후, G418 방지 식민지가 형성되기 시작하고, 육안으로 볼 수 있습니다.
- 거꾸로 형광 현미경을 사용하여 GFP 긍정적인 식민지를 확인합니다. sharpie 펜을 사용하여 접시에 이러한 식민지를 표시합니다.
- s의electively, 조직 문화 판에서 식민지 trypsinize 미디어를 대기음, 그리고 PBS 또는 트립신 솔루션으로 두 번 세포를 씻으십시오. 두 번째 세척에서 모든 솔루션을 기음하지 않습니다. 건조로부터 세포를 방지하기 위해 접시의 바닥에 액체의 얇은 레이어를 둡니다.
- 각 표시 식민지 경우 : 식민지의 가장자리 주위에 최대한 닦아 소독 면봉을 사용합니다. 이것은 세포 식민지를 포함한 서부 유럽 표준시 지역 섬을 생성합니다. 식민지에 트립신의 피펫 10 μl. 모든 식민지에 대한 반복하고 건조하지 않도록 신속하게 진행합니다. 경험이 풍부한 연구자는 대개 p150 플레이트 회 ~ 12 식민지를 선택할 수 있습니다.
- 37 판을 품어 ° C 50~10분에 대한 세포 접시에서 분리하고 둥근 나타날 때까지.
- 각 식민지의 경우 : 피펫 10 식민지에 트립신의 μl, 그리고 접시에서 세포를 분리하기 위해 몇 시간을 위아래로 피펫. 다음 24 잘 접시에 하나의 잘으로 식민지의 모든 세포를 피펫. <리> 안정적인 식민지가 성장 후, 각 식민지의 단백질 표현이 표준 서양 얼룩과 immunofluorescence를 사용하여 분석합니다. 자세한 분석을 위해 이들 세포 라인을 확장합니다.
2. 최적의 콜라겐 바인딩 (선택 사항) 유리 바닥 접시의 표면 수정
- 10mm 오프닝 각 p35 요리의 유리 부분에 유리를 silanize하기 위해, 2 %의 피펫 300 μl 3 - Aminopropyltrimethoxysilane 솔루션입니다. silanization 및 상호 연결 배선도 그림 1을 참조하십시오. 3 Aminopropyltrimethoxysilane이 필터링 물에 희석합니다.
- 상온에서 1 시간 품어.
- 3 Aminopropyltrimethoxysilane 솔루션을 기음 10 분 각각에 대한 필터링 물로 세 번 씻는다.
- ° C 1 시간 50로 설정 뜨거운 접시에 물과 장소 요리를 기음. 약간 접시에서 요리 장소 정상 접시에 습기가 탈출 수 있습니다.
- 더위에서 요리를 제거하고 쿠 수나
- 각 요리의 유리 부분에 2 % 글루 타 알데히드 솔루션의 피펫 300 μl. 글루 타 알데히드는 PBS에 희석됩니다.
- 1 시간 품어.
- 글루 타 알데히드 솔루션을 기음 10 분 각각 PBS로 세 번 설거지.
- 1 시간 동안 자외선에 노출하여 요리를 소독. silanized 요리는 상온에서 저장할 수 있습니다.
3. 추적 입자로 3D 콜라겐 젤의 준비
- 5 분 15,000 rpm으로 원심 분리기의 주식 추적 입자 (10 10 입자 / ML) 100 μl를 회전하여 형광 추적 입자를 워시, 액체를 대기음, 미디어 500 μl를 추가합니다. 5 번 반복합니다. 마지막으로 세척 후, 미디어 30 μl에 resuspend 입자.
- 평소처럼 표현 GFP 세포를 Trypsinize.
- 약 2 × 10 6 세포 / ML로 Resuspend 세포 펠릿.
- eppendorf 튜브로 성장 미디어 피펫 240 μl.
- 1M Hepes의 12.6 μl, 여과 물 20 μl, 세포 용액 50 μl 후, 형광 입자의 10 μl를 추가합니다.
- 마지막으로, 소 진피의 콜라겐 전 용액 (1 MG / ML의 작업 농도를 얻기 위해)의 167 μl를 추가합니다.
- 철저 솔루션을 섞어 다음 silanized 유리 바닥 접시의 유리 부분에 솔루션의 80 μl를 피펫.
- 장소 인큐베이터에 요리와 젤, 37에서 중합 수 있도록 ° C 30 분. p35 유리 바닥 접시에있는 전형적인 콜라겐 젤에 대한 그림 1A를 참조하십시오.
- 각각의 접시에 신중하게 성장 미디어 2 ML을 추가합니다.
4. 시간 저속 이미지 수집을위한 절차
- 현미경 인클로저의 온도 제어의 전원을 켜고 37 ° C.에 범위 챔버가 안정 상태의 온도로 평형하자 라이브 세포 이미징 시스템의 예를 들어 그림 2를 참조하십시오.
- 중성 산도를 유지하는 25 밀리미터 Hepes와 보충의 새로운 미디어로 미디어를 변경합니다. 에DIC 이미지, 유리 톱을 가지고 하나와 접시의 교환 상단. parafilm의 얇은 스트립을 사용하여 미디어 증발을 방지하기 위해 접시의 측면을 다룹니다.
- 기름 침지 목적은 목적에 침지 액 한방울을 넣으십시오.
- 현미경 스테이지에 접시를 포함하고있는 콜라겐 젤 장소, 요리 침지 액체와 접촉하게 있는지 확인하십시오.
- 샘플 및 이미지에 관심이 세포에 대한 검색 중점을두고 있습니다. 무대 드리프트를 최소화하기 위해 요리 긴 캡처를 시작하기 전에 약 45 분 동안 정착하실 수 있습니다.
- 이미지 수집의 매개 변수를 지정합니다. modulating 레이저 파워, 노출 시간, 주파수 및 캡처 시간의 기간에 의해 세포가 손상될 수 레이저 노출을 최소화합니다. 실제 매개 변수는 현미경 시스템과 세포 유형과 다릅니다.
- 시간 경과 수집하는 동안 억제제는 추가할 수 있습니다. 억제제 추가 실험, parafilm으로 접시를 봉인하지 않습니다.
- 준비하다Hepes는 원하는 작업 농도의 약물과 미디어를 보충하고 있습니다.
- 미디어, 일시 정지 이미지 캡처에 약물을 추가하고 조심스럽게 접시를 방해하지 않고 접시 상단을 제거하면 준비 완료.
- 접시에있는 미디어를 대기음, 그리고 그릇에 미디어를 포함하는 마약을 피펫. 그런 다음, 접시 위로 조심스럽게를 교체하십시오.
- 샘플 수 뉴 미디어의 추가로 인해 밖에서 초점, 초점을 다시 조정.
- 캡처를 다시 시작한 후, 다음 30 분 동안 캡처를 모니터링하고, 필요에 따라 초점을 다시 조정. 약물 또한 실험의 예를 들어 그림 4를 참조하십시오.
5. FRAP 절차 및 분석
- FRAP 설치 프로그램은 시스템 사이에 제조 업체의 지침을 따라 다릅니다.
- 라이브 세포 이미징을위한 매개 변수를 설정합니다.
- photobleaching에 대한 매개 변수를 설정합니다. 세포를 손상하지 않고 형광 신호를 photobleach 충분한 레이저 파워를 사용합니다. 이 액면을 테스트연습 세포에 ameters.
- 이미지 캡처를 시작하고 관심 영역을 photobleaching하기 전에 이미지 캡처의 적어도 5 프레임을 수 있습니다.
- 캡처 계속 및 복구 시간은 전체 형광 복구를 캡처하기에 충분해야합니다. FRAP 실험의 예를 들어 그림 5를 참조하십시오.
- photobleached 지역의 평균 형광 강도 (이전과 photobleaching 후) 시간이 지남에 따라 측정하여 형광 복구를 분석합니다. 통계 분석 소프트웨어 (예 : 엑셀)를 사용하여 지수 방정식에 복구 곡선에 맞게 : I = I F (1 - E - 캐럿), 내가 F의 최종 강도이며, 강도이고, t는 시간이며, τ ½이 절반 최종 값에 도달하는 농도에 대한 걸리는 시간입니다 τ ½ = 에선 (2) / K. 하프 타임은 단백질의 이동성의 속도를 측정하기위한 한 방법입니다.
- 매개 변수, 하프 타임 및 지수 - 맞게 곡선의 최종 강도를 얻을 수 있습니다. 일을 계산초기 형광 농도에 최종의 비율을 복용하여 전자 모바일 분수.
6. 대표 결과
매트릭스 내에서 건강한 상피 세포의 살아있는 세포 이미징의 예제는 그림 3에 표시됩니다. 건강하지 못한 세포가 종종 중단 막, 그리고 vacuoles의 과도한 번호 반면 건강한 세포는 부드럽고, 지속적인 멤브레인, 그리고 독특한 핵을 나타냅니다. 3D 매트릭스에서 하나의 상피 세포는 1 마이 그 레이션하고, 며칠에 걸쳐, 상피 세포의 매트릭스 2 시간 입체, 구형, 다중 세포 cysts를 형성하고 있습니다. 세포는 매우 동적이며, 낭종 (그림 3) 이내에 마이 그 레이션. 마이 그 레이션 세포 끼쳤다 견인 세력의 결과로 매트릭스 변형은 주변 행렬 (그림 4)에 포함된 추적 입자의 변위를 분석합니다. 추적 입자의 움직임은 다릅니다 최대 투사 이미지로 표시됩니다엔트 시간 점, 각 시점의 시간 (그림 4B)을 표시하는 의사 색입니다. 또는 개별 추적 입자의 이미지는 시간이 지남에 따라 추적 입자 (그림 4C)의 움직임을 보여주는 몽타주로 표시됩니다. 모든 이미지 분석 ImageJ를 사용하여 이루어졌다. 매트릭스 변형 이러한 질적 평가는, 따라서 마이 그 레이션 세포 끼쳤다 세력은 트랙션 힘의 분포의 유용 첫번째 근사치입니다. 3D로 마이 그 레이션 세포 끼쳤다 견인 세력의 양적 평가는이 프로토콜의 범위를 벗어납니다 등에서 3,4 설명되어 있습니다.
실험을 photobleaching 후 전형적인 형광 복구는 그림 5에 표시됩니다. 관심 지역은 건강하고 손상되지 않은 세포를 유지하면서 형광 강도가 가시, 배경 수준 (신호 대 잡음 비율을 극대화하기)에 비해 감소되도록 최적의 레이저 설정을 사용 photobleached해야합니다. 최적의 설정은 B한다각 FRAP 설정이 다른이므로 E는 경험적으로 결정 (예, FRAP를 사용하여 레이저를 스캐닝 공촛점 시스템).
포스트 FRAP 이미지 수집의 노출 시간 간격은 신중하게 배경 photobleaching을 피하기 위해 제어해야합니다. 낮은 레이저 파워, 짧은 노출 시간 및 민감한 카메라의 사용과 높은 효율적인 광학의 사용은 높은 품질의 FRAP 이미징을 위해 필수적입니다. 이미지 수집 중 표백 형광이 중요한 경우이 배경 페이딩은 계량 및 관찰 형광 강도 복구에서 정상화해야합니다. 환경의 3D 특성으로 인해, 형광 강도 복구의 Z - 구성 요소가 상당한 될 수 있습니다. 따라서, photobleached 지역의 전후 3D - 스택 이미지를 복용하여 photobleached 볼륨을 정의하는 것이 중요합니다. 또한 분석 및 형광 회복의 모델링은 다른 5,6 설명되어 있습니다.
라이브 세포 이미징 t의 독특한 조합echniques : GFP 매트릭스 변형 및 억제제의 추가를 모니터 cytoskeletal 단백질, 빨간색 형광 추적 입자의 역학에 따라이 단백질 역학, 견인 강제 및 분자 경로의 분석을 위해 동시에 사용할 수 있습니다.
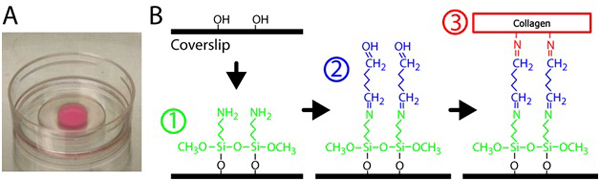
그림 1. 콜라겐 젤의 작성. 유리 바닥 접시에) Polymerized의 콜라겐 매트릭스. 젤의 핑크 색상이 포함된 형광 입자에 의한 것입니다. B) 절차 유리 표면에 콜라겐 젤 crosslink하는 유리 바닥 요리를 취급합니다. 첫째, 유리 바닥 요리는 3 Aminopropyltrimethoxysilane 솔루션, 유리 콜라겐 매트릭스를 crosslinks 후 글루 타 알데히드 솔루션으로 처리됩니다.
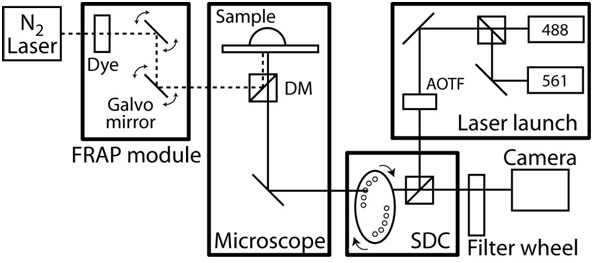
그림 2. FRAP / 공촛점 현미경 설정의 설계도. 공촛점현미경은 CoolSnap HQ II CCD 카메라와 자이스 혈구 AxioObserver에 따라 완전히 Slidebook 소프트웨어 (지능형 이미징 혁신)에 의해 자동으로 진행됩니다. 공촛점 단위 맞춤 설계되었습니다 두 레이저 사이를 전환할 밀리초를 허용하도록 Yokogawa 회전 디스크 장치 CSU10 및 음향 광학 조정할 수있는 필터 (AOTF) 두 고체 레이저 (50 MW 40 MW와 561 nm의와 488 nm의)에 따라. 방출 필터 (# 118661과 # 118085, 채도 기술) 50분의 525 NM 및 60분의 620 NM하고 이색성 거울 488-568 BrightLine 듀얼 밴드 (Semrock)입니다. 목표는 NA 1.1 및 0.62 mm의 작동 거리와 긴 작동 거리 40x C - 고차 색지움 목표 및 NA 1.4와 63x 계획 - 고차 색지움 목표 및 0.19 mm의 작동 거리입니다. 현미경은 광학 섬유 염료 레이저, 컴퓨터 제어 빔 위치와 강도, 그리고 회절 제한된 장소의 크기를 펌핑 구성되어 FRAP의 photoablation 시스템을 포함하고 있습니다. 또한 현미경을 갖추고있다각 축에 0.1 미크론 선형 인코더를 포함 XY 전동 무대. 시간 경과 이미징 동안 환경 온도 맞춤 설계된 현미경 챔버 및 피드백 온도 제어 히터에 의해 유지됩니다. 모든 소음 및 진동을 분리하려면 전체 현미경 시스템은 진동이없는 테이블에 있습니다.
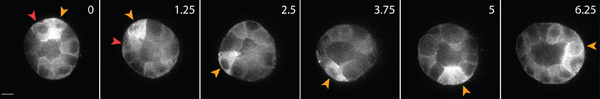
그림 3. GFP - 굴지 표현 상피 세포의 세포 이미징을 살고 있습니다. 이러한 세포는 3D 콜라겐 매트릭스에 문화 4 일 후에 낭종을 형성. 다른 낭종의 내부 (빨간색 화살촉) 내에서 마이 그 레이션하는 동안 일부 세포가 낭종 (노란색 화살촉)의 표면을 따라 이동합니다. 스케일 바 10 μm의, 시간 시간.
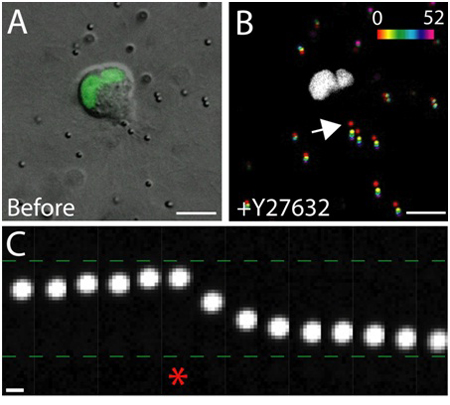
그림 4. 트랙션위원회에서 Rho - 키나제의 효과가 억제. G을 표현하는 마이 그 레이션 MDCK 세포) DIC 이미지FP는 핵 마커 태그. 이미지는 Rho - 키나제 억제제 Y - 27632의 치료 직전 찍은 거예요. 스케일 바 10 μm의. B) 입자 변위는 Y - 27632의 추가로 인한. 다양한 시간 포인트 (0-52 분)에있는 입자의 위치는 강도 규모에 따라 의사 색의했고 다음 하나의 이미지에 투영. 흰색 영역은 마이 그 레이션 세포에있는 GFP 긍정적인 핵이다. 스케일 바 10 μm의. 분 시간. 세포의 후행 가장자리 C) 입자 운동 (B의 화살표 참조). 별표 Y - 27632 또한 이전에 캡처된 마지막 프레임을 나타냅니다. 추적 입자는 각각 방향과 거리에서 마이 그 레이션하기 전에 세포의 후행 가장자리와 Y - 27632의 추가 이후에 옮겼습니다. 스케일 바 1 μm의.
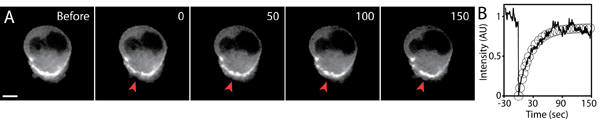
그림 5. 3 차원 매트릭스의 세포 마이 그 레이션을 표현 GFP - 굴지의 FRAP 분석. 의) Timelapse 이미지 GFP -굴지의 photobleaching 전후의 세포를 표현. 휴대폰 뒤쪽에 축적된 GFP - 굴지의 작은 지역은 timepoint 0 (빨간색 화살촉) photobleached되었습니다. 시간 (초), 스케일 바 5 μm의. B) photobleached 지역 (실선)과 형광 복구 (원)의 기하 급수적인 적합의 평균 형광 강도는 시간이 지남에 꾸몄다. 형광 강도는 photobleaching 전에 초기 값을 정상화되었습니다.
토론
여기서 우리는 3 차원 매트릭스의 세포 이주의 메커니즘을 연구 라이브 세포 이미징을 사용하는 방법을 설명합니다. 이 기술의 성공은 안정적으로 GFP - 태그 단백질을 표현하는 "좋은"클론을 얻는 방법에 따라 달라집니다. GFP 단백질의 낮은 수준이 너무 높은 GFP 레벨 셀에 바람직하지 않은 부작용이되지만, 세포의 건강을 위태롭게 할 여분의 자극에 노출이 필요합니다. 따라서 세포에 유전...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
우리는 원고의 중요한 읽기위한 박사님 스미다 감사합니다. 이 작품은 베크 만 젊은 탐정 수상 (SY), 헬맨 가족 새로운 교수진 수상 (SY), NIH 유레카, 캘리포니아 암 연구 조정위원회의 대학에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| 콜라겐은 소, 전을 입력합니다 | BD Biosciences | 354,231 | 주식 3 MG / ML에 관한 |
| 3 aminopropyltrimethoxysilane | 시그마 알드리치 | 281,778 | 물에 희석 |
| 글루 타 알데히드 | 시그마 알드리치 | 340,855 | PBS에 희석 |
| 1M Hepes | Invitrogen | 15630-080 | |
| Fluospheres의 폴리스티렌 microspheres 1 μm의 빨강, 형광 (605분의 580) | Invitrogen | F13083 | |
| Geneticin (G418) | Invitrogen | 11811-031 | |
| 문화 미디어 구성 요소 : | |||
| DMEM | Invitrogen | 31600-034 | |
| 태아 소 혈청 | 애틀랜타 체액 | S115500 | |
| 페니실린 / 스트렙토 마이신 | Invitrogen | 15140-122 | |
| Kanamycin | Invitrogen | 15160-054 | |
참고문헌
- Shih, W., Yamada, S., Myosin, . A dependent retrograde flow drives 3D cell migration. Biophys. J. 98 (8), L29-L31 (2010).
- O'Brien, L. E., Yu, W., Tang, K., Jou, T. S., Zegers, M. M., Mostov, K. E. Morphological and biochemical analysis of Rac1 in three-dimensional epithelial cell cultures. Methods Enzymol. 406, 676-691 (2006).
- Legant, W. R., Miller, J. S., Blakely, B. L., Cohen, D. M., Genin, G. M., Chen, C. S. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat. Methods. 7 (12), 969-971 (2010).
- Del Alamo, J. C., Meili, R., Alonso-Latorre, B., Rodriguez-Rodriguez, J., Aliseda, A., Firtel, R. A., Lasheras, J. C. Spatio-temporal analysis of eurkaryotic cell motility by improved force cytometry. Proc. Natl. Acad. Sci. U.S.A. 104 (33), 13343-13348 (2007).
- Lippincott-Schwartz, J., Snapp, E., Kenworthy, A. Studying protein dynamics in living cells. Nat. Rev. Mol. Cell Biol. 2 (6), 444-456 (2001).
- Phair, R. D., Misteli, T. Kinetic modeling approaches to in vivo imaging. Nat. Rev. Mol. Cell Biol. 2 (12), 898-907 (2001).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. Fluorescent toolbox for assessing protein location and function. Science. 312 (5771), 217-224 (2006).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유