A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Live-תא הדמיה של תאים מעבר הבעת חלבונים fluorescently-מתויג מטריקס תלת מימדי
In This Article
Summary
תהליכים תאיים כגון נדידת תאים מסורתי נחקרו על דו מימדי, משטחי פלסטיק נוקשה. דו"ח זה מתאר טכניקה ישירות חזותי לוקליזציה חלבון וניתוח הדינמיקה חלבון בתאי נודדות בתוך מטריצה יותר רלוונטי מבחינה פיזיולוגית תלת מימדי,.
Abstract
באופן מסורתי, נדידת תאים נחקרה על דו מימדי, משטחי פלסטיק נוקשה. עם זאת, במהלך תהליכים ביולוגיים חשובים כגון ריפוי פצעים, התחדשות רקמות, גרורות סרטן, התאים חייבים לנווט רקמות מורכבות תלת ממדי, תאית. כדי להבין טוב יותר את המנגנונים מאחורי אלה תהליכים ביולוגיים, חשוב לבחון את תפקידם של החלבונים האחראיים על נהיגה נדידת תאים. כאן, אנו מתאר פרוטוקול ללמוד את המכניזם של נדידת תאים באמצעות שורת תאים אפיתל (MDCK), וכן תלת ממדי, סיבי, עצמית polymerizing מטריקס כמערכת מודל. זה תאי מטריקס ברור אופטית ניתנת בקלות לחיות תאים לימודי הדמיה טוב יותר מחקה את הסביבה הפיזיולוגית, רקמות רכות. דו"ח זה מדגים טכניקה ישירות חזותי לוקליזציה חלבון דינמיקה, ו דפורמציה של מטריקס תלת ממדי שמסביב.
בחינהביעור לוקליזציה של חלבונים ודינמיקה במהלך תהליכים תאיים מספק תובנה מפתח לתוך פונקציות חלבון. תגי פלורסנט מקודדים גנטית לספק שיטה ייחודית התבוננות לוקליזציה חלבון ודינמיקה. באמצעות טכניקה זו, אנו יכולים לנתח את הצטברות subcellular של מפתח, כוח להפקת רכיבים cytoskeletal בזמן אמת כמו תמרונים התא באמצעות המטריצה. בנוסף, באמצעות תגי פלורסנט עם מספר אורכי גל שונים, אנו יכולים לבחון את לוקליזציה של חלבונים רבים בו זמנית, ובכך מאפשר לנו לבחון, למשל, אם חלבונים שונים יש תפקידים דומים או מסתעף. יתר על כן, הדינמיקה של החלבונים המתויגים fluorescently ניתן לכמת באמצעות שחזור פלורסנט לאחר photobleaching (FRAP) ניתוח. זה מבחני המדידה ניידות חלבון ואיך קשור ביציבות החלבונים הם לרשת cytoskeletal.
על ידי שילוב של תאים חיים הדמיה בטיפול של מעכבי תפקוד החלבון,אנו יכולים לבחון בזמן אמת את השינויים בהתפלגות של חלבונים מורפולוגיה של תאים נודדים. יתר על כן, אנו משלבים גם לחיות תאים הדמיה עם שימוש של חלקיקים נותב פלורסנט מוטבע בתוך המטריצה כדי להמחיש את העיוות מטריקס במהלך נדידת תאים. לפיכך, אנו יכולים לדמיין כיצד תא נודדות מפיצה כוח להפקת חלבונים, שבו כוחות המתיחה הם הפעילו את המטריצה שמסביב. באמצעות טכניקות אלה, אנו יכולים לקבל תובנה חשובה התפקידים של חלבונים ספציפיים תרומתם המנגנונים של נדידת תאים.
Protocol
1. הדור של שורת תאים יציבה (תאים MDCK למשל)
- פלייט תאים ב 80-90% confluency בצלחת P35. אל תתנו תאים טופס monolayer ומחוברות 100%, אשר תפחית את יעילות transfection.
- Transfect תאים עם פלסמיד עניין באמצעות Lipofectamine 2000. מטב התנאים transfection באמצעות פרוטוקול של היצרן.
- למחרת, קטע את התאים לשתי p150 בצלחות פטרי. המנה גדולה מומלץ לאפשר מרווח מספיק בין המושבות יציב.
- למחרת, לשנות את התקשורת להוסיף 500 מיקרוגרם / מ"ל של G418 על כל מנה. ריכוז G418 צריך להיות מותאם שורות תאים בודדים.
- שינוי בתקשורת בכל יום אחר למשך כ 2 שבועות. לאחר 2 שבועות, G418 עמידים מושבות צריך להתחיל הטופס יהיו גלויים בעין בלתי מזוינת.
- באמצעות מיקרוסקופ פלואורסצנטי הפוך, לזהות מושבות GFP חיובית. מארק אלה מושבות בצלחת באמצעות עט לנוכל.
- כדי selectively trypsinize המושבות מהצלחת בתרבית רקמה, לשאוב את התקשורת, לשטוף את התאים פעמיים עם PBS או פתרון טריפסין. ביום לשטוף את השני, שלא ישאפו את כל הפתרון. השאירו שכבה דקה של נוזל בתחתית הצלחת כדי למנוע מתאי הייבוש.
- עבור כל המושבה המסומנים: השימוש מטלית כותנה מעוקרים כדי לנגב קרוב ככל האפשר מסביב לקצה של המושבה. פעולה זו תיצור אי של אזור רטוב שמכיל את המושבה התא. פיפטה 10 μl של טריפסין על המושבה. חזור על הפעולה עבור כל המושבה, ולהמשיך במהירות כדי למנוע התייבשות. חוקר מנוסה יכול בדרך כלל לבחור ~ 12 מושבות בכל צלחת p150.
- דגירה צלחת ב 37 מעלות צלזיוס למשך 5-10 דקות עד תאים להתנתק הצלחת להופיע בסיבוב.
- עבור כל המושבה: פיפטה 10 μl של טריפסין על המושבה, פיפטה למעלה ולמטה כמה פעמים לנתק את התאים מן הצלחת. ואז פיפטה כל התאים מן המושבה אל תוך הבאר אחד בצלחת 24 באר.
- לאחר מושבות יציב גדלו, ביטוי החלבון של המושבה כל מנותח באמצעות כתם המערבי immunofluorescence סטנדרטיים. הרחבת שורות תאים אלה לניתוח נוסף.
2. שינוי פני השטח של צלחת תחתית זכוכית מחייב קולגן אופטימלי (אופציונאלי)
- כדי silanize הזכוכית, פיפטה 300 μl של 2% -3 Aminopropyltrimethoxysilane פתרון על חלק הזכוכית של כל מנה P35 עם פתח 10 מ"מ. ראה איור 1 עבור silanization ו cross-linking סכמטית. 3-Aminopropyltrimethoxysilane הוא מדולל במים מסוננים.
- דגירה במשך שעה 1 בטמפרטורת החדר.
- לשאוב את הפתרון 3-Aminopropyltrimethoxysilane ולשטוף עם מים מסוננים שלוש פעמים במשך 10 דקות כל אחד.
- לשאוב את המים ומניחים על צלחת צלחות חם להגדיר עד 50 מעלות צלזיוס במשך 1.5 שעות. צמרות המקום של מנות מעט את המנה כל כך לחות בצלחת יכול לברוח.
- הסר מנות מהאש לאפשר והומהיב
- פיפטה 300 μl של פתרון glutaraldehyde 2% על חלק הזכוכית של כל מנה. Glutaraldehyde הוא מדולל PBS.
- דגירה במשך שעה 1.
- לשאוב את הפתרון glutaraldehyde ו לשטוף כלים עם PBS שלוש פעמים במשך 10 דקות כל אחד.
- לעקר מנות על ידי חשיפה לאור UV במשך שעה 1. המנות silanized ניתן לאחסן בטמפרטורת החדר.
3. הכנת ג'ל קולגן 3D עם חלקיקים נותב
- לשטוף חלקיקים נותב ניאון על ידי ספינינג למטה 100 μl של חלקיקים מניות נותב (10 10 חלקיקים / ml) בצנטריפוגה בסל"ד 15,000 במשך 5 דקות, לשאוב את הנוזל, ולהוסיף 500 μl של התקשורת. חזור 5 פעמים. לאחר לשטוף האחרון, חלקיקים resuspend ב μl 30 של המדיה.
- Trypsinize תאים GFP להביע כרגיל.
- Resuspend תא גלולה כ 2 x 10 6 תאים / מ"ל.
- פיפטה 240 μl של התקשורת צמיחה לתוך צינור Eppendorf.
- הוסף μl של 12.6 Hepes 1M, 20 μl של מים מסוננים, 50 μl של פתרון התא, ולאחר מכן 10 μl של חלקיקים ניאון.
- לבסוף, להוסיף 167 μl של קולגן בדרמיס שור אני הפתרון (כדי לקבל ריכוז העבודה של 1 מ"ג / מ"ל).
- מערבבים פתרון יסודי, אז פיפטה 80 μl של הפתרון על חלק הזכוכית של צלחת זכוכית silanized התחתונה.
- מניחים צלחת לתוך החממה ולאפשר ג'ל כדי לפלמר על 37 מעלות צלזיוס במשך 30 דקות. ראה איור 1A עבור ג'ל קולגן טיפוסי מנה P35 תחתית זכוכית.
- הוסף 2 מ"ל של התקשורת צמיחה היטב כל מנה.
4. נוהל רכישת זמן לשגות תמונה
- הפעל בקרת הטמפרטורה של המתחם מיקרוסקופ ולתת קאמרית היקף לאזן את הטמפרטורה למצב יציב על 37 ° C. ראה איור 2 למשל מערכת לחיות תאים הדמיה.
- שינוי המדיה המדיה החדשה בתוספת 25 Hepes mM לשמור על pH נייטרלי. עבורDIC הדמיה, להחליף את החלק העליון של צלחת עם אחד שיש לו בראש זכוכית. באמצעות רצועה דקה של parafilm, מכסים את הצד של המנה כדי למנוע אידוי התקשורת.
- עבור המטרה טבילה שמן, המקום טיפה אחת של נוזל טבילה על המטרה.
- מניחים את ג'ל המכיל קולגן צלחת על הבמה מיקרוסקופ, ולוודא המנה יוצר מגע עם הנוזל טבילה.
- פוקוס מדגם לחפש תאים עניין התמונה. כדי למזער להיסחף הבמה, לאפשר צלחת להתפשר על כ -45 דקות לפני תחילת כיבוש ארוך.
- ציין את הפרמטרים הרכישה של התמונה. מזעור החשיפה הלייזר, אשר יכול לגרום נזק לתאים, על ידי ויסות כוח לייזר, זמן חשיפה, תדירות ומשך זמן לתפוס. הפרמטרים בפועל תשתנה בהתאם למערכת מיקרוסקופ ואת סוג התא.
- במהלך רכישת זמן לשגות, מעכב ניתן להוסיף. לצורך ניסוי תוספת מעכב, לא חותם את המנה עם parafilm.
- Prepהם Hepes בתוספת התקשורת עם תרופה בריכוז העבודה הרצויה.
- כאשר מוכן להוסיף תרופה התקשורת, להשהות את לכידת התמונה, להסיר בזהירות את החלק העליון צלחת מבלי להפריע את המנה.
- לשאוב את התקשורת בצלחת, ועל פיפטה תרופה המכילה מדיה לתוך המנה. ואז, בזהירות להחליף את גבי צלחת.
- המדגם עלול להיות מחוץ להתמקד עקב תוספת של מדיה חדשה, להסתגל המוקד.
- הפעל מחדש את ללכוד, ולאחר מכן לעקוב אחר ללכוד את 30 הדקות הבאות, ולתקן את המיקוד לפי הצורך. ראה איור 4 למשל הניסוי בנוסף סמים.
5. FRAP הליך ניתוח
- ההתקנה FRAP משתנה בין מערכות, בצע את ההוראות של היצרן.
- הגדרת פרמטרים עבור דימות תאים חיים.
- הגדרת הפרמטרים photobleaching. השתמש כוח לייזר מספיק photobleach את האות ניאון מבלי לפגוע בתא. מבחן אלה נקובameters על תאים בפועל.
- התחל לכידת תמונה, ולאפשר לפחות 5 מסגרות של לכידת תמונה לפני photobleaching את האזור של עניין.
- המשך ללכוד, וזמן ההתאוששות צריך להיות מספיק כדי ללכוד את התאוששות הקרינה מלא. ראה איור 5 למשל הניסוי FRAP.
- ניתוח שחזור הקרינה על ידי מדידת עוצמת פלורסנט הממוצע של האזור photobleached (לפני ואחרי photobleaching) לאורך זמן. באמצעות תוכנת ניתוח סטטיסטי (כגון Excel), להתאים את עקומת התאוששות למשוואה מעריכית: אני אני = f (1-e-KT), שם אני נמצא את עוצמת, אני f היא עוצמת הסופי, t הוא הזמן, τ ½ הוא הזמן שלוקח עוצמת להגיע במחצית הערך הסופי: τ ½ = ln (2) / k. חצי שעה הוא מדד של שיעור הניידות של החלבון.
- השג את הפרמטרים, חצי זמן ועוצמת סופית עקומה מעריכית-מתאים. חישוב הדואר על ידי לקיחת חלק ניידים היחס בין הסופי לעוצמות הקרינה הראשונית.
6. נציג תוצאות
דוגמה של הדמיה לחיות תאים של תאים אפיתל בריא בתוך המטריצה מוצגת באיור 3. תאים בריאים התערוכה קרום חלק, רציף, ועל גרעין מובהק, בעוד תאים בריאים לעיתים קרובות יש קרום שיבשו, ומספר מופרז של vacuoles. במטריצה 3D, בתאי אפיתל יחיד להעביר 1, במשך מספר ימים, בתאי אפיתל צורה תלת ממדית, כדורית, רב הסלולר ציסטות בתוך המטריצה 2. התאים הם גם דינמיים מאוד, ולהעביר בתוך הציסטה (איור 3). דפורמציה מטריצה כתוצאה של כוחות המתיחה המופעל על ידי תאים נודדים מנותח באמצעות תזוזה של חלקיקים נותב משוקע בתוך הסביבה (איור 4). תנועות החלקיקים נותב מוצגים כתמונת היטל מרבי של הבדליםזמן ent נקודות, כל נקודה בזמן הוא פסאודו בצבע כדי לציין את הזמן (איור 4B). לחלופין, תמונות של חלקיק יחיד נותב מוצגים מונטאז' להראות את התנועה של החלקיקים מעקב לאורך זמן (איור 4C). ניתוח כל תמונה נעשה באמצעות ImageJ. אלה הערכות איכותיות של דפורמציה מטריצה, ולכן הכוחות המופעל על ידי תאים נודדים, הם קירוב ראשון שימושי חלוקת כוח המתיחה. הערכה כמותית של כוחות המתיחה המופעל על ידי תאים נודדים ב-3D הוא מעבר להיקף של פרוטוקול זה מתואר במקומות אחרים 3,4.
התאוששות הקרינה האופיינית לאחר photobleaching הניסוי שמוצג באיור 5. האזור של עניין יש photobleached באמצעות הגדרות לייזר מותאם כך את עוצמת הקרינה היא בבירור פחתה לעומת רמות הרקע (על מנת למקסם את אות לרעש יחס), תוך שמירה על תאים בריאים ללא פגע. ההגדרה המיטבית חייב בהדואר נקבע באופן אמפירי כמו כל התקנה FRAP שונה (למשל, FRAP באמצעות לייזר סריקת מערכת confocal).
החשיפה זמן מרווח של רכישת שלאחר FRAP התמונה חייב להיות מבוקר בקפידה, כדי למנוע photobleaching רקע. השימוש בלייזר נמוך עוצמה, זמן חשיפה קצר, ואת השימוש במצלמה רגישה אופטיקה יעיל גבוהה חיוניים הדמיה באיכות גבוהה FRAP. אם הקרינה הלבנה במהלך הרכישה התמונה משמעותי, דהייה רקע זה יש לכמת מנורמל של התאוששות האינטנסיביות צפו פלואורסצנטי. בשל אופייה של סביבת 3D, המרכיב-z של התאוששות עוצמת הקרינה עלולה להיות משמעותית. לפיכך, חשוב להגדיר נפח photobleached ידי לקיחת לפני ואחרי 3D-מחסנית תמונות של אזור photobleached. ניתוח נוסף דוגמנות של התאוששות הקרינה נדונה במקום אחר 5,6.
השילוב הייחודי של תאים חיים הדמיה techniques: GFP לעקוב אחר הדינמיקה של חלבונים cytoskeletal, אדום פלואורסצנטי חלקיקים נותב לפקח על עיוות מטריקס, ועל תוספת של מעכבי, ניתן להשתמש בו זמנית לניתוח הדינמיקה חלבון, כוח המתיחה מסלולים מולקולריים.
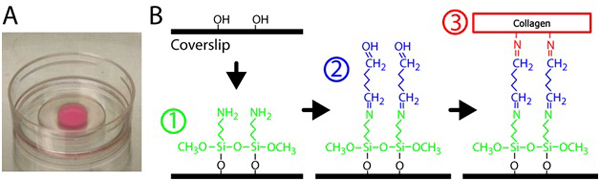
באיור 1. הכנת ג'ל קולגן. א) polymerized מטריצה קולגן על צלחת עם תחתית מזכוכית. הצבע הוורוד של ג'ל נובעת חלקיקים פלורסנט מוטבע. ב) נוהל לטיפול התחתונה צלחות זכוכית crosslink ג'ל קולגן למשטח זכוכית. ראשית, צלחת תחתית זכוכית מטופל עם פתרון 3-Aminopropyltrimethoxysilane, אז הפתרון glutaraldehyde כי crosslinks מטריצת קולגן אל הזכוכית.
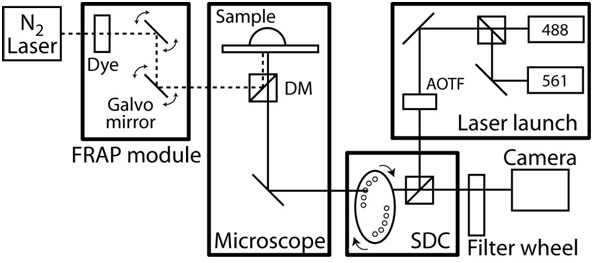
באיור 2. שרטוטים של ההתקנה confocal / FRAP מיקרוסקופ. Confocalהמיקרוסקופ מבוסס על AxioObserver Zeiss עם מצלמת CCD HQ CoolSnap השני אוטומטי לחלוטין על ידי Slidebook תוכנה (Intelligent חידושים Imaging). יחידת confocal הוא אישית מעוצבת, המבוסס על יחידת דיסק Yokogawa ספינינג CSU10 ושני לייזרים של מצב מוצק (488 ננומטר mW עם 50 ו 561 ננומטר עם mW 40) עם acousto אופטי מסנן מתכוונן (AOTF) כדי לאפשר אלפיות מעבר בין שני לייזרים. מסנני פליטה הם ננומטר 525/50 ו - 620/60 ננומטר (# 118661 ו # 118085, טכנולוגיה Chroma) ואת המראה dichroic הוא 488-568 הלהקה BrightLine כפול (Semrock). המטרות הן רב עובד 40X מרחק C-Apochromat אובייקטיבי עם NA 1.1 ומרחק עבודה של 0.62 מ"מ, וכן מטרת תוכנית 63x-Apochromat עם NA 1.4 ואת מרחק העבודה של 0.19 מ"מ. מיקרוסקופ כולל גם photoablation FRAP מערכת מורכבת של סיבים אופטית שאוב צבע לייזר, קרן בשליטת מחשב העמדה והעוצמה, וגודל מוגבל עקיפה במקום. יתר על כן, המיקרוסקופ הוא מצוידשלב ממונע xy הכוללת 0.1 מיקרון encoders ליניארי על כל ציר. במהלך הדמיה זמן לשגות, הטמפרטורה הסביבתית מתוחזק על ידי תא מיקרוסקופ מנהג תוכנן תנור עם בקרת טמפרטורה משוב. כדי לבודד רעש ורעידות, מערכת מיקרוסקופ כולו על השולחן, רטט חופשי.
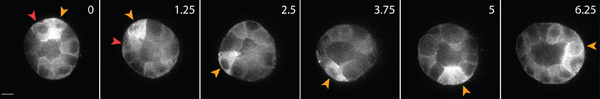
באיור 3. הדמיה חיה של התא בתאי אפיתל להביע GFP-אקטין. תאים אלה יצרו ציסטה לאחר 4 ימים של תרבות במטריצה קולגן 3D. תאים מסוימים לנוע לאורך פני השטח של ציסטה (חץ צהוב), בעוד אחרים נודדים בתוך הפנים של ציסטה (חץ אדום). סולם בר 10 מיקרומטר, זמן שעות.
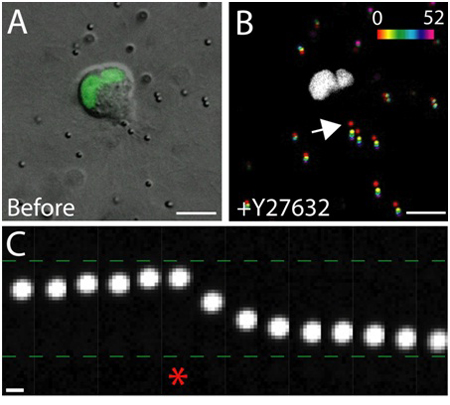
איור 4. ההשפעה של Rho-kinase עיכוב על כוח המתיחה. א) התמונה DIC התא MDCK נודדות להביע GFP מתויג סמן גרעיני. התמונה צולמה מיד לפני הטיפול מעכב Rho-kinase Y-27632. סולם בר 10 מיקרומטר. ב) עקירה חלקיקים הנובע תוספת של Y-27632. העמדות החלקיקים בנקודות זמן שונות (0 - 52 דקות) היו פסאודו בצבע לפי סולם העוצמה, ואז מוקרן על גבי תמונה אחת. האזור הלבן הוא גרעין חיובי GFP בתאים נודדות. סולם בר 10 מיקרומטר. זמן בתוך דקות. ג) תנועת החלקיקים לעבר נגרר לקצה של התא (ראה החץ B). כוכבית מציינת את המסגרת האחרונה שנתפסו לפני כן Y-27632. נותב החלקיקים נעו לעבר והרחק נגרר לקצה של התא נודדות לפני ואחרי תוספת של Y-27632, בהתאמה. סולם 1 בר מיקרומטר.
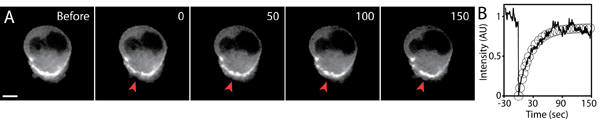
איור 5. FRAP ניתוח של ה-GFP-אקטין להביע נודדות תא במטריצה תלת מימדי. א) Timelapse תמונות של ה-GFP-אקטין להביע התא של לפני ואחרי photobleaching. אזור קטן של אקטין-GFP שהצטבר בחלק האחורי של התא היה photobleached (חץ אדום) בשעה timepoint 0. זמן בשניות, בר בהיקף 5 מיקרומטר. ב) עוצמת הקרינה הממוצעת באזור photobleached (קו מוצק), וכן להתאים מעריכי ההתאוששות פלואורסצנטי (עיגולים) להתוות לאורך זמן. עוצמת הקרינה הייתה מנורמל לערך הראשוני לפני photobleaching.
Discussion
כאן אנו מתארים שיטה לשימוש לחיות תאים הדמיה ללמוד את המכניזם של נדידת תאים במטריצה תלת מימדי. ההצלחה של טכניקה זו תלויה בהשגת "טוב" שיבוטים ביציבות להביע GFP-tagged חלבונים. רמה נמוכה של חלבון ה-GFP ידרוש חשיפה עירור עודף פשרות בריאות התא, ואילו רמה גבוהה מדי של GFP יה...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
אנו מודים לד"ר גרנט סאמידה לקריאה ביקורתית של כתב היד. עבודה זו נתמכה על ידי פרס החוקר הצעיר Beckman (ש"י), משפחה חדשה הלמן הפקולטה פרס (ש"י), EUREKA-NIH, מאוניברסיטת קליפורניה לחקר הסרטן ועדת התיאום.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| קולגן, שור, סוג I | BD Biosciences | 354231 | מלאי הוא כ 3 מ"ג / מ"ל |
| 3-aminopropyltrimethoxysilane | סיגמא אולדריץ' | 281778 | מדולל במים |
| glutaraldehyde | סיגמא אולדריץ' | 340855 | מדולל ב PBS |
| 1M Hepes | Invitrogen | 15630-080 | |
| Fluospheres פוליסטירן microspheres 1 מיקרומטר, אדום פלואורסצנטי (580/605) | Invitrogen | F13083 | |
| Geneticin (G418) | Invitrogen | 11811-031 | |
| תרבות התקשורת מרכיבים: | |||
| DMEM | Invitrogen | 31600-034 | |
| סרום שור עוברית | אטלנטה הביולוגיים | S115500 | |
| פניצילין / סטרפטומיצין | Invitrogen | 15140-122 | |
| Kanamycin | Invitrogen | 15160-054 | |
References
- Shih, W., Yamada, S., Myosin, . A dependent retrograde flow drives 3D cell migration. Biophys. J. 98 (8), L29-L31 (2010).
- O'Brien, L. E., Yu, W., Tang, K., Jou, T. S., Zegers, M. M., Mostov, K. E. Morphological and biochemical analysis of Rac1 in three-dimensional epithelial cell cultures. Methods Enzymol. 406, 676-691 (2006).
- Legant, W. R., Miller, J. S., Blakely, B. L., Cohen, D. M., Genin, G. M., Chen, C. S. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat. Methods. 7 (12), 969-971 (2010).
- Del Alamo, J. C., Meili, R., Alonso-Latorre, B., Rodriguez-Rodriguez, J., Aliseda, A., Firtel, R. A., Lasheras, J. C. Spatio-temporal analysis of eurkaryotic cell motility by improved force cytometry. Proc. Natl. Acad. Sci. U.S.A. 104 (33), 13343-13348 (2007).
- Lippincott-Schwartz, J., Snapp, E., Kenworthy, A. Studying protein dynamics in living cells. Nat. Rev. Mol. Cell Biol. 2 (6), 444-456 (2001).
- Phair, R. D., Misteli, T. Kinetic modeling approaches to in vivo imaging. Nat. Rev. Mol. Cell Biol. 2 (12), 898-907 (2001).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. Fluorescent toolbox for assessing protein location and function. Science. 312 (5771), 217-224 (2006).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved