Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Live-ячейки изображения по переносу клеток, экспрессирующих флуоресцентно с метками Белки в трехмерной матрице
В этой статье
Резюме
Клеточных процессов, таких как сотовые миграции традиционно изучался на двумерных, жесткие пластмассовые поверхности. В настоящем докладе описывается методика визуализации белка непосредственно локализации и анализа динамики белков в клетках, мигрирующих в физиологически более актуальной, трехмерные матрицы.
Аннотация
Традиционно, миграции клеток изучалась на двумерных, жесткие пластмассовые поверхности. Тем не менее, во время важных биологических процессов, таких как заживление ран, регенерации тканей, метастазирования и рака, клетки должны ориентироваться в сложной, трехмерной внеклеточной ткани. Чтобы лучше понять механизмы, лежащие в этих биологических процессов, важно для изучения роли белков, ответственных за вождение миграции клеток. Здесь мы опишем протокол для изучения механизмов клеточной миграции с использованием эпителиальных клеточных линий (MDCK), и трехмерные, волокнистых, само-полимеризации матрицы в качестве модельной системы. Это оптически прозрачные внеклеточного матрикса легко поддаются живых клеток исследования изображений и лучше имитирует физиологическую, мягких тканей среды. Данный отчет демонстрирует технику для визуализации непосредственно локализации белка и динамики, и деформации окружающей трехмерной матрицы.
Экзаменination локализации белка и динамики в процессе клеточных процессов обеспечивает понимание ключевых белков функций. Генетически закодированный флуоресцентные метки обеспечивают уникальный метод для наблюдения локализации белка и динамики. Используя эту технику, мы можем проанализировать субклеточных накопления ключ, сила генерирующих компонентов цитоскелета, в режиме реального времени, как клетка маневров через матрицу. Кроме того, использование нескольких флуоресцентных меток с разными длинами волн, мы можем рассмотреть локализацию нескольких белков одновременно, что позволяет нам проверить, например, могут ли различные белки имеют сходные или различные роли. Кроме того, динамика флуоресцентно меткой белки могут быть количественно, используя флуоресцентные Восстановление после фотообесцвечивания (FRAP) анализа. Это измерение анализов подвижности белка и как стабильно связаны белки цитоскелета в сети.
Объединив жить-клеточной визуализации при лечении ингибиторами функции белка,мы можем рассмотреть в режиме реального времени изменения в распределении белков и морфологии мигрирующих клеток. Кроме того, мы и объединяем в живых клеток изображений с использованием флуоресцентных частиц трассирующими встроены в матрицу для визуализации матрицы деформации в процессе миграции клеток. Таким образом, мы можем представить себе, как мигрирующие ячейки распределяет силу генерирующих протеины, и где тяги силы оказываемого на окружающую матрицу. С помощью этих методов, мы можем получить ценную информацию о роли специфических белков и их вклад в механизмы клеточной миграции.
протокол
1. Генерация стабильной клеточной линии (например, MDCK клеток)
- Пластина клеток на 80-90% слияния в p35 блюдо. Не позволяйте клетки образуют 100% сливающийся монослой, что снизит эффективность трансфекции.
- Трансфекции клеток с плазмидой интерес использованием Lipofectamine 2000 года. Оптимизация трансфекции условиях с использованием протокола производителя.
- На следующий день, прохождение клетки на две P150 чашках Петри. Большое блюдо рекомендуется обеспечить достаточное расстояние между стабильной колонии.
- На следующий день, изменение средств массовой информации и добавить 500 мкг / мл G418 к каждому блюду. Концентрация G418 должен быть оптимизирован для отдельных клеточных линий.
- Изменение СМИ через день в течение примерно 2 недель. Через 2 недели G418-устойчивых колоний должны начать формироваться, и будут видны невооруженным глазом.
- Использование перевернутой флуоресцентного микроскопа, выявить положительные GFP колоний. Отметьте эти колонии на пластины с использованием пера шулер.
- Чтобы сизбирательно trypsinize колоний от планшета для культуры ткани, аспирата из средств массовой информации, и промыть клетки в два раза с PBS или раствора трипсина. На втором мыть, не аспирата из всех решение. Оставьте тонкий слой жидкости на нижней части пластины, чтобы предотвратить клетки от высыхания.
- Для каждой отмеченной колонии: использовать стерилизованное ватный тампон, чтобы уничтожить как можно ближе по краям колонии. Это создаст острове мокрой область, содержащую ячейки колонии. Внесите 10 мкл трипсина на колонию. Повторите для каждой колонии, и приступить быстро, чтобы избежать высыхания. Опытный исследователь, как правило, выбор ~ 12 колоний на P150 пластины.
- Инкубируйте пластины при температуре 37 ° С в течение 5-10 минут, пока клетки отделяются от плиты и кажутся круглыми.
- Для каждой колонии: Внесите 10 мкл трипсина на колонию, и пипетку вверх и вниз несколько раз, чтобы отделить клетки от пластинки. Потом пипеткой все клетки колонии в одной скважины в 24 и блюдо.
- После стабильной колонии выросли, экспрессию белка каждой колонии анализируется с помощью стандартной западной пятно и иммунофлюоресценции. Развернуть эти клеточные линии, для дальнейшего анализа.
2. Модификация поверхности стеклянной посуде дно для оптимального обязательными коллагена (опционально)
- Для silanize стекла, пипетки 300 мкл 2% 3-Aminopropyltrimethoxysilane раствор на стекло часть каждого p35 блюдо с 10 мм отверстие. См. рисунок 1 для silanization и сшивания схеме. 3-Aminopropyltrimethoxysilane разводят в фильтрованной воде.
- Выдержите в течение 1 часа при комнатной температуре.
- Аспирацию из 3-Aminopropyltrimethoxysilane раствора и промыть фильтрованной воды три раза в течение 10 минут каждый.
- Аспирацию из воды и поместите блюда на горячей пластине установлен на 50 ° С в течение 1,5 часов. Место вершины блюда немного от блюдо так, чтобы влаги в блюде может убежать.
- Удалить блюда с огня и дайте воркуютл
- Внесите 300 мкл 2% глутарового альдегида раствор на стекло Часть каждого блюда. Глутаральдегида разводят в PBS.
- Выдержите в течение 1 часа.
- Аспирацию из глутаральдегида решения и мыть посуду с PBS три раза в течение 10 минут каждый.
- Стерилизовать блюд под воздействием ультрафиолетового излучения в течение 1 часа. Silanized блюда можно хранить при комнатной температуре.
3. Подготовка 3D-гель с частицами коллаген трассирующей
- Вымойте флуоресцентных частиц трассирующими счет остановки 100 мкл фондовом частиц трассирующими (10 10 частиц / мл) в центрифуге при 15000 оборотов в минуту в течение 5 минут, аспирата из жидкости, и добавить 500 мкл СМИ. Повторить 5 раз. После последней стирки, ресуспендирования частиц в 30 мкл СМИ.
- Trypsinize клеток, экспрессирующих GFP, как обычно.
- Ресуспендируют осадок клеток примерно 2 х 10 6 клеток / мл.
- Внесите 240 мкл питательной среды в трубке Эппендорф.
- Добавить 12,6 мкл 1М Hepes, 20 мкл отфильтрованной воды, 50 мкл клеточной решение, то 10 мкл флуоресцентных частиц.
- Наконец, добавьте 167 мкл бычьего коллагена дермы Я раствор (для получения рабочей концентрации 1 мг / мл).
- Смешайте раствор тщательно, то пипеткой 80 мкл раствора на стекло часть silanized блюдо стеклянным дном.
- Место блюдо в инкубаторе и позволяют гель для полимеризации при 37 ° С в течение 30 минут. См. рисунок 1А для типичных геля коллагена в p35 блюдо стеклянным дном.
- Добавить 2 мл питательной среды тщательно к каждому блюду.
4. Порядок покадровой получения изображения
- Включите контроля температуры корпуса микроскопа и пусть объем камеры равновесие в состоянии постоянной температуры до 37 ° C. На рисунке 2 показан пример жить-клеточной визуализации системы.
- Изменение информации к новой среде с 25 мМ Hepes поддерживать нейтральный рН. ДляDIC изображений, обмена начало блюдо с тот, который имеет стеклянный верх. Использование тонкую полоску парафильмом, крышка стороне блюда, чтобы предотвратить испарение СМИ.
- Для объективной иммерсионного масла, положите одну каплю иммерсионной жидкости на цель.
- Место гель, содержащий коллаген блюдо на столике микроскопа, и убедитесь, что блюдо вступает в контакт с иммерсионной жидкости.
- Фокус образца и поиск сот интерес к изображению. Чтобы свести к минимуму этапе дрейф, позволяют блюдо урегулировать в течение приблизительно 45 минут до начала долгого захвата.
- Укажите параметры получения изображений. Свернуть лазерного воздействия, которое может привести к повреждению клеток, путем модуляции мощности лазера, воздействие времени, частоты и продолжительности время захвата. Фактические параметры будут меняться в зависимости от системы микроскопа и типа клеток.
- Во время покадровой приобретение, ингибитор может быть добавлен. Для эксперимента ингибитор того, не уплотнение блюдо с парафильмом.
- Приготовительныйявляются Hepes дополнен сред с наркотиками на желаемой рабочей концентрации.
- Когда все готово, чтобы добавить препарат для средств массовой информации, пауза захвата изображения, и осторожно снимите верхнюю блюдо, не нарушая блюдо.
- Аспирацию из средств массовой информации в блюдо, и пипеткой препарат, содержащий носитель в блюдо. Затем аккуратно заменить блюдо сверху.
- Выборка может быть вне внимания из-за добавления новых средств массовой информации, отрегулируйте фокус.
- Перезагрузка захвата, затем следить за захват в течение следующих 30 минут, и скорректировать фокус по мере необходимости. См. рисунок 4 для примера препарат эксперимент дополнение.
5. Процедура FRAP и анализ
- FRAP установки колеблется в пределах системы, следовать инструкциям производителя.
- Настройка параметров для живых клеток изображений.
- Настройка параметров для фотообесцвечивания. Используйте достаточную мощность лазера photobleach флуоресцентного сигнала, не повреждая клетки. Проверьте эти номинальнойameters на практике клеток.
- Начало захвата изображения, и позволяет по крайней мере 5 кадров съемки, перед фотообесцвечивания области интереса.
- Продолжить захвата, и время восстановления должно быть достаточно для захвата полного восстановления флуоресценции. На рисунке 5 пример FRAP эксперимента.
- Анализ флуоресценции восстановления путем измерения средней интенсивности флуоресцентного photobleached площади (до и после фотообесцвечивания) с течением времени. Использование статистического программного обеспечения для анализа (например, Excel), подходит к кривой восстановления экспоненциальное уравнение: I = I е (1-е-кт), где я есть интенсивность, я е является конечной интенсивности, т есть время, и τ ½ является время, необходимое для интенсивности до половины конечного значения: τ ½ = LN (2) / k. Полставки является мерой скорости подвижности белка.
- Получить параметры, на полставки и окончательного интенсивности от экспоненциального кривую. Рассчитать йэлектронной мобильных фракция, взяв отношение конечной к начальной интенсивности флуоресценции.
6. Представитель Результаты
Примером живых клеток изображений здоровых эпителиальных клеток в матрице показано на рисунке 3. Здоровые клетки обладают гладкой, непрерывной мембраны и различные ядра, в то время как нездоровые клетки часто нарушается мембраны, а чрезмерное количество вакуолей. В 3D-матрицы, одним эпителиальные клетки мигрируют 1, и в течение нескольких дней, эпителиальные клетки образуют трехмерную, сферические, многоклеточные кисты в пределах матрицы 2. Клетки также очень динамичный, и мигрируют в пределах кисты (рис. 3). Матрица деформации в результате тяги силы, с которыми мигрирующих клеток анализируется через смещение трассирующих частиц, внедренных в окружающей матрице (рис. 4). Движения частиц трассирующими отображаются в виде максимального изображение проекции отличаютсяЛОР временных точках, и каждый момент времени является псевдо-цветным, чтобы указать время (рис. 4В). Кроме того, изображение отдельной частицы трассирующими отображаются в виде монтажа, чтобы показать движение частиц примеси в течение долгого времени (рис. 4С). Все анализа изображений было сделано с использованием ImageJ. Эти качественные оценки матрицы деформации, и, следовательно, силы, действующие на мигрирующих клеток, полезны первом приближении распределения тяговых сил. Количественная оценка тяговых сил, действующих на мигрирующих клеток в 3D выходит за рамки этого протокола, и описана в другом месте 3,4.
Флуоресценции типичного восстановления после фотообесцвечивания эксперимента приведена на рисунке 5. Интересующей нас области должны быть photobleached использованием оптимизированными параметрами лазерного так, что интенсивность флуоресценции заметно уменьшилось по сравнению с фоновым уровням (максимально сигнал-шум), сохраняя при этом здоровые и неповрежденные клетки. Оптимальные настройки должны бэлектронной определяется эмпирически, поскольку каждый FRAP установка отличается (например, FRAP использованием лазерной сканирующей конфокальной системы).
Экспозиции и временных интервала после FRAP получения изображения необходимо тщательно контролировать, чтобы избежать фоне фотообесцвечивания. Использование более низких мощности лазерного излучения, малое время экспозиции, а также использование чувствительной камеры и высокоэффективной оптикой имеют важное значение для высокой изображений FRAP качества. Если флуоресценции отбеливания во время получения изображения является значительным, этом фоне затухания должна быть количественно и нормированных по наблюдаемой флуоресценции восстановления интенсивности. Благодаря 3D характер окружающей среды, г-компонента восстановления интенсивности флуоресценции может стать значительным. В связи с этим важно определить объем photobleached, принимая до и после 3D-стека изображений photobleached регионе. Дальнейший анализ и моделирование флуоресценции восстановления обсуждается в другом месте 5,6.
Уникальное сочетание живых клеток изображений тechniques: GFP следовать динамике цитоскелета, белки, красной флуоресценции трассирующих частиц для контроля матрицы деформации, а добавление ингибиторов, может быть использован одновременно для анализа динамики белков, тяговое усилие и молекулярных путей.
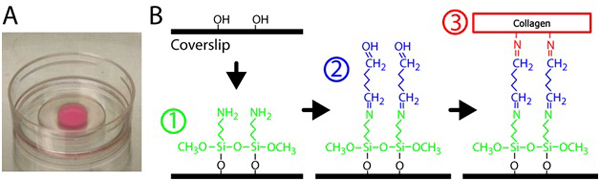
Рисунок 1. Подготовка коллагеновый гель. ) Полимеризованные коллагеновой матрицы на стеклянным дном тарелку. Розовый цвет геля из-за встроенных флуоресцентных частиц. В) Процедура для лечения блюда со стеклянным дном для сшивки коллагена гель для стеклянной поверхности. Во-первых, блюдо со стеклянным дном обрабатывают 3-Aminopropyltrimethoxysilane решение, то решение, которое глутаральдегида сшивки коллагена матрицы стекла.
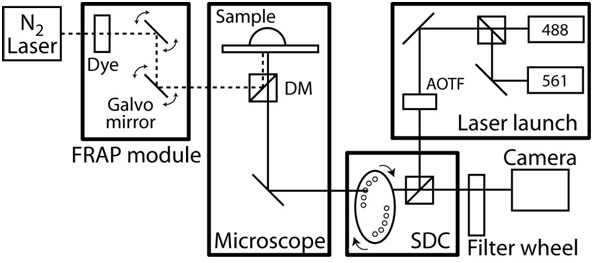
Рисунок 2. Схемы конфокальной / FRAP микроскопом установки. Конфокальноймикроскопа основано на Zeiss AxioObserver с CoolSnap HQ камера CCD II и полностью автоматизирован с помощью программного обеспечения Slidebook (Intelligent изображений инновации). Конфокальной устройство специально созданных и на основе Yokogawa вращающийся диск единицы CSU10 и два твердотельных лазеров (488 нм с мощностью 50 мВт и 561 нм с 40 мВт) с акустооптического перестраиваемого фильтра (AOTF), чтобы позволить миллисекунд переключение между двумя лазерами. Выбросов фильтры 525/50 нм и 620/60 нм (# 118661 и # 118085, Chroma Technology) и дихроичных зеркала 488-568 BrightLine Двухдиапазонный (Semrock). Цели большим рабочим расстоянием 40x C-Apochromat цель с Н. А. 1.1 и рабочее расстояние 0,62 мм, а 63x Plan-Apochromat цель с Н. А. 1.4 и рабочее расстояние 0,19 мм. Микроскоп также включает в себя системы FRAP photoablation, который состоит из волокна с оптической накачкой лазер на красителе, управляемый компьютером положение луча и интенсивность, и дифракционного предела размер пятна. Кроме того, микроскоп снабженэтап ху моторизованных, которая включает 0,1 мкм датчики линейных перемещений на каждой оси. Во время покадровой обработки изображений, температура окружающей среды находится в ведении специально разработанные камеры микроскопа и нагреватель с регулировкой температуры обратной связи. Чтобы выделить какой-либо шума и вибрации, всей системы микроскопа на вибрации стола.
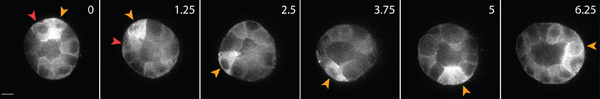
Рисунок 3. Живая клетка изображений эпителиальных клеток, экспрессирующих GFP-актин. Эти клетки образуются кисты после 4 дней культуры в 3D-матрицу коллагена. Некоторые клетки перемещаются по поверхности кисты (желтые стрелки), а другие мигрируют в пределах интерьер кисты (красные стрелки). Шкала бар 10 мкм, время в часах.
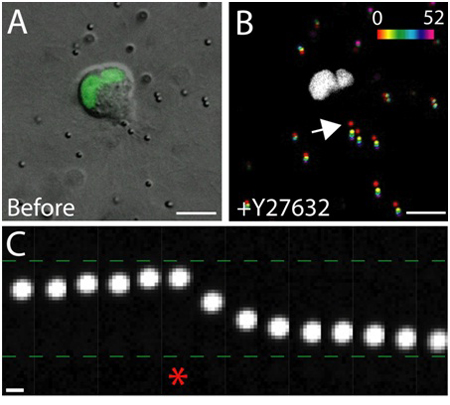
Рисунок 4. Влияние Rho-киназы торможение на силу тяги. A) DIC образ миграции MDCK ячейки выражения GFP меткой ядерное маркером. Снимок был сделан непосредственно перед лечения Rho-киназы ингибитор Y-27632. Шкала бар 10 мкм. Б) смещения частиц в результате добавления Y-27632. Положения частиц в различных точках времени (0 - 52 мин) псевдо-цветного по шкале интенсивности, а затем проецируется на одно изображение. Белый регион GFP положительного ядра в миграции клеток. Шкала бар 10 мкм. Время в минутах. C) движения частиц на заднем краю ячейки (см. стрелку в В). Asterisk обозначает последний кадр захватили до Y-27632 дополнительно. Частица трассирующими двинулся к и от задней кромки миграции ячейки до и после добавления Y-27632, соответственно. Шкала бар 1 мкм.
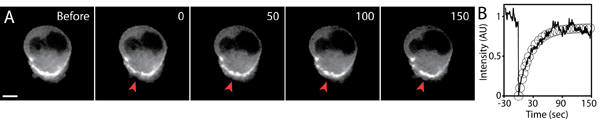
Рисунок 5. FRAP анализ GFP-актин выражения ячейки мигрируют в трехмерной матрице. ) Timelapse образы GFP-актина выражения ячейки до и после фотообесцвечивания. Небольшой области GFP-актин, накопленных на ячейки тыла photobleached (красные стрелки) на timepoint 0. Время в секундах, масштабная линейка 5 мкм. Б) средняя интенсивность флуоресценции photobleached области (сплошная линия), и экспоненциальный приступе флуоресценции восстановления (кружки), построенные с течением времени. Интенсивность флуоресценции была нормализована к исходному значению до фотообесцвечивания.
Обсуждение
Здесь мы опишем метод с использованием живых клеток изображений для изучения механизмов миграции клеток в трехмерной матрице. Успех этого метода зависит от получения "хорошего" клонов стабильно выразить GFP с метками белков. Низкий уровень белков GFP потребуется чрезмерное воздейс...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим доктора Гранта Сумида за критическое прочтение рукописи. Эта работа была поддержана Бекман премия для молодых следователь (SY), семьи Hellman Новая премия факультета (SY), NIH EUREKA, Калифорнийский университет онкологический научный координационный комитет.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Коллаген, крупного рогатого скота, тип I | BD Biosciences | 354231 | Питание патронами около 3 мг / мл |
| 3-aminopropyltrimethoxysilane | Sigma Aldrich | 281778 | Развести в воде |
| глутаральдегида | Sigma Aldrich | 340855 | Развести в ФСБ |
| 1M Hepes | Invitrogen | 15630-080 | |
| Fluospheres полистирола микросфер 1 мкм, красная флуоресценция (580/605) | Invitrogen | F13083 | |
| Генетицин (G418) | Invitrogen | 11811-031 | |
| Культура СМИ компоненты: | |||
| DMEM | Invitrogen | 31600-034 | |
| Эмбриональной бычьей сыворотки | Атланты биологические препараты | S115500 | |
| Пенициллина / стрептомицина | Invitrogen | 15140-122 | |
| Канамицин | Invitrogen | 15160-054 | |
Ссылки
- Shih, W., Yamada, S., Myosin, . A dependent retrograde flow drives 3D cell migration. Biophys. J. 98 (8), L29-L31 (2010).
- O'Brien, L. E., Yu, W., Tang, K., Jou, T. S., Zegers, M. M., Mostov, K. E. Morphological and biochemical analysis of Rac1 in three-dimensional epithelial cell cultures. Methods Enzymol. 406, 676-691 (2006).
- Legant, W. R., Miller, J. S., Blakely, B. L., Cohen, D. M., Genin, G. M., Chen, C. S. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat. Methods. 7 (12), 969-971 (2010).
- Del Alamo, J. C., Meili, R., Alonso-Latorre, B., Rodriguez-Rodriguez, J., Aliseda, A., Firtel, R. A., Lasheras, J. C. Spatio-temporal analysis of eurkaryotic cell motility by improved force cytometry. Proc. Natl. Acad. Sci. U.S.A. 104 (33), 13343-13348 (2007).
- Lippincott-Schwartz, J., Snapp, E., Kenworthy, A. Studying protein dynamics in living cells. Nat. Rev. Mol. Cell Biol. 2 (6), 444-456 (2001).
- Phair, R. D., Misteli, T. Kinetic modeling approaches to in vivo imaging. Nat. Rev. Mol. Cell Biol. 2 (12), 898-907 (2001).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. Fluorescent toolbox for assessing protein location and function. Science. 312 (5771), 217-224 (2006).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2, 905-909 (2005).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены