A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الآلي الكمي من الإسفار متشابك في
In This Article
Summary
وفرة من المستقبلات العصبية تتجمع في نقاط الاشتباك العصبي تؤثر تأثيرا قويا قوة متشابك. هذا الأسلوب الكمي المستقبلات العصبية fluorescently المسمى في ثلاثة أبعاد مع قرار واحد في المشبك C. ايليجانس، مما يسمح للمئات من نقاط الاشتباك العصبي يتميز بسرعة في عينة واحدة من دون التشوهات التي أدخلتها Z-طائرة الإسقاط.
Abstract
قوة المشبك يشير إلى اتساع ردود بعد المشبكي إلى إطلاق سراح الأحداث قبل المشبكي العصبي، ولها تأثير كبير على وظيفة الكلية الدائرة العصبية. قوة المشبك يتوقف بصورة حاسمة على وفرة من المستقبلات العصبية تتجمع في مواقع متشابك على الغشاء بعد المشبكي. يتم تحديد مستويات مستقبلات تنمويا، ويمكن تغييرها من قبل الاتجار مستقبلات بين برك السطحية المحلية، تحت المشبك، والخلايا، التي تمثل آليات هامة من اللدونة متشابك وتعديل العمليات العصبية. طرق صارمة لتحديد synaptically المموضع وفرة مستقبلات الناقل العصبي ضرورية لدراسة تطوير واللدونة متشابك. مضان المجهري هو النهج الأمثل لأنه يحافظ على المعلومات المكانية، والتمييز متشابك من غير متشابك حمامات، والتمييز بين السكان مستقبلات مترجمة إلى أنواع مختلفة من نقاط الاشتباك العصبي. الكائن الحي نموذج الجيني Caenorhabditis eleganوبشكل خاص يناسب ق لهذه الدراسات نظرا لصغر حجمها وبساطة النسبي للنظام العصبي، وشفافيتها، ومدى توافر تقنيات وراثية قوية، مما يسمح للفحص من نقاط الاشتباك العصبي في الحيوانات الأصلية سليمة.
هنا نقدم وسيلة لقياس fluorescently المسمى المستقبلات العصبية متشابك في C. ايليجانس. وتتمثل الميزة الرئيسية هي تحديد الآلية وتحليل نقاط الاشتباك العصبي الفردية في ثلاثة أبعاد متعددة في طائرة مبائر ملفات الإخراج المجهر، موقف تبويب، وحجم وكثافة مضان، ومضان الإجمالية لكل المشبك. هذا النهج ميزتان الرئيسية خلال التحليل اليدوي للZ-طائرة التوقعات للبيانات مبائر. أولا، لأنه يتم تضمين كل طائرة من مجموعة البيانات مبائر، يتم فقدان أي بيانات من خلال Z-إسقاط طائرة، تقوم عادة على المعدلات كثافة بكسل أو الحدود القصوى. الثانية، وتحديد نقاط الاشتباك العصبي هو الآلي، ولكن يمكن للتفتيش من قبل القوات المسلحة الرواندية السابقةperimenter كما عائدات تحليل البيانات، مما يتيح استخلاص سريعة ودقيقة للبيانات من عدد كبير من نقاط الاشتباك العصبي. ويمكن بسهولة لمئات الآلاف من نقاط الاشتباك العصبي في عينة يمكن الحصول عليها، وتنتج مجموعات البيانات الكبيرة إلى تحقيق أقصى قدر من القوة الإحصائية. اعتبارات لإعداد C. وتناقش أيضا ايليجانس لتحليلها، وإجراء التصوير مبائر للحد من التباين بين الحيوانات ضمن مجموعات العلاج. على الرغم من أن وضعت لتحليل C. مستقبلات ايليجانس بعد المشبكي، وهذه الطريقة مفيدة بشكل عام في أي نوع من synaptically المموضع البروتين، أو في الواقع، أي إشارة مضان أن يكون موضعيا إلى مجموعات منفصلة، ونقاط و، أو العضيات.
يتم تنفيذ الإجراء في ثلاث خطوات: 1) إعداد العينات، 2) التصوير مبائر، و 3) تحليل الصور. الخطوات 1 و 2 هي محددة لC. ايليجانس، في حين أن الخطوة 3 تنطبق بصورة عامة على أي إشارة مضان منقط في الميكروسكوب متحد البؤر.
Protocol
1. إعداد الديدان عن التصوير
ويستند هذا الجزء من البروتوكول بشأن جيم نشرت ويرد تقنيات زراعة ايليجانس 1،2، و في الشكل 1.
- تنمو الديدان في ارتفاع لوحات البيبتون أجار NGM (10 سم) مع المصنف E. NA22 البكتيريا القولونية حتى تجويع تقريبا. إذا المناعية، واحد لوحة إنتاج موثوق بها الديدان يكفي لمدة 1 فرد وصمة عار، مع الأخذ بعين الاعتبار الخسائر على طول الطريق، وتستخدم معايير صارمة لتحديد الديدان للتصوير (انظر الجزء 2).
- الديدان الحصاد وذلك بصب قليل من DDH مل 2 0 على لوحة، ويحوم لفترة وجيزة، وسكب السائل في أنبوب 15 مل المخروطية (اكرر إذا لزم الأمر لنقل اكثر من الديدان إلى أنبوب). بيليه في أجهزة الطرد المركزي السريرية لمدة 3 دقائق، ز 1000x. غسل بيليه 1-3x مع DDH 2 O حتى طاف هو واضح لإزالة البكتيريا المتبقية. استخدام ماصات نقل البولي بروبلين لإزالة supernatants، كما الديدان التمسك زجاج(من هذه الخطوة فصاعدا فإن من الأهمية بمكان لتقليل الوقت بين خطوات لتجنب الخسائر في الجدوى البيض).
- بعد غسل الماضي، resuspend بيليه دودة في 5 مل محلول هيبوكلوريت القلوية إلى ليز الديدان وبيض الافراج عنهم. صخرة بلطف، وفحص أنابيب تحت المجهر تشريح حوالي مرة واحدة في الدقيقة الواحدة. عندما تكون هي lysed حوالي 50٪ من الديدان (أنها سوف تظهر العزم وكسر مفتوح)، إنهاء تحلل عن طريق ملء أنبوب إلى الأعلى مع الواق البيض، عدة مرات قلب، والتكوير لمدة 3 دقائق، ز 1000x. يجب أن تحلل وقت لا يتجاوز 5 دقائق.
- إزالة طاف مع ماصة، ونقل وغسل بيليه 3x مع الواق البيض.
- للفصل بين البيض من الحطام، وتطفو عليها على وسادة من السكروز بنسبة 30٪ في DDH 2 O: بعد غسل النهائي من الخطوة 1.4، إزالة بعناية بيليه طاف وresuspend في DDH مل 5 2 0. إضافة 5 مل العقيمة السكروز 60٪ في DDH 2 O، وتخلط جيدا. تدور في أجهزة الطرد المركزي السريرية 6 دقائق، ز 1000x. وجمع البيض في الغضروف المفصلي (سوف هكتارهاء مظهر غائم)، في حين أن الحطام سوف بيليه.
- باستخدام ماصة نقل البلاستيك، تمتص البيض في حجم الحد الأدنى، ونقل إلى غير المصنف لوحات أجار NGM. ويمكن شطف أي بيض التمسك جانب أنبوب أسفل بلطف ونقل كذلك. غير المصنف واحد 10 سم لكل لوحة سلالة تحليل كاف.
- احتضان لوحات غير المصنف مع البيض بين عشية وضحاها (~ 16 ساعة) في 20 درجة مئوية. تنفيس عن لوحة لساعات القليلة الأولى لتجف من قبل ترك الغطاء قليلا لبضع ساعات، ولكن تأكد لتغطية بين عشية وضحاها.
- بعد الفقس، ونقل اليرقات L1 إلى أنبوب مخروطي 15 مل في بصل S (إضافة قليل مل S بصل إلى لوحة، دوامة، تصب في أنبوب). بيليه في أجهزة الطرد المركزي السريرية (3 دقائق، ز 1000x)، resuspend في حجم الحد الأدنى من بصل S، ونقل إلى 10 سم لوحات أجار NGM المصنف مع NA22 البكتيريا. 2 استخدام لوحات هنا للاطلاع على كل لوحة أصلية من الخطوة 1.1. احتضان الديدان حتى تصل إلى سن المطلوب.
- رصد الثقافات مرة أو مرتين في اليوم الواحد. إذا كانوا في خطر سو يتضورون جوعا، ونقل إلى لوحات NA22 الطازجة. للديدان N2 من النوع البري، ويسبق الموت جوعا من قبل تشكيل خط أو موجة من الديدان التي تنتقل عبر لوحة مثل الحيوانات تهاجر بشكل جماعي بعيدا عن مناطق الغذاء المنضب. مرة واحدة هذه الأشكال، سيتم الغذائية استنفدت تماما في غضون بضع ساعات.
- الديدان هي الآن جاهزة للالمناعية أو التصوير الحي. تحديد وتلطيخ الديدان في التعليق هو الأمثل لأنه لا يمكن تصوير أعداد كبيرة من الديدان على حالها بسهولة. تلطيخ الاجراءات بناء على فيني وRuvkun 3-6 بروتوكول أفضل من تجميد شق الإجراءات لأن هناك حاجة لأعداد كبيرة من الديدان للتصوير.
2. مبائر التصوير
- جبل الدود على الشرائح للتصوير مبائر. ضبط كثافة من الديدان إلى بضع مئات لكل ميكروليتر. جعل لوحة من الاغاروز 2٪ في S-القاعدية التي تحيط بها حلقة رقيقة من الفازلين لمنع تبخر أثناء التصوير (طبق عبر حقنة 3 مل مزودة إبرة قطع عيار 25). ماصة 1microliters قليل من التعليق على دودة زلة غطاء (استخدام مخدر إذا الديدان الحية التصوير)، وخفض لوحة الاغاروز على زلة غطاء، نشر الديدان بالتساوي على وسادة.
- حدد الديدان للتصوير. اختيار الديدان حيث نقاط الاشتباك العصبي التي تهم موجهة نحو هدف عدسة، مع تشريد شعاعي لا يزيد عن ± 45 درجة (حيث 0 درجة يعني التوجه مباشرة نحو الهدف). نفذ هذا التقييم بسرعة (بضع ثوان) لتجنب photobleaching. هو الأمثل لحجم الثقافات الأولية لضمان ما يكفي من الديدان سوف تلبي هذه المعايير الهندسية.
- استكمال التصوير مبائر للعينة. عينات مسطح نسبيا التي يمكن شملت داخل أبواب حوالي 14 0.4 ميكرون سميكة تحقيق أفضل النتائج. السرعة العالية، والصور منخفضة الدقة (512 × 512 بيكسل) هي كافية لسرعة جمع بيانات دقيقة. تجنب تشبع كاشف مع القوة المفرطة إشارة، وهذا سوف يسبب التقليل من مضانالإشارات.
3. آلية تحديد وتحليل الكتل متشابك فردية
- فتح ملفات الإخراج متعددة TIF من مجهر متحد البؤر باستخدام Volocity 4.0 (أو أعلى) والبرمجيات (PerkinElmer).
- محصول بعيدا المناطق من الصورة التي لا تحتوي على بنية الفوائد (صورة -> المسائل المركزية الموسعة -> المحاصيل إلى اختيار> اختيار منطقة ذات الاهتمام باستخدام 'حر عائد الاستثمار "أداة - -> عمليات؛ 2A الشكل). علما، والتركيز الموسعة تنتج إسقاط الطائرة Z-على شاشة الكمبيوتر للمساعدة في تحليل، ولكن لا يؤثر على البيانات الأساسية، وينطبق الشيء نفسه على التعديلات السطوع والتباين، إذا لزم الأمر).
- قياس طول منطقة تحليلها باستخدام أداة الخط. وسيتم احتساب طول الخط، وأضاف إلى جدول البيانات (الشكل 2B).
- تحديد الكائنات باستخدام "كائنات حسب الكثافة 'مرشح (المقاييس واسطة). تحديد عتبة مثل هذه التجمعات هي متشابكوأبرز وغير متشابك خلفية ليست (الشكل 2C). قد إدراج علامة 1 متشابك مستقلة المسمى مع لون آخر يساعد بشكل لا لبس فيه تحديد نقاط الاشتباك العصبي. نقاط الاشتباك العصبي نموذجي تتراوح بين بضعة لvoxels بضع مئات. تعيين العتبة مرة واحدة باستخدام عينة السيطرة، واستخدامها لجميع العينات اللاحقة. العتبة كل عينة على حدة هو أمر غير مقبول لأنه يقدم احتمال التحيز مجرب. ويتم اختيار الأشياء وجدولتها تلقائيا (الشكل 2D).
- ترتيب وتصدير البيانات. القضاء على الكائنات من 2 أو أقل voxels، لأن هذه عادة ما تكون بقع خلفية. يمكن القضاء على هذه من خلال تصفية أخرى، أو خلال تحليل لاحق. لتسهيل المصب إزالتها، وإعادة ترتيب ملف البيانات بواسطة "حجم الكائن إرادة بحيث كل مجموعة معا. تصدير البيانات في تنسيق CSV، والتي يمكن فتحها بواسطة Microsoft Excel أو برامج جداول البيانات الأخرى. وتنتج كل صورة من ملف واحد الانتاج.
- إذا Volocity الناعمةسلعة غير متوفرة، وسائل بديلة لتحليل Z-طائرة التوقعات للبيانات مبائر يمكن استخدام (المرجع على سبيل المثال. 7، أو تحليل اليدوي باستخدام يماغيج)، على الرغم من فقدان 3 الابعاد المعلومات (انظر المناقشة).
4. ممثل النتائج
وينبغي أن الأسلوب الكمي قدم يكون قادرا على التمييز بين السكان مجموعة من سطوع مختلفة وأحجام مختلفة. صور ممثل والبيانات الكمية المقابلة التي قدمت في الشكل (3) إظهار أمثلة على التمييز على أساس هذه المعايير. وكقاعدة عامة يجب أن النتائج تتوافق مع ما هو واضح للعين. في حالة مستقبلات UNC-49 GABA المناعية للنخاع العصب بطني من C. ايليجانس، جميع الحيوانات ظهرت عادة متشابهة جدا من حيث الحجم والنضج، ومجموع قيم مضان متشابك لمجموعة من خمسة ديدان (طبيعية لطول الحبل العصب تحليل) أظهرت الخطأ المعياري قيم حوالي 10٪ من ال 4 متوسط. قد طفرة جينية وعلاجات تجريبية أخرى (مثل التعرض للمخدرات) تغيير ليس فقط في حجم وقيم الكثافة وتوزيع الترددات من مجموعات متشابك، ولكن ربما التنموية للوقت الدورة والتزامن من الديدان، مما أدى إلى ارتفاع التقلبات. لكن يجب أن النتائج الكمية تعكس دائما ما يمكن أن يكون موضع تقدير بصريا وإذا لم يكن، والتفتيش من الصور والكائنات التي تم تحديدها من قبل Volocity ينبغي الكشف عن مكان وقوع الخطأ، واقتراح إجراءات تصحيحية مثل العتبة إعادة أو إزالة الكائنات مصطنع.

الشكل 1. إعداد جيم متزامن ويتم الحصول على ايليجانس الثقافات. الثقافات متزامن من هذا الإجراء لأنه C. الاعتقالات تنمية ايليجانس والمرحلة L1 اليرقات في حالة عدم وجود الغذاء، ويستأنف عند تقديم الطعام.
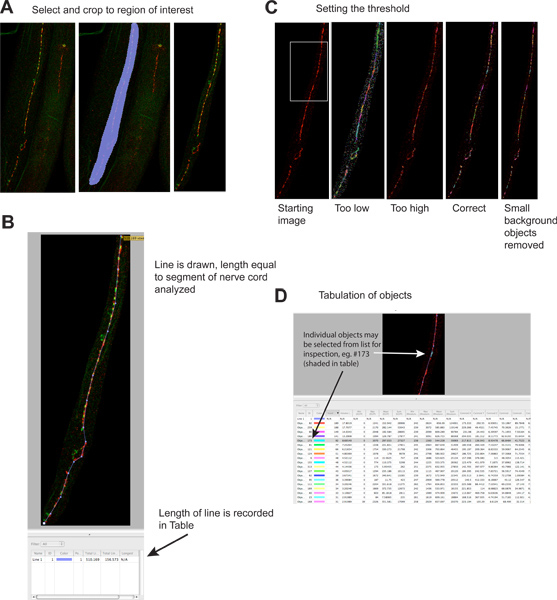
الشكل 2. تحديد الكميات من نقاط ومتشابك.
- وتفجرت مناطق خارجة من الصورة لتقليل حجم الملفات وزيادة الدقة. اليسار لوحة جهة يظهر بدءا صورة، وسط لوحة تظهر منطقة محددة، لوحة اليمين يظهر صورة بعد الحصاد. أحمر إشارة UNC-49 مستقبلات GABA المناعي، إشارة خضراء synaptobrevin-GFP (علامة قبل المشبكي) التي أعرب عنها في الخلايا العصبية قبل المشبكي GABA 4. انقر هنا لعرض أكبر شخصية .
- يتم رسم خط على طول العصب قطعة الحبل السري ليتم تحليلها، ويتم تسجيلها تلقائيا طوله في جدول النتائج. هذه المعلومات ضرورية لتطبيع البيانات متشابك نظرا لطول الحبل العصبي للتحليل، والتي يمكن أن تختلف عدة مرات إذا الديدان تصبح مجزأة خلال تلطيخ.www.jove.com/files/ftp_upload/4090/4090fig2blarge.jpg "الهدف =" _blank "> اضغط هنا لعرض أكبر شخصية.
- ويطبق عتبة لتحديد مجموعات متشابك الفردية. لوحة اليسار يظهر صورة قبل العتبة، وترد أمثلة على مستويات العتبة مختلفة في لوحات منفصلة (إشارة خضراء محذوف). ويصور كل كائن التعرف على صورة ملونة مثل منطقة. لاحظ التوافق بين الكتل ومتشابك واضح بصريا في اللوحة أقصى اليمين والمناطق الملونة على لوحة أقصى اليمين. انقر هنا لعرض أكبر شخصية .
- يتم سرد كل كائن التي تم تحديدها بشكل منفصل في جدول النتائج. ويمكن اختيار الكائنات الفردية، ويتم تسليط الضوء على الصورة للتفتيش عند الرغبة في ذلك. لاحظ أن الجدول يحتوي على معلومات عن أحمر ('رودامين') والأخضر ('EGFP') قنوات، وقناة المعلومات الخضراء مضللا منذ الكائنات كانتحدد بشكل صارم على اساس مضان أحمر. ويمكن أيضا أن يتم تنفيذ هذا التحليل على الصور لون واحد. اضغط هنا لعرض أكبر شخصية .
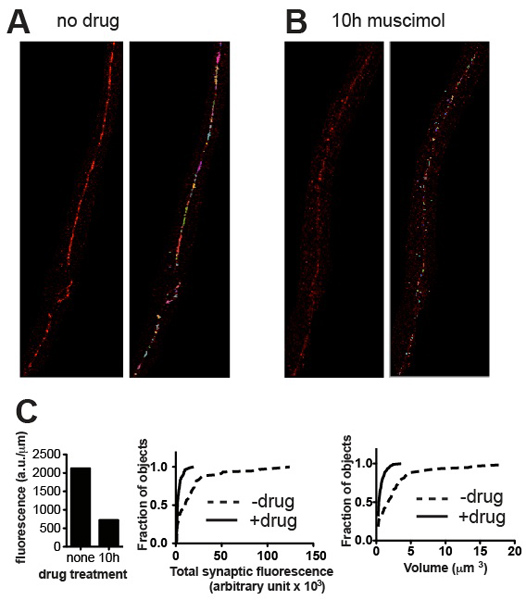
الشكل 3. نتائج ممثل. الميكروسكوب الممثل من البرية من نوع C. ايليجانس ملطخة لمستقبلات UNC 49-GABA قبل (A) وبعد (B) مع العلاج muscimol، ناهض مستقبلات GABA التي تسبب المستقبلات لتصبح downregulated بعد التعرض الطويل لوحات تظهر الصور تفجرت قبل (يسار) وبعد (يمين) العتبة وازالة بقع خلفية صغيرة. (ج) من مؤامرات المعلمات متشابك الكمي للعينات هو مبين في (أ) و (ب): مضان مجموع طبيعية لطول الحبل العصب (يسار)، ورسوم بيانية الاحتمال التراكمي للفرد المشبك محتوى مضان (وسط) والمشبك حجم (righر)، مما يدل على انخفاض كبير إحصائيا في محتوى متشابك وحجم الناجمة عن التعرض ناهض (ن = 60 نقاط الاشتباك العصبي للعلاج، ن 115 = نقاط الاشتباك العصبي للالمعاملة muscimol، P <0.001، كولموغوروف-سميرنوف اختبار http://www.physics.csbsju .edu / احصائيات / KS-test.html ).
Discussion
تم تصميم طريقة عرض هنا لاستخراج كمية متعددة المعلمة بيانات عن أعداد كبيرة من نقاط الاشتباك العصبي في C. ايليجانس، في حين تحقيق أقصى قدر من الاتساق ضمن مجموعات العلاج. ثلاث ميزات تسهم في تحقيق هذه الأهداف. أولا، يتم تنفيذ المناعية على السكان دودة متزامن للتأكد من ?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
فإن الكتاب أود أن أشكر ألف بنهام للمساعدة في تطوير البروتوكول. وقد تم تمويل هذا العمل من قبل المعاهد الوطنية للصحة منح NS06747 إلى BAB
Materials
| Name | Company | Catalog Number | Comments | ||||||
| اسم البرنامج | شركة | تعليق (اختياري) | |||||||
| Volocity V4.0 أو أعلى | PerkinElmer / Improvision | تحقق الأساسية الخاصة بك التصوير المحلية منشأة من أجل الوصول إلى هذا البرنامج. البرنامج التجريبي هو متاح على موقع PerkinElmer. يتطلب هذا الأسلوب فقط وحدة تحديد الكميات من Volocity. | |||||||
| الجدول 2. كواشف ومعدات معينة. | |||||||||
| |||||||||
| الجدول رقم 1. حلول. |
References
- Christensen, M. A primary culture system for functional analysis of C. elegans neurons and muscle cells. Neuron. 33, 503-514 (2002).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods Cell Biol. 48, 3-29 (1995).
- Bettinger, J. C., Lee, K., Rougvie, A. E. Stage-specific accumulation of the terminal differentiation factor LIN-29 during Caenorhabditis elegans development. Development. 122, 2517-2527 (1996).
- Davis, K. M. Regulated lysosomal trafficking as a mechanism for regulating GABAA receptor abundance at synapses in Caenorhabditis elegans. Mol. Cell Neurosci. 44, 307-317 (2010).
- Finney, M., Ruvkun, G. The unc-86 gene product couples cell lineage and cell identity in C. elegans. Cell. 63, 895-905 (1990).
- Rowland, A. M. Presynaptic terminals independently regulate synaptic clustering and autophagy of GABAA receptors in Caenorhabditis elegans. J. Neurosci. 26, 1711-1720 (2006).
- Burbea, M. Ubiquitin and AP180 regulate the abundance of GLR-1 glutamate receptors at postsynaptic elements in C. elegans. Neuron. 35, 107-120 (2002).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Oda, S., Tomioka, M., Iino, Y. Neuronal plasticity regulated by the insulin-like signaling pathway underlies salt chemotaxis learning in Caenorhabditis elegans. J. Neurophysiol. 106, 301-308 (2011).
- Sankaranarayanan, S. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- McDonald, N. A. Generation and functional characterization of fluorescent, N-terminally tagged CB1 receptor chimeras for live-cell imaging. Mol. Cell Neurosci. 35, 237-248 (2007).
- Shakiryanova, D. Synaptic neuropeptide release induced by octopamine without Ca2+ entry into the nerve terminal. Proc. Natl. Acad. Sci. U. S. A. 108, 4477-4481 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved