Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Автоматизированная количественная оценка Synaptic флуоресценции в
В этой статье
Резюме
Обилие рецепторов нейромедиатора группируются в синапсах сильно влияет синаптической силы. Этот метод количественной флуоресцентно-меченных рецепторов нейромедиатора в трех измерениях с одного синапса резолюцию С. Элеганс, Что позволило в сотни синапсов, быстро характеризуется в пределах одного образца без искажения, вносимые г-плоскости проекции.
Аннотация
Synapse strength refers to the amplitude of postsynaptic responses to presynaptic neurotransmitter release events, and has a major impact on overall neural circuit function. Synapse strength critically depends on the abundance of neurotransmitter receptors clustered at synaptic sites on the postsynaptic membrane. Receptor levels are established developmentally, and can be altered by receptor trafficking between surface-localized, subsynaptic, and intracellular pools, representing important mechanisms of synaptic plasticity and neuromodulation. Rigorous methods to quantify synaptically-localized neurotransmitter receptor abundance are essential to study synaptic development and plasticity. Fluorescence microscopy is an optimal approach because it preserves spatial information, distinguishing synaptic from non-synaptic pools, and discriminating among receptor populations localized to different types of synapses. The genetic model organism Caenorhabditis elegans is particularly well suited for these studies due to the small size and relative simplicity of its nervous system, its transparency, and the availability of powerful genetic techniques, allowing examination of native synapses in intact animals.
Here we present a method for quantifying fluorescently-labeled synaptic neurotransmitter receptors in C. elegans. Its key feature is the automated identification and analysis of individual synapses in three dimensions in multi-plane confocal microscope output files, tabulating position, volume, fluorescence intensity, and total fluorescence for each synapse. This approach has two principal advantages over manual analysis of z-plane projections of confocal data. First, because every plane of the confocal data set is included, no data are lost through z-plane projection, typically based on pixel intensity averages or maxima. Second, identification of synapses is automated, but can be inspected by the experimenter as the data analysis proceeds, allowing fast and accurate extraction of data from large numbers of synapses. Hundreds to thousands of synapses per sample can easily be obtained, producing large data sets to maximize statistical power. Considerations for preparing C. elegans for analysis, and performing confocal imaging to minimize variability between animals within treatment groups are also discussed. Although developed to analyze C. elegans postsynaptic receptors, this method is generally useful for any type of synaptically-localized protein, or indeed, any fluorescence signal that is localized to discrete clusters, puncta, or organelles.
The procedure is performed in three steps: 1) preparation of samples, 2) confocal imaging, and 3) image analysis. Steps 1 and 2 are specific to C. elegans, while step 3 is generally applicable to any punctate fluorescence signal in confocal micrographs.
протокол
1. Подготовка червей для работы с изображениями
Этот сегмент протокол основан на опубликованных C. Элеганс культуры методами 1,2 и изложена на рисунке 1.
- Рост червей на высоком пептон NGM агаром (10 см) с семенами Na22 E. бактерии кишечной палочки до почти голодали. Если окрашивания, одной пластины надежно производить достаточное количество червей в течение 1 человек пятно, с учетом потерь в пути, и жесткие критерии для выбора червей для работы с изображениями (см. часть 2).
- Урожай червей, поливая несколько мл DDH 2 0 на пластине, циркулируя кратко и заливки жидкости в 15 мл коническую трубку (повторите, если необходимо перевести большую часть червей в пробирку). Гранул в клинической центрифуге в течение 3 мин, 1000x г. Вымойте гранул 1-3x с DDH 2 O до супернатант ясно, удалить остатки бактерий. Использование пипетки полипропилена передачи удалить супернатантах, как черви придерживаться стекла(От этого шага вперед очень важно, чтобы свести к минимуму время между шаги, чтобы избежать потери жизнеспособности яйца).
- После последней стирки, Ресуспендируйте червь гранул в 5 мл щелочного раствора гипохлорита лизировать червей и выпуск яиц. Рок мягко, и исследовать трубы под микроскопом рассечения примерно раз в минуту. Когда около 50% червей лизируются (они появятся согнуты и взломан), прекратить лизис путем заполнения трубы сверху яйцом буфера, переворачивая несколько раз, и гранулирования в течение 3 мин, 1000x г. Лизис времени не должна превышать 5 мин.
- Удалить супернатант с передачей пипетку и промыть гранул 3 раза с яйцом буфера.
- Чтобы отделить яйца от мусора, они плавали на подушке на 30% сахарозы в DDH 2 O: после последней промывки с шагом 1.4, осторожно удалите супернатант и ресуспендируют осадок в 5 мл DDH 2 0. Добавьте 5 мл стерильного 60% сахарозы в DDH 2 O, и хорошо перемешать. Спиновая в клинической центрифуге 6 мин, 1000x г. Яйца будут собирать на мениске (они будут Хаве мутный вид), а мусор будет гранул.
- Использование пластиковой пипетки передачи поглощать яйца в минимальном объеме и передать unseeded пластин агара НГО. Любые яйца придерживаясь стороне трубки можно промыть осторожно и передается, как хорошо. Один 10 см unseeded пластины на штамм проанализированы достаточно.
- Инкубируйте unseeded пластины с яйцами в течение ночи (~ 16 часов) при 20 ° C. Вентиляционная пластина в течение первых нескольких часов, чтобы высушить его, оставив крышку немного не в течение нескольких часов, но обязательно, чтобы покрыть всю ночь.
- После вылупления, передает L1 личинок 15 мл коническую трубку в базальных S (добавить в базальной пластинке, вихревые несколько мл S, залить в трубку). Гранул в клинической центрифуге (3 мин, 1000x г), ресуспендируют в минимальном объеме базальной S и передачи до 10 см NGM агаром высевают с Na22 бактерий. Используйте 2 пластины здесь для каждого оригинальную пластинку, начиная с шага 1.1. Инкубировать до черви достигают желаемого возраста.
- Мониторинг культур один или два раза в день. Если они находятся в опасности ое голодали, передать свежее Na22 пластин. Для дикого типа червей N2, голода предшествует формирование линии или волна червей, который перемещается через пластину, животные мигрируют массово отдельно от пищевых продуктов, обедненных зон. После этого формы, пища будет полностью исчерпана в течение нескольких часов.
- Черви готовы для окрашивания или живые изображения. Крепление и окрашивание червей подвеска оптимальным, поскольку большое количество интактных черви могут быть отображены легко. Окрашивание процедуры, основанные на Финни и Ruvkun протокол 3-6 предпочтительнее замораживания взломать процедуры, потому что большое количество червей, необходимых для обработки изображений.
2. Конфокальной микроскопии
- Установите червей на слайдах для конфокальной микроскопии. Отрегулируйте плотность червей до нескольких сотен на микролитр. Сделать площадку на 2% агарозном в S-базальных окружен тонким кольцом вазелином для предотвращения испарения во время съемки (применяется по 3 мл шприца снабжены отсечки 25 иглы). ПипетироватьНесколько мкл червя подвески на покровное стекло (если использовать обезболивающий изображения живых червей), а также снизить площадку агарозы на покровное стекло, распространение червей равномерно по площадке.
- Выбор червей для работы с изображениями. Выберите червей, где синапсы интересы ориентированы на объектив с радиального смещения не более чем на ± 45 ° (при 0 ° означает, ориентированных непосредственно на цели). Выполнить эту оценку быстро (несколько секунд), чтобы избежать фотообесцвечивания. Масштабы начальной культур оптимизированы для обеспечения достаточного черви удовлетворить эти геометрические критерии.
- Заполните конфокальной микроскопии образца. Относительно плоских образцов, которые могут быть включены в около 14 0.4 мкм толстым слоем наилучшие результаты. Высокая скорость, низкое разрешение изображений (512 х 512 пикселей) достаточно для быстрого точного сбора данных. Избегайте насыщения детектора с чрезмерной силы сигнала, так как это приведет к занижению флуоресценциисигналов.
3. Автоматизированная идентификация и анализ отдельных кластеров Synaptic
- Открыто несколько выходных файлов TIF с использованием конфокальной микроскопии Volocity 4.0 (или выше) программного обеспечения (PerkinElmer).
- Урожая от областей изображения, которые не содержат структуры интереса (Image -> Расширенные Focus -> Выбрать сферу интересов с помощью "Freehand ROI" инструмент -> Действия -> Crop на выбор; Рисунок 2А). Обратите внимание, расширенный фокус производит г-плоскости проекции на экране компьютера, чтобы помочь Вашим анализом, но не влияет на исходные данные, то же самое относится и к яркости и контрастности, в случае необходимости).
- Измерьте длину области проанализированы с помощью Line Tool. Длина линии будет рассчитан и добавил к таблице данных (рис. 2В).
- Выявление объектов с помощью "объектов по интенсивности" фильтр (Измерения режим). Укажите порог, что синаптические кластероввыделены и не-синаптической фон не (рис. 2). Включение независимого синаптических маркером помечены другим цветом может помочь однозначно идентифицировать синапсов. Типичные синапсов варьироваться от нескольких до нескольких сотен вокселей. Установите порог один раз, используя контрольный образец, и использовать его для всех последующих образцах. Выделение каждого образца в отдельности неприемлемо, поскольку оно представляет потенциал для экспериментатора предвзятости. Объекты выбираются таблицы и автоматически (рис. 2D).
- Организовать и экспорт данных. Ликвидация объектов 2 или меньше вокселей, поскольку они, как правило фоне пятна. Они могут быть устранены путем дальнейшей фильтрации, или во время последующего анализа. Для облегчения удаления вниз по течению, отсортировать файл данных "размер объекта", так они будут все группы вместе. Экспорт данных в CSV формат, который можно открыть с помощью Microsoft Excel или другие программы электронных таблиц. Каждое изображение производит один выходной файл.
- Если Volocity мягкийПосуда недоступна, альтернативные методы для анализа Z-плоскости проекции конфокальной данные могут быть использованы (например, ссылка 7, или ручной анализ с использованием ImageJ), хотя в 3-мерном информация теряется (см. Обсуждение).
4. Представитель Результаты
Количественного метода, изложенного должны быть в состоянии различать кластер популяций разных яркости и разных объемов. Представитель изображения и соответствующие количественные данные представлены на рисунке 3 показаны примеры дифференциации на основе этих параметров. Как правило, результаты должны соответствовать тому, что видно на глаз. В случае UNC-49 ГАМК-рецепторов иммунной брюшной нервной С. Элеганс, все животные обычно оказались очень близки по размерам и степени зрелости, а общая синаптических флуоресценции значений для группы из пяти червей (нормированной на длину шнура нерв проанализировал) показали Стандартная ошибка значения около 10% от среднего 4. Генетические мутации и другие экспериментальные процедуры (например, лекарственного препарата) может изменить не только объем и значение интенсивности и частоты распределения синаптических кластеров, но, возможно, с развитием времени курс и синхронность червей, что приведет к повышению изменчивости. Однако количественные результаты всегда должны отражать то, что можно оценить визуально, и если нет, то проверка образов и объектов, определенных Volocity должны выявить, где произошла ошибка и предложить меры по исправлению положения, такие как повторное порога или удаление артефактного объектов.

Рисунок 1. Подготовка синхронных C. Элеганс культур. синхронных культур получены от этой процедуры, потому что C. Элеганс развития аресты и L1 личиночной стадии при отсутствии пищи, и возобновляется, когда пища вводится.
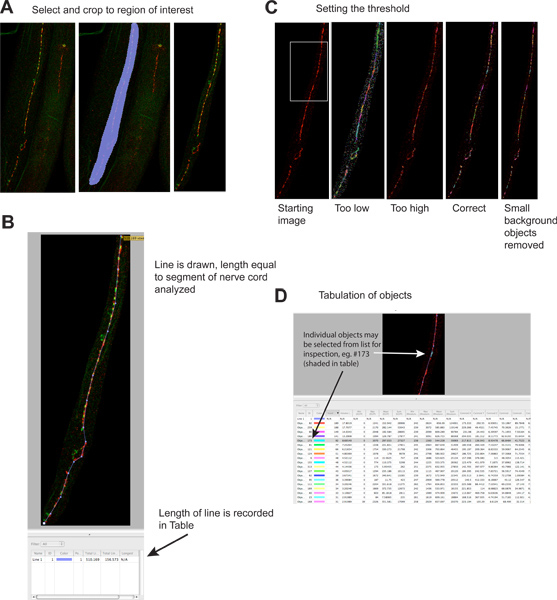
Рисунок 2. Количественный синаптических puncta.
- Посторонние области изображения обрезаются, чтобы уменьшить размеры файлов и увеличения специфичности. Левая панель показывает рукой, начиная изображения, средняя панель показывает выбранный регион, правая панель показывает изображение после обрезки. Красный сигнал UNC-49 ГАМК-рецепторов иммунофлюоресценции, зеленый сигнал synaptobrevin-GFP (пресинаптических маркеров), выраженные в пресинаптических ГАМК-нейронов 4. Нажмите здесь, чтобы увеличить рисунок .
- Линия длины отрезка нерва шнур должны быть проанализированы, а его длина автоматически записывается в таблице результатов. Эта информация необходима для нормализации синаптических данных из-за длины шнура анализируемых нерва, которая может изменяться в несколько раз, если черви станут фрагментированными, во время окрашивания.www.jove.com/files/ftp_upload/4090/4090fig2blarge.jpg "целевых =" _blank "> Нажмите здесь, чтобы увеличить цифру.
- Порог применяется для идентификации отдельных синаптических кластеров. Левая панель показывает изображение до порога, примеры различных уровней порога приведены в отдельной панели (зеленый сигнал опущен). Каждый выявленный объект изображен на картинке, как цветные области. Обратите внимание на соответствие между визуально очевидно синаптических кластеров в самой левой панели и цветных областей на самой правой панели. Нажмите здесь, чтобы увеличить рисунок .
- Каждый выявленный объект перечислены отдельно в таблице результатов. Отдельные объекты могут быть выбраны и выделены на изображение для проверки, если необходимо. Обратите внимание, что таблица содержит информацию для красного («родамин) и зеленый (« EGFP) каналов; зеленый канал информации может ввести в заблуждение, так как объекты былиопределены на основе строго по красной флуоресценции. Этот анализ также может быть выполнена на одном цветные изображения. Нажмите здесь, чтобы увеличить рисунок .
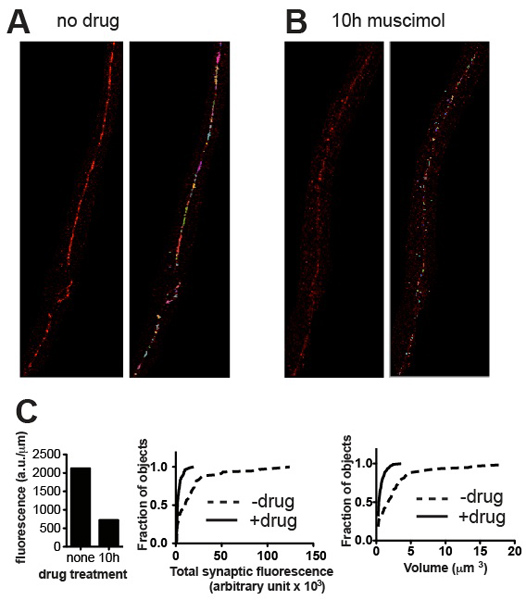
Рисунок 3. Представитель результаты. Представитель микрофотографии от дикого типа C. Элеганс окрашивали для UNC-49 ГАМК-рецепторов до (А) и после (б) лечение мусцимола, ГАМК-агонистов рецепторов, который вызывает рецепторов стать подавленные после длительной экспозиции. Панели показать обрезать изображения до (слева) и после (справа) порога и удаления небольших пятна фона. (C) Земельные участки количественных параметров синаптических образцах показано в (A) и (Б): общая флуоресценции, нормированные на нервы Длина шнура (слева) и кумулятивные гистограммы вероятности отдельного содержания флуоресценции синапс (в центре) и синапсов объема (Рогт), демонстрируя статистически значимое снижение синаптической содержание и объем индуцированных агонистами экспозиции (п = 60 синапсов для необработанной, п = 115 синапсов для мусцимола обработанные, р <0,001, Колмогорова-Смирнова http://www.physics.csbsju .edu / статистика / KS-test.html ).
Обсуждение
Метод, представленная здесь, предназначен для извлечения количественных многопараметрических данных для больших групп населения синапсов в C. Элеганс, при максимальном последовательности в группах. Три особенности способствуют достижению этих целей. Во-первых, окрашивания осущ?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить А. Benham за помощь в разработке протокола. Эта работа финансировалась NIH грант NS06747 к BAB
Материалы
| Name | Company | Catalog Number | Comments | ||||||
| Название программы | Компания | Комментарии (опционально) | |||||||
| Volocity v4.0 или выше | PerkinElmer / Improvision | Проверьте свои местные средства основного изображения для доступа к этим программным обеспечением. Демо-программа доступна на сайте PerkinElmer. Этот метод требует только количественное модуль Volocity. | |||||||
| Таблица 2. Специальные реагенты и оборудование. | |||||||||
| |||||||||
| Таблица 1. Решения. |
Ссылки
- Christensen, M. A primary culture system for functional analysis of C. elegans neurons and muscle cells. Neuron. 33, 503-514 (2002).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods Cell Biol. 48, 3-29 (1995).
- Bettinger, J. C., Lee, K., Rougvie, A. E. Stage-specific accumulation of the terminal differentiation factor LIN-29 during Caenorhabditis elegans development. Development. 122, 2517-2527 (1996).
- Davis, K. M. Regulated lysosomal trafficking as a mechanism for regulating GABAA receptor abundance at synapses in Caenorhabditis elegans. Mol. Cell Neurosci. 44, 307-317 (2010).
- Finney, M., Ruvkun, G. The unc-86 gene product couples cell lineage and cell identity in C. elegans. Cell. 63, 895-905 (1990).
- Rowland, A. M. Presynaptic terminals independently regulate synaptic clustering and autophagy of GABAA receptors in Caenorhabditis elegans. J. Neurosci. 26, 1711-1720 (2006).
- Burbea, M. Ubiquitin and AP180 regulate the abundance of GLR-1 glutamate receptors at postsynaptic elements in C. elegans. Neuron. 35, 107-120 (2002).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Oda, S., Tomioka, M., Iino, Y. Neuronal plasticity regulated by the insulin-like signaling pathway underlies salt chemotaxis learning in Caenorhabditis elegans. J. Neurophysiol. 106, 301-308 (2011).
- Sankaranarayanan, S. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- McDonald, N. A. Generation and functional characterization of fluorescent, N-terminally tagged CB1 receptor chimeras for live-cell imaging. Mol. Cell Neurosci. 35, 237-248 (2007).
- Shakiryanova, D. Synaptic neuropeptide release induced by octopamine without Ca2+ entry into the nerve terminal. Proc. Natl. Acad. Sci. U. S. A. 108, 4477-4481 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены