JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
에서 시냅틱 형광의 자동 부량
요약
시냅스에서 신경 전달 물질 수용체 클러스터의 풍부한 강력히 시냅스 강도에 영향을 미칩니다. 이 방법에서는 단일 시냅스 해상도로 가로, 세로, 높이로 fluorescently-라벨이 신경 전달 물질 수용체를 quantifies C. elegans, 시냅스 수백이 빠르게 Z-평면 투영에 의해 도입 왜곡없이 하나의 샘플 내에서 특성화 수 있도록.
초록
시냅스 강도는 presynaptic 신경 전달 물질 릴리스 행사 postsynaptic 응답의 진폭을 참조하고, 전반적인 신경 회로의 기능에 큰 영향을 미치고 있습니다. 시냅스 강도가 매우 postsynaptic 멤브레인에서 시냅스 사이트에서 클러스터된 신경 전달 물질 수용체의 풍부에 따라 달라집니다. 수용체 레벨이 발달 설립되며, 시냅스 소성 및 neuromodulation의 중요한 메커니즘을 나타내는 표면화된, subsynaptic, 그리고 세포 내 수영장, 사이 수용체 인신 매매에 의해 변경될 수 있습니다. synaptically-화된 신경 전달 물질 수용체 풍요로움을 계량하기위한 엄격한 방법은 시냅스 개발 및 소성을 공부하는 것이 필수적입니다. 그것이 아닌 시냅스 수영장에서 시냅스 구별, 그리고 시냅스의 다른 유형에 지역화된 수용체 인구들 사이에서 차별, 공간 정보를 유지하기 때문에 형광 현미경은 최적의 접근 방식이다. 유전자 모델 생물 Caenorhabditis elegan의은 특히 손상 동물의 네이티브 시냅스의 시험을 수 있도록 작은 크기와 상대의 신경 계통의 단순화, 투명성, 그리고 강력한 유전자 기술의 가용성으로 인해 이러한 연구에 가장 적합합니다.
여기에서 우리는 C.에 fluorescently-라벨이 시냅스 신경 전달 물질 수용체를 quantifying위한 방법을 제시 elegans. 그 주요 기능은 멀티 비행기 공촛점 현미경 출력 파일, tabulating 위치, 볼륨, 형광 강도 및 각 시냅스에 대한 전체 형광 세 차원에서 개별 시냅스의 자동 식별 및 분석입니다. 이 접근법은 공촛점 데이터의 Z-비행기 예측의 수동 분석을 두번 주요 장점이 있습니다. 공촛점 데이터 집합의 모든 비행기가 포함되어 있기 때문에 첫째, 어떤 데이터는 일반적으로 화소 농도의 평균이나 맥시멈을 토대로 Z-평면 투영을 통해 손실되지 않습니다. 시냅스의 둘째, 신분증은 자동이지만, 예전에 의해 검사를 수시냅스 다수의 데이터를 신속하고 정확하게 추출 수 있도록 데이터 분석 진행 등 perimenter. 샘플 당 시냅스 수천 수백 쉽게 큰 데이터를 생산하는 통계 능력을 극대화할 수 설정, 얻을 수있다. C를 준비하기위한 고려 사항 분석 및 치료 그룹 내에서 동물 간의 다양성을 최소화하기 위해 공촛점 이미징을 수행하기위한 elegans도 설명합니다. C를 분석하기 위해 개발된 있지만 elegans postsynaptic 수용체가이 방법은 실제로 synaptically-화된 단백질, 또는 개별 클러스터, puncta 또는 organelles에 현지되는 형광 신호의 모든 유형에 대해 일반적으로 유용합니다.
절차는 세 단계로 수행됩니다 : 1) 표본 2의 준비)를 공촛점 이미징, 그리고 3) 이미지 분석. 단계 1과 2는 C.에만 해당 elegans, 3 단계는 일반적으로 공촛점 micrographs에 작은 반점이있는 형광 신호에 적용할 수있는 동안.
프로토콜
1. 이미징에 대한 웜의 작성
프로토콜의이 세그먼트는 게시 C. 기반으로 elegans 문화 기술 1,2, 그리고이 그림 1에 설명되어있다.
- NA22 E. 높은 펩톤 NGM 한천 플레이트 (10 ㎝) 씨앗에 벌레를 성장 대장균 박테리아는 거의 굶어까지. immunostaining 경우, 한 접시가 안정적으로 길을 따라 계정 손실을 고려하고, 영상에 대한 웜 (파트 2 참조)을 선택하는 데 사용되는 엄격한 기준, 얼룩 한 개인에 대한 충분한 벌레를 생산합니다.
- 접시에 ddH 2 0 몇 ML를 따르고 의한 수확 웜, 간략하게 소용돌이 치는, 그리고 15 ML 원뿔 튜브 (반복 튜브에 벌레의 대부분을 전송하기 위해 필요한 경우)에 액체를 붓는. 3 분, 1000x g 대한 임상 원심의 펠릿. 뜨는가 잔류 세균을 제거해도 좋다 때까지 ddH 2 O로 1 배 펠릿 씻으십시오. 벌레가 유리에 집착로 supernatants를 제거하는 폴리 프로필렌 전송 pipettes를 사용하여(이 단계 이후부터 그것은 계란 생존의 손실을 방지하기위한 조치 사이의 시간을 최소화하는 것이 중요합니다.)
- 마지막 세척 후 resuspend 웜 펠렛은 5 ML 알칼리성 염소산 용액에 웜 및 릴리스 계란을 lyse합니다. 부드럽게 바위, 약 한 분당 해부 현미경 하에서 튜브를 검사합니다. 벌레의 약 50 %가 (그들은 구부 러와 오픈 깨진 나타납니다) lysed 때, 계란 버퍼, 반전 여러 번으로 맨 위로 튜브를 충전하고, 3 분, 1000x g을 위해 pelleting하여 용해를 종료할 수 있습니다. 용해 시간은 5 분 초과할 수 없습니다.
- 전달 피펫으로 뜨는 제거하고 계란 버퍼와 함께 펠릿 배 씻는다.
- 파편으로부터 계란을 분리하려면 ddH 2 O의 30 % 자당의 쿠션에 흘려 보내곤 : 1.4 단계에서 최종 세척 후 신중 5 ML ddH 2 0에서 뜨는 및 resuspend 펠릿를 제거합니다. ddH 2 O 5 ML 멸균 60 % 자당을 추가하고 잘 섞는다. 임상 원심 분리기로 6 분, 1000x G를 봐. 계란은 (그들이 저기에됩니다 초승달 모양으로 수집합니다) 흐린 모양이 있어요, 파편 펠릿 하겠읍니다.
- 플라스틱 전송 피펫을 사용하여 최소한의 볼륨에 계란을 빨고 unseeded NGM 한천 플레이트로 전송합니다. 튜브의 측면을 지키는 모든 계란이 부드럽게 아래로 씻어서 잘으로 전송할 수 있습니다. 한 10cm는 분석 스트레인 당 플레이트가 충분 unseeded.
- 20 하룻밤 달걀 (~ 16 시간) ° C.로 unseeded 번호판을 품어 몇 시간 동안 약간 떨어져 뚜껑을 떠나는하여 건조 처음 몇 시간 동안 번호판을 빼낼하지만 하룻밤 사이에 충당해야합니다.
- 부화 후, S의 자연적으로 흐르는 것과, 반사적으로 흐르는에서 15 ML 원뿔 튜브 (관에 부어, 몇 ML S 플레이트에 자연적으로 흐르는 것과, 반사적으로 흐르는 소용돌이 추가)로 L1의 유충을 전송. 임상 님의 자연적으로 흐르는 것과, 반사적으로 흐르는 중 최소 볼륨에서 resuspend 원심 분리기 (3 분, 1000x G), 그리고 NA22 박테리아 놓는 10cm의 NGM 한천 플레이트로 전송에서 펠릿. 1.1 단계에서 각 원본 판은 여기 두 접시를 사용합니다. 벌레가 원하는 연령에 도달할 때까지 알을 품다.
- 한 두 번 하루에 문화를 모니터링합니다. 그들은 위험 O에있는 경우F 굶주리고, 신선한 NA22 플레이트로 전송. 야생 형 N2의 웜 들어, 기아는 동물들이 멀리 식품 고갈 영역에서 실내 masse을 마이 그 레이션으로 번호판을 가로질러 이동하는 벌레의 라인이나 파도의 형성에 의해 선행된다. 이 양식되면, 음식 완전히 몇 시간 이내에 소진됩니다.
- 웜 지금 immunostaining 또는 라이브 이미징을위한 준비가되어 있습니다. 그대로 웜 다수가 쉽게 몇 군데 수 있기 때문에 문제점을 해결하는 서스펜션의 벌레를 더럽히는 것은 최적입니다. 웜 다수가 영상에 필요한되기 때문에 Finney와 Ruvkun 프로토콜 3-6을 바탕으로 염색법 절차는 동결 균열 절차 바람직합니다.
2. 공촛점 이미징
- 공촛점 이미징을위한 슬라이드에 벌레를 탑재합니다. microliter 당 몇 백에 벌레의 밀도를 조정합니다. 관련 2퍼센트 아가로 오스의 패드를 만들어 S-기저 (컷 - 오프 25 게이지 바늘로 장착되어 3 ML에 주사기를 통해 적용) 이미징 동안 증발을 방지하기 위해 바셀린의 얇은 고리에 둘러싸여. 를 피펫커버 슬립 진입 웜 정지 몇 microliters은 (영상 라이브 웜 경우 마취제를 사용하여), 그리고 커버 슬립에 아가로 오스 패드를 낮추고, 패드 위에 고르게 웜 확산.
- 이미징에 대한 웜을 선택합니다. ± 45 ° (0 °가 직접 목표 방향으로 지향적인 의미 임)보다 관심이 시냅스는 더 이상의 방사상 변위와 함께 객관적인 렌즈쪽으로 방향 웜을 선택합니다. photobleaching 피하기 위해 (몇 초) 신속하게 이러한 평가를 수행합니다. 초기 문화의 규모는 충분한 웜 이러한 기하학적인 기준을 충족하도록 최적화되어 있습니다.
- 표본의 공촛점 이미징을 완료합니다. 0.4 약 14 μm의 두께 구역 내에 포함하고 있습니다 비교적 평평한 샘플은 최상의 결과를 생산하고 있습니다. 높은 속도, 낮은 해상도 이미지 (512 X 512 픽셀) 급속한 정확한 데이터 수집을위한 충분한입니다. 이것은 형광의 싼 견적을 일으킬하므로 포화에게 과도한 신호 강도와 검출기를 피하십시오신호.
3. 개인 시냅틱 클러스터의 자동 식별 및 분석
- 오픈 멀티 TIF 출력 Volocity 4.0 (이상) 소프트웨어 (PerkinElmer)를 사용 공촛점 현미경에서 파일.
- 자르기 떨어진 관심의 구조가 포함되지 않은 이미지의 영역 (이미지 -> 확장 포커스 -> 작업 - - '자유형 투자 수익 (ROI)'도구를 사용하여 관심> 선택 영역 선택으로 돌아가기> 자르기, 그림 2A). 참고 확장 초점은 분석을 돕기 위해 컴퓨터 화면 Z-평면 투영을 생산하지만, 기본 데이터에 영향을주지 않으며 동일, 필요한 경우) 밝기 및 대비 조정을위한 사실이다.
- 선 도구를 사용하여 분석 영역의 길이를 측정합니다. 라인의 길이를 계산하고 데이터 테이블 (그림 2B)에 추가됩니다.
- 필터 (측정 모드) '강도에 의해 객체'를 사용하여 개체를 식별합니다. 시냅스 클러스터가 그러한 한계를 지정강조와 비 시냅스 배경은 (그림 2C)되지 않습니다. 다른 색상으로 표시하는 독립적인 시냅스 마커의 포함은 시냅스를 식별 unambiguously 도움이 될 수 있습니다. 전형적인 시냅스는 몇에서 몇 백 voxels로 다양합니다. 컨트롤 샘플을 사용하여 한번 임계값을 설정하고, 이후의 모든 샘플을 위해 사용합니다. 그것이 실험자 바이어스의 가능성을 소개하기 때문에 각 예제를 Thresholding 것은 별도로 받아 들일수 없죠. 개체가 선택되고 (그림 2D) 자동으로 표로하고 있습니다.
- 정렬 및 데이터를 내보냅니다. 이들은 보통 배경 점들 때문에, 2 개 이하 voxels의 개체를 제거합니다. 이러한 추가적인 필터링에 의해, 또는 후속 분석하는 동안 제거될 수 있습니다. '개체 크기'하여 제거 하류, 다시 정렬 데이터 파일을 촉진하기 때문에 그들은 모두 그룹이 함께합니다. Microsoft Excel 또는 다른 스프레드 시트 프로그램에서 열 수 CSV 형식에서 데이터를 내보냅니다. 각 이미지는 하나의 출력 파일을 생성합니다.
- 만약 Volocity의 소프트도자기를 사용할 수 없습니다, 다른 방법은 3 차원 정보가 손실됩니다 있지만 (토론 참조) (예 : 심판. 7 또는 ImageJ를 사용하여 수동 분석) 활용할 수 있습니다 공촛점 데이터의 Z-비행기 전망을 분석하는 것입니다.
4. 대표 결과
제시 부량 방식은 서로 다른 밝기와 다른 볼륨의 클러스터 인구를 구분할 수 있어야합니다. 그림 3에 제시된 대표 이미지와 해당 양적 데이터는 이러한 매개 변수에 기초하여 차별의 예를 보여줍니다. 일반적으로 결과는 눈에 분명 무엇을 따라야한다. C의 복부 신경 코드를 immunostaining UNC-49 GABA 수용체의 경우 elegans, 모든 동물은 일반적으로 크기와 성숙에 매우 유사한 나타나 다섯 웜의 그룹 (분석 신경 코드의 길이로 정규화)에 대한 총 시냅스 형광 값은 표준 오류를 보여주 평균 4의 약 10 %의 가치. 유전자 돌연변이 및 기타 실험적인 트리 트먼트 (예 : 약물 노출) 볼륨과 강도 가치와 시냅스 클러스터의 주파수 분배뿐만 아니라 변경할 수 있지만, 아마도, 시간 코스와 웜의 synchrony 발달은 높은 변화로 이어지는. 그러나 정량 결과는 항상 오류가 발생하고 다시 thresholding 또는 artefactual 객체의 제거 등 시정 조치를 제안하는 위치를 공개해야 Volocity으로 식별 이미지와 개체의 검사, 시각 및이 아니라면 감상할 수 있습니다 무엇 반영한다.

1 그림. 동기식 C.의 작성 elegans 문화. 동기 문화가이 과정에서 얻은되어 있기 때문에 C. elegans 개발 체포 및 식품의 부재에서 L1 애벌레의 무대, 그리고 음식이 소개되었을 때 다시 시작합니다.
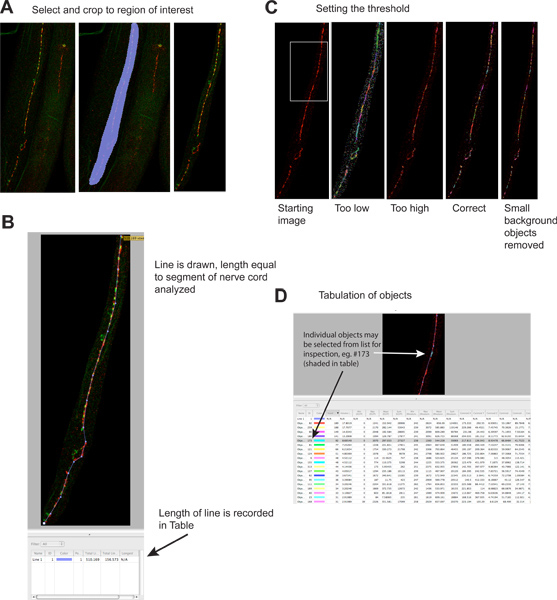
그림 2. 시냅스 puncta의 Quantitation.
- 이미지의 필요없는 영역은 파일 크기를 줄이고 특이성을 높이기 위해 자른있다. 왼쪽 패널은 이미지를 시작 보여주고, 중간 패널은 선택된 영역을 보여주는, 오른쪽 패널 자르기 후 이미지를 보여줍니다. 빨간 신호가 UNC-49 GABA 수용체 immunofluorescence이며, 녹색 신호가 presynaptic GABA 뉴런 4에서 표현 synaptobrevin-GFP (presynaptic 마커)입니다. 큰 그림을 보려면 여기를 누르십시오 .
- 선 분석되는 신경 코드 세그먼트의 길이를 그려 있으며, 그 길이가 자동으로 결과를 테이블에 기록됩니다. 이 정보는 벌레가 염색법 도중에 조각되어있다면 몇 배 다를 수 analyzable 신경 코드의 길이로 인해 시냅스 데이터를 정상화하는 데 필요합니다.www.jove.com/files/ftp_upload/4090/4090fig2blarge.jpg "대상 ="_blank "> 큰 그림을 보려면 여기를 클릭하십시오.
- 임계값은 개별 시냅스 클러스터를 식별하는 데 적용됩니다. 왼쪽 패널 thresholding 전에 이미지를 보여주고, 다른 thresholding 수준의 예제는 별도의 패널 (녹색 신호가 생략)에 표시됩니다. 각 확인된 개체는 색 영역으로 이미지 그려져 있습니다. 가장 왼쪽 패널에서 시각적으로 확연히 시냅스 클러스터와 가장 오른쪽 패널의 컬러 영역 간의 통신을 확인합니다. 큰 그림을 보려면 여기를 누르십시오 .
- 각 확인된 개체는 결과 테이블에 별도로 나열됩니다. 개별 개체가 선택될 수 있으며, 원하는 경우 검사 이미지를 강조 표시됩니다. 저 테이블은 빨간색 ( 'rhodamine')과 녹색 ( 'EGFP') 채널에 대한 정보가 포함되어 있습니다; 객체 였을 때부터 녹색 채널 정보는 잠재적으로 잘못된 것입니다엄격히 적색 형광을 기반으로 밝혀졌습니다. 이 분석은 또한 하나의 컬러 이미지에서 수행됩니다. 큰 그림을 보려면 여기를 누르십시오 .
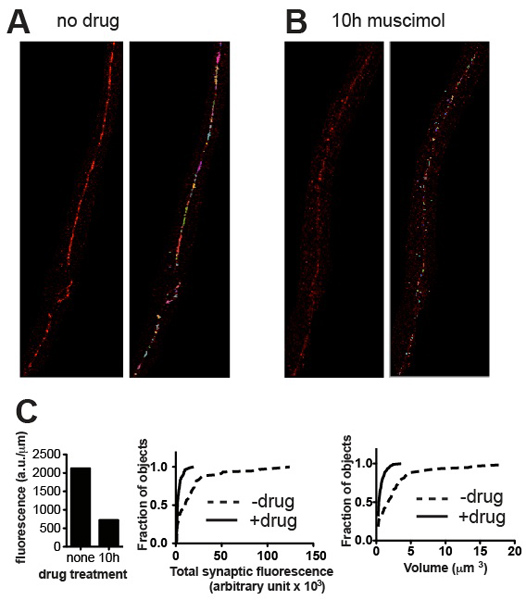
그림 3. 대표 결과입니다. 대표 micrographs 야생 형 C.부터 전에 UNC-49 GABA 수용체에 대해 묻다 elegans ()와 muscimol, 장기 노출 후 downregulated 될 수용체를 일으키는 GABA 수용체 작용제와 (B) 치료 후. 패널은 전 (왼쪽)와 (오른쪽) thresholding과 작은 배경 얼룩의 제거 후 자른 이미지를 보여줍니다. (C)과 같이 표본에 대한 정량 시냅스 매개 변수의 음모 (A)와 (B) : 총 형광 용기는 코드 길이 (왼쪽) 및 누적 확률 histograms 개별 시냅스의 형광 컨텐츠 (가운데)와 시냅스 볼륨 (맞로 정규화T), 작용제 노출 (muscimol-치료를위한 치료, N = 115 시냅스를위한 n은 = 60 시냅스에 의해 유도된 시냅스 내용과 볼륨에서 통계적으로 의미있는 감소를 시연, P <0.001, Kolmogorov - 스미 르 노프 검사 http://www.physics.csbsju .edu / 통계 / KS-test.html ).
토론
여기에 제시된 방법은 C.에있는 시냅스의 대규모 인구에 대한 정량 멀티 파라미터 데이터를 추출하도록 설계되었습니다 elegans, 치료 그룹 내에서 일관성을 극대화하면서. 세 가지 특징은 이러한 목적에 기여한다. 첫째, immunostaining 모든 동물들이 같은 나이가되도록 동기 웜 집단에서 수행됩니다. 표현 수준의 발달 규정 실험적 치료의 효과를 흐릿하게 수 있기 때문에이 단계는 중요?...
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
저자 프로토콜의 개발 지원을위한 A. Benham 감사드립니다. 이 작품은 BAB에 NIH 교부금 NS06747 추진하는 사업
자료
| Name | Company | Catalog Number | Comments | ||||||
| 소프트웨어의 이름 | 회사 | 댓글 (옵션) | |||||||
| Volocity V4.0 이상 | PerkinElmer / Improvision | 이 소프트웨어에 액세스하려면 로컬 이미징 핵심 시설을 확인합니다. 데모 소프트웨어는 PerkinElmer 웹사이트에서 사용할 수 있습니다. 이 방법은 Volocity만을 Quantitation 모듈이 필요합니다. | |||||||
| 표 2. 특정 시약 및 장비. | |||||||||
| |||||||||
| 표 1. 솔루션. |
참고문헌
- Christensen, M. A primary culture system for functional analysis of C. elegans neurons and muscle cells. Neuron. 33, 503-514 (2002).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods Cell Biol. 48, 3-29 (1995).
- Bettinger, J. C., Lee, K., Rougvie, A. E. Stage-specific accumulation of the terminal differentiation factor LIN-29 during Caenorhabditis elegans development. Development. 122, 2517-2527 (1996).
- Davis, K. M. Regulated lysosomal trafficking as a mechanism for regulating GABAA receptor abundance at synapses in Caenorhabditis elegans. Mol. Cell Neurosci. 44, 307-317 (2010).
- Finney, M., Ruvkun, G. The unc-86 gene product couples cell lineage and cell identity in C. elegans. Cell. 63, 895-905 (1990).
- Rowland, A. M. Presynaptic terminals independently regulate synaptic clustering and autophagy of GABAA receptors in Caenorhabditis elegans. J. Neurosci. 26, 1711-1720 (2006).
- Burbea, M. Ubiquitin and AP180 regulate the abundance of GLR-1 glutamate receptors at postsynaptic elements in C. elegans. Neuron. 35, 107-120 (2002).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Oda, S., Tomioka, M., Iino, Y. Neuronal plasticity regulated by the insulin-like signaling pathway underlies salt chemotaxis learning in Caenorhabditis elegans. J. Neurophysiol. 106, 301-308 (2011).
- Sankaranarayanan, S. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- McDonald, N. A. Generation and functional characterization of fluorescent, N-terminally tagged CB1 receptor chimeras for live-cell imaging. Mol. Cell Neurosci. 35, 237-248 (2007).
- Shakiryanova, D. Synaptic neuropeptide release induced by octopamine without Ca2+ entry into the nerve terminal. Proc. Natl. Acad. Sci. U. S. A. 108, 4477-4481 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유