需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
突触荧光自动定量
摘要
强烈的大量聚集在突触的神经递质受体影响突触强度。这种方法量化单突触决议的荧光标记的神经递质受体在三个层面 C。线虫,让数百个突触被迅速的特点是在一个单一的样本没有推出Z-平面上的投影的扭曲。
摘要
突触的强度是指突触突触前神经递质释放的事件的反应幅度,并有一个整体的神经电路功能产生重大影响。突触强度严重依赖于大量聚集在突触的突触后膜部位的神经递质受体。受体水平的发展,建立和受体之间贩运表面本地化,突触,细胞内池代表突触可塑性和神经调节的重要机制,可以通过改变。严格的方法来量化本地化的突触神经递质受体的丰度是必不可少的,以研究突触的发展和可塑性。荧光显微镜是一个最佳的方法,因为它保留了空间信息,区分从非突触池的突触,和本地化为不同类型的突触受体人口之间的歧视。遗传模式生物线虫elegans是特别适合这些研究中,由于体积小,相对简单的神经系统,其透明度,并提供强大的基因技术,使本地完整的动物突触检查。
在这里,我们提出了一个定量荧光标记C.突触神经递质受体的方法线虫 。其主要特点是多面的共聚焦显微镜输出文件,制表位置,体积,荧光强度,并为每个突触的总荧光三个维度的单个突触的自动识别和分析。这种方法有两个超过手册z平面聚焦数据预测分析的主要优点。首先,因为每一个聚焦数据集平面,没有数据丢失通过Z-平面上的投影,通常是基于像素的强度平均值或最大值。其次,识别突触是自动化的,但可以通过前检查perimenter作为数据分析所得,允许快速,准确地从大量的突触中提取数据。数百数千突触每个样品可以很容易地获得,产生大量的数据集,以最大限度地提高统计能力。注意事项准备C。进行分析,并进行聚焦成像,以尽量减少动物在治疗组之间的变异线虫进行了讨论。尽管分析C。线虫突触后受体,这种方法通常是有用任何突触本地化的蛋白质,事实上,任何荧光信号,定位于离散集群,puncta,或细胞器的类型。
执行过程中的三个步骤:1)制备样品,2)聚焦成像,和3)图像分析。具体到 C步骤1和2 线虫 ,而第3步是普遍适用于任何点状共聚焦显微镜的荧光信号。
研究方案
1。成像蠕虫的制备
这部分协议的基础上发表C.线虫培养技术1,2, 图1中概述。
- 生长在高的蛋白胨NGM的琼脂板(10厘米)播种与NA22 ... E.蠕虫大肠杆菌的细菌,直到近饿死。染色,如果一个板块将可靠地生产出足够的蠕虫1个人污点,一路上,考虑损失和用于选择成像蠕虫(见第2部分)的严格标准。
- DDH 2 0几毫升倾吐板丰年虫,简要纷飞,液体倒入15毫升锥形管(如果必要的转移大部分的蠕虫管重复)。颗粒为3分,1000倍Ğ临床离心机。 DDH 2 O的清洗颗粒1-3X,直到上清液是明确的,以除去残留的细菌。使用聚丙烯转移移液器去除上清,蠕虫坚持以玻璃(从这个步骤开始,这是关键,以尽量减少步骤之间的时间,以避免在卵子活力的损失)。
- 最后一次洗涤后,悬浮的蠕虫病毒颗粒5毫升碱性次氯酸钠溶液溶解蠕虫和释放卵子。轻轻摇动,并检查管解剖显微镜下每分钟一次。当约50%的蠕虫裂解(他们会出现弯曲和破开),终止灌装管顶端鸡蛋缓冲,翻转几次,3分钟,1000XĞ造粒裂解。溶解时间不得超过5分钟。
- 用移液管取出上清液,用鸡蛋缓冲颗粒3X。
- 分开碎片鸡蛋,漂浮在DDH 2 O的 30%蔗糖垫:从1.4步的最后一次洗涤后,小心地取出5毫升DDH 2 0上清,重悬沉淀。加入5毫升无菌DDH 2 O的 60%的蔗糖,拌匀。在临床离心机旋转6分钟,Ğ1000倍。鸡蛋会收集半月板(他们将哈VE的外观阴天),而碎片会沉淀。
- 使用塑料移液管,吸鸡蛋在一个最小的体积,并转移到非种子选手NGM的平板。坚持管侧的任何鸡蛋,可冲洗下来轻轻地转移以及。一个10厘米非种子选手,每盘分析应变是足够的。
- 鸡蛋隔夜(16小时)在20°C孵育的非种子选手板发泄板的前几个小时,干它留下了几个小时的盖子稍微偏离,但一定要覆盖过夜。
- 孵化后,转让的L1幼虫在S基底的圆锥形管15毫升(添加一个几毫升S基底板,漩涡,倒入管)。佩莱在临床离心机(3分,1000倍Ğ)悬浮在体积最小的S基底,并转移至10厘米NGM的琼脂板NA22 ...细菌接种。这里每个步骤1.1原板使用2板。孵育蠕虫,直到达到所需的年龄。
- 监测每天一次或两次的文化。如果他们是在危险Øf挨饿,转移到新鲜NA22 ...板。对于野生型N2蠕虫,饥饿之前,整个板块移动作为动物迁移大批远离食品耗尽区形成了一条线或波蠕虫。食品一旦这种形式,将在几个小时内完全耗尽。
- 蠕虫现在准备染色或实时成像。悬浮液中的固定和染色蠕虫是最理想的,很容易因为大量完整的蠕虫可以成像。染色方法的基础上芬尼和Ruvkun的协议3-6冻结的破解程序是可取的,因为需要大量的蠕虫成像。
2。共聚焦成像
- 装入上聚焦成像幻灯片的蠕虫病毒。蠕虫密度调整到每微升几百。使在2%琼脂糖垫的S-基底四周环薄薄的凡士林,以防止在成像蒸发(通过3毫升装上了截止25号针头注射器适用)。吸取1蠕虫悬挂几微升到盖玻片(使用麻醉剂,如果成像活虫),降低到盖玻片的琼脂糖垫,遍布垫的蠕虫均匀。
- 选择蠕虫成像。蠕虫利益的突触是面向物镜,没有更多的径向位移,超过±45°(0°是指直接朝着目标导向)选择。快速执行此评估(几秒钟),以避免漂白。初步培养规模进行了优化,以确保足够的蠕虫将满足这些几何条件。
- 完成标本共聚焦成像。相对平坦的样品,可在约14个0.4微米厚的部分包含产生最好的结果。高速,低分辨率图像(512 x 512像素)有足够的快速准确的数据采集。避免饱和过度的信号强度探测器,因为这将导致低估荧光信号。
3。个体突触集群的自动识别和分析
- 开放式多TIF共聚焦显微镜使用,Volocity 4.0(或更高)软件(珀金埃尔默)的输出文件。
- 作物以外地区的形象,不包含利益结构(图片- >扩展聚焦- - >动作- >使用“写意的投资回报率的工具的兴趣选择面积>作物以选择; 图2A)。注意,扩展重点在电脑屏幕上产生的z平面的投影来帮助你分析,但不影响基础数据;同样是真实的亮度和对比度调整,如果必要的话)。
- 使用直线工具分析测量的长度。将计算该行的长度,并添加到数据表( 图2B)。
- 识别物体使用强度对象的过滤器(测量模式)。突触集群指定一个阈值强调和非突触的背景是不是( 图2C)。列入用另一种颜色标记一个独立的突触标记可能有助于明确确定的突触。典型的突触范围从几个到几百个像素。设置阈值,一旦使用控制样品,并用它为所有后续的样品。阈值每个样品分别是不可接受的,因为它引入了实验者偏见的潜力。对象被选中自动汇总( 图2D)。
- 安排和导出数据。消除2个或更少的像素的对象,因为这些通常是背景斑点。这些都可以通过进一步筛选淘汰,或在随后的分析。 “对象大小”,以方便他们搬迁下游,重新排序的数据文件,所以他们将所有组。在CSV格式,可以通过Microsoft Excel或其他电子表格程序打开导出的数据。每个图像产生一个输出文件。
- 如果Volocity软洁具是不可用,替代的方法,Z平面聚焦数据分析预测,可利用(如文献。7,或使用ImageJ的手动分析),虽然3维信息丢失(见讨论)。
4。代表结果
量化的方法应该是能够区分不同亮度和不同的卷集群种群。 图3中的代表图像和相应的定量数据表明这些参数的基础上分化的例子。作为一般规则,结果应符合什么是显而易见的眼睛。在UNC-49 GABA的免疫受体的腹神经索C 的情况下线虫 ,所有的动物通常出现在规模和成熟度非常相似,一组五个蠕虫(归分析神经线的长度)的总突触的荧光值显示标准错误值约10%的平均4。基因突变和其他试验性治疗(如药物暴露)可能会改变,不仅数量和强度值和突触集群频率分布,但可能发展的时间进程和同步的蠕虫,从而导致更高的变异。然而,定量结果应该总是反映什么可以欣赏视觉的图像,Volocity确定应该显示发生错误的位置,并提出纠正措施,如阈值或去除不真实对象的对象,如果没有,检查。

图1。准备同步C.从这个过程中得到的文化。同步文化,因为C。线虫逮捕和发展的L1幼虫阶段在没有食物的情况下,恢复食物时介绍。
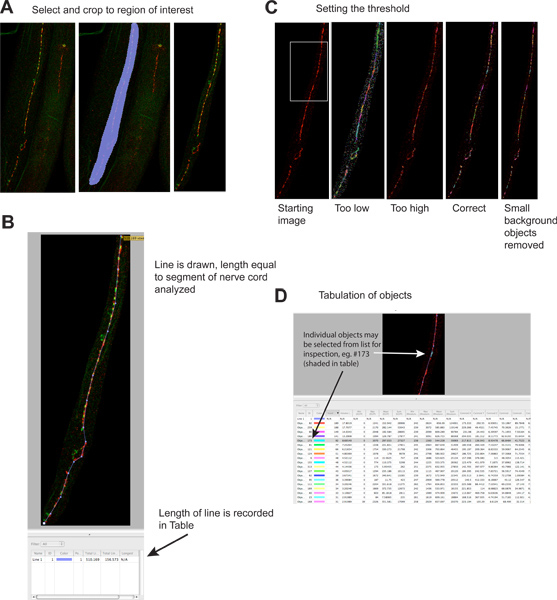
图2。定量突触puncta。
- 外来地区的形象出现,以减少文件大小和增加特异性。左手面板显示图像开始,中间面板显示选择区域,右侧面板显示图像后种植。红色信号是UNC-49 GABA受体免疫,绿色信号是突触的绿色荧光蛋白(突触标记)表示GABA的神经元在突触前4。 点击这里查看大图 。
- A线的神经线部分进行分析得出的长度,其长度将被自动记录在结果表中。这个信息是必要的正常化由于突触数据分析的神经线的长度,它可以改变数倍,如果蠕虫变得支离破碎,在染色。www.jove.com/files/ftp_upload/4090/4090fig2blarge.jpg“目标=”_blank“>点击这里查看大图。
- 阈值用于识别单个突触集群。左侧面板显示图像前阈值;不同的阈值水平的例子是在单独的面板(绿色信号略)所示。每个标识的对象是作为一个彩色的地区形象的描绘。注意最左边的面板在视觉上明显的突触集群和最右边的面板上的彩色地区之间的对应关系。 点击这里查看大图 。
- 在结果表中,每一个确定的对象,单独列出。可以选择单个对象,对图像进行检查,如果需要强调的。注意:该表中包含的信息为红色(罗丹明)和绿色(绿色荧光蛋白“)的渠道;绿色通道信息可能是误导,因为对象是根据严格红色荧光。也可以进行这种分析,在单一的彩色图像。 点击这里查看大图 。
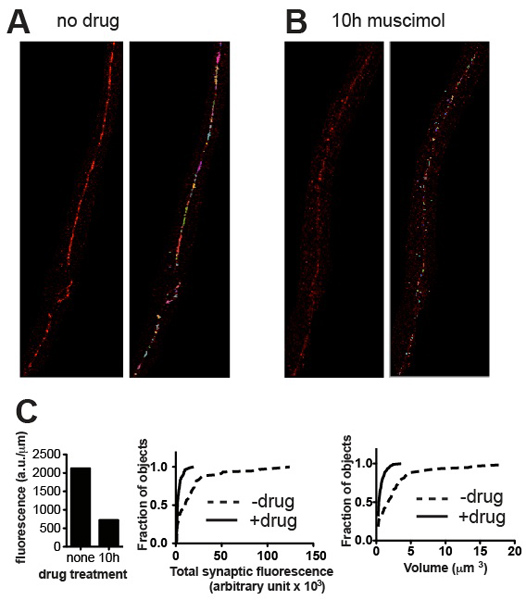
图3。代表结果。代表显微镜,从野生型C. UNC-49 GABA受体染色前线虫 (A)和(B)与治疗,GABA受体激动剂蝇蕈醇导致受体下调后成为长期暴露后。面板显示前(左)后(右)阈值和拆除的小背景斑点的裁剪图像。 (三)图所示的标本定量突触参数(A)和(二):总荧光归到神经线长(左),和累积概率直方图个别突触荧光内容(中)和突触的体积(和规格的T),显示出统计学显着减少突触的内容和数量激动剂曝光(N = 60为未经处理的,N = 115蝇蕈处理突触的突触诱导,P <0.001,Kolmogorov-Smirnov检验http://www.physics.csbsju .edu /统计/ KS-test.html的 )。
讨论
这里介绍的方法设计到突触的大量人口在 C中提取的多参数的定量数据线虫 ,同时最大限度地提高治疗组内的一致性。三个特点有助于实现这些目标。首先,免疫组化进行同步蠕虫种群,以确保所有的动物都是一样的年龄。这一步是至关重要的,因为发育调控的表达水平可能掩盖的实验性治疗的效果(如UNC的49 GABA受体免疫变化的若干倍在发展(光戴维斯等人,在准备中))。...
披露声明
没有利益冲突的声明。
致谢
笔者想感谢贝纳姆A.协助协议的发展。这项工作是由NIH资助NS06747 BAB
材料
| Name | Company | Catalog Number | Comments | ||||||
| 该软件的名称 | 公司 | 评论(可选) | |||||||
| volocity V4.0或更高 | 珀金埃尔默/ Improvision | 检查你访问这个软件的本地影像核心设施。演示软件可在珀金埃尔默网站。这种方法只需要Volocity定量模块。 | |||||||
| 表2。特定的试剂和设备。 | |||||||||
| |||||||||
| 表1。解决方案。 |
参考文献
- Christensen, M. A primary culture system for functional analysis of C. elegans neurons and muscle cells. Neuron. 33, 503-514 (2002).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods Cell Biol. 48, 3-29 (1995).
- Bettinger, J. C., Lee, K., Rougvie, A. E. Stage-specific accumulation of the terminal differentiation factor LIN-29 during Caenorhabditis elegans development. Development. 122, 2517-2527 (1996).
- Davis, K. M. Regulated lysosomal trafficking as a mechanism for regulating GABAA receptor abundance at synapses in Caenorhabditis elegans. Mol. Cell Neurosci. 44, 307-317 (2010).
- Finney, M., Ruvkun, G. The unc-86 gene product couples cell lineage and cell identity in C. elegans. Cell. 63, 895-905 (1990).
- Rowland, A. M. Presynaptic terminals independently regulate synaptic clustering and autophagy of GABAA receptors in Caenorhabditis elegans. J. Neurosci. 26, 1711-1720 (2006).
- Burbea, M. Ubiquitin and AP180 regulate the abundance of GLR-1 glutamate receptors at postsynaptic elements in C. elegans. Neuron. 35, 107-120 (2002).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Oda, S., Tomioka, M., Iino, Y. Neuronal plasticity regulated by the insulin-like signaling pathway underlies salt chemotaxis learning in Caenorhabditis elegans. J. Neurophysiol. 106, 301-308 (2011).
- Sankaranarayanan, S. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- McDonald, N. A. Generation and functional characterization of fluorescent, N-terminally tagged CB1 receptor chimeras for live-cell imaging. Mol. Cell Neurosci. 35, 237-248 (2007).
- Shakiryanova, D. Synaptic neuropeptide release induced by octopamine without Ca2+ entry into the nerve terminal. Proc. Natl. Acad. Sci. U. S. A. 108, 4477-4481 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。