このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
シナプス蛍光の自動定量
要約
シナプスでクラスタ化された神経伝達物質受容体の存在量は強くシナプス強度に影響を与えます。このメソッドは、の単シナプスの分解能で三次元的に蛍光標識された神経伝達物質受容体を定量化する C.エレガンス、シナプスの数百人が急速にz-平面の投影によって導入された歪みがなく、単一試料内で特徴づけることができるようになります。
要約
シナプス強度が前シナプス神経伝達物質の放出イベントへのシナプス応答の振幅を表し、全体的な神経回路の機能に大きな影響を与えます。シナプスの強さは批判的にシナプス後膜上のシナプス部位でクラスタ化された神経伝達物質受容体の量に依存。受容体レベルは、発達が確立され、シナプス可塑性と神経調節の重要なメカニズムを表す表面ローカライズされ、シナプス、細胞内プールの間に受容体の輸送によって変更することができます。シナプスにローカライズされた神経伝達物質受容体の存在量を定量化する厳密な方法は、シナプスの開発と可塑性を研究するために不可欠である。それは非シナプスプールからシナプスを区別し、シナプスの種類に応じてローカライズされた受容体の個体の間で区別する、空間情報を維持するために蛍光顕微鏡では、最適なアプローチです。遺伝的モデル生物線虫elegansは特に無傷の動物のネイティブシナプスの検査を可能にする、小型サイズとその神経系の相対的なシンプルさ、透明性、および強力な遺伝学的手法の利用に起因するこれらの研究に適しています。
ここでは、Cで蛍光標識されたシナプスの神経伝達物質受容体を定量するための方法を提示エレガンス 。その主な特徴は、マルチプレーン共焦点顕微鏡の出力ファイル、集計の位置、ボリューム、蛍光強度と、各シナプスの総蛍光の三次元の個々のシナプスの自動識別と分析である。このアプローチは、共焦点のデータをz平面投影の手動分析上の2つの主要な利点があります。共焦点のデータセットのすべての面が含まれているため、まず、データは通常、ピクセル強度の平均値または最大値に基づいて、z-平面投影を介して失われることはありません。第二に、シナプスの識別は、自動化されていますが、元で検査することができますシナプスの多数からのデータの迅速かつ正確な抽出を可能にするデータ分析が進むにつれてperimenter、。サンプルあたりのシナプスの数百〜数千を容易に得ることができる、大容量のデータを生成する統計的検出力を最大化するために設定します。 Cを調製するための考慮事項分析、および治療 グループ内の動物間のばらつきを最小限にするために共焦点イメージングを行うための線虫についても説明します。 Cを分析するために開発がelegansのシナプス後受容体は、このメソッドは、通常、実際にシナプスにローカライズされたタンパク質、または、離散的なクラスタ、涙点、または細胞小器官に局在化されている任意の蛍光シグナルの任意のタイプのに便利です。
手順は、次の3つの手順で実行されます。1)試料2の製造)は共焦点イメージング、3)画像解析。ステップ1と2 は 、Cに固有のものです線虫は、ステップ3は、一般的に共焦点顕微鏡写真内の任意の点状の蛍光シグナルに適用された。
プロトコル
1。イメージングのためのワームの準備
プロトコルのこのセグメントは、公開C.に基づいています虫培養技術1,2、 図1に概説されています。
- NA22 E.高ペプトンNGM寒天プレート(10cm)のシードにワームを育てる大腸菌ほぼ餓死するまで。免疫染色した場合、1プレートが確実に(パート2を参照)アカウント道に沿って損失、およびイメージングのためのワームを選択するために使用する厳密な基準を考慮して、染色1個人のための十分なワームが生成されます。
- プレートにDDH 2 0の数mlを注ぐことによって収穫のワーム、簡単に渦巻く、15 mlのコニカルチューブ(チューブにワームのほとんどを転送するために必要に応じて繰り返し)に液体を注ぐ。 3分、1000Xグラムの臨床遠心分離機でペレット。上清までのddH 2 Oで洗浄し、ペレット1-3Xは、残留細菌を除去することが明らかである。ワームは、ガラスに付着として、上清を除去するためにポリプロピレン転送ピペットを使用して、(このステップ以降は、それは卵の生存率の損失を避けるために、ステップ間の時間を最小限に抑えることが重要です)。
- 最後の洗浄後、ワーム、およびリリースの卵を溶解する5ミリリットルアルカリ性次亜塩素酸溶液中で再懸濁しワームペレット。優しくロック、1分あたり約解剖顕微鏡下でチューブを調べます。ワームの約50%が(彼らが曲がって開いて壊れて表示されます)を溶解させたときに、卵·バッファ、反転数回で一番上にチューブを充填し、3分、1000X gのペレット化による溶解を終了します。溶解時間が5分を超えてはなりません。
- 転送ピペットで上清を除去し、卵Bufferでペレットを3倍に洗浄する。
- 破片から卵を分離するため、DDH 2 Oの30%ショ糖のクッションの上にフロート:ステップ1.4から最後の洗浄後、慎重に5ミリリットルのddH 2 0で上清とペレットを再懸濁しを削除します。のddH 2 O 5 mlの滅菌60%ショ糖を追加して、よく混ぜる。臨床遠心分離機6分、1000X gでスピン。卵は(それらは、HAますメニスカスで収集します。破片ペレットますが、)曇った外観を簡単お好み検索。
- プラスチック製のピペットを使用して、最小限のボリュームで卵を吸うと非シードNGM寒天プレートに移す。チューブの側面に付着した卵はそっとすすぎと同様に転送することができます。分析した菌株ごとに10センチメートルシーディングプレートで十分です。
- 20一晩卵(〜16時間)℃でシーディングプレートをインキュベート数時間のために少し蓋を残して、それを乾燥させるために、最初の数時間のためにプレートを大気開放しますが、一晩をカバーするようにしてください。
- 孵化した後、基底Sの15 mlコニカルチューブ(プレートに数ml S基礎を追加し、渦巻、チューブに注ぐ)にL1幼虫を転送します。臨床のS基礎最小限のボリュームで再懸濁し、遠心(3分間、1000Xグラム)と、NA22細菌を接種した10 cmのNGM寒天平板への転送のペレット。ステップ1.1から各原版はここ2プレートを使用しています。ワームは、希望する年齢に達するまでインキュベートします。
- 1日に1回または2回ごとに文化を監視します。彼らは危険Oである場合飢えfは、新鮮なNA22プレートに移す。野生型N2のワームについては、飢餓、動物が離れて食糧枯渇ゾーンから一斉に移行するようにプレートを横切って移動するワームのラインや波の形成によって先行されています。このフォームの後、食品は完全に数時間以内に枯渇する。
- ワームは、現在、免疫染色やライブイメージングのための準備が整いました。そのままワームの大規模な番号が容易に撮像することができるので、懸濁液中にワームを固定して染色することが最適です。ワームは、多数のイメージングのために必要されているため、フィニーとRuvkunはプロトコル3月6日に基づいて、染色手順は、凍結クラック手順に好適である。
2。共焦点像
- 共焦点イメージングのためのスライド上でワームをマウントします。マイクロリットルあたり数百にワームの密度を調整します。 (カットオフ25ゲージ針を備えた3 mlの注射器を介して印加される)は、撮像時の蒸発を防ぐためにワセリンの細いリングで囲まれたS-基底の2%アガロースのパッドを作成します。ピペットカバースリップの上にワームの懸濁液を数マイクロリットル(イメージングライブワームであれば麻酔を使用します)、カバースリップの上にアガロースパッドを下げて、パッドに均等にワームを拡散。
- イメージングのためのワームを選択します。 ±45°(0°は、直接目的志向を意味する)よりも興味のあるシナプスがこれ以上の半径方向の変位と、対物レンズに向かって配向しているワームを選択してください。退色を避けるために(数秒)すぐにこの評価を行う。初期の文化の規模は十分なワームは、これらの幾何学的な基準を満たすことを確実にするために最適化されています。
- 標本の共焦点イメージングを完了します。 0.4約14μmの厚さのセクション内に包含することができ、比較的平坦な試料は、最良の結果を生成します。高速、低解像度画像(512×512ピクセル)迅速で正確なデータ収集のために十分である。これは蛍光の過小評価の原因となりますので、飽和の過剰な信号強度を持つ検出器を避ける信号。
3。個々のシナプスClustersの自動識別と分析
- Volocity 4.0(またはそれ以降)ソフトウェア(パーキンエルマー)を用いた共焦点顕微鏡からのオープンマルチTIF出力ファイルを作成します。
- 作物離れて興味のある構造が含まれていない画像の領域(画像- >拡張フォーカス- 'フリーハンドROI "ツールを使用して、興味の>範囲選択- > [アクション- >作物の選択に、 図2A)。 (注)、拡張焦点は、分析を支援するためのコンピュータの画面上でz-平面の投影を生成しますが、基になるデータには影響しません。同じことが、必要に応じて)の明るさとコントラストの調整にも当てはまります。
- ラインツールを使用して解析領域の長さを測定します。線の長さを計算し、データテーブル( 図2B)に追加されます。
- フィルタ(測定モード) '強度によるオブジェクト "を使用してオブジェクトを識別します。シナプスのクラスタがあるようなしきい値を指定します。強調表示と非シナプス背景には、( 図2C)ではありません。別の色で標識された独立したシナプスのマーカーを含めることは、シナプスを識別明確に助けるかもしれない。典型的なシナプスは、数から数百ボクセルに及ぶ。コントロールサンプルを使用して一度しきい値を設定し、後続のすべてのサンプルのためにそれを使用しています。それは実験者のバイアスの可能性を紹介しますので、各サンプルを閾値と別々に受け入れられません。オブジェクトが選択された( 図2D)を自動的に集計されています。
- アレンジとデータをエクスポートします。これらは通常、バックグラウンドの斑点であるため、2つまたはより少ないボクセルのオブジェクトを排除します。これらは、さらにフィルタリングすることによって、以降の解析時に除去することができます。 "オブジェクトのサイズ"によってそれらの除去の下流、再ソートデータファイルを容易にするために、彼らはすべてのグループが一緒になります。 Microsoft Excelや他のスプレッドシートプログラムで開くことができるCSV形式でデータをエクスポートします。各画像は1つの出力ファイルを生成します。
- Volocityソフトであればウェアが使用できない、代替のメソッドが3次元情報が失われているが(説明を参照してください)(例参照。7、またはImageJを使用して手動で分析)を利用することができる共焦点顕微鏡データのZ平面投影を分析することです。
4。代表的な結果
提示定量法は、さまざまな明るさと異なるボリュームのクラスタの集団を区別することができるはずです。 図3に示す代表的な画像と対応する定量的データは、これらのパラメータに基づいて差別化の例を示しています。一般的なルールとして、結果は目に明らかであるものに準拠する必要があります。 Cの腹側神経索を免疫染色、UNC-49 GABA A受容体の場合elegansは 、すべての動物は、通常サイズと成熟度に非常に似て登場し、5ワームのグループ(分析神経コードの長さに正規化)の合計シナプスの蛍光値は標準誤差を示した平均4の約10%の値。遺伝子変異や他の実験的な治療(例えば、薬剤曝露)量と強度の値とシナプスのクラスタの頻度分布だけでなく、変更するかもしれませんが、おそらく、時間経過やワームの同期の発達は、より高い変動性につながる。しかし、定量的な結果は常にエラーが発生し、再しきい値またはartefactualオブジェクトの除去などの是正措置を示唆しているどこに明らかにする必要がありますVolocityによって識別された画像やオブジェクトの検査、視覚的にない場合は理解できるものを反映する必要があります。

図1。同期での準備線虫の培養。同期文化は、このプロシージャから取得されますので、C. elegansの開発逮捕や食品の非存在下でのL1幼虫、食品が導入され再開されます。
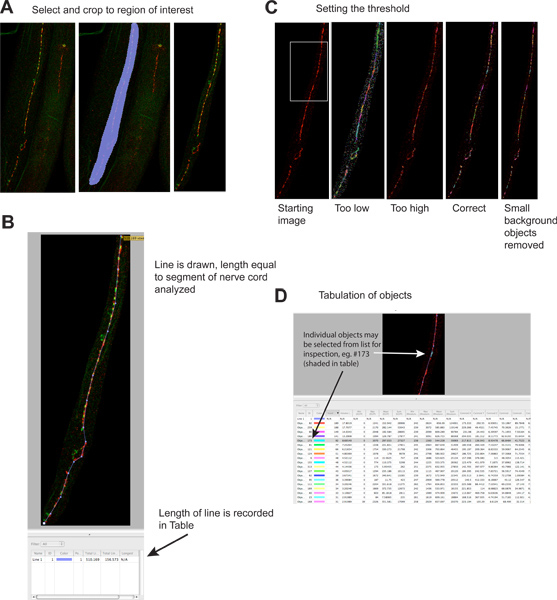
図2。シナプスの涙点の定量。
- 画像の余分な領域は、ファイルサイズを削減し、特異性を高めるためにトリミングされます。左側のパネルが起動イメージを示し、中央のパネルが選択された領域を示し、右側のパネルには、トリミング後の画像を示しています。赤の信号がUNC-49 GABA受容体の免疫ですが、緑の信号は、シナプス前GABAニューロンが4で表されるシナプトブレビン-GFP(シナプスマーカー)です。 拡大図を表示するには、ここをクリックしてください 。
- 行が分析する神経コードセグメントの長さを描かれ、その長さは自動的に結果表に記録されています。この情報は、ワームは染色中に断片化している場合、いくつかの倍を変えることができる解析可能な神経コードの長さに起因するシナプスのデータを正規化する必要があります。www.jove.com/files/ftp_upload/4090/4090fig2blarge.jpg "ターゲット=" _blank ">拡大図を表示するには、ここをクリックしてください。
- しきい値は、個々のシナプスのクラスタを識別するために適用されます。左側のパネルには、しきい値の前にイメージを示し、異なるしきい値レベルの例は、別のパネル(緑色の信号は省略)に示されています。識別された各オブジェクトは、着色された領域として画像上に描かれています。一番左のパネルで、視覚的に明らかシナプスクラスタと一番右のパネルに着色された地域間の対応関係に注意してください。 拡大図を表示するには、ここをクリックしてください 。
- 識別された各オブジェクトは、結果テーブルに個別に記載されています。個々のオブジェクトを選択することができ、必要に応じて検査のために画像上で強調表示されます。オブジェクトがあったので緑のチャネル情報は、潜在的に紛らわしいのですが表が赤( 'ローダミン')と緑( 'EGFP')チャネルの情報が含まれていることに注意してください。厳密には赤色の蛍光に基づいて同定した。この分析は、単一カラー画像上で実行される可能性があります。 拡大図を表示するには、ここをクリックしてください 。
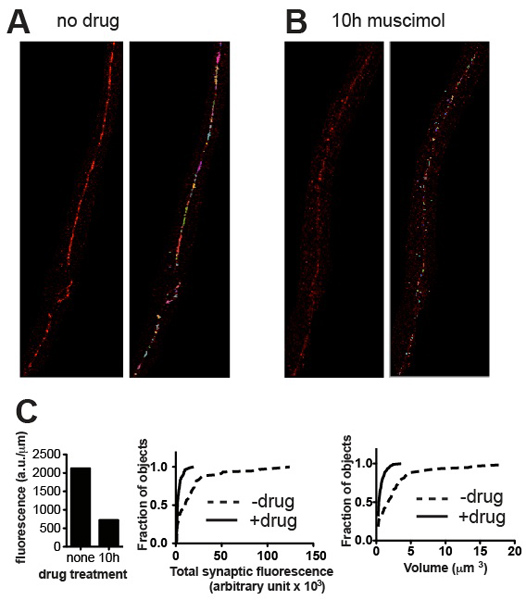
図3。代表的な結果、野生型C.からの代表的な顕微鏡写真elegansは前に()とムシモール、受容体は長時間露光した後にダウンレギュレートになるようになりGABA受容体アゴニスト(B)と治療後のUNC-49 GABA受容体のために染色した。パネルは、前(左)と(右)しきい値と小さなバックグラウンドのしみを除去した後のトリミング画像を表示します。 (C)に示すように、標本の定量的なシナプスのパラメータのプロット(A)と(B):総個々のシナプス蛍光コンテンツの神経コードの長さ(左)と累積確率のヒストグラム(中央)に正規化蛍光とシナプス量(right)は、アゴニスト曝露(ムシモール処理のための治療は、n = 115シナプスのn = 60シナプスによって誘発されるシナプスの内容とボリュームで統計的に有意な減少を示す、P <0.001、コルモゴロフ-スミルノフ検定試験http://www.physics.csbsju .edu /統計/ KS-test.htmlという 。)
ディスカッション
ここで紹介するメソッドは、Cのシナプスの大集団の定量的なマルチパラメータデータを抽出するように設計されていエレガンス 、試験治療グループ内の一貫性を最大化しながら。三つの特徴は、これらの目標に貢献しています。最初に、免疫染色はすべての動物が同じ年齢であることを確認し、同期ワーム集団で実行されます。発現レベルの開発規制が実験的治療の効果を不?...
開示事項
利害の衝突が宣言されません。
謝辞
著者らは、プロトコルの開発を支援するためにA.ベンハムに感謝します。この作品は、BABにNIHの助成金NS06747によって賄われていた
資料
| Name | Company | Catalog Number | Comments | ||||||
| ソフトウェアの名前 | 会社 | コメント(オプション) | |||||||
| Volocity v4.0以上 | パーキンエルマー/ Improvision | このソフトウェアにアクセスするためのローカルイメージングのコア機能を確認してください。デモ·ソフトウェアは、パーキンエルマー社のウェブサイトで入手できます。このメソッドは、Volocityの唯一の定量モジュールが必要です。 | |||||||
| 表2特異的試薬および装置。 | |||||||||
| |||||||||
| 表1。ソリューション。 |
参考文献
- Christensen, M. A primary culture system for functional analysis of C. elegans neurons and muscle cells. Neuron. 33, 503-514 (2002).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods Cell Biol. 48, 3-29 (1995).
- Bettinger, J. C., Lee, K., Rougvie, A. E. Stage-specific accumulation of the terminal differentiation factor LIN-29 during Caenorhabditis elegans development. Development. 122, 2517-2527 (1996).
- Davis, K. M. Regulated lysosomal trafficking as a mechanism for regulating GABAA receptor abundance at synapses in Caenorhabditis elegans. Mol. Cell Neurosci. 44, 307-317 (2010).
- Finney, M., Ruvkun, G. The unc-86 gene product couples cell lineage and cell identity in C. elegans. Cell. 63, 895-905 (1990).
- Rowland, A. M. Presynaptic terminals independently regulate synaptic clustering and autophagy of GABAA receptors in Caenorhabditis elegans. J. Neurosci. 26, 1711-1720 (2006).
- Burbea, M. Ubiquitin and AP180 regulate the abundance of GLR-1 glutamate receptors at postsynaptic elements in C. elegans. Neuron. 35, 107-120 (2002).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Oda, S., Tomioka, M., Iino, Y. Neuronal plasticity regulated by the insulin-like signaling pathway underlies salt chemotaxis learning in Caenorhabditis elegans. J. Neurophysiol. 106, 301-308 (2011).
- Sankaranarayanan, S. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- McDonald, N. A. Generation and functional characterization of fluorescent, N-terminally tagged CB1 receptor chimeras for live-cell imaging. Mol. Cell Neurosci. 35, 237-248 (2007).
- Shakiryanova, D. Synaptic neuropeptide release induced by octopamine without Ca2+ entry into the nerve terminal. Proc. Natl. Acad. Sci. U. S. A. 108, 4477-4481 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved