Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Içinde Synaptic florasan Otomatik Sayısallaştırma
Bu Makalede
Özet
Kavşaklarda bulunan kümelenmiş nörotransmitter reseptörlerinin bolluğu güçlü sinaptik gücü etkiler. Bu yöntem tek-sinaps çözünürlükte üç boyutlu olarak floresan etiketli nörotransmitter reseptörleri quantifies C. elegans, Sinaps yüzlerce hızla z-düzlemi projeksiyon tarafından tanıtılan bozulmaları olmadan tek bir örnek içinde karakterize izin vererek.
Özet
Synapse gücü presinaptik nörotransmitter serbest olaylara postsinaptik yanıtların genlik ifade eder, ve genel nöral devre fonksiyonu üzerinde büyük etkisi vardır. Synapse gücü kritik postsinaptik membran üzerinde sinaptik da kümelenmiş ve nörotransmitter reseptörlerinin bolluk bağlıdır. Reseptör düzeyleri gelişimsel olarak kurulan ve sinaptik plastisite ve nöromodülasyon önemli mekanizmalarını temsil eden yüzey lokalize, subsynaptic ve hücre içi havuzları arasında reseptör kaçakçılığı tarafından değiştirilebilir. Synaptically-lokalize nörotransmitter reseptör bolluk ölçmek için titiz bir yöntem geliştirme ve sinaptik plastisite çalışmak esastır. Olmayan-sinaptik havuzlarından sinaptik ayırt ve sinaps farklı lokalize reseptör popülasyonlar arasında ayrım, mekansal bilgi korur, çünkü floresan mikroskobu optimum bir yaklaşımdır. Genetik model organizma Caenorhabditis Eleganlar, özellikle de sağlıklı hayvan yerli sinapsların muayene izin, küçük boyutu ve göreceli kendi sinir sisteminin basitliği, şeffaflığı, ve güçlü genetik tekniklerin durumu nedeniyle bu çalışmalar için uygundur.
Burada C. floresan etiketli sinaptik nörotransmitter reseptörleri hesaplamak için bir yöntem sunmak elegans. Onun temel özelliği çoklu düzlem konfokal mikroskop çıktı dosyaları, tablolama konumu, hacmi, floresan ve her sinaps için toplam floresan üç boyutlu bireysel sinapsların otomatik tanımlama ve analiz olduğunu. Bu yaklaşım konfokal veri z-düzlemi projeksiyonlar manuel analizi üzerinde iki temel avantajı vardır. Konfokal veri seti her düzlemde yer alması nedeniyle Birincisi, hiçbir veri genellikle piksel yoğunluğu ortalamaları ya da maxima dayalı, z-düzlemi projeksiyon yoluyla kaybolur. Sinapsların İkincisi, otomatik tanımlama, ama ex kontrol edilebilirsinaps, çok sayıda veri doğru ve hızlı ekstraksiyon izin veri analizi ilerledikçe perimenter,. Örnek başına sinaps binlerce yüzlerce kolayca büyük veri üreten istatistiksel gücü maksimize etmek için ayarlar, elde edilebilir. C. hazırlarken dikkat edilmesi gereken noktalar analiz ve tedavi grupları içinde hayvanlar arasındaki değişkenliği en aza indirmek için konfokal görüntüleme gerçekleştirmek için elegans da tartışılır. C. analiz etmek için geliştirilmiş olsa da elegans postsinaptik reseptörler, bu yöntem gerçekten synaptically-lokalize protein, ya, ayrık kümeler, punktumlarda veya organeller yerleştiğini herhangi bir floresans sinyalinin herhangi bir türü için genellikle yararlıdır.
Prosedür üç aşamada gerçekleştirilir: 1) örnekleri, 2 hazırlanması) konfokal görüntüleme, ve 3) görüntü analizi. Basamak 1 ve 2 C. özgü elegans, 3. adımı genellikle odaklı mikrograflar herhangi punktat floresan sinyal için geçerli iken.
Protokol
1. Görüntüleme için Worms hazırlanması
Bu protokolün segmenti yayınlanan C. dayanmaktadır elegans kültür teknikleri 1,2 ve Şekil 1'de belirtilmiştir.
- NA22 E. ile yüksek pepton NGM agar (10 cm) numaralı seribaşı üzerine solucanlar büyür coli bakterisinin neredeyse açlıktan kadar. Immun Eğer, bir tabak güvenilir yol boyunca hesap kayıpları dikkate alındığında, ve görüntüleme için worm (Part 2) seçmek için kullanılan katı kriterleri, leke 1 kişi için yeterli solucanlar üretecek.
- Tabağa GKD 2 0 birkaç ml dökerek Hasat solucanlar, kısaca dönen ve 15 ml konik tüp (tekrar tüpe solucanlar en aktarmak gerekirse) içine sıvı dökme. 3 dakika, 1000x g klinik santrifüj Pelet. Süpernatant kalan bakteriler kaldırmak için netleşene kadar GKD 2 O ile 1-3x pelet yıkayın. Solucanlar cam sopa gibi, süpernatantlar kaldırmak için polipropilen transferi pipet kullanın(Bu adım itibaren yumurta canlılık kayıpları önlemek için adımlar arasındaki zaman en aza indirmek için önemlidir).
- Son yıkamadan sonra, Pastör pipetiyle solucan pelet 5 ml alkalin hipoklorit solüsyonu içinde solucanlar ve serbest yumurta lyse için. Hafifçe sallayın ve bir kere dakikada bir mikroskop altında tüpleri inceleyin. Solucanların yaklaşık% 50 (bunlar eğildi ve açık kırık görünecektir) parçalanır zaman, Yumurta Tampon, tersini birkaç kez üst tüp dolum ve 3 dakika, 1000x g pelet tarafından parçalama feshedebilir. Lizis süresi 5 dk geçmemelidir.
- Transferi pipetle süpernatantı ve Yumurta Tampon ile pelet 3x yıkayın.
- Enkaz yumurta ayırmak için, GKD 2 O% 30 sakaroz bir yastık onları yüzer: adım 1.4 den son yıkamadan sonra, dikkatle 5 ml GKD 2 0 süpernatan ve Pastör pipetiyle pelet çıkarın. GKD 2 O 5 ml steril% 60 sakkaroz ekleyin ve iyice karıştırın. Klinik santrifüj 6 dk, 1000x g Spin. Yumurta (bunlar ha olacak menisküs de toplayacak) bulutlu bir görünüm ettik, enkaz pelet olacak iken.
- Plastik bir transferi pipet kullanarak, minimal hacim yumurta emmek ve dereceye giremeyen NGM agar transfer. Tüp yan yapışan yumurta hafifçe aşağı durulanır ve de transfer edilebilir. Bir adet 10 cm analiz zorlanma başına plaka yeterli dereceye giremeyen.
- 20 gece boyunca yumurta (~ 16 saat) ° C ile dereceye giremeyen inkübe edin Birkaç saat için biraz kapalı kapağı bırakarak kurutun ilk birkaç saat için plaka havalandırın, ama bir gecede kapsayacak emin olun.
- Yumurtadan çıktıktan sonra, S Bazal bir 15 ml konik boru (tüp içine dökün, birkaç mL S plaka Bazal, girdap eklemek) için L1 larva transferi. Klinik S Bazal minimum hacmi tekrar süspansiyon santrifüj (3 dk, 1000x g) ve NA22 bakteri ile tohumlanan 10 cm NGM agar için transfer Pelet. Adım 1.1 'den her orijinal plaka için buraya 2 tabak kullanın. Solucanlar istenilen yaşına kadar inkübe edin.
- Bir veya iki kez günlük kültürleri izler. Tehlike o isenizf açlıktan, taze NA22 plakaları transfer. Vahşi tip N2 solucanlar için, açlıktan hayvanları uzak gıda tükenmiş bölgeleri kitleler halinde göç gibi plaka üzerinde hareket ettiği solucanlar bir çizgi veya dalga oluşumu önce gelmelidir. Bu formları sonra, gıda tamamen birkaç saat içinde seyreltilmiş edilecektir.
- Worms şimdi immun veya canlı görüntüleme için hazırdır. Sağlam solucanlar, çok sayıda kolaylıkla görüntülenebilir çünkü Tespit ve süspansiyon solucanlar boyama en uygunudur. Solucanlar sayıda görüntüleme için gerekli olduğundan ve Finney Ruvkun protokolüne göre 3-6 boyanması prosedürler dondurma-çatlama prosedürler için tercih edilir.
2. Konfokal Görüntüleme
- Konfokal görüntüleme için kızaklar üzerinde solucan takın. Mikrolitre başına birkaç yüz solucanların yoğunluğunu ayarlayın. % 2 agaroz bir ped olun S-bazal (cut-off 25 iğne takılmış 3 ml şırınga ile uygulanan) görüntüleme sırasında buharlaşmayı önlemek için vazelin ince bir halka ile çevrili. Bir Pipetibir kapak kayma üzerine solucan süspansiyon birkaç mikrolitre (görüntüleme canlı solucanlar eğer anestezi kullanırlar) ve kapağı kayma üzerine agaroz pedi düşürmek, yüzey üzerinde eşit solucanlar yayılıyor.
- Görüntüleme için solucanlar seçin. ± 45 ° (0 ° doğrudan hedefi yönelmiş demektir burada) daha ilgi sinapsların daha fazla radyal deplasman, objektif lens yönelmiştir solucanlar seçin. Photobleaching önlemek için (birkaç saniye) hızlı bir şekilde bu değerlendirme gerçekleştirin. İlk kültürlerin ölçekli yeterli solucanlar bu geometrik kriterleri tatmin edecek sağlamak için optimize edilmiştir.
- Numunenin konfokal görüntüleme tamamlayın. 0.4 yaklaşık 14 mikron kalınlığında kesitler kapsamına girenler olabilir nispeten düz örnekleri iyi sonuçlar üretebilir. Yüksek hızlı, düşük çözünürlüklü görüntü (512 x 512 piksel) hızlı doğru veri toplanması için yeterlidir. Bu floresans hesaplanmasına yol olarak, doyurarak aşırı sinyal gücü ile dedektör kaçınınsinyalleri.
3. Bireysel Synaptic Kümelerin Otomatik Tanımlama ve Analiz
- Açık çoklu TIF çıkış Volocity 4.0 (veya üstü) yazılım (Perkin Elmer) kullanarak konfokal mikroskop dosyaları.
- Bitki uzakta faiz yapısı içermeyen görüntünün alanlarını (Image -> Genişletilmiş Odak -> Actions - - 'Freehand ROI' aracını kullanarak ilgi> Alan seç Seçimi> Kırp; Şekil 2A). Not Genişletilmiş Odak analizinizi yardım için bilgisayar ekranında bir z-düzlemi projeksiyon üreten, ancak temel veri etkilemez; aynı gerekirse) parlaklık ve kontrast ayarlamaları için de geçerlidir.
- Line Tool kullanılarak analiz alanının uzunluğunu ölçün. Hat uzunluğu hesaplanır ve veri tablosu (Şekil 2B) eklenecektir.
- Filtresi (Ölçümler modu) 'Yoğunluk tarafından Nesneler' kullanarak nesneleri tanımlayın. Sinaptik kümeler olduğu gibi, bir eşiğin belirtinvurgulanmış ve non-sinaptik arka plan (Şekil 2C) değildir. Başka bir renk etiketli bağımsız bir sinaptik marker İçerme sinapsların açıkça belirlemek yardımcı olabilir. Tipik sinapsların bir kaç birkaç yüz voksellerden arasında değişir. Bir kontrol örneği ile bir kez eşik ayarlayın ve sonraki tüm örnekler için kullanabilirsiniz. Bu deneyci çelişki potansiyelini tanıttı çünkü her bir örnek eşikleme ayrı ayrı kabul edilemez. Objeler seçilir ve (Şekil 2B) otomatik olarak tablo haline getirilmiştir.
- Düzenlemek ve İhracat verileri. Bu genellikle arka lekeler olduğundan, 2 veya daha az voksellerden nesneleri ortadan kaldırın. Bunlar, başka filtrelenmesi, bir sonraki analiz elimine edilebilir. 'Nesne boyutu' ile bunların kaldırılmasına aşağı, yeniden sıralama veri dosyası kolaylaştırmak için böylece tüm grup birlikte olacak. Microsoft Excel veya diğer elektronik tablo programı açılabilir CSV formatında veri verir. Her resim bir çıktı dosyası oluşturur.
- Eğer Volocity yumuşakeşya kullanılamaz, alternatif yöntemler 3 boyutlu bilgi kaybı olmasına rağmen (Tartışma bakın), (örneğin ref. 7 veya ImageJ kullanarak manuel analizi) faydalanilabilir konfokal veri Z-düzlem projeksiyonlar analiz etmektir.
4. Temsilcisi Sonuçlar
Sunulan kantifikasyon metodu farklı parlaklık ve farklı birimlerin küme nüfusu ayırt edebilmelidir. Şekil 3 'de temsili görüntü ve karşılık gelen sayısal verilerin bu parametreleri esas alınarak farklılaşma örnekleri gösterirler. Genel bir kural olarak sonuçlar göze bellidir ne uygun olmalıdır. C sinirin ventral kord İmmünoboyama UNC-49 GABA reseptörünün durumda elegans, tüm hayvanlar genellikle büyüklük ve olgunluk çok benzeri çıktı ve beş solucanlar bir grup (analiz sinir kordon boyunu normalize) için toplam sinaptik floresan değerleri standart hata gösterdi ortalama 4 yaklaşık% 10 arasında değerlere. Genetik mutasyon ve diğer deneysel tedaviler (örn. ilaca maruz kalma) hacim ve yoğunluk değerleri ve sinaptik kümelerin frekans dağılımları sadece değiştirebilir, ama belki, zaman seyri ve solucanların senkronize gelişimsel değişkenliğinin yüksek yol. Ancak nicel sonuçlar her zaman hata oluştu ve yeniden eşikleme veya artefactual nesnelerin kaldırılması gibi düzeltici eylem önermek nerede açığa çıkarmalıdır Volocity tarafından belirlenen görüntüleri ve nesneleri denetim, görsel ve değilse takdir ne yansıtmalıdır.

Şekil 1.. Senkron C. hazırlanması elegans kültürler. Senkron kültürleri bu prosedür elde çünkü C. elegans gelişimi tutuklamalar ve gıda yokluğunda L1 larva ve besin geldiğinde devam eder.
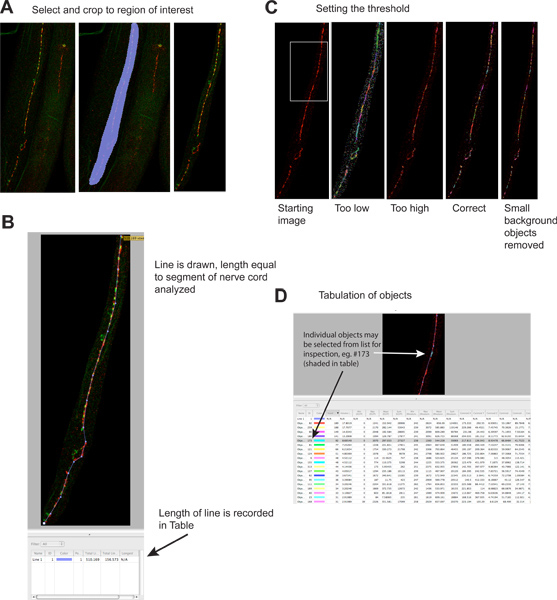
Şekil 2. Sinaptik punktumlarda kantitasyonu.
- Görüntünün gereksiz bölgeleri dosya boyutlarını azaltmak ve özgünlüğü artırmak için kırpılır. Sol panelde görüntü başlangıç gösterir, orta panel seçilmiş bölgeyi gösterir, sağ panel kırpma sonra görüntü gösterir. Kırmızı sinyal UNC-49 GABA reseptör immünfloresan olduğunu, yeşil sinyal presinaptik GABA nöronlar 4 olarak ifade synaptobrevin-GFP (presinaptik belirteci) olduğunu. büyük rakam görmek için buraya tıklayın .
- A hattı analiz edilecek sinir kord parçasının uzunluğu çekilir, ve uzunluğu otomatik sonuçlar Tablo kaydedilir. Bu bilgiler, solucanlar boyama sırasında parçalanır halinde birkaç misli değişebilir analiz sinir kordun uzunluğu, nedeniyle sinaptik verileri normalize için gereklidir.www.jove.com/files/ftp_upload/4090/4090fig2blarge.jpg "target =" _blank "> büyük rakamı görmek için buraya tıklayın.
- A tek tek eşik sinaptik kümeler tanımlamak için uygulanır. Sol paneli eşik önce görüntü gösterir; farklı eşik seviyesi örnekleri ayrı paneller (yeşil sinyal atlanmıştır) 'de gösterilmiştir. Her tespit nesne renkli bir bölge olarak görüntü üzerinde tasvir edilmiştir. En soldaki panelinde görsel belirgin sinaptik kümeleri ve en sağ paneldeki renkli bölgeler arasındaki yazışmalar unutmayın. büyük rakam görmek için buraya tıklayın .
- Her tanımlanan nesnesi sonuçlar tablo ayrıca listelenmiştir. Bireysel nesneler seçilebilir ve istenirse muayene için görüntü üzerinde vurgulanır. Bu tablo kırmızı ('rodamin') ve yeşil ('EGFP') kanallar için bilgi içerir; nesneleri olduklarından yeşil kanal bilgileri potansiyel yanıltıcıkesinlikle kırmızı floresan göre belirledi. Bu analizi de tek renkli görüntüler üzerinden yapılabilir. büyük rakam görmek için buraya tıklayın .
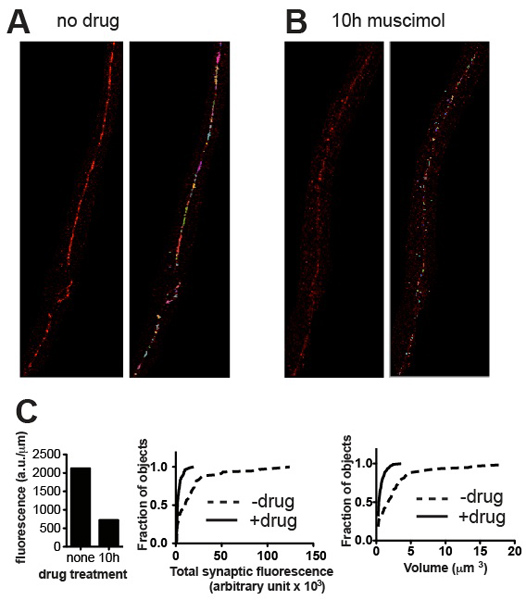
Şekil 3. Temsilcisi sonuçları. Temsilcisi mikrograflarından wild-tip C'den önce UNC-49 GABA reseptörleri için boyandı elegans (A) ve muscimol, uzun pozlama sonra downregüle olmak reseptörleri neden olan bir GABA reseptör agonisti olan (B) tedavi sonrası. Paneller önce (solda) ve (sağda) eşikleme ve küçük arka lekeleri çıkarıldıktan sonra kırpılmış görüntüleri gösterir. (C) gösterilen örnekler için kantitatif sinaptik parametrelerin Arsalar (A) ve (B): toplam floresans sinir kablosu uzunluğu (solda) ve kümülatif olasılık histogramları bireysel sinaps floresans içerik (orta) ve sinaps hacmi (righ normalizet), agonist pozlama (muscimol tedavi için işlenmemiş, n = 115 sinaps n = 60 sinapsların ile indüklenen sinaptik içerik ve hacim olarak istatistiksel olarak anlamlı bir azalma göstererek; p <0.001, Kolmogorov-Smirnov testi http://www.physics.csbsju .edu / stats / KS-test.html ).
Tartışmalar
Burada sunulan yöntemi C. sinapsların büyük popülasyonlar için kantitatif çok parametre veri ayıklamak için tasarlanmıştır elegans, tedavi grupları içindeki tutarlılığı en üst düzeye çıkarırken. Üç özellikleri bu hedeflere katkıda. İlk olarak, immun tüm hayvanlar aynı yaşta olması için senkron solucan nüfus yapılmaktadır. Ifade seviyelerinin gelişim düzenlemesi deneysel tedavinin etkisi gizleyen bu adım kritiktir (örn. UNC-49 GABA reseptörü immünfloresans içi...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar protokolünün gelişimi ile yardımcı A. Benham teşekkür etmek istiyorum. Bu çalışma BAB NIH hibe NS06747 tarafından finanse edildi
Malzemeler
| Name | Company | Catalog Number | Comments | ||||||
| Yazılım Adı | Şirket | Yorumlar (isteğe bağlı) | |||||||
| Volocity v4.0 ya da daha yüksek | Perkin Elmer / Improvision | Bu yazılım erişim için yerel görüntüleme çekirdek tesis edin. Demo yazılımı Perkin Elmer web sitesinde mevcuttur. Bu yöntem, yalnızca Volocity kantitasyonu modülü gerektirir. | |||||||
| Tablo 2. Özel reaktifleri ve ekipmanları. | |||||||||
| |||||||||
| Tablo 1. Çözümler. |
Referanslar
- Christensen, M. A primary culture system for functional analysis of C. elegans neurons and muscle cells. Neuron. 33, 503-514 (2002).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods Cell Biol. 48, 3-29 (1995).
- Bettinger, J. C., Lee, K., Rougvie, A. E. Stage-specific accumulation of the terminal differentiation factor LIN-29 during Caenorhabditis elegans development. Development. 122, 2517-2527 (1996).
- Davis, K. M. Regulated lysosomal trafficking as a mechanism for regulating GABAA receptor abundance at synapses in Caenorhabditis elegans. Mol. Cell Neurosci. 44, 307-317 (2010).
- Finney, M., Ruvkun, G. The unc-86 gene product couples cell lineage and cell identity in C. elegans. Cell. 63, 895-905 (1990).
- Rowland, A. M. Presynaptic terminals independently regulate synaptic clustering and autophagy of GABAA receptors in Caenorhabditis elegans. J. Neurosci. 26, 1711-1720 (2006).
- Burbea, M. Ubiquitin and AP180 regulate the abundance of GLR-1 glutamate receptors at postsynaptic elements in C. elegans. Neuron. 35, 107-120 (2002).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Oda, S., Tomioka, M., Iino, Y. Neuronal plasticity regulated by the insulin-like signaling pathway underlies salt chemotaxis learning in Caenorhabditis elegans. J. Neurophysiol. 106, 301-308 (2011).
- Sankaranarayanan, S. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- McDonald, N. A. Generation and functional characterization of fluorescent, N-terminally tagged CB1 receptor chimeras for live-cell imaging. Mol. Cell Neurosci. 35, 237-248 (2007).
- Shakiryanova, D. Synaptic neuropeptide release induced by octopamine without Ca2+ entry into the nerve terminal. Proc. Natl. Acad. Sci. U. S. A. 108, 4477-4481 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır