Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La cuantificación automática de la fluorescencia en el Synaptic
En este artículo
Resumen
La abundancia de receptores de neurotransmisores en las sinapsis agrupadas influye fuertemente en la fuerza sináptica. Este método cuantifica marcadas con fluorescencia receptores de neurotransmisores en tres dimensiones con una sola sinapsis resolución en C. elegans, Permitiendo cientos de sinapsis que se caracteriza rápidamente dentro de una sola muestra sin distorsiones introducidas por proyección plano z.
Resumen
Fuerza de la sinapsis se refiere a la amplitud de las respuestas postsinápticas a la liberación de neurotransmisores presinápticos eventos, y tiene un gran impacto en la función global de circuitos neuronales. Fuerza de la sinapsis depende fundamentalmente de la abundancia de receptores de neurotransmisores sinápticos agrupados en los sitios en la membrana postsináptica. Los niveles del receptor se estableció el desarrollo, y pueden ser alterados por el tráfico de receptores entre los depósitos de superficie localizada, subsináptica, e intracelular, lo que representa un importante mecanismo de plasticidad sináptica y la neuromodulación. Rigurosos métodos para cuantificar la abundancia sinápticamente localizado receptores de neurotransmisores son esenciales para estudiar el desarrollo y la plasticidad sináptica. La microscopia de fluorescencia es un método óptimo, ya que preserva la información espacial, distinguiendo sináptica de la no-sinápticas piscinas, y discriminar entre las poblaciones de los receptores localizados en diferentes tipos de sinapsis. El organismo modelo Caenorhabditis genética elegans es especialmente adecuado para estos estudios debido al pequeño tamaño y relativa simplicidad de su sistema nervioso, su transparencia, y la disponibilidad de potentes técnicas genéticas, permitiendo el examen de las sinapsis nativas en animales intactos.
Aquí presentamos un método para cuantificar marcadas con fluorescencia receptores de los neurotransmisores sinápticos en C. elegans. Su característica clave es la identificación automática y análisis de las sinapsis individuales en tres dimensiones en varios archivos planos microscopio confocal de salida, la posición de la tabulación, el volumen, la intensidad de fluorescencia, y la fluorescencia total de cada sinapsis. Este enfoque tiene dos ventajas principales sobre el análisis manual de las proyecciones de Z-Plane de datos confocal. En primer lugar, porque todos los planos del conjunto de datos confocal se incluye, no hay datos se pierden a través de proyección plano z, por lo general basada en las medias de intensidad de pixel o máximos. Identificación En segundo lugar, de las sinapsis es automático, pero puede ser inspeccionado por el exexperimentador medida que avanza el análisis de datos, lo que permite la extracción rápida y precisa de los datos de un gran número de sinapsis. Cientos de miles de sinapsis por la muestra se puede obtener fácilmente, produciendo grandes conjuntos de datos para maximizar la potencia estadística. Consideraciones para la preparación de C. elegans para el análisis, y la realización de la imagen confocal para minimizar la variabilidad entre los animales dentro de los grupos de tratamiento también se discuten. Aunque se desarrolló para analizar C. receptores postsinápticos elegans, este método es útil en general para cualquier tipo de sinápticamente-localizada proteína, o de hecho, cualquier señal de fluorescencia que se localiza en racimos discretos, puncta o orgánulos.
El procedimiento se realiza en tres etapas: 1) preparación de muestras, 2) imagen confocal, y 3) el análisis de imágenes. Pasos 1 y 2 son específicos a C. elegans, mientras que el paso 3 es generalmente aplicable a cualquier señal de fluorescencia punteada en micrografías confocal.
Protocolo
1. Preparación de los gusanos de la Imagen
Este segmento del protocolo está basado en los C. técnicas de cultivo elegans 1,2, y se describe en la Figura 1.
- Criar gusanos de alta las placas de agar peptona NGM (10 cm) sembradas con E. NA22 la bacteria E. hasta casi morir de hambre. Si inmunotinción, una placa, producirá gusanos suficientes para una persona mancha, teniendo en cuenta las pérdidas a lo largo del camino, y los estrictos criterios utilizados para seleccionar a los gusanos de imagen (véase la Parte 2).
- Gusanos de cosecha de verter algunos mililitros de ddH 2 0 en la placa, girando brevemente, y verter el líquido en un tubo cónico de 15 ml (repetir si es necesario para transferir la mayor parte de los gusanos en el tubo). Pellet en centrífuga clínica durante 3 min, g 1000x. Lavar precipitado 1-3x con ddH2O hasta el sobrenadante es claro para eliminar las bacterias residuales. Utilizar pipetas de polipropileno de transferencia para eliminar sobrenadantes, como gusanos se adhieren al vidrio(A partir de este paso es fundamental para minimizar el tiempo entre los pasos para evitar pérdidas en la viabilidad de los huevos).
- Después del último lavado, resuspender el pellet en gusano de 5 ml de solución de hipoclorito alcalino para lisar los gusanos y los huevos de liberación. Rock suave, y examinar los tubos bajo un microscopio de disección de una vez por minuto. Cuando el 50% de los gusanos se lisan (aparecerán doblado y roto abierto), terminar la lisis por el tubo de llenado a la parte superior con tampón de huevo, invirtiendo varias veces, y la granulación durante 3 min, 1000x g. Lisis tiempo no debe exceder de 5 minutos.
- Eliminar el sobrenadante con una pipeta de transferencia, y lavar la pastilla 3 veces con tampón de huevo.
- Para separar los huevos de los desechos, flotar sobre un colchón de sacarosa al 30% en ddH 2 O: después del lavado final de la etapa 1.4, quite cuidadosamente el sobrenadante y resuspender el pellet en 5 ml de ddH 2 0. Añadir 5 ml de sacarosa al 60% en ddH2O, y mezclar bien. Gira en centrífuga clínica 6 min, g 1000x. Los huevos se recogen en el menisco (se de HaVe un aspecto turbio), mientras que los desechos se pellet.
- Utilizando una pipeta de transferencia de plástico, aspirar los huevos en un volumen mínimo y transferir a sembradas placas de agar NGM. Cualquier huevos que se adhieren a lado del tubo se puede enjuagar suavemente hacia abajo y se transfiere también. Una placa de 10 cm de cabeza de serie por cada cepa analizada es suficiente.
- Incubar las placas sembradas con los huevos durante la noche (~ 16 h) a 20 ° C. Ventile la placa durante las primeras horas para que se seque, dejando la tapa un poco fuera por unas horas, pero asegúrese de cubrir durante la noche.
- Después de la eclosión, las larvas L1 transferir a un tubo cónico de 15 ml en el basal S (añadir unos pocos ml S a la placa basal, remolino, verter en el tubo). Pellet en centrífuga clínica (3 min, 1000x g), resuspender en un volumen mínimo de S basal, y la transferencia de hasta 10 cm placas de agar sembradas con NGM NA22 bacterias. Usar 2 placas de aquí para cada plato original del paso 1.1. Incubar hasta que los gusanos lleguen a la edad deseada.
- Monitorear las culturas una o dos veces por día. Si ellos están en peligro of muriendo de hambre, la transferencia a nuevas NA22 placas. Para los gusanos N2 de tipo salvaje, el hambre es precedida por la formación de una línea o una ola de gusanos que se mueve a través de la placa como los animales emigran en masa lejos de alimentos agotadas zonas. Una vez que estas formas, la comida va a estar definitivamente agotado en pocas horas.
- Los gusanos ya están listos para inmunotinción o imágenes en vivo. Fijación y tinción gusanos en suspensión es óptimo, ya que un gran número de gusanos intactos se pueden visualizar fácilmente. Los procedimientos de tinción basados en el protocolo de Finney y Ruvkun 3-6 son preferibles a las heladas agrieten los procedimientos, porque un gran número de gusanos son necesarios para la creación de imágenes.
2. Confocal de imágenes
- Montar los gusanos en las diapositivas de imagen confocal. Ajuste la densidad de gusanos a unos pocos centenares por microlitro. Hacer una almohadilla de agarosa al 2% en S-basal rodeado por un delgado anillo de vaselina para evitar la evaporación durante la imagen (aplicado a través de una jeringa de 3 ml equipado con una aguja de calibre de corte 25). Pipetearpocos microlitros de la suspensión de gusano en una hoja de cubierta (uso de anestesia, si imagen gusanos vivos), y bajar la plataforma de agarosa en la hoja de la cubierta, la difusión de los gusanos de manera uniforme sobre la almohadilla.
- Seleccione gusanos para obtener imágenes. Seleccione gusanos en las sinapsis de interés se orientan a la lente del objetivo, con el desplazamiento radial de no más de ± 45 ° (donde 0 ° significa que está orientado directamente hacia el objetivo). Lleve a cabo esta evaluación rápida (unos segundos) para evitar photobleaching. La escala de los cultivos iniciales se optimiza para asegurar suficientes gusanos se satisfacen estos criterios geométricos.
- Completa la imagen confocal de la muestra. Muestras relativamente planas que pueden ser comprendidas dentro de aproximadamente 14 micras de espesor 0,4 secciones producir los mejores resultados. De alta velocidad, las imágenes de baja resolución (512 x 512 píxeles) son suficientes para la rápida recolección de datos precisos. Evite saturar el detector con intensidades de señal excesivas, ya que esto causará una subestimación de la fluorescenciaseñales.
3. Automático de Identificación y Análisis de Clusters sinápticas individuales
- Abrir varios archivos TIF de salida del microscopio confocal utilizando Volocity 4.0 (o superior) (PerkinElmer).
- Cultivos de distancia áreas de la imagen que no contienen la estructura de interés (Imagen -> Focus extendida -> Seleccionar área de interés mediante "Freehand ROI Tool -> Acciones -> Recortar a la selección, la Figura 2A). Tenga en cuenta, de enfoque extendido produce una proyección plano z en la pantalla de la computadora para ayudar a su análisis, pero no afecta a los datos subyacentes, lo mismo es cierto para los ajustes de brillo y contraste, si es necesario).
- Medir la longitud de la zona analizada utilizando la herramienta Línea. La longitud de la línea se calcula y se añade a la tabla de datos (Figura 2B).
- Identificar los objetos que utilizan los 'Objetos de intensidad' filtro (modo de Medidas). Especifique un umbral de tal manera que las agrupaciones son sinápticaspuso de relieve y no-sináptica de fondo no es (Fig. 2C). La inclusión de un marcador independiente sináptica marcado con otro color puede ayudar a identificar inequívocamente las sinapsis. Sinapsis típicas van desde unos pocos a unos pocos cientos de voxels. Establecer el umbral de una vez usando una muestra de control, y lo utilizan para todas las muestras posteriores. Umbral cada muestra por separado es inaceptable porque introduce la posibilidad de sesgo del experimentador. Los objetos se seleccionan y se tabulan automáticamente (Figura 2D).
- Organizar y exportar los datos. Eliminar objetos de 2 o menos voxels, ya que por lo general son manchas de fondo. Estos pueden ser eliminados por filtrado adicionales, o durante su posterior análisis. Para facilitar su posterior eliminación, re-ordenar el archivo de datos "el tamaño del objeto 'ellos también lo harán todos los grupos juntos. Exportar los datos en formato CSV, lo que puede ser abierto por Microsoft Excel u otros programas de hoja de cálculo. Cada imagen produce un archivo de salida.
- Si Volocity suavesoftware son los métodos alternativos no están disponibles, para analizar Z-Plane proyecciones de los datos confocal se puede utilizar (por ejemplo ref. 7, o el análisis manual de uso de ImageJ), aunque en 3 dimensiones se pierde información (ver Discusión).
4. Los resultados representativos
El método de cuantificación que aparece debería ser capaz de distinguir entre las poblaciones de racimo de diferente brillo y volúmenes diferentes. Imágenes representativas y los correspondientes datos cuantitativos presentados en la Figura 3 muestran ejemplos de diferenciación sobre la base de estos parámetros. Como regla general, los resultados deben ajustarse a lo que es evidente para el ojo. En el caso de UNC-49 receptor de GABA inmunotinción el cordón nervioso ventral de C. elegans, todos los animales por lo general parecían muy similares en tamaño y madurez, y el total de los valores sinápticos de fluorescencia para un grupo de cinco gusanos (normalizada a la longitud del cordón nervioso analizados) mostró Error estándar valores de aproximadamente 10% de la media 4. La mutación genética y otros tratamientos experimentales (por ejemplo, exposición de drogas) pueden alterar no sólo el volumen y los valores de la intensidad y la distribución de frecuencias de grupos sinápticos, pero posiblemente el desarrollo del curso temporal y la sincronía de los gusanos, lo que lleva a una mayor variabilidad. Sin embargo, los resultados cuantitativos siempre debe reflejar lo que se puede apreciar visualmente y si no, la inspección de las imágenes y los objetos identificados por Volocity debe revelar donde ocurrió el error y sugerir las medidas correctivas, tales como re-umbral o eliminación de objetos artefactuales.

Figura 1. Preparación de síncrono C. culturas elegans. culturas sincrónicas se obtienen de este procedimiento, pues C. elegans arrestos de desarrollo y de la fase L1 larvas en la falta de alimentos, y se reanuda cuando el alimento se introduce.
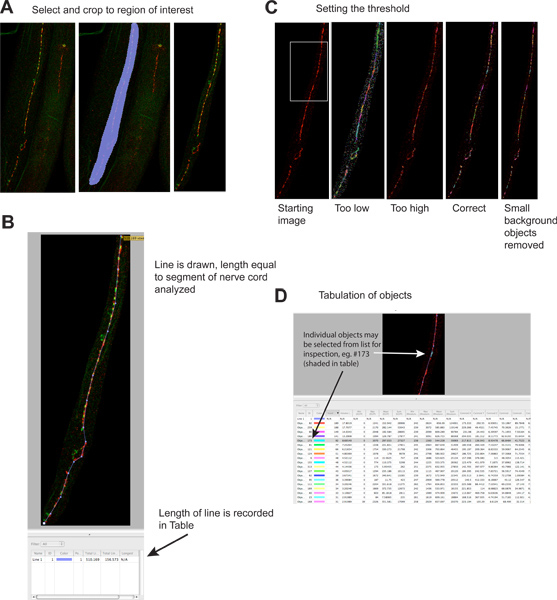
Figura 2. La cuantificación de puncta sináptica.
- Regiones extrañas de la imagen se recortan para reducir el tamaño de los archivos y aumentar la especificidad. Panel de la izquierda muestra a partir de la imagen, el panel medio muestra la región seleccionada, el panel derecho muestra la imagen después del recorte. El rojo es señal de la UNC-49 de inmunofluorescencia receptor GABA, la señal verde es sinaptobrevina-GFP (un marcador presináptico) se expresa en neuronas GABA presinápticos 4. Haga clic aquí para ver más grande la figura .
- Se traza una línea de la longitud del segmento de la médula nerviosa a analizar, y su longitud se graba automáticamente en la tabla de resultados. Esta información es necesaria para normalizar los datos sinápticas debido a la longitud de cordón nervioso analizable, que puede variar varias veces si gusanos se fragmentan durante la tinción.www.jove.com/files/ftp_upload/4090/4090fig2blarge.jpg "target =" _blank "> Haga clic aquí para ver más grande figura.
- Un umbral se aplica para identificar agrupaciones individuales sinápticas. Panel de la izquierda muestra la imagen antes de umbral; ejemplos de niveles de umbralización diferentes se muestran en paneles separados (señal verde se omite). Cada objeto identificado se representa en la imagen como una región coloreada. Tenga en cuenta la correspondencia entre los grupos sinápticos visualmente evidentes en el panel más a la izquierda y las regiones de colores en el panel derecho de la mayoría. Haga clic aquí para ver más grande la figura .
- Cada objeto identificado está en la lista por separado en la tabla de resultados. Objetos pueden ser seleccionados, y se destacan en la imagen para la inspección, si lo desea. Tenga en cuenta que la tabla contiene información para el rojo ("rodamina ') y verde (' EGFP ') canales, la información del canal verde es potencialmente engañoso ya que los objetos fueronidentificados con base estrictamente en la fluorescencia de color rojo. Este análisis también se puede realizar en las imágenes de un solo color. Haga clic aquí para ver más grande la figura .
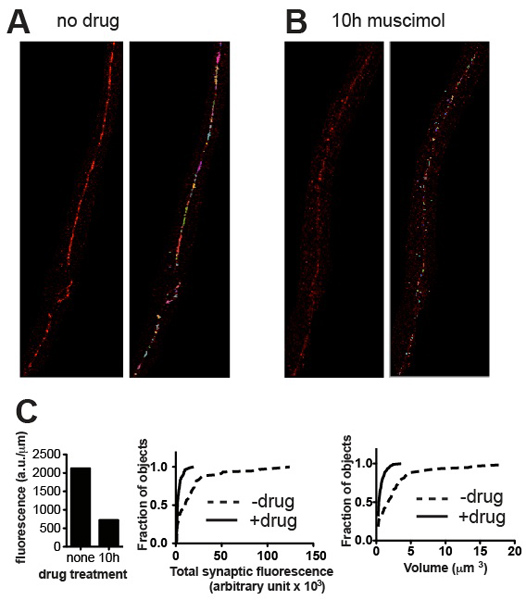
Figura 3. Los resultados representativos. Micrografías representativas de tipo salvaje C. elegans teñidas para UNC-49 antes de receptores de GABA (A) y después (B) el tratamiento con el muscimol, un agonista de los receptores GABA que provoca receptores para convertirse en downregulated después de una larga exposición. Los paneles muestran imágenes recortadas antes (izquierda) y después (derecha) de umbral y la eliminación de manchas pequeñas de fondo. (C) Las representaciones de los parámetros cuantitativos sinápticas de los modelos que figuran en (A) y (B): total de fluorescencia normalizada a la longitud del nervio espinal (izquierda), y los histogramas de probabilidad acumulativa de contenido individual de fluorescencia sinapsis (centro) y el volumen de sinapsis (right), lo que demuestra una reducción estadísticamente significativa en el contenido y el volumen sináptica inducida por la exposición agonista (n = 60 sinapsis para tratar, n = 115 sinapsis para muscimol tratado, p <0,001, test de Kolmogorov-Smirnov http://www.physics.csbsju .edu / stats / KS-test.html ).
Discusión
El método que aquí se presenta está diseñado para extraer parámetros cuantitativos de múltiples datos para grandes poblaciones de las sinapsis en C. elegans, al tiempo que maximiza la consistencia dentro de los grupos de tratamiento. Tres características de contribuir a estos objetivos. En primer lugar, inmunotinción se realiza en las poblaciones de gusano síncronos para asegurar que todos los animales tienen la misma edad. Este paso es crítico porque la regulación del desarrollo de los niveles de ex...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a A. Benham para ayudar con el desarrollo del protocolo. Este trabajo fue financiado por el NIH subvención NS06747 de BAB
Materiales
| Name | Company | Catalog Number | Comments | ||||||
| Nombre del software | Empresa | Comentarios (opcional) | |||||||
| Volocity v4.0 o superior | PerkinElmer / Improvisación | Revise su instalación local de imagen básica para el acceso a este software. Software de demostración está disponible en el sitio web de PerkinElmer. Este método requiere sólo el módulo de cuantificación de Volocity. | |||||||
| Tabla 2. Reactivos específicos y equipos. | |||||||||
| |||||||||
| Tabla 1. Soluciones. |
Referencias
- Christensen, M. A primary culture system for functional analysis of C. elegans neurons and muscle cells. Neuron. 33, 503-514 (2002).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods Cell Biol. 48, 3-29 (1995).
- Bettinger, J. C., Lee, K., Rougvie, A. E. Stage-specific accumulation of the terminal differentiation factor LIN-29 during Caenorhabditis elegans development. Development. 122, 2517-2527 (1996).
- Davis, K. M. Regulated lysosomal trafficking as a mechanism for regulating GABAA receptor abundance at synapses in Caenorhabditis elegans. Mol. Cell Neurosci. 44, 307-317 (2010).
- Finney, M., Ruvkun, G. The unc-86 gene product couples cell lineage and cell identity in C. elegans. Cell. 63, 895-905 (1990).
- Rowland, A. M. Presynaptic terminals independently regulate synaptic clustering and autophagy of GABAA receptors in Caenorhabditis elegans. J. Neurosci. 26, 1711-1720 (2006).
- Burbea, M. Ubiquitin and AP180 regulate the abundance of GLR-1 glutamate receptors at postsynaptic elements in C. elegans. Neuron. 35, 107-120 (2002).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Oda, S., Tomioka, M., Iino, Y. Neuronal plasticity regulated by the insulin-like signaling pathway underlies salt chemotaxis learning in Caenorhabditis elegans. J. Neurophysiol. 106, 301-308 (2011).
- Sankaranarayanan, S. The use of pHluorins for optical measurements of presynaptic activity. Biophys. J. 79, 2199-2208 (2000).
- McDonald, N. A. Generation and functional characterization of fluorescent, N-terminally tagged CB1 receptor chimeras for live-cell imaging. Mol. Cell Neurosci. 35, 237-248 (2007).
- Shakiryanova, D. Synaptic neuropeptide release induced by octopamine without Ca2+ entry into the nerve terminal. Proc. Natl. Acad. Sci. U. S. A. 108, 4477-4481 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados