A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
دراسة الحمض النووي حاجز الضرر باستخدام
* These authors contributed equally
In This Article
Summary
القيطم البيض هو نظام استخراج نموذجا مفيدا للتحقيق في نقطة تفتيش الحمض النووي من التلف. هذا البروتوكول هو لإعداد مستخلصات البيض القيطم والكواشف DNA حمل الضرر الحاجز. هذه التقنيات قابلة للتكيف مع مجموعة متنوعة من النهج DNA الضارة في دراسة الحمض النووي مما يشير الى نقطة التفتيش الضرر.
Abstract
على أساس يومي، وتتعرض الخلايا لمجموعة متنوعة من الشتائم الذاتية والبيئية. لمكافحة هذه الإهانات، تطورت الخلايا DNA حاجز الضرر يشير كآلية مراقبة لاستشعار الحمض النووي من التلف والاستجابات الخلوية مباشرة إلى الحمض النووي من التلف. هناك عدة مجموعات من البروتينات التي تسمى أجهزة الاستشعار، ومحولات الطاقة والمستجيبات المشاركة في الحمض النووي من التلف مما يشير الى نقطة تفتيش (الشكل 1). في هذا المسار المعقد يشير، ATR (ATM وRad3 ذات الصلة) هي واحدة من كاينيسات الرئيسية التي يمكن أن تستجيب لالحمض النووي من التلف والإجهاد النسخ المتماثل. يمكن تنشيط ATR الفوسفات ركائز لها المصب مثل Chk1 (كيناز حاجز 1). وبناء على ذلك، فسفرته والمفعلين Chk1 يؤدي إلى آثار المصب كثيرة في نقطة تفتيش DNA الضرر بما في ذلك الاعتقال دورة الخلية، وتفعيل النسخ، إصلاح الحمض النووي الضرر، وموت الخلايا المبرمج أو الشيخوخة (الشكل 1). عند تلف الحمض النووي، وعدم تفعيل نتائج الحمض النووي حاجز الضرر في unrepبثت الضرر، وبالتالي، عدم الاستقرار الجيني. ودراسة الحمض النووي حاجز الضرر توضيح كيفية الحفاظ على سلامة الخلايا الجينية وتوفير فهم أفضل لكيفية الأمراض التي تصيب الإنسان مثل السرطان، وتطوير.
القيطم المورق مقتطفات البيض والناشئة باعتبارها قوية خالية من الخلايا استخراج النظام النموذجي في الحمض النووي من التلف البحث الحاجز. وقد وصفت في البداية استخراج منخفضة السرعة (LSE) من قبل مجموعة Masui 1. إضافة لونين الحيوانات المنوية demembranated إلى نتائج LSE في تشكيل نواة حيث يتم نسخ DNA بطريقة محافظ جزئيا مرة واحدة في دورة الخلية.
يتم تشغيل إشارات حاجز ATR/Chk1-mediated مسار من الحمض النووي من التلف أو الإجهاد تكرار 2. وتستخدم حاليا طريقتين للحث على نقطة التفتيش الحمض النووي من التلف: النهج DNA الحمض النووي الضارة والأضرار محاكاة هياكل 3. يمكن أن يتسبب الحمض النووي من التلف بواسطة أشعة (UV) فوق البنفسجية، أشعة γ-، الميثيل methanesulfonate (MMS)، ميتوميسين C (MMC)، 4-nitroquinoline-1-أكسيد (4-NQO)، أو aphidicolin 3 و 4. هو وكيل MMS مؤلكل الذي يمنع تكرار الحمض النووي وينشط الحمض النووي من التلف ATR/Chk1-mediated نقطة تفتيش 4-7. أشعة فوق البنفسجية يؤدي أيضا الحمض النووي من التلف ATR/Chk1-dependent 8 نقطة تفتيش. الحمض النووي الأضرار محاكاة هيكل AT70 هو مجمع صلب من اثنين أليغنوكليوتيد] بولي (DA) 70 وبولي-70 (DT). وقد تم تطوير النظام في مختبر بيل AT70 دانفي ويستخدم على نطاق واسع للحث على نقطة تفتيش تابعة للإشارات ATR/Chk1 9-12.
هنا، نحن تصف بروتوكولات (1) لإعداد عصائر خالية من الخلايا البيض (LSE)، (2) لعلاج الحيوانات المنوية القيطم لونين مع اثنين من DNA مختلفة الإضرار النهج (MMS والأشعة فوق البنفسجية)، (3) لإعداد DNA الأضرار محاكاة هيكل AT70، و (4) لتحريك الحمض النووي من التلف ATR/Chk1-mediated تفتيش في بورصة لندن مع لونين الحيوانات المنوية التالفة أو DNA بنية الأضرار محاكاة.
Protocol
1. LSE إعداد
- يتم حقن الضفادع الإناث (القيطم المورق) مرتين لجمع البيض. الحقنة الأولى (فتيلة) هو 100 U PMSG (مصل الفرس الحامل موجهة الغدد التناسلية) في الضفدع. يجب أن تستعد الضفادع على الأقل قبل يومين من البيض حمل مد ومعبي الضفادع صالحة للاستعمال لمدة تصل إلى أسبوعين. لرئيس الضفادع، وضخ PMSG تحت الجلد في الحويصلات الليمفاوية الظهرية باستخدام حقنة 3 مل و 27 إبرة G.
- للحث على وضع البيض، وضخ 500 U قوات حرس السواحل الهايتية (موجهة للغدد التناسلية المشيمية البشرية) في الضفدع تحت الجلد معبي في الحويصلات الليمفاوية باستخدام إبرة الظهرية G 27. احتضان الضفادع في حقن الدلاء منفصلة تحتوي على 2 لتر من محلول 1X مارك لتعديل رينغر (MMR). تسمح الضفادع 14-20 ساعة لوضع البيض قبل المجموعة.
- إزالة الضفادع من الدلاء وتصب قبالة حل MMR حتى لا يتبقى حوالي 100 مل. الحصول على البيض من الدلاء عن طريق نقل البيض إلى كوب 250 مل.
- البيض Dejelly بإضافة 100 مل من 2٪ السيستين (ضبطالرقم الهيدروجيني إلى 7.8 مع KOH M 10). دوامة بلطف البيض مع الماصة باستور الزجاج المقلوب (0.7 سم في القطر) تقريبا كل ثانية 30. صب واستبدالها مع السيستين الطازجة مرتين خلال الحضانة. عملية dejellying اكتمال في حوالي 5-15 دقيقة عندما تشكل طبقة البيض أكثر مكثف في الجزء السفلي من الكأس.
- تجاهل حل السيستين ويغسل ثلاث مرات مع البيض MMR 0.25x. دوامة البيض في الحل من قبل الماصة الزجاج. ويتم تحديد "سيئة" البيض عن طريق التفتيش البصري هي بسيطة و"منتفخ" الأبيض في المظهر. فإن "سيئة" البيض تتراكم في مركز الدورق بعد دوامات. إزالة "سيئة" من قبل البيض الماصة باستور.
- غسل البيض مع البيض يزيس العازلة (ELB) ثلاث مرات. إزالة أي "سيئة" من قبل البيض إضافية الماصة باستور. صب البيض في أنبوب فالكون 14 مل.
- تدور في أنبوب فالكون لمدة 55 ثانية في 188 XG (1،100 دورة في الدقيقة) باستخدام IEC CL2 السريرية فوق المنضدة الطرد المركزي مع الدوار الدلو المتأرجح ضغط البيض. إزالة الزائدة من المخزن المؤقتأعلى طبقة البيض. إضافة 0.5 ميكرولتر من أبروتينين الأسهم Leupeptin / و 0.5 ميكرولتر من الأسهم في مثبط حركة الخلايا B مل من البيض المضغوط.
- أجهزة الطرد المركزي في 16500 XG البيض (10،000 دورة في الدقيقة) لمدة 15 دقيقة في 4 درجات مئوية باستخدام أجهزة الطرد المركزي بالإضافة إلى الكتب التي RC6 اسرع مع HB6 الدوار الدلو المتأرجح. بعد الطرد المركزي، والبيض هي مجزأة إلى ثلاث طبقات في الأنبوب: الدهون، واستخراج، وصفار / الصباغ من الأعلى إلى الأسفل، على التوالي. ثقب الجانب من الأنبوب الصقر في الجزء السفلي من طبقة استخراج الأوسط مع إبرة G 21. إزالة بعناية الإبرة التي قد عرقلت من إبرة ثقب من البلاستيك. اضافة الى وجود إبرة جديدة G 21 تعلق على حقنة 1 مل في موقع ثقب لجمع استخراج. نضح ببطء في استخراج حقنة لتجنب فقاعات الهواء والتلوث مع الدهون وصفار / الصباغ طبقات.
- وضع مقتطفات المبردة إلى 1.5 مل أنبوب microcentrifuge. لكل ملليلتر من استخراج البيض، إضافة الأسهم الكيميائية التالية في حلول للتركيز النهائي dicated (كما هو موضح بين قوسين): (1) 10 سيكلوهيكسيميد ميكرولتر (100 ميكروغرام / مل)؛ (2) 1 ميكرولتر أبروتينين / Leupeptin (10 ميكروغرام / مل لكل منهما)؛ (3) 1 ميكرولتر مثبط حركة الخلايا B (5 ميكروغرام / مل )؛ (4) 1 Dithiothreitol ميكرولتر (1 ملم)، و (5) 0.33 نوكودازول ميكرولتر (3 ميكروغرام / مل). عكس البيضة استخراج ما لا يقل عن 10 مرات بلطف. هذا هو LSE، الذي يجب أن يتم الطازجة واستخدامها في غضون 4 ساعة. للخطر نوعية LSE بعد 4 ساعات أو تجميد ذوبان الجليد.
2. علاج الحيوانات المنوية مع النهج الكروماتين DNA الضارة
- إعداد الحيوانات المنوية طبيعية لونين وفقا لطريقة الموصوفة سابقا 13.
- إعداد MMS المعالجة لونين الحيوانات المنوية
- إعادة تعليق العادية لونين الحيوانات المنوية في 0.5 مل العازلة X.
- إضافة ~ 5،5 ميكرولتر من MMS (9.1 M متوفرة للبيع) إلى 500 ميكرولتر معلق لونين إلى تركيز النهائي من 100 ملم.
- احتضان لونين الحيوانات المنوية في أنبوب microcentrifuge في درجة حرارة الغرفة لمدة 30 دقيقة مع التناوب.
- تدور مأنبوب icrocentrifuge في حدود 686 XG (2،100 دورة في الدقيقة) لمدة 10 دقيقة في درجة حرارة الغرفة باستخدام أجهزة الطرد المركزي CL2 IEC السريرية مع الدوار الدلو المتأرجح ومحولات أنبوب.
- تجاهل طاف بيليه و resuspend في 0.5 مل من الاحتياطي X زائد BSA (3٪)، DTT (0.1 مم) وأبروتينين / Leupeptin (10 ميكروغرام / مل لكل منهما).
- كرر الخطوات (4) و (5) مرتين لغسل الحيوانات المنوية لونين.
- تحديد تركيز الحيوانات المنوية من لونين مع عدادة الكريات وتمييع الحيوانات المنوية إلى 100،000 / ميكروليتر. توفير 5 ميكرولتر مأخوذة في -80 ° C الفريزر لاستخدامها مرة أخرى.
- إعداد UV المعالجة لونين الحيوانات المنوية
- إضافة المبلغ المطلوب (على سبيل المثال 10 ميكرولتر) من لونين الحيوانات المنوية طبيعية على سطح قطعة من Parafilm.
- وضع Parafilm إلى crosslinker UV. تعيين المعلمة المطلوب الطاقة، اعتمادا على تجربتك، والبدء في تلف الحيوانات المنوية لونين عن طريق ضوء الأشعة فوق البنفسجية. على سبيل المثال، فإنه يأخذ حوالي 21 ثانية للوصول إلى 1000 ج / م 2.
- بعد UV irraوينبغي أن يضاف diation، لونين الحيوانات المنوية المعالجة UV لمقتطفات البيض على الفور.
3. إعداد الهيكل الأضرار-DNA محاكاة (AT70)
- 2 حل أليغنوكليوتيد] الاصطناعية بولي (DA) 70 (تسمى A70) وبولي-70 (DT) (تسمى T70) في الماء إلى تركيز من 2 ميكروغرام / ميكرولتر، على التوالي.
- إضافة 100 ميكرولتر من A70 و 100 ميكرولتر من T70 إلى واحد 1.5 مل أنبوب microcentrifuge. تغلي مختلطة حل الاصطناعية بنسبة ضئيلة لمدة 5 دقائق في 95 ° C في heatblock.
- تأخذ حمام كتلة جافة من أصل (مع أنبوب يحتوي على خليط AT في ذلك)، والسماح لها يبرد إلى درجة حرارة الغرفة على مقعد المختبر. هذا التعديل درجة حرارة 45-60 يستغرق حوالي دقيقة.
- تبريد الخليط هو AT70 مع تركيز النهائي من 2 ميكروغرام / ميكرولتر. مخزن 10 ميكرولتر من AT70 مأخوذة في الفريزر -20 درجة مئوية لمدة استخدامها مرة أخرى.
4. التسبب في حاجز الحمض النووي من التلف في بورصة لندن مع الحيوانات المنوية التالفة الكروماتين أو الحمض النووي من التلفمحاكاة هيكل-
- حمل DNA حاجز الضرر في بورصة لندن مع لونين الحيوانات المنوية التالفة
- إضافة 50 ميكرولتر من LSE لأنبوب مل ميكروسنتريفوج 1.5 و مكملا له مع 1 ميكرولتر من خليط الطاقة و 2 ميكرولتر من لونين الحيوانات المنوية التالفة (تركيز النهائي ~ 4000 الحيوانات المنوية / ميكرولتر رد فعل).
- احتضان الأنبوب رد فعل في درجة حرارة الغرفة لمدة 90 دقيقة ونفض الغبار الأنبوب كل 10 دقيقة.
- الاستغناء 1 ميكرولتر من خليط التفاعل على شريحة المجهر تستكمل مع 1 ميكرولتر من محلول الصبغة النووية بعد 30 دقيقة الحضانة. وضع غطاء على زلة خليط التفاعل وتحقق من وجود تشكيل نواة عبر المجهر مضان. عادة، سوف تشكل نواة مستديرة بعد 30 دقيقة من الحضانة، مشيرا إلى تكرار الحمض النووي بدأت.
- يستغرق 10 ميكرولتر من خليط التفاعل الى 90 ميكرولتر من العازلة العينة. ويتم تحليل العينات عن طريق استخدام الألغام المضادة للimmunoblotting P-S344 Chk1 أو الأجسام المضادة المقاومة للChk1.
- حمل DNA حاجز الضرر في بورصة لندن معAT70
- إضافة 50 ميكرولتر من LSE لأنبوب مل 1.5 ميكروسنتريفوج تستكمل مع 1 ميكرولتر من خليط الطاقة و 1.6 ميكرولتر من الأسهم Tautomycin.
- إضافة ميكرولتر من 1،25 مسبقة الصنع AT70 (2 ميكروغرام / ميكرولتر) أو الماء (كما المراقبة السلبية) إلى كل رد فعل. احتضان ردود الفعل في درجة حرارة الغرفة لمدة 90 دقيقة. نفض الغبار الأنابيب رد فعل كل 10 دقيقة.
- إضافة 10 ميكرولتر من خليط التفاعل الى 90 ميكرولتر من العازلة العينة. يتم فحص العينات عن طريق استخدام الألغام المضادة للimmunoblotting P-S344 Chk1 أو الأجسام المضادة المقاومة للChk1.
5. ممثل النتائج
يمكن للونين الحيوانات المنوية التالفة أو DNA بنية الأضرار محاكاة تحريك الحمض النووي من التلف ATR/Chk1-mediated تفتيش في استخراج القيطم نظام البيض. يبين الشكل 2A أن يدفع MMS Chk1 الفسفرة في Ser344 (P-S344 Chk1)، وهو مؤشر ATR تفعيل كيناز. 2B الرقم يدل على ان AT70، على DNA الأضرار محاكاة structure، يؤدي أيضا Chk1 الفسفرة. وتستخدم مجموع العينات Chk1 وتحميل عناصر التحكم في كل من الأمثلة.
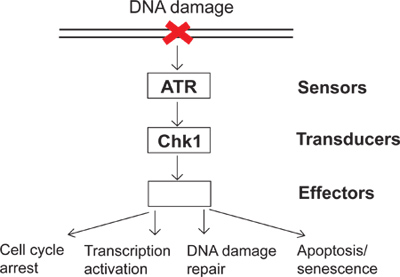
الشكل 1. رسم تخطيطي للتفتيش إشارة DNA الضرر.
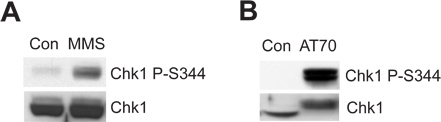
الشكل 2. هو فعل Chk1 الفسفرة من قبل أي من العلاجات MMS أو AT70 في مقتطفات البيض القيطم. (A) وحضنت MMS المتضررة لونين الحيوانات المنوية (MMS) أو العادي لونين الحيوانات المنوية (كون) في مقتطفات لمدة 90 دقيقة البيض. يتم فحص Chk1 الفسفرة في Ser344 (P-S344 Chk1) ومجموع Chk1 في مقتطفات البيض عبر immunoblotting. (B) AT70 أو الماء (CON) تضاف إلى مقتطفات البيض، على التوالي. ويتم تحليل العينات أيضا عبر immunoblotting كما في (A).
Discussion
هناك العديد من المزايا في دراسة الحمض النووي من التلف باستخدام حاجز القيطم مقتطفات البيض. استخدام مستخلصات البيض يوفر كمية كبيرة من خلايا خالية مقتطفات متزامنة في الطور البيني من دورة الخلية. ويمكن للمستخلصات البيض بسهولة وبتكلفة زهيدة بها. فمن السهل نسبيا على ...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
ويدعم هذا العمل في جزء من الأموال التي تقدمها جامعة نورث كارولينا في شارلوت، اتشوفيا الأساس صندوق للتميز أعضاء هيئة التدريس، ومنحة من NIGMS (R15GM101571).
Materials
| Name | Company | Catalog Number | Comments |
| الكواشف | |||
| مكافحة P-S344 Chk1 الأجسام المضادة | خلية اشارة | 2348L | |
| الأجسام المضادة لمكافحة Chk1 | سانتا كروز | SC7898 | |
| أبروتينين | النائب Biomedicals | 0219115880 | |
| سيكلوهيكسيميد | سيجما | C7698-5G | |
| مثبط حركة الخلايا B | EMD | 250233 | |
| Dithiothreitol (DTT) | VWR | JTF780-2 | |
| قوات حرس السواحل الهايتية | سيجما | CG10-10VL | |
| L-سيستين | سيجما | C7352-1KG | |
| Leupeptin | VWR | 97063-922 | |
| methanesulfonate الميثيل (MMS) | سيجما | 129925-5G | |
| نوكودازول | سيجما | M1404-2MG | |
| PMSG | Calbiochem | 367222 | |
| عينة العازلة | سيجما | S3401 | |
| Tautomycin | واكو كيماويات USA | 209-12041 | |
| معدات | |||
| دلو لوضع البيض | Rubbermaid المنتجات التجارية | 6308 | |
| CL2 IEC الطرد المركزي مع الدوار الدلو المتأرجح | الحرارية العلمية | 004260F | |
| HB6 الدوار الدلو المتأرجح | الحرارية العلمية | 11860 | |
| بالإضافة إلى الكتب التي RC6 الطرد المركزي اسرع | الحرارية العلمية | 46910 | |
| UV crosslinker | UVP | 95-0174-01 | |
| حلول | |||
| 1X MMR | 100 ملي مول كلوريد الصوديوم، بوكل 2 مم، 0.5 مم MgSO 4، 2.5 مم CaCl 2، 5 ملي HEPES، وضبط درجة الحموضة إلى 7.8 مع هيدروكسيد الصوديوم M 10 | ||
| أبروتينين / Leupeptin الأسهم | 10 ملغ / مل في كل من المياه. تخزين 20 ميكرولتر مأخوذة في C. ° -80 | ||
| العازلة X | السكروز 0.2 م، 80 مم بوكل، 15 مم كلوريد الصوديوم، 5 ملم MgCl 2، 1 ملم EDTA، HEPES 10 مم، ضبط الرقم الهيدروجيني إلى 7.5 بواسطة حمض الهيدروكلوريك | ||
| سيكلوهيكسيميد الأسهم | 10 ملغ / مل في الماء. تخزين 1 مليلتر مأخوذة في -20 ° C. | ||
| مثبط حركة الخلايا B الأسهم | 5 ملغ / مل في DMSO. تخزين 20 ميكرولتر مأخوذة في -20 ° C. | ||
| Dithiothreitol (DTT) سوق الأسهم | 1 M في الماء. تخزين 1 مليلتر مأخوذة في -20 ° C. | ||
| ELB | السكروز 0.25 م، 1 ملم DTT، 50 ميكروغرام / مل سيكلوهيكسيميد، 2.5 ملم MgCl 2 و 50 ملي بوكل، HEPES 10 مم، pH7.7 | ||
| نوكودازول الأسهم | 10 ملغ / مل في DMSO. تخزين 5 ميكرولتر مأخوذة في C. ° -80 | ||
| خليط الطاقة | 375 ملي فوسفات الكرياتين، 50 مم ATP، و 25 ملم MgCl 2. يتم حفظ مأخوذة في C. ° -80 | ||
| حل صبغة النووية | 0.4 ميكروغرام / مل هويشت 33258، الجلسرين 25٪(ت / ت)، في 1X PBS | ||
| Tautomycin الأسهم | 100 ميكرومتر في DMSO. تخزين 10 ميكرولتر مأخوذة في C. ° -80 |
References
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cimprich, K. A., Cortez, D. ATR: an essential regulator of genome integrity. Nat. Rev. Mol. Cell Biol. 9 (8), 616-627 (2008).
- Lupardus, P. J., Van, C., Cimprich, K. A. Analyzing the ATR-mediated checkpoint using Xenopus egg extracts. Methods. 41 (2), 222-231 (2007).
- Lupardus, P. J., Byun, T., Yee, M. C., Hekmat-Nejad, M., Cimprich, K. A. A requirement for replication in activation of the ATR-dependent DNA damage checkpoint. Genes Dev. 16 (18), 2327-2332 (2002).
- Stokes, M. P., Van Hatten, R., Lindsay, H. D., Michael, W. M. DNA replication is required for the checkpoint response to damaged DNA in Xenopus egg extracts. J. Cell Biol. 158 (5), 863-872 (2002).
- Kato, K., Strauss, B. Accumulation of an intermediate in DNA synthesis by HEp.2 cells treated with methyl methanesulfonate. Proc. Natl. Acad. Sci. U.S.A. 71 (5), 1969-1973 (1974).
- Paulovich, A. G., Hartwell, L. H. A checkpoint regulates the rate of progression through S phase in S. cerevisiae in response to DNA damage. Cell. 82 (5), 841-847 (1995).
- Guo, Z., Kumagai, A., Wang, S. X., Dunphy, W. G. Requirement for Atr in phosphorylation of Chk1 and cell cycle regulation in response to DNA replication blocks and UV-damaged DNA in Xenopus egg extracts. Genes Dev. 14 (21), 2745-2756 (2000).
- Jazayeri, A., Balestrini, A., Garner, E., Haber, J. E., Costanzo, V. Mre11-Rad50-Nbs1-dependent processing of DNA breaks generates oligonucleotides that stimulate ATM activity. EMBO. J. 27 (14), 1953-1962 (2008).
- Kumagai, A., Dunphy, W. G. Claspin, a novel protein required for the activation of Chk1 during a DNA replication checkpoint response in Xenopus egg extracts. Mol. Cell. 6 (4), 839-849 (2000).
- Yan, S., Lindsay, H. D., Michael, W. M. Direct requirement for Xmus101 in ATR-mediated phosphorylation of Claspin bound Chk1 during checkpoint signaling. J. Cell Biol. 173 (2), 181-186 (2006).
- Shiotani, B., Zou, L. Single-stranded DNA orchestrates an ATM-to-ATR switch at DNA breaks. Mol. Cell. 33 (5), 547-558 (2009).
- Tutter, A. V., Walter, J. C. Chromosomal DNA replication in a soluble cell-free system derived from Xenopus eggs. Methods Mol. Biol. 322, 121-137 (2006).
- Cross, M. K., Powers, M. Preparation and Fractionation of Xenopus laevis Egg Extracts. J. Vis. Exp. (18), e891 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved