このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
用いたDNA損傷チェックポイントの研究
要約
アフリカツメガエルの卵抽出物は、DNA損傷チェックポイントを調査するために有用なモデル系である。このプロトコルは、 アフリカツメガエルの卵抽出物とDNA損傷チェックポイント誘導試薬の調製のためのものです。これらの技術は、DNA損傷チェックポイントシグナル伝達の研究ではDNA損傷の様々なアプローチに適応可能である。
要約
毎日のように、細胞は内因性と環境の様々な侮辱にさらされる。これらの侮辱に対抗するために、細胞はDNA損傷に対するDNA損傷と直接的な細胞応答を検知する監視機構としてシグナリングDNA損傷チェックポイントを進化させてきた。 DNA損傷チェックポイントシグナル( 図1)に関わるセンサ、トランスデューサとエフェクターと呼ばれるタンパク質のいくつかのグループがあります。この複雑なシグナル伝達経路では、ATR(ATMとRAD3関連)がDNA損傷と複製ストレスに応答することができる主要なキナーゼの一つである。活性化されたATRは、そのようなのChk1(チェックポイントキナーゼ1)のような、その下流の基質をリン酸化することができます。その結果、リン酸化され、活性化されChk1は、細胞周期の停止、転写活性化、DNA損傷修復、アポトーシスや老化( 図1)を含むDNA損傷チェックポイントには多くの下 流効果につながる。 DNAが損傷されると、unrepでDNA損傷チェックポイントの結果を有効にするには失敗放映された被害と、その後、ゲノム不安定性。 DNA損傷チェックポイントの研究では、細胞は、ゲノムの完全性を維持する方法を解明し、癌などの方法ヒト疾患のより良い理解を提供し、開発していきます。
アフリカツメガエル卵抽出液は、DNA損傷チェックポイントの研究に強力な無細胞抽出液をモデル系として浮上している。低速抽出(LSE)は、当初、増井グループ1によって記述されていた。 DNAは細胞周期ごとに必ず一度、半保存方法で複製されている核形成のLSEの結果にdemembranated精子クロマチンの追加。
ATR/Chk1-mediatedチェックポイントシグナル伝達経路はDNA損傷や複製ストレス2によってトリガされます。 DNA損傷のアプローチとDNA損傷を模倣構造3:2つの方法は、現在、DNA損傷チェックポイントを誘導するために使用されています。 DNA損傷は、紫外線(UV)照射、γ線照射、メチルメタンによって誘導することができるesulfonate(MMS)、マイトマイシンC(MMC)、4 -ニトロキノリン-1 -オキシド(4-NQO)、またはアフィジコリン3、4。 MMSはDNA複製を阻害し、ATR/Chk1-mediated DNA損傷チェックポイントの活性化4-7アルキル化剤である。 UV照射もATR/Chk1-dependent DNA損傷チェックポイント8をトリガします 。 DNA損傷模倣構造AT70は、2つのオリゴヌクレオチド、ポリ - (DA)70とポリ(dT)を70のアニールされた複合体である。 AT70システムはビルダンフィーの研究室で開発したと9月12日 、広くATR/Chk1チェックポイントシグナル伝達を誘導するために使用されています。
ここでは、(2)DNA損傷模倣構造を準備するために2つの異なるDNA損傷のアプローチ(MMSとUV)、(3)でアフリカツメガエルの精子クロマチンを治療するために、無細胞卵抽出(LSE)を準備するためのプロトコルは、(1)について説明AT70、(4)損傷した精子クロマチンまたはDNA損傷を模倣する構造を持つLSEでATR/Chk1-mediated DNA損傷チェックポイントをトリガします。
プロトコル
1。 LSEの準備
- 雌のカエル( アフリカツメガエル ) は採卵のために二度注射する。最初の注入(プライミング)は、カエルあたり100 U PMSG(妊馬血清性性腺刺激ホルモン)です。カエルは、少なくとも2日間卵を敷設し、下塗りしたカエルを誘導する前に下塗りしなければならない最大2週間のために使用可能である。素数カエルに、3 mlのシリンジと27Gの針を用いて背部リンパ嚢の皮下にPMSG注射する。
- 産卵を誘発するために、27Gの針を用いて背側リンパ嚢の皮下にプライミングカエル当たり500 UのhCG(ヒト絨毛性ゴナドトロピン)を注入。 1Xマルクの改変リンゲル液(MMR)の2リットルを含む別々のバケツに注入されたカエルをインキュベートする。カエルのコレクションの前に卵を産むために14から20時間を許可します。
- バケツからカエルを取り出して、約100ミリリットルを退場するまでのMMRソリューションをオフに注ぐ。 250mlビーカーに卵を転送することによって、バケットから卵を入手してください。
- 2%システインの100ミリリットル(調整を加えることによってDejellyの卵10 MのKOHでpHを7.8〜)。倒立ガラスパスツールピペット(直径0.7センチメートル)は約30秒ごとと静かに回して卵を。インキュベーション中にデカントし、二回新鮮なシステインと交換してください。卵はビーカーの底でより凝縮層を形成するときdejellyingプロセスは、約5〜15分で完了します。
- システイン溶液を捨て、0.25x、MMRで卵を3回洗浄する。ガラスピペットによる溶液中の卵を渦巻。 "Bad"の卵は簡単な目視検査によって決定され、外観は白の "真綿"がされています。 "悪い"卵が渦巻く後にビーカーの中心に蓄積されます。パスツールピペットにより "悪い"卵を削除します。
- 卵の溶解緩衝液(ELB)で3回卵を洗います。パスツールピペットにより、任意の付加的な "悪い"卵を削除します。 14ミリリットルのファルコンチューブに卵を入れて。
- 卵をコンパクトにし、スウィングローターでCL2 IEC臨床卓上型遠心機を用いて188×gで(1,100 rpm)で55秒間ファルコンチューブを回転させます。から過剰なバッファを削除卵層の上部。アプロチニン/ロイペプチン株式及び圧密卵のmlあたりサイトカラシンBの株式の0.5μlの0.5μlを添加する。
- ℃のHB6スウィングローターのソーバルRC6プラス超高速遠心機を用いて4℃で15分間16500 x g(10,000 rpm)以上で卵を遠心分離します。遠心分離後、卵がチューブ内の3層に分画されています:それぞれ脂質、エキス、卵黄/上から下への顔料、。穿刺21Gの針で真ん中抽出層の下部のファルコンチューブの側面。穿刺針はプラスチックを妨げることがあるので慎重に針を外します。抽出液を集めるために穿刺部位に1mlシリンジに取り付けられた新鮮な21Gの針を挿入します。ゆっくり脂質と卵黄/顔料層と気泡や汚染を避けるために、シリンジに抽出液を吸引除去する。
- 冷やした1.5 mlのマイクロチューブに抽出物を置きます。卵抽出物の各ミリリットルの場合は、内に次のような化学原液を追加dicated最終濃度(括弧内):(1)10μlのシクロヘキシミド(100μg/ ml)を、(2)を1μlアプロチニン/ロイペプチン(10μg/ mlの各々)、(3)1μlのサイトカラシンB(5μg/ mlの)、(4)1μlのジチオスレイトール(1mM)を、(5)0.33μlのノコダゾール(3μg/ ml)を。卵は優しく少なくとも10倍を抽出反転。これは新鮮な作られ、4時間以内に使用しなければならないLSEです。 LSEの品質は4時間または凍結融解後に侵害された。
2。 DNA損傷アプローチと精子クロマチンの治療
- 以前13に記載の方法に従って、通常の精子クロマチンを準備します。
- MMSの処理精子クロマチンを調製
- 0.5ミリリットルバッファXに正常な精子クロマチンを再懸濁し
- 100 mMの最終濃度にクロマチンを再懸濁し500μlにMMSの〜5.5μL(株式の9.1 M)を追加します。
- 回転しながら30分間、室温で遠心管中の精子クロマチンをインキュベートする。
- メートルを紡ぐスウィングローターとチューブ·アダプター付きIEC CL2臨床遠心分離機を用いて室温で10分間、686×gで(2,100 rpm)でicrocentrifugeチューブ。
- 上清を捨て、バッファXプラスBSA(3%)、DTT(0.1 mM)およびアプロチニン/ロイペプチン(10μg/ mlの各)0.5 mlにペレットを再懸濁します。
- 手順(4)を繰り返し、(5)倍精子クロマチンを洗浄する。
- 血球計数器で精子クロマチンの濃度を決定し、10万精子/μlに希釈します。さらに使用するために-80℃の冷凍庫に5μlのアリコートを保存します。
- 紫外線処理した精子クロマチンを調製
- パラフィルムの片の表面に正常な精子クロマチンの所望の量( 例えば、10μl)を追加します。
- 紫外線架橋剤にパラフィルムを置きます。あなたの実験に応じて、所望のエネルギーパラメータを設定し、UV光を介して精子クロマチンを傷つけ始める。例えば、それは、1,000 J / mの2に到達するのに約21秒かかります。
- 紫外線IRRA後にdiation、紫外線処理した精子クロマチンはすぐに卵抽出物に加えられるべきです。
3。 DNA損傷模倣構造の作製(AT70)
- それぞれ2μg/μLの濃度に水で70(T70と称する)ポリ(dT)を70(DA) - ポリ(A70と称する)と2つの合成オリゴヌクレオチドを溶かす。
- 1 1.5 mlのマイクロチューブに100μlのA70とT70の100μlを添加する。 heatblockで95°Cで5分のための混合合成オリゴ溶液を沸騰。
- 乾燥浴ブロックを取り出す(その中に混合AT入ったチューブ付き)、それは実験台の上に室温まで冷却させます。この温度調整は約45から60分かかります。
- 冷却された混合物は2μg/μlの最終濃度はAT70です。さらに使用するために-20℃の冷凍庫でAT70アリコートのストアを10μl。
4。損傷した精子クロマチンやDNA損傷とLSEにおけるDNA損傷チェックポイントをトリガ模倣構造
- 損傷した精子クロマチンとLSEにおけるDNA損傷チェックポイントを誘導
- 1.5 mlのマイクロチューブにLSEの50μlを添加し、エネルギー混合液1μlおよび損傷精子クロマチン(最終濃度4000〜精子/μl反応系)を2μlとそれを補完するものです。
- 90分間室温で反応管をインキュベートし、10分ごとにチューブをフリック。
- 30分間インキュベートした後、核色素溶液1μlを補った顕微鏡スライド上に、反応混合物を1μlを分注する。反応混合物の上にカバースリップを置き、蛍光顕微鏡を介して、核形成を確認してください。典型的には、円形の核は、DNA複製が開始したことを示す、インキュベーションの30分後に形成されます。
- サンプルバッファー90μlのに反応混合物10μlを取る。試料は抗Chk1のP-S344または抗Chk1の抗体を用いたイムノブロットによって分析されています。
- とLSEにおけるDNA損傷チェックポイントを誘導AT70
- エネルギー混合物の1μlとTautomycin株式の1.6μlで補わ1.5 mlのマイクロチューブにLSEの50μlを添加する。
- 各反応に既製AT70(2μg/μLの場合)または水(陰性対照として)1.25μlを添加する。 90分間室温で反応をインキュベートする。反応チューブを10分毎にフリックします。
- サンプルバッファー90μlのに反応混合物の10μlを追加します。試料は抗Chk1のP-S344または抗Chk1の抗体を用いた免疫を介して検査されます。
5。代表的な結果
損傷した精子クロマチンまたはDNA損傷を模倣する構造はアフリカツメガエル卵抽出系におけるATR/Chk1-mediated DNA損傷チェックポイントをトリガすることができます。 図2Aは MMSがの指標である、Ser344(CHK1 P-S344)でChk1のリン酸化を誘導することを示していますATRキナーゼの活性化。 図2Bに示すDNA損傷模倣STRUとしてそのAT70、影も、Chk1のリン酸化をトリガします。合計Chk1のサンプルは両方の例でコントロールを読み込むとして使用されています。
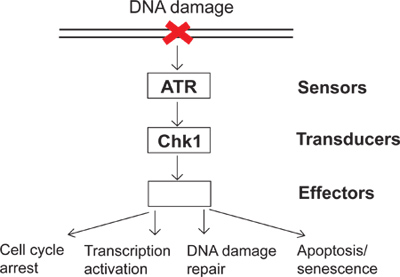
図1。 DNA損傷チェックポイントシグナル伝達の図。
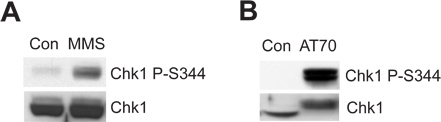
図2。 Chk1のリン酸化は、 アフリカツメガエルの卵抽出物中のMMSかAT70の治療のいずれかによって引き起こされる。()、MMS、損傷の精子クロマチン(MMS)、または通常の精子クロマチン(CON)を90分間卵抽出液中でインキュベートされる。 Chk1のSer344のリン酸化(CHK1 P-S344)と卵抽出物中の総Chk1のは、免疫ブロット法を介して検査されます。 (B)はAT70または水(CON)は、それぞれ、卵抽出液中に添加されています。サンプルはまた、()のようにして免疫ブロッティングによって分析されています。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
アフリカツメガエルの卵抽出液を用いたDNA損傷チェックポイントを研究する際にはいくつかの利点があります。卵抽出物の使用は、細胞周期の間期で同期無細胞抽出液を大量に提供しています。卵抽出物を容易かつ安価に行うことができます。これは、DNAやクロマチンを損傷すると卵抽出液から目的タンパク質をimmunodepleting後のDNA損傷チェックポイントの欠陥を明らかにすることは比...
Access restricted. Please log in or start a trial to view this content.
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、ノースカロライナ大学シャーロット校、教員の卓越性のためのワコビア基礎基金、NIGMS(R15GM101571)からの助成金によって提供された資金によって部分的にサポートされています。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | |||
| アンチChk1のP-S344抗体 | 細胞シグナリング | 2348L | |
| 抗Chk1の抗体 | サンタクルス | SC7898 | |
| アプロチニン | MPバイオメディカル | 0219115880 | |
| シクロヘキシミド | シグマ | C7698-5G | |
| サイトカラシンB | EMD | 250233 | |
| ジチオスレイトール(DTT) | VWR | JTF780-2 | |
| hCGの | シグマ | CG10-10VL | |
| L-システイン | シグマ | C7352-1KG | |
| ロイペプチン | VWR | 97063-922 | |
| メタンスルホン酸メチル(MMS) | シグマ | 129925-5G | |
| ノコダゾール | シグマ | M1404-2MG | |
| PMSG | カルビオケム | 367222 | |
| サンプルバッファー | シグマ | S3401 | |
| Tautomycin | 和光ケミカルUSA | 209から12041 | |
| 機器 | |||
| 産卵用のバケツ | ラバーメイドコマーシャル製品 | 6308 | |
| スウィングローターとCL2のIEC遠心分離機 | サーモサイエンティフィック | 004260F | |
| HB6スイングバケットローター | サーモサイエンティフィック | 11860 | |
| ソーバルRC6プラス超高速遠心機 | サーモサイエンティフィック | 46910 | |
| UVクロスリンカー | UVP | 95-0174-01 | |
| ソリューション | |||
| 1X MMR | 100mMのNaCl、2 mMの塩化カリウム、0.5mMのMgSO 4を 、2.5 mMのCaCl 2、5mMのHEPESは、10M NaOHで7.8にpHを調整 | ||
| アプロチニン/ロイペプチン株式 | 水に10 mg / mlの各。 -80℃で、20μlのアリコートを保存 | ||
| バッファX | 0.2 Mスクロース、80mMのKClを、15mMのNaCl、5mMのMgCl 2、1mMのEDTA、10mMのHEPESは、HClでpHを7.5に調整 | ||
| シクロヘキシミド株式 | 1水中で0 mg / mlである。 -20℃で保存して1mlのアリコート | ||
| サイトカラシンB株式 | DMSO中5 mg / mlである。 -20℃で、20μlのアリコートを保存 | ||
| ジチオスレイトール(DTT)の株式 | 水の中の1 M。 -20℃で保存して1mlのアリコート | ||
| ELB | 0.25Mスクロース、1mMのDTT、50μg/ mlのシクロヘキシミド、2.5mMのMgCl 2、50mMのKCl、10mMのHEPES、pH7.7 | ||
| ノコダゾール株式 | DMSO中10 mg / mlである。 -80℃で5μlのアリコートを保存 | ||
| エネルギー混合 | 375 mMのクレアチンリン酸、50mMのATP、および25 mMのMgCl 2。アリコートを-80℃で保存されます | ||
| 核色素溶液 | 0.4μg/ mlのヘキスト33258、25%グリセロール(v / v)を、1×PBS中 | ||
| Tautomycin株式 | DMSO中の100μM。 -80℃で10μlアリコートを保存 |
参考文献
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cimprich, K. A., Cortez, D. ATR: an essential regulator of genome integrity. Nat. Rev. Mol. Cell Biol. 9 (8), 616-627 (2008).
- Lupardus, P. J., Van, C., Cimprich, K. A. Analyzing the ATR-mediated checkpoint using Xenopus egg extracts. Methods. 41 (2), 222-231 (2007).
- Lupardus, P. J., Byun, T., Yee, M. C., Hekmat-Nejad, M., Cimprich, K. A. A requirement for replication in activation of the ATR-dependent DNA damage checkpoint. Genes Dev. 16 (18), 2327-2332 (2002).
- Stokes, M. P., Van Hatten, R., Lindsay, H. D., Michael, W. M. DNA replication is required for the checkpoint response to damaged DNA in Xenopus egg extracts. J. Cell Biol. 158 (5), 863-872 (2002).
- Kato, K., Strauss, B. Accumulation of an intermediate in DNA synthesis by HEp.2 cells treated with methyl methanesulfonate. Proc. Natl. Acad. Sci. U.S.A. 71 (5), 1969-1973 (1974).
- Paulovich, A. G., Hartwell, L. H. A checkpoint regulates the rate of progression through S phase in S. cerevisiae in response to DNA damage. Cell. 82 (5), 841-847 (1995).
- Guo, Z., Kumagai, A., Wang, S. X., Dunphy, W. G. Requirement for Atr in phosphorylation of Chk1 and cell cycle regulation in response to DNA replication blocks and UV-damaged DNA in Xenopus egg extracts. Genes Dev. 14 (21), 2745-2756 (2000).
- Jazayeri, A., Balestrini, A., Garner, E., Haber, J. E., Costanzo, V. Mre11-Rad50-Nbs1-dependent processing of DNA breaks generates oligonucleotides that stimulate ATM activity. EMBO. J. 27 (14), 1953-1962 (2008).
- Kumagai, A., Dunphy, W. G. Claspin, a novel protein required for the activation of Chk1 during a DNA replication checkpoint response in Xenopus egg extracts. Mol. Cell. 6 (4), 839-849 (2000).
- Yan, S., Lindsay, H. D., Michael, W. M. Direct requirement for Xmus101 in ATR-mediated phosphorylation of Claspin bound Chk1 during checkpoint signaling. J. Cell Biol. 173 (2), 181-186 (2006).
- Shiotani, B., Zou, L. Single-stranded DNA orchestrates an ATM-to-ATR switch at DNA breaks. Mol. Cell. 33 (5), 547-558 (2009).
- Tutter, A. V., Walter, J. C. Chromosomal DNA replication in a soluble cell-free system derived from Xenopus eggs. Methods Mol. Biol. 322, 121-137 (2006).
- Cross, M. K., Powers, M. Preparation and Fractionation of Xenopus laevis Egg Extracts. J. Vis. Exp. (18), e891(2008).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved