Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Etude de l'ADN à l'aide de Checkpoint dommages
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Xenopus oeuf extrait est un système modèle utile pour étudier le point de contrôle de dommages à l'ADN. Ce protocole est destiné à la préparation d'extraits d'œufs de xénope et de l'ADN réactifs induisant des dommages aux points de contrôle. Ces techniques sont adaptables à une variété d'approches endommageant l'ADN dans l'étude de la signalisation checkpoint dommages de l'ADN.
Résumé
Sur une base quotidienne, les cellules sont soumises à une variété d'insultes endogènes et environnementaux. Pour lutter contre ces insultes, les cellules ont évolué checkpoint dommages à l'ADN de signalisation comme un mécanisme de surveillance afin de détecter les dommages de l'ADN et directs réponses cellulaires aux dommages à l'ADN. Il ya plusieurs groupes de protéines appelés capteurs, transducteurs et des effecteurs impliqués dans la signalisation checkpoint dommages de l'ADN (figure 1). Dans cette voie de signalisation complexe, ATR (ATM et Rad3 liée) est l'un des principaux kinases qui peuvent répondre aux dommages à l'ADN et le stress de réplication. Activé ATR peut phosphoryler ses substrats en aval tels que Chk1 (Checkpoint kinase 1). Par conséquent, phosphorylée et activée Chk1 conduit à de nombreux effets en aval sur le check-point dommages à l'ADN, y compris l'arrêt du cycle cellulaire, activation de la transcription, réparation de l'ADN et l'apoptose ou la sénescence (Figure 1). Lorsque l'ADN est endommagé, ne pas activer les dommages à l'ADN des résultats de points de contrôle dans unrepdommages aéré et, par la suite, l'instabilité génomique. L'étude du point de contrôle dommages à l'ADN permettront d'élucider comment les cellules de maintenir l'intégrité du génome et de fournir une meilleure compréhension de la façon dont les maladies humaines telles que le cancer, se développer.
Xenopus laevis extraits d'œufs sont en train de devenir un puissant système acellulaire modèle extrait dans la recherche checkpoint dommages de l'ADN. À basse vitesse extrait (LSE) a été initialement décrite par le groupe Masui 1. L'ajout de la chromatine des spermatozoïdes demembranated aux résultats LSE dans la formation des noyaux où l'ADN est répliqué de façon semiconservative une fois par cycle cellulaire.
La voie de signalisation ATR/Chk1-mediated point de contrôle est déclenché par lésions de l'ADN ou 2 stress réplicatif. Deux méthodes sont actuellement utilisées pour induire le point de contrôle de dommages à l'ADN: approches endommageant l'ADN et l'ADN des dommages imitant les structures 3. Altération de l'ADN peut être induite par les rayons ultraviolets (UV), γ-irradiation, méthyle méthaneesulfonate (MMS), la mitomycine C (MMC), 4-nitroquinoléine-1-oxyde (4-NQO), ou aphidicoline 3, 4. MMS est un agent alkylant qui inhibe la réplication de l'ADN et active le point de contrôle des dommages l'ADN ATR/Chk1-mediated 4-7. Irradiation UV déclenche également la 8 ADN ATR/Chk1-dependent dommages checkpoint. L'ADN des dommages-imitant la structure AT70 est un complexe recuit de deux oligonucléotides poly-(dA) 70 et le poly-(dT) 70. Le système AT70 a été développé dans le laboratoire Bill Dunphy et est largement utilisé pour induire ATR/Chk1 signalisation aux points de contrôle 9-12.
Ici, nous décrivons les protocoles (1) pour préparer des extraits d'œufs exempts de cellules (LSE), (2) pour traiter la chromatine des spermatozoïdes de Xenopus avec deux ADN différents endommager les approches (MMS et UV), (3) pour préparer l'ADN des dommages imitant la structure AT70, et (4) pour déclencher le point de contrôle des dommages dans l'ADN ATR/Chk1-mediated LSE avec la chromatine de sperme endommagé ou un dommage d'ADN-imitant la structure.
Protocole
1. Préparation LSE
- Grenouilles femelles (Xenopus laevis) sont injectées deux fois pour la collecte des œufs. La première injection (amorçage) est de 100 U PMSG (gonadotrophine sérique de jument gravide) par grenouille. Grenouilles doit être amorcée au moins deux jours avant d'œuf induisant la ponte et les grenouilles apprêtées sont utilisables jusqu'à deux semaines. Pour les grenouilles premiers, injecter PMSG voie sous-cutanée dans les sacs lymphatiques dorsaux en utilisant une seringue de 3 ml et 27 G aiguille.
- Pour induire la ponte, injecter 500 U hCG (gonadotrophine chorionique humaine) par voie sous-cutanée grenouille amorcée dans les sacs lymphatiques dorsaux aide d'une aiguille 27 G. Incuber les grenouilles injectées dans des seaux séparés contenant 2 litres de solution 1x Marc modifié Ringer (ROR). Laissez les grenouilles 14-20 h à pondre avant la collecte.
- Retirer les grenouilles des seaux et verser la solution ROR jusqu'à environ 100 ml est à gauche. Obtenir des œufs des seaux en transférant les oeufs dans un bécher de 250 ml.
- Dejelly oeufs en ajoutant 100 ml de cystéine 2% (réglagepH à 7,8 avec KOH 10 M). Remuer doucement les oeufs avec une pipette Pasteur en verre inversé (0,7 cm de diamètre) environ toutes les 30 secondes. Décanter et la remplacer par la cystéine frais deux fois pendant l'incubation. Le processus dejellying est achevée en environ 5-15 minutes lorsque les oeufs former une couche plus dense au fond du bécher.
- Jeter la solution de cystéine et de laver les oeufs trois fois avec MMR 0.25x. Swirl les oeufs dans la solution par une pipette de verre. "Bad" oeufs sont déterminées par une simple inspection visuelle et sont "gonflés" apparence blanche. Les «mauvaises» les œufs s'accumulent au centre du bécher après agitation. Retirez les «mauvais» par les œufs d'une pipette Pasteur.
- Lavez les oeufs avec Lysis Buffer Egg (ELB) trois fois. Retirez tous les autres «mauvais» par les œufs d'une pipette Pasteur. Verser les œufs dans un tube de 14 ml Falcon.
- Faites tourner le tube Falcon de 55 sec à 188 xg (1100 rpm) selon la norme IEC CL2 clinique table centrifugeuse avec un rotor à godets oscillants pour compacter les œufs. Retirer l'excès de tampon de lasupérieure de la couche d'oeuf. Ajouter 0,5 ul d'aprotinine / stock leupeptine et 0,5 l de bouillon cytochalasine B par ml d'oeufs compactés.
- Centrifuger à 16500 xg oeufs (10.000 rpm) pendant 15 min à 4 ° C en utilisant la RC6 Sorvall ainsi centrifugeuse superspeed avec HB6 rotor swing-out. Après centrifugation, les oeufs sont fractionnées en trois couches dans le tube: lipide, extrait, et le jaune / pigment de haut en bas, respectivement. Percer la paroi du tube Falcon dans la partie inférieure de la couche intermédiaire avec un extrait d'aiguilles 21 G. Retirez délicatement l'aiguille que l'aiguille de ponction peut être obstrué par du plastique. Insérez une nouvelle aiguille 21 G montée sur une seringue de 1 ml dans le site de ponction pour recueillir l'extrait. Aspirer lentement dans l'extrait de seringue pour éviter les bulles d'air et la contamination par le lipide et le jaune / pigment couches.
- Placez les extraits dans une solution refroidie tube de 1,5 ml. Pour chaque millilitre d'extrait d'oeuf, ajouter les solutions suivantes stocks de produits chimiques dans l'dicated concentration finale (indiquée entre parenthèses): (1) 10 ul cycloheximide (100 pg / ml); (2) 1 ul aprotinine / leupeptine (10 pg / ml); (3) 1 ul cytochalasine B (5 ug / ml ); (4) 1 Dithiothreitol ul (1 mM) et (5) 0,33 Nocodazole ul (3 pg / ml). Inverser l'œuf extraire au moins 10 fois doucement. Il s'agit de la LSE, qui doit être préparée et utilisée dans les 4 heures. La qualité de la LSE est compromise après 4 h ou de gel-dégel.
2. Traitement de la chromatine du sperme avec les approches endommageant l'ADN
- Préparer la chromatine de sperme normale selon le procédé décrit précédemment 13.
- Préparer la chromatine des spermatozoïdes MMS traité
- Reprendre la chromatine des spermatozoïdes normale dans 0,5 ml de tampon X.
- Ajouter ~ 5,5 l de MMS (9,1 M en stock) à 500 ul resuspendues chromatine à une concentration finale de 100 mM.
- Incuber la chromatine de sperme dans microtube à température ambiante pendant 30 min avec rotation.
- Faites tourner la mTube icrocentrifuge à 686 xg (2100 rpm) pendant 10 min à température ambiante en utilisant la centrifugeuse IEC CL2 clinique avec rotor swing et adaptateurs pour tubes.
- Rejeter le surnageant et remettre en suspension le culot dans 0,5 ml de tampon BSA X plus (3%), TNT (0,1 mM) et aprotinine / leupeptine (10 pg / ml).
- Répéter les étapes (4) et (5) deux fois pour laver la chromatine de sperme.
- Déterminer la concentration de la chromatine des spermatozoïdes avec un hémocytomètre et diluer à 100.000 spermatozoïdes / ul. Économiser 5 aliquots à -80 ° C congélateur pour une utilisation ultérieure.
- Préparer la chromatine des spermatozoïdes traité contre les UV
- Ajouter la quantité désirée (par exemple 10 pi) de la chromatine des spermatozoïdes normale sur la surface d'un morceau de parafilm.
- Placez le Parafilm dans un agent de réticulation UV. Réglez le paramètre d'énergie souhaité, en fonction de votre expérience, et de commencer à endommager la chromatine des spermatozoïdes par la lumière UV. Par exemple, il faut environ 21 secondes pour atteindre 1000 J / m 2.
- Après UV irramédiation, la chromatine des spermatozoïdes traité contre les UV doivent être ajoutées aux extraits d'œufs immédiatement.
3. Préparation d'un ADN dommages imitant la structure (AT70)
- Dissoudre deux oligonucléotides synthétiques poly-(dA) 70 (désigné A70) et le poly-(dT) 70 (désigné T70) dans de l'eau à une concentration de 2 ug / ul, respectivement.
- Ajouter 100 ul de A70 et 100 pi de T70 à un tube de 1,5 ml. Faire bouillir solution mixte synthétique oligo pendant 5 min à 95 ° C dans un heatblock.
- Prenez le bloc bain sec sur (avec le tube contenant AT mélange dans celle-ci), et laissez-le refroidir à température ambiante sur une paillasse de laboratoire. Ce réglage de la température prend environ 45-60 min.
- Le mélange refroidi est AT70 avec une concentration finale de 2 ug / ul. Magasin de 10 ul d'aliquotes AT70 à -20 ° C congélateur pour une utilisation ultérieure.
4. Déclenchement du Checkpoint dommages de l'ADN dans la chromatine des spermatozoïdes avec LSE endommagé ou un DNA DamageStructure imitation-
- Provoquer le point de contrôle de dommages à l'ADN dans la chromatine LSE sperme endommagé
- Ajouter 50 ul de la LSE à un tube de 1,5 ml et compléter avec 1 pl du mélange d'énergie et de 2 pi de la chromatine des spermatozoïdes endommagés (concentration finale ~ 4,000 spermatozoïdes / réaction ul).
- Incuber le tube de réaction à température ambiante pendant 90 min et feuilleter le tube toutes les 10 min.
- Verser 1 pi de mélange réactionnel sur une lame de microscope supplémenté avec 1 ul de solution de colorant nucléaire après 30 min d'incubation. Placer une lamelle couvre-objet sur le mélange de réaction et contrôler la formation de noyaux par l'intermédiaire d'un microscope à fluorescence. En règle générale, les noyaux ronde se former après 30 min d'incubation, indiquant réplication de l'ADN a initié.
- Prenez 10 uL du mélange réactionnel dans 90 ul de tampon d'échantillon. Les échantillons sont analysés par immunoblot en utilisant anti-Chk1 P-S344 ou anti-Chk1 anticorps.
- Provoquer le point de contrôle de dommages à l'ADN dans le LSEAT70
- Ajouter 50 ul de la LSE à un tube de 1,5 ml additionné de 1 ul du mélange d'énergie et 1,6 ul de stock tautomycine.
- Ajouter 1,25 ul de pré-faites AT70 (2 pg / pl) ou de l'eau (comme témoin négatif) à chaque réaction. Incuber les réactions à la température ambiante pendant 90 min. Balayez les tubes de réaction toutes les 10 min.
- Ajouter 10 ul du mélange réactionnel dans 90 ul de tampon d'échantillon. Les échantillons sont examinés par immunoblot en utilisant anti-Chk1 P-S344 ou anti-Chk1 anticorps.
5. Les résultats représentatifs
La chromatine des spermatozoïdes endommagés ou endommagent l'ADN imitant la structure peut déclencher le poste de contrôle ADN ATR/Chk1-mediated dommages dans le système de Xenopus extrait d'oeuf. Montre la figure 2A que le MMS induit la phosphorylation de Chk1 à Ser344 (Chk1 P-S344), qui est un indicateur de activation de la kinase ATR. figure 2B montre que AT70, en tant que dommages de l'ADN imitant structure, déclenche aussi la phosphorylation de Chk1. Total des échantillons Chk1 sont utilisés comme chargement des contrôles dans les deux exemples.
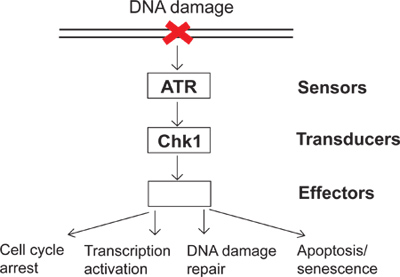
Figure 1. Un schéma de la signalisation checkpoint dommages de l'ADN.
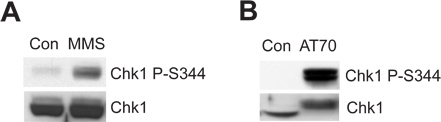
Figure 2. Chk1 phosphorylation est induite soit par MMS ou AT70 traitements dans des extraits d'œufs de xénope. (A) le sperme endommagé par MMS chromatine (MMS) ou de la chromatine des spermatozoïdes normale (Con) sont incubés dans des extraits d'œufs pendant 90 min. Chk1 phosphorylation sur Ser344 (Chk1 P-S344) et Chk1 totale dans les extraits d'œufs sont examinés par immunoblot. (B) ou de l'eau AT70 (Con) sont ajoutés dans des extraits d'oeufs, respectivement. Les échantillons sont analysés par immunobuvardage aussi que dans (A).
Access restricted. Please log in or start a trial to view this content.
Discussion
Il ya plusieurs avantages à étudier le point de contrôle de dommages à l'ADN en utilisant Xenopus extraits d'œufs. L'utilisation d'extraits d'oeufs fournit une grande quantité d'extraits exempts de cellules synchronisées en interphase du cycle cellulaire. Les extraits d'oeufs peuvent être facilement et économiquement faite. Il est relativement facile à endommager l'ADN ou de la chromatine et de révéler un défaut dans le poste de contrôle de dommages de l'ADN apr...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail est soutenu en partie par des fonds fournis par l'Université de Caroline du Nord à Charlotte, Wachovia Fondation Caisse d'excellence faculté, et une subvention de NIGMS (R15GM101571).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Réactifs | |||
| Anti-Chk1 P-S344 anticorps | Signalisation cellulaire | 2348L | |
| Chk1 anticorps anti- | Santa Cruz | SC7898 | |
| L'aprotinine | MP Biomédical | 0219115880 | |
| Cycloheximide | Sigma | C7698-5G | |
| Cytochalasine B | EMD | 250233 | |
| Dithiothréitol (DTT) | VWR | JTF780-2 | |
| hCG | Sigma | CG10-10VL | |
| L-cystéine | Sigma | C7352-1KG | |
| Leupeptine | VWR | 97063-922 | |
| Méthyl méthanesulfonate (MMS) | Sigma | 129925-5G | |
| Nocodazole | Sigma | M1404-2MG | |
| PMSG | Calbiochem | 367222 | |
| Tampon d'échantillon | Sigma | S3401 | |
| Tautomycine | Wako Chemicals USA | 209-12041 | |
| Équipement | |||
| Seau pour la ponte | Rubbermaid Commercial Products | 6308 | |
| CL2 CEI centrifugeuse avec rotor à godets oscillants | Thermo Scientific | 004260F | |
| HB6 rotor à godets oscillants | Thermo Scientific | 11860 | |
| Sorvall RC6, plus centrifugeuse superspeed | Thermo Scientific | 46910 | |
| Réticulation UV | UVP | 95-0174-01 | |
| Solutions | |||
| 1x MMR | 100 mM NaCl, 2 mM de KCl, 0,5 mM MgSO4, CaCl2 2,5 mM, HEPES 5 mM, ajuster le pH à 7,8 avec NaOH 10 M | ||
| L'aprotinine / Leupeptine actions | 10 mg / ml dans de l'eau. Stocker 20 aliquotes à -80 ° C. | ||
| X tampon | 0,2 M de saccharose, 80 mM de KCl, 15 mM de NaCl, MgCl2 5 mM, EDTA 1 mM, HEPES 10 mM, ajuster le pH à 7,5 par HCl | ||
| Actions cycloheximide | 10 mg / ml dans de l'eau. Boutique aliquotes de 1 ml à -20 ° C. | ||
| Cytochalasine B de stock | 5 mg / ml dans du DMSO. Stocker 20 aliquotes à -20 ° C. | ||
| Dithiothréitol (DTT) de bouillon | 1 M dans l'eau. Boutique aliquotes de 1 ml à -20 ° C. | ||
| ELB | 0,25 M de saccharose, 1 mM DTT, 50 pg / ml de cycloheximide, MgCl2 2,5 mM, KCl 50 mM, HEPES 10 mM, pH7.7 | ||
| Nocodazole actions | 10 mg / ml dans du DMSO. Stocker 5 aliquotes à -80 ° C. | ||
| Mélange d'énergie | 375 mM de phosphate de créatine, ATP 50 mM et 25 mM MgCl 2. Des aliquotes sont enregistrés à -80 ° C. | ||
| Solution de colorant nucléaire | 0,4 pg / ml de Hoechst 33258, le glycérol 25%(V / v), dans du PBS 1x | ||
| Actions tautomycine | 100 M dans le DMSO. Stocker 10 aliquotes à -80 ° C. |
Références
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cimprich, K. A., Cortez, D. ATR: an essential regulator of genome integrity. Nat. Rev. Mol. Cell Biol. 9 (8), 616-627 (2008).
- Lupardus, P. J., Van, C., Cimprich, K. A. Analyzing the ATR-mediated checkpoint using Xenopus egg extracts. Methods. 41 (2), 222-231 (2007).
- Lupardus, P. J., Byun, T., Yee, M. C., Hekmat-Nejad, M., Cimprich, K. A. A requirement for replication in activation of the ATR-dependent DNA damage checkpoint. Genes Dev. 16 (18), 2327-2332 (2002).
- Stokes, M. P., Van Hatten, R., Lindsay, H. D., Michael, W. M. DNA replication is required for the checkpoint response to damaged DNA in Xenopus egg extracts. J. Cell Biol. 158 (5), 863-872 (2002).
- Kato, K., Strauss, B. Accumulation of an intermediate in DNA synthesis by HEp.2 cells treated with methyl methanesulfonate. Proc. Natl. Acad. Sci. U.S.A. 71 (5), 1969-1973 (1974).
- Paulovich, A. G., Hartwell, L. H. A checkpoint regulates the rate of progression through S phase in S. cerevisiae in response to DNA damage. Cell. 82 (5), 841-847 (1995).
- Guo, Z., Kumagai, A., Wang, S. X., Dunphy, W. G. Requirement for Atr in phosphorylation of Chk1 and cell cycle regulation in response to DNA replication blocks and UV-damaged DNA in Xenopus egg extracts. Genes Dev. 14 (21), 2745-2756 (2000).
- Jazayeri, A., Balestrini, A., Garner, E., Haber, J. E., Costanzo, V. Mre11-Rad50-Nbs1-dependent processing of DNA breaks generates oligonucleotides that stimulate ATM activity. EMBO. J. 27 (14), 1953-1962 (2008).
- Kumagai, A., Dunphy, W. G. Claspin, a novel protein required for the activation of Chk1 during a DNA replication checkpoint response in Xenopus egg extracts. Mol. Cell. 6 (4), 839-849 (2000).
- Yan, S., Lindsay, H. D., Michael, W. M. Direct requirement for Xmus101 in ATR-mediated phosphorylation of Claspin bound Chk1 during checkpoint signaling. J. Cell Biol. 173 (2), 181-186 (2006).
- Shiotani, B., Zou, L. Single-stranded DNA orchestrates an ATM-to-ATR switch at DNA breaks. Mol. Cell. 33 (5), 547-558 (2009).
- Tutter, A. V., Walter, J. C. Chromosomal DNA replication in a soluble cell-free system derived from Xenopus eggs. Methods Mol. Biol. 322, 121-137 (2006).
- Cross, M. K., Powers, M. Preparation and Fractionation of Xenopus laevis Egg Extracts. J. Vis. Exp. (18), e891(2008).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon