Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Untersuchung der DNA Damage Checkpoint mit
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Xenopus Eiextrakt ist ein nützliches Modellsystem, um die DNA-Schäden Prüfpunkt untersuchen. Dieses Protokoll ist für die Herstellung von Xenopus Ei-Extrakten und DNA-Schaden induzierenden Prüfpunkt Reagenzien. Diese Techniken sind an eine Vielzahl von DNA-schädigenden Ansätze in der Untersuchung der DNA-Schädigung Prüfpunkt Signalisierung.
Zusammenfassung
Auf einer täglichen Basis, werden die Zellen zu einer Vielzahl von endogenen und Umwelteinflüssen ausgesetzt. Um diese Beleidigungen zu bekämpfen, haben Zellen DNA damage checkpoint Signalisierung als Überwachungs-Mechanismus, um DNA-Schäden und direkte zelluläre Antworten auf DNA-Schäden spüren entwickelt. Es gibt mehrere Gruppen von Proteinen namens Sensoren, Wandlern und Effektoren in DNA damage checkpoint-Signalisierung (Abbildung 1) beteiligt. In diesem komplexen Signalwegs ist ATR (ATM und Rad3-bezogen) einer der wichtigsten Kinasen, die zu DNA-Schädigungen und Replikation Streß reagieren. Activated ATR kann phosphorylieren seine nachgelagerten Substrate wie Chk1 (Checkpoint Kinase 1). Folglich phosphoryliert und aktiviert Chk1 führt zu viele stromabwärts Wirkungen in der DNA-Schädigung Prüfpunkt einschließlich Zellzyklusarrest, Transkriptionsaktivierung, DNA-Schäden zu reparieren und Apoptose oder Seneszenz (Abbildung 1). Wenn DNA beschädigt ist, es nicht die DNA damage checkpoint Ergebnisse in UNREP aktivierenausgestrahlt Schäden und anschließend genomische Instabilität. Die Untersuchung der DNA damage checkpoint wird klären, wie Zellen genomischen Integrität zu erhalten und ein besseres Verständnis davon, wie Krankheiten, wie Krebs, zu entwickeln.
Xenopus laevis Ei Extrakte werden als starke zellfreien Extrakt Modellsystem in DNA-Schädigung Prüfpunkt Forschung entstehen. Low-Speed-Extrakt (LSE) wurde ursprünglich von der Masui Gruppe 1 beschrieben. Die Zugabe von demembranated Spermienchromatin LSE Ergebnisse in Keimbildung, wo DNA in einem semikonservativen fashion einmal pro Zellzyklus repliziert wird.
Die ATR/Chk1-mediated Checkpoint-Signalweg ist durch DNA-Schädigung oder Replikation Stress 2 ausgelöst. Zwei Methoden werden derzeit verwendet, um die DNA damage checkpoint induzieren: DNA-schädigende Ansätze und DNA-Schäden-ähnlichen Strukturen 3. DNA-Schädigung durch Ultraviolett (UV)-Bestrahlung, γ-Bestrahlung, induziert werden Methyl methanesulfonate (MMS), Mitomycin C (MMC), 4-nitrochinolin-1-oxid (4-NQO) oder Aphidicolin 3, 4. MMS ist ein Alkylierungsmittel, das DNA-Replikation hemmt und aktiviert der DNA-Schädigung ATR/Chk1-mediated Prüfpunkt 4-7. UV-Bestrahlung löst auch die ATR/Chk1-dependent DNA damage checkpoint 8. Die DNA-Schädigung nachahmende Struktur AT70 ist ein Komplex aus zwei getemperten Oligonukleotide Poly-(dA) 70 und Poly-(dT) 70. Die AT70 System wurde Bill Dunphy Labor entwickelt und wird häufig verwendet, um ATR/Chk1 Checkpoint Signalisierung 9-12 induzieren.
Hier beschreiben wir Protokollen (1) bis zellfreie Extrakte Ei (LSE) herzustellen, (2) an Xenopus Spermienchromatinstruktur mit zwei verschiedenen DNA schädigen Ansätze (MMS und UV), (3) zu behandeln, um die DNA-Schäden-nachahmende Struktur vorzubereiten AT70, und (4) die DNA-Schädigung ATR/Chk1-mediated Prüfpunkt in LSE mit beschädigten Spermienchromatinstruktur oder einem DNA-Schaden-nachahmende Struktur auslösen.
Protokoll
Ein. LSE Vorbereitung
- Female Fröschen (Xenopus laevis) zweimal für Eiersammlung injiziert. Die erste Injektion (Grundierung) 100 U PMSG (Pregnant Mare Serum Gonadotropin) pro Frosch. Frösche muss grundiert mindestens zwei Tage vor induzierende Eiablage und grundiert Frösche sind geeignet für bis zu zwei Wochen. Um prime Frösche, injizieren PMSG subkutan in die dorsale Lymphsäcke mit einem 3 ml-Spritze und 27 G Nadel.
- Um Eiablage zu induzieren, zu injizieren 500 U hCG (humanes Chorion Gonadotropin) pro grundiert frog subkutan in die dorsale Lymphsäcke mit einer 27 G Nadel. Inkubieren injizierten Frösche in separaten Eimer mit 2 Liter 1x Marcs modifizierte Ringer-Lösung (MMR). Lassen Frösche 14-20 hr Eier vor der Abholung zu legen.
- Entfernen Sie die Frösche aus den Eimern und gießen Sie das MMR-Lösung bis etwa 100 ml übrig ist. Erhalten Eier von den Schaufeln durch Übertragen Eier in einen 250 ml-Becher.
- Dejelly Eier durch Zugabe von 100 ml 2% Cystein (EinstellungpH-Wert auf 7,8 mit 10 M KOH). Vorsichtig schwenken die Eier mit einem umgekehrten Glas Pasteur Pipette (0,7 cm Durchmesser) etwa alle 30 Sekunden. Dekantieren und ersetzen mit frischen Cystein zweimal während der Inkubation. Die dejellying abgeschlossen ist in etwa 5-15 Minuten, wenn die Eier einen kondensierten Schicht am Boden des Bechers zu bilden.
- Entsorgen Sie die Cystein-Lösung und waschen Eier dreimal mit 0,25 x MMR. Swirl die Eier in der Lösung durch eine Glaspipette. "Bad" Eier werden durch einfache Sichtprüfung bestimmt und sind "puffy" weißes Aussehen. Die "schlechten" Eier in der Mitte des Bechers nach wirbelnden ansammeln. Entfernen Sie "schlechte" Eier von einer Pasteur-Pipette.
- Waschen Sie Eier mit Ei Lysis Buffer (ELB) dreimal. Entfernen Sie alle zusätzlichen "schlechte" Eier von einer Pasteur-Pipette. Gießen Eier in eine 14 ml-Falcon-Röhrchen.
- Drehen Sie das Falcon-Röhrchen für 55 sec bei 188 xg (1.100 rpm) mit dem CL2 IEC klinischen Tischzentrifuge mit einem Ausschwingrotor, um die Eier zu verdichten. Entfernen Sie das überschüssige Puffer aus derSpitze des Ei-Schicht. Fügen Sie 0,5 ul Aprotinin / Leupeptin Lager und 0,5 ul Cytochalasin B Bestand pro ml des verdichteten Eier.
- Zentrifuge Eier bei 16.500 × g (10.000 UpM) für 15 min bei 4 ° C unter Verwendung des Sorvall RC6 zuzüglich superspeed Zentrifuge mit HB6 Ausschwingrotor. Nach Zentrifugation fraktioniert sind Eier in drei Schichten in der Röhre: Lipid-Extrakt, und Dotter / Pigment von oben nach unten sind. Punktieren der Seite des Falcon-Röhrchen in dem unteren Abschnitt der mittleren Schicht mit einem Extrakt 21 G Nadel. Entfernen Sie vorsichtig die Nadel die Punktionsnadel durch Kunststoff verbaut werden kann. Legen einen neuen 21 G Nadel, die an einer 1 ml-Spritze in die Punktionsstelle, um den Extrakt zu sammeln. Langsam absaugen Extrakt in die Spritze, um Luftblasen und Verunreinigungen mit der Lipid-und Eigelb / Pigment Schichten zu vermeiden.
- Legen Sie die Extrakte in ein gekühltes 1,5 ml Mikrozentrifugenröhrchen. Für jeden Milliliter Ei-Extrakt, fügen Sie die folgende chemische Stammlösungen der insyndizierte Endkonzentration (in Klammern): (1) 10 ul Cycloheximid (100 ug / ml); (2) 1 ul Aprotinin / Leupeptin (10 ug / ml); (3) 1 ul Cytochalasin B (5 pg / ml ); (4) 1 ul Dithiothreitol (1 mM) und (5) 0,33 ul Nocodazol (3 pg / ml). Invert das Ei zu extrahieren mindestens 10 mal sanft. Dies ist die LSE, die frisch zubereitet werden müssen und innerhalb von 4 Stunden. Die Qualität der LSE wird nach 4 h oder Frost-Tau beeinträchtigt.
2. Treatment of Sperm Chromatin mit DNA-schädigenden Approaches
- Planen normalen Spermienchromatinstruktur gemäß dem zuvor beschriebenen Verfahren 13.
- Bereiten Sie MMS-behandelten Spermienchromatin
- Resuspendieren normalen Spermienchromatin in 0,5 ml Puffer X.
- Fügen Sie ~ 5,5 ul von MMS (9,1 M in stock) zu 500 ul resuspendiert Chromatin zu einer Endkonzentration von 100 mM.
- Inkubieren Spermienchromatinstruktur in Mikrozentrifugenröhrchen bei Raumtemperatur für 30 min mit der Drehung.
- Drehen Sie das microcentrifuge Rohr bei 686 xg (2.100 rpm) für 10 min bei Raumtemperatur mit dem IEC CL2 klinischen Zentrifuge mit Ausschwingrotor und Rohradapter.
- Überstand verwerfen und das Pellet in 0,5 ml Puffer X plus BSA (3%), DTT (0,1 mM) und Aprotinin / Leupeptin (10 ug / ml).
- Wiederholen Sie die Schritte (4) und (5) zweimal, um die Spermienchromatin waschen.
- Bestimmung der Konzentration von Spermien Chromatin mit einem Hämozytometer und verdünnt auf 100.000 Spermien / ul. Sparen mit 5 ul Aliquots in -80 ° C Gefrierschrank zur weiteren Verwendung.
- Bereiten UV-behandelten Spermienchromatin
- Hinzufügen gewünschter Betrag (z. B. 10 ul) von normalen Spermienchromatinstruktur auf der Oberfläche eines Stücks Parafilm.
- Legen Sie die Parafilm in einem UV-Crosslinker. Stellen Sie die gewünschte Energie-Parameter, je nach Experiment, und beginnen, die Spermienchromatin via UV-Licht beschädigt werden. Beispielsweise dauert es etwa 21 Sekunden bis 1.000 J / m 2 zu erreichen.
- Nach der UV-Bestrahlungsstrahlung, UV-behandelten Spermienchromatin sollten Ei Extrakte sofort gutgeschrieben.
3. Herstellung eines DNA-Damage-nachahmende Struktur (AT70)
- Aufzulösen zwei synthetische Oligonukleotide Poly-(dA) 70 (bezeichnet als A70) und Poly-(dT) 70 (bezeichnet als T70) in Wasser auf eine Konzentration von 2 ug / ul sind.
- Fügen Sie 100 ul A70 und 100 ul T70 zu einem 1,5 ml Mikrozentrifugenröhrchen. Sieden gemischten synthetischen Oligo-Lösung für 5 min bei 95 ° C in einem heatblock.
- Nehmen Sie die Trockenbad Block aus (mit dem Rohr mit AT Mischung davon), und lassen Sie es abkühlen auf Raumtemperatur auf einem Labortisch. Diese Temperatureinstellung dauert etwa 45-60 min.
- Das abgekühlte Gemisch wird AT70 mit einer endgültigen Konzentration von 2 ug / ul. Shop 10 ul AT70 Aliquots bei -20 ° C Gefrierschrank zur weiteren Verwendung.
4. Das Auslösen der DNA Damage Checkpoint in LSE mit Damaged Sperm Chromatin oder DNA-Schäden-Ähnlichen Struktur
- DNA-Schädigung induziert Checkpoint in LSE mit beschädigten Spermienchromatin
- Fügen Sie 50 ul LSE zu einem 1,5 ml Mikrozentrifugenröhrchen und ergänzen Sie es mit 1 ul of Energy Mischung und 2 ul beschädigten Spermien Chromatin (Endkonzentration ~ 4.000 Spermien / ul Reaktion).
- Inkubieren das Reaktionsrohr bei Raumtemperatur für 90 min und Flick das Rohr alle 10 min.
- Dispense 1 ul Reaktionsgemisch auf einen Objektträger mit 1 ul der nuklearen Farbstofflösung nach 30-minütiger Inkubation ergänzt. Legen Sie ein Deckglas über dem Reaktionsgemisch und überprüfen Keimbildung über Fluoreszenz-Mikroskop. Typischerweise wird rundkernigen nach 30 min Inkubation bilden, der angibt, DNA-Replikation initiiert.
- Nehmen Sie sich 10 ul des Reaktionsgemisches in 90 ul Probenpuffer. Die Proben werden mittels Immunoblot mit anti-Chk1 P-S344 oder Anti-Chk1 Antikörpern analysiert.
- DNA-Schädigung induziert Checkpoint in LSE mit derAT70
- Fügen Sie 50 ul LSE zu einem 1,5 ml Mikrozentrifugenröhrchen mit 1 ul of Energy Mischung und 1,6 ul Tautomycin Lager ergänzt.
- Hinzufügen 1,25 ul von vorgefertigten AT70 (2 ug / ul) oder Wasser (als negative Kontrolle) zu jeder Reaktion. Inkubieren der Reaktionen bei Raumtemperatur für 90 min. Flick die Reaktionsrohre alle 10 min.
- Fügen Sie 10 ul des Reaktionsgemisches in 90 ul Probenpuffer. Die Proben werden mittels Immunoblot mit anti-Chk1 P-S344 oder Anti-Chk1 Antikörper untersucht.
5. Repräsentative Ergebnisse
Die beschädigten Spermien Chromatin oder DNA-Schäden-ähnlichen Struktur kann die ATR/Chk1-mediated DNA damage checkpoint in der Xenopus Ei-Extrakt auszulösen. 2A zeigt, dass MMS Chk1 Phosphorylierung an Ser344 (Chk1 P-S344), die ein Indikator für ist induziert ATR-Kinase-Aktivierung. 2B zeigt, dass AT70, als DNA-Schäden-ähnlichen structure, löst auch Chk1 Phosphorylierung. Insgesamt Chk1 Proben werden als Be-Kontrollen in beiden Beispielen verwendet.
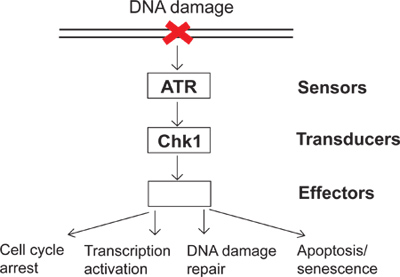
Abbildung 1. Ein Diagramm der DNA-Schädigung Prüfpunkt Signalisierung.
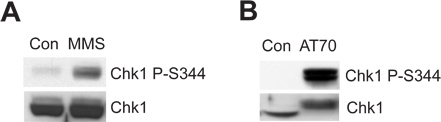
Abbildung 2. Chk1 Phosphorylierung wird durch entweder MMS oder AT70 Behandlungen in Xenopus-Extrakten Ei induziert. (A) MMS-geschädigter Spermienchromatinstruktur (MMS) oder normale Spermienchromatinstruktur (Con) in Ei Extrakte werden für 90 min inkubiert. Chk1 Phosphorylierung an Ser344 (Chk1 P-S344) und insgesamt Chk1 in Ei-Extrakte werden über Immunoblot untersucht. (B) AT70 oder Wasser (Con) in Ei-Extrakten zugegeben. Proben werden auch über Immunoblotting, wie in (A) analysiert.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Es gibt mehrere Vorteile bei der Untersuchung der DNA-Schädigung unter Verwendung Prüfpunkt Xenopus Ei-Extrakten. Die Verwendung von Ei-Extrakten stellt eine große Menge von zellfreien Extrakten in Interphase des Zellzyklus synchronisiert. Die Ei-Extrakten kann leicht und kostengünstig hergestellt werden. Es ist relativ leicht zu DNA oder Chromatin beschädigen und einen Defekt in der DNA-Schädigung Checkpoint nach immunodepleting eines Zielproteins aus Eiextrakt offenbaren. Anschließend kann eine potenti...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wird teilweise durch Mittel von der University of North Carolina in Charlotte, Wachovia Stiftungsfonds für Dozenten excellence, und einem Zuschuss von NIGMS (R15GM101571) vorgesehen ist.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagenzien | |||
| Anti-Chk1 P-S344 Antikörper | Cell Signaling | 2348L | |
| Anti-Chk1 Antikörper | Santa Cruz | SC7898 | |
| Aprotinin | MP Biomedicals | 0219115880 | |
| Cycloheximid | Sigma | C7698-5G | |
| Cytochalasin B | EMD | 250233 | |
| Dithiothreitol (DTT) | VWR | JTF780-2 | |
| hCG | Sigma | CG10-10VL | |
| L-Cystein | Sigma | C7352-1KG | |
| Leupeptin | VWR | 97063-922 | |
| Methylmethansulfonat (MMS) | Sigma | 129.925-5G | |
| Nocodazol | Sigma | M1404-2MG | |
| PMSG | Calbiochem | 367222 | |
| Probenpuffer | Sigma | S3401 | |
| Tautomycin | Wako Chemicals USA | 209-12041 | |
| Ausrüstung | |||
| Eimer für die Eiablage | Rubbermaid Commercial Products | 6308 | |
| CL2 IEC Zentrifuge mit Ausschwingrotor | Thermo Scientific | 004260F | |
| HB6 Ausschwingrotor | Thermo Scientific | 11860 | |
| Sorvall RC6 Plus Superspeed-Zentrifuge | Thermo Scientific | 46910 | |
| UV-Crosslinker | UVP | 95-0174-01 | |
| Lösungen | |||
| 1x MMR | 100 mM NaCl, 2 mM KCl, 0,5 mM MgSO 4, 2,5 mM CaCl 2, 5 mM HEPES, pH auf 7,8 mit 10 M NaOH | ||
| Aprotinin / Leupeptin Lager | 10 mg / ml in Wasser. Bewahren Sie 20 ul Aliquots bei -80 ° C. | ||
| Buffer X | 0,2 M Sucrose, 80 mM KCl, 15 mM NaCl, 5 mM MgCl 2, 1 mM EDTA, 10 mM HEPES, pH auf 7,5 mit HCl | ||
| Cycloheximid Lager | 10 mg / ml in Wasser. Store 1 ml Aliquots bei -20 ° C. | ||
| Cytochalasin B Lager | 5 mg / ml in DMSO. Bewahren Sie 20 ul Aliquots bei -20 ° C. | ||
| Dithiothreitol (DTT) stock | 1 M in Wasser. Store 1 ml Aliquots bei -20 ° C. | ||
| ELB | 0,25 M Saccharose, 1 mM DTT, 50 ug / ml Cycloheximid, 2,5 mM MgCl 2, 50 mM KCl, 10 mM HEPES, pH7.7 | ||
| Nocodazol Lager | 10 mg / ml in DMSO. Bewahren 5 ul Aliquots bei -80 ° C. | ||
| Energie Mixture | 375 mM Creatinphosphat, 50 mM ATP und 25 mM MgCl 2. Aliquots werden bei -80 ° C gespeicherten | ||
| Nuclear Farbstofflösung | 0,4 ug / ml Hoechst 33258, 25% Glycerin(V / v), in 1x PBS | ||
| Tautomycin Lager | 100 uM in DMSO. Bewahren Sie 10 ul Aliquots bei -80 ° C. |
Referenzen
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cimprich, K. A., Cortez, D. ATR: an essential regulator of genome integrity. Nat. Rev. Mol. Cell Biol. 9 (8), 616-627 (2008).
- Lupardus, P. J., Van, C., Cimprich, K. A. Analyzing the ATR-mediated checkpoint using Xenopus egg extracts. Methods. 41 (2), 222-231 (2007).
- Lupardus, P. J., Byun, T., Yee, M. C., Hekmat-Nejad, M., Cimprich, K. A. A requirement for replication in activation of the ATR-dependent DNA damage checkpoint. Genes Dev. 16 (18), 2327-2332 (2002).
- Stokes, M. P., Van Hatten, R., Lindsay, H. D., Michael, W. M. DNA replication is required for the checkpoint response to damaged DNA in Xenopus egg extracts. J. Cell Biol. 158 (5), 863-872 (2002).
- Kato, K., Strauss, B. Accumulation of an intermediate in DNA synthesis by HEp.2 cells treated with methyl methanesulfonate. Proc. Natl. Acad. Sci. U.S.A. 71 (5), 1969-1973 (1974).
- Paulovich, A. G., Hartwell, L. H. A checkpoint regulates the rate of progression through S phase in S. cerevisiae in response to DNA damage. Cell. 82 (5), 841-847 (1995).
- Guo, Z., Kumagai, A., Wang, S. X., Dunphy, W. G. Requirement for Atr in phosphorylation of Chk1 and cell cycle regulation in response to DNA replication blocks and UV-damaged DNA in Xenopus egg extracts. Genes Dev. 14 (21), 2745-2756 (2000).
- Jazayeri, A., Balestrini, A., Garner, E., Haber, J. E., Costanzo, V. Mre11-Rad50-Nbs1-dependent processing of DNA breaks generates oligonucleotides that stimulate ATM activity. EMBO. J. 27 (14), 1953-1962 (2008).
- Kumagai, A., Dunphy, W. G. Claspin, a novel protein required for the activation of Chk1 during a DNA replication checkpoint response in Xenopus egg extracts. Mol. Cell. 6 (4), 839-849 (2000).
- Yan, S., Lindsay, H. D., Michael, W. M. Direct requirement for Xmus101 in ATR-mediated phosphorylation of Claspin bound Chk1 during checkpoint signaling. J. Cell Biol. 173 (2), 181-186 (2006).
- Shiotani, B., Zou, L. Single-stranded DNA orchestrates an ATM-to-ATR switch at DNA breaks. Mol. Cell. 33 (5), 547-558 (2009).
- Tutter, A. V., Walter, J. C. Chromosomal DNA replication in a soluble cell-free system derived from Xenopus eggs. Methods Mol. Biol. 322, 121-137 (2006).
- Cross, M. K., Powers, M. Preparation and Fractionation of Xenopus laevis Egg Extracts. J. Vis. Exp. (18), e891(2008).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten