Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Estudio del Checkpoint Daño del ADN utilizando
* Estos autores han contribuido por igual
En este artículo
Resumen
Xenopus huevo extracto es un sistema modelo útil para investigar el punto de control de daño en el DNA. Este protocolo es para la preparación de extractos de huevo de Xenopus y reactivos de punto de control de daño de ADN que inducen. Estas técnicas son adaptables a una variedad de enfoques que dañan el ADN en el estudio de la señalización de punto de control de daño de ADN.
Resumen
Sobre una base diaria, las células se someten a una variedad de lesiones endógenas y ambientales. Para combatir estas agresiones, las células han evolucionado checkpoint daño en el DNA de señalización como un mecanismo de vigilancia para detectar daños en el ADN y dirigir la respuesta celular al daño del ADN. Hay varios grupos de proteínas llamadas sensores, transductores y efectores implicados en la señalización de punto de control de daños en el ADN (Figura 1). En esta vía de señalización complejo, ATR (ATM y Rad3 relacionada-) es una de las principales quinasas que pueden responder al daño del ADN y la replicación del estrés. ATR activados pueden fosforilar sus sustratos tales como aguas abajo (quinasa Chk1 Checkpoint 1). En consecuencia, fosforila y activa Chk1 conduce a muchos efectos aguas abajo en el punto de control de daño del ADN incluyendo la detención del ciclo celular, activación de la transcripción, reparación de daños en el ADN, y la apoptosis o senescencia (Figura 1). Cuando el ADN está dañado, no activa los resultados de punto de control de daño del ADN en UNREPdaños al aire y, posteriormente, la inestabilidad genómica. El estudio del puesto de control el daño del ADN aclarará cómo las células mantener la integridad genómica y proporcionar un mejor entendimiento de cómo las enfermedades humanas, tales como el cáncer, desarrollar.
Xenopus laevis extractos de huevo se están convirtiendo en un poderoso sistema libre de células modelo de extracto en la investigación puesto de control de daños en el ADN. Baja velocidad extracto (LSE) fue descrito inicialmente por el grupo Masui 1. La adición de cromatina de los espermatozoides demembranated a los resultados de LSE en la formación de núcleos cuando el ADN se replica de manera semiconservativa una vez por ciclo celular.
El puesto de control vía de señalización ATR/Chk1-mediated es desencadenada por el estrés o daño en el ADN de replicación 2. Dos métodos se utilizan actualmente para inducir el punto de control de daño en el ADN: los enfoques que dañan el ADN y el ADN que imitan las estructuras de daños-3. Daño del ADN puede ser inducida por la radiación ultravioleta (UV), γ-irradiación, metilo metanonaesulfonate (MMS), mitomicina C (MMC), 4-nitroquinolina-1-óxido (4-NQO), o afidicolina 3, 4. MMS es un agente alquilante que inhibe la replicación del ADN y activa el punto de control de daños del ADN ATR/Chk1-mediated 4-7. Irradiación UV también provoca el daño del ADN 8 ATR/Chk1-dependent puesto de control. El daño en el ADN que imita la estructura AT70 es un complejo de recocido de dos oligonucleótidos poli-(dA) 70 y poli-70 (dT). El sistema AT70 fue desarrollado en el laboratorio Bill Dunphy y es ampliamente utilizada para inducir ATR/Chk1 señalización de punto de control 9-12.
Aquí, se describen protocolos (1) para preparar extractos libres de células de huevo (LSE), (2) para el tratamiento de la cromatina de esperma de Xenopus con dos ADN diferentes enfoques dañar (MMS y UV), (3) para preparar el ADN daños que imita la estructura AT70, y (4) para activar el punto de control de daños del ADN ATR/Chk1-mediated en LSE con cromatina de esperma dañado o una estructura que imita a daño en el DNA.
Protocolo
1. Preparación LSE
- Ranas hembra (Xenopus laevis) se inyecta dos veces para la recolección de huevos. La primera inyección (cebado) es 100 U PMSG (gonadotropina sérica de yegua preñada) por rana. Las ranas se debe purgar por lo menos dos días antes de la inducción de huevo y por el que se ranas cebados son utilizables para un máximo de dos semanas. Para las ranas primos, inyectar PMSG por vía subcutánea en los sacos linfáticos dorsales usando una jeringa de 3 ml y aguja 27 G.
- Para inducir la puesta de huevos, inyectar 500 U hCG (gonadotropina coriónica humana) por vía subcutánea rana preparado en los sacos linfáticos dorsales usando una aguja de 27 G. Incubar las ranas inyectados en cubos separados que contengan 2 litros de solución modificada 1x Marc Ringer (MMR). Permitir ranas 14-20 horas para poner sus huevos antes de la recolección.
- Retire las ranas de los cubos y vierta la solución MMR hasta alrededor de 100 ml que queda. Obtener huevos de los cubos mediante la transferencia de huevos a un vaso de precipitados de 250 ml.
- Dejelly huevos mediante la adición de 100 ml de 2% de cisteína (ajustarpH a 7,8 con 10 M KOH). Revuelva suavemente los huevos con un vaso invertido pipeta Pasteur (0,7 cm de diámetro) aproximadamente cada 30 segundos. Decantar y reemplazar con cisteína fresco dos veces durante la incubación. El proceso dejellying es completa en aproximadamente 5-15 min cuando los huevos formar una capa más condensada en la parte inferior del vaso de precipitados.
- Deseche la solución de cisteína y lavar tres veces con huevos MMR 0.25x. Swirl los huevos en la solución con una pipeta de vidrio. "Bad" huevos se determinó por inspección visual simple y son "hinchada" blanca en apariencia. Los "malos" huevos se acumularán en el centro del vaso de precipitados después de remolino. Quite "malos" huevos con una pipeta Pasteur.
- Lavar los huevos con Lysis Buffer huevo (ELB) tres veces. Retire todos los adicionales "malos" los huevos con una pipeta Pasteur. Vierta los huevos en un tubo de 14 ml Falcon.
- Haga girar el tubo Falcon de 55 segundos a 188 xg (1.100 rpm) con el CL2 IEC clínica de sobremesa centrífuga con un rotor basculante para compactar los huevos. Eliminar el exceso de tampón de lala parte superior de la capa de huevo. Añada 0,5 l de aprotinina / stock leupeptina y 0,5 l de citocalasina B por ml de stock de huevos compactados.
- Centrifugar los huevos a 16.500 xg (10.000 rpm) durante 15 min a 4 ° C utilizando el RC6 Sorvall más centrífuga superspeed HB6 con rotor basculante. Después de la centrifugación, los huevos son fraccionados en tres capas en el tubo: lípidos, extracto, y la yema / pigmento de arriba a abajo, respectivamente. Perforar la pared del tubo Falcon en la porción inferior de la capa de extracto de media con una aguja de 21 G. Retire con cuidado la aguja cuando la aguja de punción puede ser obstruida por el plástico. Inserte una aguja 21 G unida a una jeringa de 1 ml en el sitio de punción para recoger el extracto. Lentamente aspirar el extracto en la jeringa para evitar burbujas de aire y la contaminación con los lípidos y la yema / pigmento capas.
- Coloque los extractos en un tubo de microcentrífuga refrigerada 1,5 ml. Para cada mililitro de extracto de huevo, añadir las soluciones químicas siguientes valores para el endicated concentración final (mostrado entre paréntesis): (1) 10 cicloheximida l (100 mg / ml); (2) 1 l aprotinina / leupeptina (10 mg / ml cada uno); (3) 1 l citocalasina B (5 mg / ml ); (4) 1 l de ditiotreitol (1 mM), y (5) 0,33 l Nocodazol (3 mg / ml). Invertir el huevo extraer al menos 10 veces suavemente. Este es el LSE, el cual debe ser fresca y utilizarse dentro de 4 hr. La calidad de la LSE está en peligro después de 4 horas o congelación-descongelación.
2. El tratamiento de la cromatina espermática con los criterios que dañan el ADN
- Preparar cromatina de esperma normal de acuerdo con el método descrito previamente 13.
- Preparar MMS tratado con cromatina espermática
- Resuspender cromatina espermática normal en 0,5 ml de tampón X.
- Añadir ~ 5,5 l de MMS (9,1 M en stock) a 500 l cromatina resuspendieron a una concentración final de 100 mM.
- Incubar cromatina de los espermatozoides en un tubo de microcentrífuga a temperatura ambiente durante 30 min con rotación.
- Haga girar la microcentrifuge tubo a 686 xg (2.100 rpm) durante 10 min a temperatura ambiente usando la centrífuga IEC CL2 clínica con el rotor basculante y adaptadores de tubo.
- Desechar el sobrenadante y resuspender el precipitado en 0,5 ml de tampón de X plus BSA (3%), DTT (0,1 mM) y aprotinina / leupeptina (10 mg / ml cada uno).
- Repetir los pasos (4) y (5) dos veces para lavar la cromatina de los espermatozoides.
- Determinar la concentración de la cromatina espermática con un hemocitómetro y se diluye hasta 100.000 espermatozoides / l. Ahorra 5 alícuotas a -80 ° C congelador para su uso posterior.
- Prepara con tratamiento UV cromatina espermática
- Añade la cantidad deseada (por ejemplo 10 l) de la cromatina de esperma normal en la superficie de un trozo de Parafilm.
- Coloque el Parafilm en un reticulador UV. Ajuste el parámetro deseado energía, dependiendo de su experiencia, y comienzan a dañar la cromatina de los espermatozoides a través de la luz ultravioleta. Por ejemplo, se tarda aproximadamente 21 segundos para llegar a 1.000 J / m 2.
- Después de UV irramediación, tratada con UV cromatina de los espermatozoides debe ser añadido a los extractos de huevo inmediatamente.
3. Preparación de un daño en el DNA que imita la estructura (AT70)
- Disolver dos oligonucleótidos sintéticos de poli-(dA) 70 (designada como A70) y poli-70 (dT) (designado como T70) en agua a una concentración de 2 mg / l, respectivamente.
- Añadir 100 l de A70 y 100 l de T70 a un tubo de microcentrífuga de 1,5 ml. Hervir solución mixta sintético oligo durante 5 min a 95 ° C en un heatblock.
- Tome el bloque baño seco, fuera (con el tubo que contiene el AT mezcla en ella), y deje que se enfríe a temperatura ambiente sobre una mesa de laboratorio. Este ajuste de temperatura tarda alrededor de 45-60 min.
- La mezcla enfriada es AT70 con una concentración final de 2 mg / l. Tienda 10 l de alícuotas AT70 en congelador a -20 ° C para su uso posterior.
4. Activar el Checkpoint Daño del ADN en la cromatina espermática con LSE dañado o un daño del ADNQue imita la estructura
- Inducir el puesto de control de daños en el ADN en la cromatina LSE con espermatozoides dañados
- Añadir 50 l de LSE a un tubo de microcentrífuga de 1,5 ml y complementarlo con 1 l de mezcla de energía y 2 l de cromatina de los espermatozoides dañados (concentración final ~ 4.000 espermatozoides / l de reacción).
- Incubar el tubo de reacción a temperatura ambiente durante 90 min y la película del tubo cada 10 min.
- Dispensar 1 l de mezcla de reacción en un portaobjetos de microscopio suplementado con 1 l de solución de tinte nuclear después de 30-min de incubación. Colocar un cubreobjetos sobre la mezcla de reacción y comprobar para la formación de núcleos a través de microscopio de fluorescencia. Típicamente, los núcleos redondos se forman después de 30 min de incubación, lo que indica la replicación del ADN se ha iniciado.
- Tomar 10 l de la mezcla de reacción en 90 l de tampón de muestra. Las muestras se analizan mediante inmunotransferencia utilizando anti-Chk1 P-S344 o anticuerpos anti-Chk1.
- Inducir el punto de control de daños del ADN en LSE con laAT70
- Añadir 50 l de LSE a un tubo de microcentrífuga de 1,5 ml suplementado con 1 l de mezcla de energía y un 1,6 l de acciones Tautomycin.
- Añadir 1,25 l de pre-hechos AT70 (2 g / l) o agua (como control negativo) a cada reacción. Se incuban las reacciones a temperatura ambiente durante 90 min. Flick los tubos de reacción cada 10 min.
- Añadir 10 l de la mezcla de reacción en 90 l de tampón de muestra. Las muestras se examinaron a través de inmunotransferencia utilizando anti-Chk1 P-S344 o anticuerpos anti-Chk1.
5. Los resultados representativos
La cromatina de los espermatozoides o estructura de daño en el DNA que imita puede desencadenar el puesto de control de daños del ADN ATR/Chk1-mediated en el sistema de extracto de huevo Xenopus. Figura 2A muestra que el MMS Chk1 induce la fosforilación en Ser344 (Chk1 P-S344), que es un indicador de activación de la quinasa ATR. Figura 2B muestra que AT70, como un daño en el DNA que imita estrumagen, también provoca Chk1 fosforilación. Total de muestras de Chk1 se utilizan como controles de carga en ambos ejemplos.
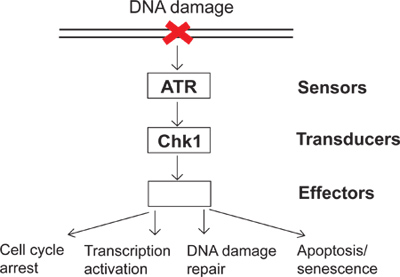
Figura 1. Un diagrama de la señalización de punto de control de daño de ADN.
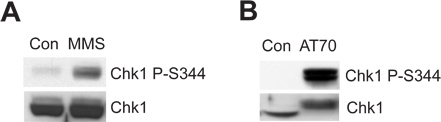
Figura 2. Chk1 fosforilación es inducida por cualquiera de MMS o AT70 tratamientos en extractos de Xenopus huevo. (A) MMS dañada por el esperma cromatina (MMS) o cromatina de esperma normal (Con) se incuban en extractos de huevos de 90 min. Chk1 fosforilación en Ser344 (Chk1 P-S344) y Chk1 total en los extractos de huevo son examinados por inmunotransferencia. (B) AT70 o agua (Con) se añaden en los extractos de huevo, respectivamente. Las muestras también se analizaron mediante inmunotransferencia como en (A).
Access restricted. Please log in or start a trial to view this content.
Discusión
Hay varias ventajas en el estudio del punto de control de daño en el DNA utilizando extractos de Xenopus huevo. El uso de extractos de huevo proporciona una gran cantidad de extractos libres de células sincronizadas en la interfase del ciclo celular. Los extractos de huevo puede ser realizado fácilmente y económicamente. Es relativamente fácil de dañar el ADN o cromatina y para revelar un defecto en el punto de control de daño de ADN después de immunodepleting una proteína diana a partir de extracto de...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo está apoyado en parte por fondos proporcionados por la Universidad de Carolina del Norte en Charlotte, Wachovia fondo base para la excelencia docente, y una subvención de NIGMS (R15GM101571).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivos | |||
| Anti-P-S344 Chk1 anticuerpos | Señalización Celular | 2348L | |
| Chk1 anticuerpos anti- | Santa Cruz | SC7898 | |
| La aprotinina | MP Biomedicals | 0219115880 | |
| La cicloheximida | Sigma | C7698-5G | |
| Citocalasina B | EMD | 250233 | |
| Ditiotreitol (DTT) | VWR | JTF780-2 | |
| hCG | Sigma | CG10-10VL | |
| L-cisteína | Sigma | C7352-1KG | |
| Leupeptina | VWR | 97063-922 | |
| Metanosulfonato de metilo (MMS) | Sigma | 129925-5G | |
| Nocodazol | Sigma | M1404-2MG | |
| PMSG | Calbiochem | 367222 | |
| Muestra de tampón | Sigma | S3401 | |
| Tautomycin | Wako Chemicals EE.UU. | 209-12041 | |
| Equipo | |||
| Cuchara para la puesta de huevos | Rubbermaid Commercial Products | 6308 | |
| CL2 IEC centrífuga con rotor basculante | Thermo Scientific | 004260F | |
| HB6 rotor basculante | Thermo Scientific | 11860 | |
| Sorvall RC6 más centrifugadora supervelocidad | Thermo Scientific | 46910 | |
| Reticulador UV | UVP | 95-0174-01 | |
| Soluciones | |||
| 1x MMR | 100 mM NaCl, 2 mM KCl, 0,5 mM MgSO 4, 2,5 mM CaCl 2, 5 mM de HEPES, ajustar el pH a 7,8 con 10 M NaOH | ||
| La aprotinina / Leupeptina acciones | 10 mg / ml cada una en agua. Almacenar 20 alícuotas a -80 ° C. | ||
| Buffer X | 0,2 M de sacarosa, 80 mM KCl, 15 mM NaCl, 5 mM MgCl 2, 1 mM EDTA, 10 mM HEPES, ajustar el pH a 7,5 con HCl | ||
| La cicloheximida acciones | 10 mg / ml en agua. Tienda de 1 ml alícuotas a -20 ° C. | ||
| Citocalasina B de stock | 5 mg / ml en DMSO. Almacenar 20 alícuotas a -20 ° C. | ||
| Ditiotreitol (DTT) acciones | 1 M en agua. Tienda de 1 ml alícuotas a -20 ° C. | ||
| ELB | 0,25 M sacarosa, 1 mM DTT, 50 ug / ml de cicloheximida, 2,5 mM de MgCl 2, 50 mM KCl, 10 mM HEPES, pH 7,7 | ||
| Nocodazol acciones | 10 mg / ml en DMSO. Guarde 5 alícuotas a -80 ° C. | ||
| Mezcla de Energía | 375 mM de fosfato de creatina, 50 mM de ATP, y 25 mM de MgCl 2. Las alícuotas se guardan a -80 ° C. | ||
| Solución de tinte nuclear | 0,4 g / ml Hoechst 33258, glicerol 25%(V / v), en 1x PBS | ||
| Tautomycin acciones | 100 mM en DMSO. Almacenar 10 alícuotas a -80 ° C. |
Referencias
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cimprich, K. A., Cortez, D. ATR: an essential regulator of genome integrity. Nat. Rev. Mol. Cell Biol. 9 (8), 616-627 (2008).
- Lupardus, P. J., Van, C., Cimprich, K. A. Analyzing the ATR-mediated checkpoint using Xenopus egg extracts. Methods. 41 (2), 222-231 (2007).
- Lupardus, P. J., Byun, T., Yee, M. C., Hekmat-Nejad, M., Cimprich, K. A. A requirement for replication in activation of the ATR-dependent DNA damage checkpoint. Genes Dev. 16 (18), 2327-2332 (2002).
- Stokes, M. P., Van Hatten, R., Lindsay, H. D., Michael, W. M. DNA replication is required for the checkpoint response to damaged DNA in Xenopus egg extracts. J. Cell Biol. 158 (5), 863-872 (2002).
- Kato, K., Strauss, B. Accumulation of an intermediate in DNA synthesis by HEp.2 cells treated with methyl methanesulfonate. Proc. Natl. Acad. Sci. U.S.A. 71 (5), 1969-1973 (1974).
- Paulovich, A. G., Hartwell, L. H. A checkpoint regulates the rate of progression through S phase in S. cerevisiae in response to DNA damage. Cell. 82 (5), 841-847 (1995).
- Guo, Z., Kumagai, A., Wang, S. X., Dunphy, W. G. Requirement for Atr in phosphorylation of Chk1 and cell cycle regulation in response to DNA replication blocks and UV-damaged DNA in Xenopus egg extracts. Genes Dev. 14 (21), 2745-2756 (2000).
- Jazayeri, A., Balestrini, A., Garner, E., Haber, J. E., Costanzo, V. Mre11-Rad50-Nbs1-dependent processing of DNA breaks generates oligonucleotides that stimulate ATM activity. EMBO. J. 27 (14), 1953-1962 (2008).
- Kumagai, A., Dunphy, W. G. Claspin, a novel protein required for the activation of Chk1 during a DNA replication checkpoint response in Xenopus egg extracts. Mol. Cell. 6 (4), 839-849 (2000).
- Yan, S., Lindsay, H. D., Michael, W. M. Direct requirement for Xmus101 in ATR-mediated phosphorylation of Claspin bound Chk1 during checkpoint signaling. J. Cell Biol. 173 (2), 181-186 (2006).
- Shiotani, B., Zou, L. Single-stranded DNA orchestrates an ATM-to-ATR switch at DNA breaks. Mol. Cell. 33 (5), 547-558 (2009).
- Tutter, A. V., Walter, J. C. Chromosomal DNA replication in a soluble cell-free system derived from Xenopus eggs. Methods Mol. Biol. 322, 121-137 (2006).
- Cross, M. K., Powers, M. Preparation and Fractionation of Xenopus laevis Egg Extracts. J. Vis. Exp. (18), e891(2008).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados