Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Исследование Checkpoint повреждения ДНК использовании
* Эти авторы внесли равный вклад
В этой статье
Резюме
Xenopus яйцо экстракт является полезной модели системы для расследования контрольно-пропускного пункта повреждения ДНК. Этот протокол предназначен для подготовки Xenopus яйцо экстракты и повреждение ДНК реагенты контрольно-пропускном пункте вызывающим. Эти методы могут быть адаптированы к различным повреждающим ДНК подходы в изучении контрольно-пропускного пункта сигнализации повреждения ДНК.
Аннотация
On a daily basis, cells are subjected to a variety of endogenous and environmental insults. To combat these insults, cells have evolved DNA damage checkpoint signaling as a surveillance mechanism to sense DNA damage and direct cellular responses to DNA damage. There are several groups of proteins called sensors, transducers and effectors involved in DNA damage checkpoint signaling (Figure 1). In this complex signaling pathway, ATR (ATM and Rad3-related) is one of the major kinases that can respond to DNA damage and replication stress. Activated ATR can phosphorylate its downstream substrates such as Chk1 (Checkpoint kinase 1). Consequently, phosphorylated and activated Chk1 leads to many downstream effects in the DNA damage checkpoint including cell cycle arrest, transcription activation, DNA damage repair, and apoptosis or senescence (Figure 1). When DNA is damaged, failing to activate the DNA damage checkpoint results in unrepaired damage and, subsequently, genomic instability. The study of the DNA damage checkpoint will elucidate how cells maintain genomic integrity and provide a better understanding of how human diseases, such as cancer, develop.
Xenopus laevis egg extracts are emerging as a powerful cell-free extract model system in DNA damage checkpoint research. Low-speed extract (LSE) was initially described by the Masui group1. The addition of demembranated sperm chromatin to LSE results in nuclei formation where DNA is replicated in a semiconservative fashion once per cell cycle.
The ATR/Chk1-mediated checkpoint signaling pathway is triggered by DNA damage or replication stress 2. Two methods are currently used to induce the DNA damage checkpoint: DNA damaging approaches and DNA damage-mimicking structures 3. DNA damage can be induced by ultraviolet (UV) irradiation, γ-irradiation, methyl methanesulfonate (MMS), mitomycin C (MMC), 4-nitroquinoline-1-oxide (4-NQO), or aphidicolin3, 4. MMS is an alkylating agent that inhibits DNA replication and activates the ATR/Chk1-mediated DNA damage checkpoint 4-7. UV irradiation also triggers the ATR/Chk1-dependent DNA damage checkpoint 8. The DNA damage-mimicking structure AT70 is an annealed complex of two oligonucleotides poly-(dA)70 and poly-(dT)70. The AT70 system was developed in Bill Dunphy's laboratory and is widely used to induce ATR/Chk1 checkpoint signaling 9-12.
Here, we describe protocols (1) to prepare cell-free egg extracts (LSE), (2) to treat Xenopus sperm chromatin with two different DNA damaging approaches (MMS and UV), (3) to prepare the DNA damage-mimicking structure AT70, and (4) to trigger the ATR/Chk1-mediated DNA damage checkpoint in LSE with damaged sperm chromatin or a DNA damage-mimicking structure.
протокол
1. Подготовка LSE
- Женский лягушек (Xenopus Хепориз) вводится два раза для сбора яиц. Первая инъекция (грунтовка) составляет 100 U PMSG (Беременные Mare сыворотке гонадотропина) в лягушку. Лягушки должны быть загрунтованы по крайней мере, за два дня до вызывающие откладки яиц и загрунтовать лягушки могут использоваться на срок до двух недель. Премьер-лягушки, вводят подкожно ГСЖК в спинной лимфатический мешочки с использованием 3 мл шприц и иглу 27 G.
- Для стимулирования откладки яиц, вводить 500 U ХГЧ (хорионического гонадотропина человека) на загрунтованную лягушки подкожно в спинных мешочков лимфатических использованием 27 G игла. Инкубируйте впрыском лягушек в отдельных ведра, содержащий 2 л раствора 1x Марка изменения Рингера (MMR). Разрешить лягушек 14-20 часов, чтобы отложить яйца до коллекцию.
- Снимите лягушек из ведра и вылить раствор MMR примерно до 100 мл осталось. Получите яйца из ведра, передавая яйца в 250 мл стакан.
- Dejelly яйца, добавляя 100 мл 2% цистеина (настройкарН до 7,8 с 10 М КОН). Осторожно вращать яйца с перевернутой стеклянной пипетки Пастера (0,7 см в диаметре) примерно каждые 30 сек. Слейте и заменить свежим цистеина в два раза во время инкубации. Dejellying процесс завершится примерно через 5-15 минут, когда яйца сформировать более конденсированного слоя на дне стакана.
- Откажитесь от раствора цистеина и мыть яйца три раза 0.25x MMR. Swirl яйца в раствор стеклянной пипетки. "Bad" яйца определяется простым визуальным осмотром и являются "пухлые" белые по внешнему виду. "Плохими" яйца будут накапливаться в центре стакана после закрученной. Удалить "плохих" яйца пипеткой Пастера.
- Мойте яйца с яйцом буфера для лизиса (СОБ) в три раза. Удалите все дополнительные "плохих" яйца пипеткой Пастера. Залейте яйца в 14 мл трубки Falcon.
- Спиновые трубки сокола в течение 55 сек при 188 мкг (1100 оборотов в минуту) с помощью CL2 IEC клинических настольной центрифуге с бакет ротор для уплотнения яйца. Удалите излишки буфера изверхней части яйца слоя. Добавить 0,5 мкл Апротинин / акция лейпептин и 0,5 мкл на складе цитохалазин на мл уплотненного яйца.
- Центрифуга яйца в 16500 мкг (10.000 оборотов в минуту) в течение 15 мин при 4 ° С с использованием Sorvall RC6 плюс сверхскоростные центрифуги с HB6 бакет ротора. После центрифугирования, яйца фракционированного на три слоя в трубку: липиды, экстракт и желток / пигмент сверху вниз, соответственно. Прокол стороне трубки сокола в нижней части среднего слоя экстракта с 21 игл G. Аккуратно извлеките иглу, как прокалывание иглой может быть затруднен пластика. Вставьте новую иглу 21 G прикреплены к 1 мл шприца в месте прокола, чтобы собрать экстракт. Медленно аспирации экстракта в шприц, чтобы избежать пузырьков воздуха и загрязнение липидов и желток / пигмент слоев.
- Поместите экстракты в охлажденный 1,5 трубку микроцентрифужных мл. Для каждого миллилитра экстракта яйцо, добавьте следующие растворы химических Вdicated конечная концентрация (в скобках): (1) 10 мкл Циклогексимид (100 мкг / мл); (2) 1 мкл Апротинин / лейпептин (10 мкг / мл); (3) 1 мкл цитохалазин (5 мкг / мл ); (4) 1 мкл Dithiothreitol (1 мМ) и (5) 0.33 мкл нокодазолом (3 мкг / мл). Переверните яйцо извлечь по крайней мере, в 10 раз мягко. Это LSE, которое должно быть свежим и использовать в течение 4 часов. Качество LSE находится под угрозой после 4 ч или замораживания-оттаивания.
2. Лечение спермы хроматина с ДНК Повреждение подходы
- Подготовка нормального хроматина сперматозоидов в соответствии с методом, описанным ранее 13.
- Подготовить MMS-обработанной спермы хроматина
- Ресуспендируют нормальных хроматина сперматозоидов в 0,5 мл буфера X.
- Добавить ~ 5,5 мкл MMS (9,1 M в наличии) до 500 мкл ресуспендировали хроматина до конечной концентрации 100 мМ.
- Инкубируйте спермы хроматина в микроцентрифуге трубки при комнатной температуре в течение 30 мин с вращением.
- Побочные мicrocentrifuge трубки на 686 мкг (2100 оборотов в минуту) в течение 10 мин при комнатной температуре с использованием IEC CL2 клинической центрифуге с качающимся ротором ведро и трубка адаптеров.
- Удалите супернатант и ресуспендируют осадок в 0,5 мл буфера X плюс BSA (3%), DVB-T (0,1 мм) и Апротинин / лейпептин (10 мкг / мл).
- Повторите шаги (4) и (5) в два раза мыть спермы хроматина.
- Определить концентрацию сперматозоидов хроматина с гемоцитометр и разбавить до 100.000 спермы / мкл. Скидка 5 мкл аликвоты в -80 ° C морозильник для дальнейшего использования.
- Подготовка УФ-обработанной спермы хроматина
- Добавить желаемую сумму (например, 10 мкл) нормальная хроматина сперматозоидов на поверхности куска Parafilm.
- Поместите Parafilm в УФ сшивателя. Установить желаемый энергетический параметр, в зависимости от вашего эксперимента, и начать повредить сперму хроматина с помощью ультрафиолетового света. Например, она занимает около 21 секунд, чтобы достигать 1000 Дж / м 2.
- После УФ-облучениячения, УФ-обработанной спермы хроматина следует добавить яйцо экстрактов немедленно.
3. Подготовка повреждения ДНК имитирующих структуру (AT70)
- Растворите двух синтетических олигонуклеотидов поли-(дА) 70 (обозначается как A70) и поли-(дТ) 70 (обозначается как T70) в воде в концентрации 2 мкг / мл, соответственно.
- Добавить 100 мкл A70 и 100 мкл T70 одной трубке микроцентрифужных 1,5 мл. Отварить смешанных синтетических олиго решение в течение 5 мин при 95 ° С в теплоблока.
- Возьмите сухую ванну из блоков (с трубой, содержащий по меньшей смесь в ней), и дайте ему остыть до комнатной температуры на лабораторном столе. Эта регулировка температуры занимает около 45-60 минут.
- Охлажденную смесь AT70 с конечной концентрации 2 мкг / мкл. Магазин 10 мкл аликвоты в AT70 -20 ° C морозильник для дальнейшего использования.
4. Запуск Checkpoint повреждений ДНК в LSE с повреждением хроматина сперматозоидов или повреждения ДНКИмитирующих структуры
- Вызвать контрольно-пропускном пункте повреждений ДНК в LSE с повреждением хроматина спермы
- Добавить 50 мкл LSE в 1,5 мл трубки микроцентрифужных и дополнить его с 1 мкл энергетики смеси и 2 мкл поврежденных хроматина сперматозоидов (конечная концентрация сперматозоидов ~ 4,000 / мкл реакции).
- Инкубируйте реакционной трубке при комнатной температуре в течение 90 минут и вылить трубку каждые 10 мин.
- Внесите 1 мкл реакционной смеси на предметное стекло микроскопа с добавлением 1 мкл ядерной раствор красителя после 30-минутной инкубации. Поместите крышку скольжения над реакционной смеси и проверить на формирование ядер с помощью флуоресцентного микроскопа. Как правило, круглые ядра будут формироваться после 30 мин инкубации, с указанием репликации ДНК инициировал.
- Возьмите 10 мкл реакционной смеси в 90 мкл буфера для образца. Образцы анализировали с помощью иммуноблоттинга с использованием анти-Chk1 P-S344 или анти-Chk1 антител.
- Вызвать контрольно-пропускном пункте повреждений ДНК в LSE сAT70
- Добавить 50 мкл LSE до 1,5 мл микроцентрифужных трубы с добавлением 1 мкл энергии смеси и 1,6 мкл Tautomycin акций.
- Добавить 1,25 мкл готовых AT70 (2 мкг / мкл) или воды (в качестве отрицательного контроля) для каждой реакции. Инкубируйте реакции при комнатной температуре в течение 90 мин. Флик реакционных труб каждые 10 мин.
- Добавить 10 мкл реакционной смеси в 90 мкл буфера для образца. Образцы исследовали с помощью иммуноблоттинга с использованием анти-Chk1 P-S344 или анти-Chk1 антител.
5. Представитель Результаты
Поврежденного хроматина сперматозоидов или повреждение ДНК имитирующих структуру может вызвать ATR/Chk1-mediated контрольно-пропускном пункте повреждение ДНК в экстракте системе Xenopus яйцо. Рисунок 2А показывает, что MMS вызывает Chk1 фосфорилирования в Ser344 (Chk1 P-S344), который является показателем ATR киназы активации. рис. 2В показывает, что AT70, как повреждение ДНК, имитирующие STRUcture, также вызывает Chk1 фосфорилирования. Всего образцов Chk1 используются в качестве контроля загрузки в обоих примерах.
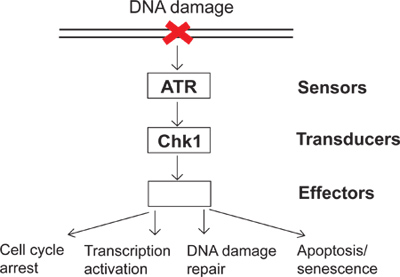
Рисунок 1. Схема контрольно-пропускного пункта сигнализации повреждения ДНК.
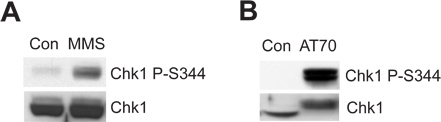
Рисунок 2. Chk1 фосфорилирования индуцированный либо MMS или AT70 лечения в Xenopus экстракты яйцо. (A) MMS-поврежденные сперматозоиды хроматина (MMS) или нормальный хроматина сперматозоидов (Con) инкубируют в яйце экстракт в течение 90 мин. Chk1 фосфорилирования по Ser344 (Chk1 P-S344) и общего Chk1 в яйце экстракты исследовали с помощью иммуноблоттинга. (B) AT70 или воды (Con) будут добавлены в яйце экстракты, соответственно. Пробы также анализировали с помощью иммуноблоттинга, как и в (A).
Обсуждение
Есть несколько преимуществ в изучении контрольно-пропускного пункта повреждения ДНК использовании Xenopus яйцо экстрактов. Использование яйцо экстракт содержит большое количество бесклеточных экстрактов синхронизированы в интерфазе клеточного цикла. Яйцо экстракты могут быть ле...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа частично поддержана средств, предоставленных Университетом Северной Каролины в Шарлотте, Wachovia основу фонда для профессорско-преподавательского мастерства, и грант от NIGMS (R15GM101571).
Материалы
| Name | Company | Catalog Number | Comments |
| Реагенты | |||
| Anti-Chk1 P-S344 антитела | Cell Signaling | 2348L | |
| Anti-Chk1 антител | Санта-Крус | SC7898 | |
| Апротинин | MP Biomedicals | 0219115880 | |
| Циклогексимид | Сигма | C7698-5G | |
| Цитохалазин | EMD | 250233 | |
| Dithiothreitol (DTT) | VWR | JTF780-2 | |
| ХГЧ | Сигма | CG10-10VL | |
| L-цистеин | Сигма | C7352-1кг | |
| Лейпептин | VWR | 97063-922 | |
| Метиловый метансульфонат (MMS) | Сигма | 129925-5G | |
| Нокодазолом | Сигма | M1404-2MG | |
| ГСЖК | Calbiochem | 367222 | |
| Пример буфер | Сигма | S3401 | |
| Tautomycin | Wako Chemicals США | 209-12041 | |
| Оборудование | |||
| Ковш для откладки яиц | Rubbermaid Commercial Products | 6308 | |
| CL2 IEC центрифуге с бакет ротора | Thermo Scientific | 004260F | |
| HB6 качающийся ротор ведро | Thermo Scientific | 11860 | |
| Sorvall RC6 плюс сверхскоростные центрифуги | Thermo Scientific | 46910 | |
| УФ сшивателя | UVP | 95-0174-01 | |
| Решения | |||
| 1x MMR | 100 мМ NaCl, 2 мМ KCl, 0,5 мМ MgSO 4, 2,5 мМ CaCl 2, 5 мМ HEPES, рН до 7,8 с помощью 10 М NaOH | ||
| Апротинин / лейпептин складе | 10 мг / мл в воде. Храните 20 мкл аликвоты при -80 ° C. | ||
| Буфер X | 0,2 М сахарозы, 80 мМ KCl, 15 мМ NaCl, 5 мМ MgCl 2, 1 мМ ЭДТА, 10 мМ HEPES, отрегулировать рН до 7,5 соляной кислотой | ||
| Циклогексимид складе | 10 мг / мл в воде. Магазин 1 мл аликвоты при -20 ° C. | ||
| Цитохалазин складе | 5 мг / мл в ДМСО. Храните 20 мкл аликвоты при -20 ° C. | ||
| Dithiothreitol (DTT) акции | 1 M в воде. Магазин 1 мл аликвоты при -20 ° C. | ||
| ELB | 0,25 М сахарозы, 1 мМ DTT, 50 мкг / мл циклогексимид, 2,5 мМ MgCl 2, 50 мМ KCl, 10 мМ HEPES, pH7.7 | ||
| Нокодазолом складе | 10 мг / мл в ДМСО. Храните 5 мкл аликвоты при -80 ° C. | ||
| Энергия смеси | 375 мм креатин фосфат, 50 мМ ATP и 25 мМ MgCl 2. Аликвоты сохраняются при температуре -80 ° C. | ||
| Ядерная раствор красителя | 0,4 мкг / мл Hoechst 33258, 25% глицерина(V / V), в 1x PBS | ||
| Tautomycin складе | 100 мкм в ДМСО. Храните 10 мкл аликвоты при -80 ° C. |
Ссылки
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cimprich, K. A., Cortez, D. ATR: an essential regulator of genome integrity. Nat. Rev. Mol. Cell Biol. 9 (8), 616-627 (2008).
- Lupardus, P. J., Van, C., Cimprich, K. A. Analyzing the ATR-mediated checkpoint using Xenopus egg extracts. Methods. 41 (2), 222-231 (2007).
- Lupardus, P. J., Byun, T., Yee, M. C., Hekmat-Nejad, M., Cimprich, K. A. A requirement for replication in activation of the ATR-dependent DNA damage checkpoint. Genes Dev. 16 (18), 2327-2332 (2002).
- Stokes, M. P., Van Hatten, R., Lindsay, H. D., Michael, W. M. DNA replication is required for the checkpoint response to damaged DNA in Xenopus egg extracts. J. Cell Biol. 158 (5), 863-872 (2002).
- Kato, K., Strauss, B. Accumulation of an intermediate in DNA synthesis by HEp.2 cells treated with methyl methanesulfonate. Proc. Natl. Acad. Sci. U.S.A. 71 (5), 1969-1973 (1974).
- Paulovich, A. G., Hartwell, L. H. A checkpoint regulates the rate of progression through S phase in S. cerevisiae in response to DNA damage. Cell. 82 (5), 841-847 (1995).
- Guo, Z., Kumagai, A., Wang, S. X., Dunphy, W. G. Requirement for Atr in phosphorylation of Chk1 and cell cycle regulation in response to DNA replication blocks and UV-damaged DNA in Xenopus egg extracts. Genes Dev. 14 (21), 2745-2756 (2000).
- Jazayeri, A., Balestrini, A., Garner, E., Haber, J. E., Costanzo, V. Mre11-Rad50-Nbs1-dependent processing of DNA breaks generates oligonucleotides that stimulate ATM activity. EMBO. J. 27 (14), 1953-1962 (2008).
- Kumagai, A., Dunphy, W. G. Claspin, a novel protein required for the activation of Chk1 during a DNA replication checkpoint response in Xenopus egg extracts. Mol. Cell. 6 (4), 839-849 (2000).
- Yan, S., Lindsay, H. D., Michael, W. M. Direct requirement for Xmus101 in ATR-mediated phosphorylation of Claspin bound Chk1 during checkpoint signaling. J. Cell Biol. 173 (2), 181-186 (2006).
- Shiotani, B., Zou, L. Single-stranded DNA orchestrates an ATM-to-ATR switch at DNA breaks. Mol. Cell. 33 (5), 547-558 (2009).
- Tutter, A. V., Walter, J. C. Chromosomal DNA replication in a soluble cell-free system derived from Xenopus eggs. Methods Mol. Biol. 322, 121-137 (2006).
- Cross, M. K., Powers, M. Preparation and Fractionation of Xenopus laevis Egg Extracts. J. Vis. Exp. (18), e891 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены