A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חקר מחסום הניזק לדנ"א באמצעות
* These authors contributed equally
In This Article
Summary
Xenopus ביצת התמצית היא מערכת מודל שימושית לחקור מחסום הניזק לדנ"א. פרוטוקול זה מיועד להכנת תמציות ביצת Xenopus ריאגנטים ישכנעו מחסום ניזק לדנ"א. טכניקות אלה הן התאמה למגוון של גישות מזיקות DNA במחקר של איתות מחסום הניזק לדנ"א.
Abstract
על בסיס יומי, תאים נחשפים למגוון של עלבונות אנדוגניים וסביבתיים. כדי להתמודד עם העלבונות האלה, תאים התפתחו מחסום ניזק לדנ"א איתות כמנגנון מעקב לחוש ניזק לדנ"א ותגובות תאיות ישירות לניזק לדנ"א. ישנן מספר קבוצות של חלבונים הנקראים חיישנים, מתמר וגורמים מעורבים באיתות מחסום ניזק לדנ"א (איור 1). במסלול איתות מורכבת זו, ATR (כספומט וRad3 קשור) הוא אחד מקינאזות העיקרית שיכול להגיב לניזק לדנ"א, ומתח שכפול. הפעיל ATR יכול phosphorylate מצעי מורדה כגון Chk1 (קינאז מחסום 1). כתוצאה מכך, פוספורילציה והפעיל Chk1 מוביל לתופעות רבות במורד מחסום הניזק לדנ"א, כוללים מעצר מחזור תא, הפעלת שעתוק, תיקון ניזק לדנ"א, ואפופטוזיס או הזדקנות (איור 1). כאשר ה-DNA פגומה, שלא הצליח להפעיל את תוצאות מחסום הניזק לדנ"א בunrepניזק שודר, ועקב כך חוסר יציבות, הגנומי. המחקר של מחסום הניזק לדנ"א יבהיר כיצד תאים לשמור על שלמות גנטית ולספק הבנה טובה יותר של איך מחלות אנושיות, כגון סרטן, להתפתח.
תמציות Xenopus laevis ביצה מתגלות כמערכת חזקה תא חינם תמצית מודל במחקר מחסום ניזק לדנ"א. תמצית מהירות נמוכה (LSE) בתחילה תארה Masui קבוצת 1. התוספת של הכרומטין הזרע demembranated לתוצאות LSE בהיווצרות גרעינים שבו DNA משוכפל באופנת semiconservative פעם אחת בכל מחזור התא.
מסלול איתות מחסום ATR/Chk1-mediated מופעל על ידי ניזק לדנ"א או מתח כפול 2. שתי שיטות עיקריות משמשת כיום כדי לגרום הניזק לדנ"א מחסום: גישות מזיקות DNA ומבני ניזק-DNA מחק 3. ניזק לדנ"א יכול להיגרם על ידי קרינת אולטרה סגולה (UV), γ-קרינה, מהתיל methanesulfonate (MMS), mitomycin C (MMC), 4-nitroquinoline-1-התחמוצת (4-NQO), או aphidicolin 3, 4. MMS הוא סוכן אלקילציה שמעכב שכפול הדנ"א ומפעיל את מחסום הניזק לדנ"א ATR/Chk1-mediated 4-7. קרינת UV גם מפעילה 8 מחסום הניזק לדנ"א ATR/Chk1-dependent. מבנה ה-DNA ניזק מחקי AT70 הוא מורכב משני annealed oligonucleotides פולי-(DA) 70 ופולי-70 (dT). AT70 המערכת פותחה במעבדתו של ביל דאנפי ונמצאת בשימוש נרחב כדי לגרום ATR/Chk1 איתות מחסום 9-12.
כאן, אנו מתארים פרוטוקולים (1) כדי להכין תמציות ביצת תא חינם (LSE), (2) לטיפול בכרומטין זרע עם DNA Xenopus שתי שונים לפגוע גישות (MMS ו UV), (3) כדי להכין את מבנה ה-DNA ניזק המחקים AT70, ו( 4) כדי לעורר את מחסום הניזק לדנ"א ATR/Chk1-mediated בLSE בכרומטין זרע פגום או מבנה ה-DNA ניזק מחקים.
Protocol
1. הכנת LSE
- צפרדעי נשים (Xenopus laevis) מוזרקות פעמים לאיסוף ביצים. הזריקה הראשונה (יחול) היא 100 U PMSG (Mare הסרום גונדוטרופין הריון) לצפרדע. צפרדעים חייבות להיות דרוכות לפחות ימים לפני ביצת גרימת הנחת וצפרדעים דרוכות הן שמישות לתקופה של עד שבועות. לצפרדעי ממשלה, להזריק PMSG תת עורית בגב הצ'קים הלימפה באמצעות מזרק 3 מ"ל ומחט 27 G.
- כדי לגרום להטלת ביצים, להזריק 500 U (gonadotrophin כוריוני האנושי) hCG לצפרדע דרוכה תת עורי בגב הצ'קים הלימפה באמצעות מחט 27 G. דגירת צפרדעים הזריקו בדלי נפרד המכיל 2 ליטר של הפתרון של 1x מארק modified של רינגר (MMR). אפשר צפרדעים 14-20 שעות כדי להטיל את ביצים לפני שהאוסף.
- הסר את הצפרדעים מהדליים ולשפוך את פתרון MMR עד לסביבות 100 מ"ל שנותר. להשיג ביצים מהדליים ידי העברת ביצים לכוס 250 מ"ל.
- ביצי Dejelly ידי הוספת 100 מ"ל של ציסטאין 2% (להתאיםpH ל -7.8 עם 10 M KOH). ערבלו בעדינות את הביצים עם pipet הפוך זכוכית פסטר (0.7 סנטימטרי קוטר) בערך כל שנייה 30. למזוג ולהחליף עם ציסטאין הטרי פעמים במהלך דגירה. תהליך dejellying יושלם בכ 5-15 דקות, כאשר את הביצים ליצור שכבה מרוכזת יותר בתחתית הכוס.
- השלך את פתרון ציסטאין ולשטוף ביצים שלוש פעמים עם MMR 0.25x. לערבל את הביצים בפתרון על ידי pipet זכוכית. ביצים "רעות" נקבעות על ידי בדיקה ויזואלית פשוטה ולבן "נפוח" בהופעה. את הביצים "הרעות" תצטברנה במרכז הכוס לאחר מתערבל. הסר ביצים "רעות" על ידי pipet פסטר.
- שטוף את הביצים עם ביצת תמוגה חוצצת (ELB) שלוש פעמים. הסר את כל ביצים נוספות "רעות" על ידי pipet פסטר. יוצק את הביצים לתוך צינור 14 מ"ל פלקון.
- ספין צינור פלקון עבור 55 שניות ב188 XG (1,100 סל"ד) באמצעות צנטריפוגות הקלינית CL2 IEC טבלה העליונה עם הרוטור דלי מתנדנד לדחוס את הביצים. הסר חיץ עודף מעליון של שכבת הביצה. הוסף 0.5 μl של / מניות Aprotinin Leupeptin ו -0.5 μl של מניית B Cytochalasin למ"ל של ביצים דחוסות.
- צנטריפוגה ביצים ב16500 XG (10,000 סל"ד) במשך 15 דקות ב 4 ° C באמצעות Sorvall RC6 תוספת צנטריפוגה SuperSpeed עם הרוטור הדלי HB6 מתנדנד. לאחר צנטריפוגה, ביצים מופרדות לשלוש שכבות בצינור: שומנים, חילוץ וחלמון / פיגמנט מלמעלה עד למטה, בהתאמה. לנקב את הצד של צינור פלקון בחלק התחתון של שכבת תמצית האמצע עם מחט 21 G. מוציא בזהירות את המחט כפי שהכשילה את מחט הניקוב בפלסטיק. הכנס מחט טריה 21 G מחוברת למזרק 1 מ"ל לאתר לנקב לאסוף את התמצית. לאט לשאוב לתוך מזרק התמצית, כדי למנוע בועות אוויר וזיהום מים עם השומנים וחלמון / פיגמנט שכבות.
- הנח את התמציות לתוך צינור microcentrifuge מצונן 1.5 מ"ל. לכל מ"ל של תמצית ביצים, להוסיף את פתרוני המניות הכימיות הבאים לריכוז סופי dicated (בסוגריים): (1) 10 Cycloheximide μl (100 מיקרוגרם / מ"ל); (2) 1 μl Aprotinin / Leupeptin (10 מיקרוגרם / מ"ל כל אחד); (3) 1 μl Cytochalasin B (5 מיקרוגרם / מ"ל ); (4) 1 Dithiothreitol μl (מ"מ 1); ו( 5) Nocodazole μl 0.33 (3 מיקרוגרם / מ"ל). הפוך את הביצה לחלץ לפחות 10 פעמים בעדינות. זה LSE, שחייבת להתבצע טרי ולהשתמש בו בתוך 4 שעות. איכות LSE נפגעת לאחר 4 שעות או הקפאה, הפשרה.
2. טיפול בכרומטין הזרע עם DNA גישות לגרום ניזק
- הכן הכרומטין זרע התקין על פי השיטה שתוארה בעבר 13.
- הכן הכרומטין זרע MMS טופל
- Resuspend הכרומטין זרע נורמלי ב0.5 מ"ל המאגר X.
- הוסף ~ 5.5 μl של MMS (9.1 מ 'במלאי) עד 500 μl resuspended הכרומטין לריכוז סופי של 100 מ"מ.
- דגירת הכרומטין זרע בצינור microcentrifuge בטמפרטורת חדר למשך 30 דקות ברוטציה.
- ספין מ 'צינור icrocentrifuge ב686 XG (2,100 סל"ד) למשך 10 דקות בטמפרטורת חדר באמצעות צנטריפוגות הקלינית IEC CL2 עם הרוטור דלי מתנדנד ומתאמי צינור.
- בטל supernatant ו resuspend גלול ב 0.5 מ"ל של ההצפה X בתוספת BSA (3%), DTT (0.1 מ"מ) וAprotinin / Leupeptin (10 מיקרוגרם / מ"ל כל אחד).
- חזור על שלבים (4) ו (5) פעמים כדי לשטוף את הכרומטין הזרע.
- לקבוע את הריכוז של הכרומטין זרע עם hemocytometer ולדלל ל100.000 זרע / μl. שמור 5 aliquots μl במקפיא ° C -80 לשימוש נוסף.
- הכן הכרומטין הזרע UV טופל
- הוסף סכום רצוי (10 μl למשל) של הכרומטין הזרע התקין על פני השטח של פיסת Parafilm.
- הנח Parafilm לcrosslinker UV. הגדרת פרמטר רצוי אנרגיה, בהתאם לניסוי שלך, ולהתחיל לפגוע הכרומטין הזרע באמצעות אור UV. לדוגמה, זה לוקח כ 21 שניות כדי להגיע ל1000 J / מ 2.
- לאחר UV irradiation הכרומטין, UV טופל הזרע יש להוסיף לתמציות ביצים באופן מיידי.
3. הכנת מבנה ה-DNA ניזק מחקים (AT70)
- להמס 2 oligonucleotides הסינטטי פולי-(DA) 70 (מיועד כA70) ופולי-70 (dT) (מיועד כT70) במים לריכוז של 2 מיקרוגרם / μl, בהתאמה.
- הוסף 100 μl של A70 ו 100 μl של T70 לצינור microcentrifuge 1 1.5 מ"ל. מרתיח פתרון מעורב סינטטי Oligo למשך 5 דקות ב 95 מעלות צלזיוס בheatblock.
- קח בלוק האמבטיה היבשה החוצה (עם הצינור המכיל תערובת AT בו), ולתת לו להתקרר לטמפרטורת חדר על שולחן מעבדה. התאמת טמפרטורה זה לוקחת בערך 45-60 דקות.
- התערובת המקוררת היא AT70 עם ריכוז סופי של 2 מיקרוגרם / μl. 10 μl החנות של AT70 aliquots ב-20 ° C מקפיא לשימוש נוסף.
4. מפעיל מחסום הניזק לדנ"א בLSE עם הכרומטין זרע הפגום או ניזק לדנ"אמחקי מבנה
- מחסום לגרום ניזק לדנ"א בLSE בכרומטין זרע פגום
- הוסף 50 μl של LSE לצינור microcentrifuge מ"ל 1.5 ומשלים אותו עם μl 1 מתוך תערובת אנרגיה ו2 μl של הכרומטין זרע הפגום (ריכוז סופי ~ 4000 זרע / תגובת μl).
- דגירת צינור התגובה בטמפרטורת חדר למשך 90 דקות ולהעיף את הצינור כל 10 דקות.
- לוותר μl 1 מתוך תערובת תגובה לשקופית מיקרוסקופ השלימה עם μl 1 מתוך פתרון לצבוע גרעיני לאחר דגירה 30-דקות. הנח תלוש כיסוי מעל תערובת התגובה ולבדוק להיווצרות גרעינים באמצעות מיקרוסקופ פלואורסצנטי. בדרך כלל, גרעיני סיבוב יהוו לאחר 30 דקות של דגירה, המציין שכפול הדנ"א יזם.
- קח 10 μl של תערובת התגובה ל90 μl של חיץ מדגם. דגימות מנותחות באמצעות immunoblotting באמצעות אנטי Chk1 P-S344 או נוגדנים כנגד Chk1.
- לגרום ניזק לדנ"א במחסום עם LSEAT70
- הוסף 50 μl של LSE לצינור microcentrifuge מ"ל 1.5 בתוספת עם μl 1 מתוך תערובת אנרגיה ו -1.6 μl מניות Tautomycin.
- הוסף 1.25 μl של AT70 המוכן מראש (2 מיקרוגרם / μl) או מים (כשליטה שלילית) לכל תגובה. דגירה את התגובות בטמפרטורת חדר במשך 90 דקות. פליק צינורות התגובה כל 10 דקות.
- הוסף 10 μl של תערובת התגובה ל90 μl של חיץ מדגם. דגימות נבדקות באמצעות immunoblotting באמצעות אנטי Chk1 P-S344 או נוגדנים כנגד Chk1.
5. נציג תוצאות
הכרומטין הזרע הפגום או מבנה ה-DNA ניזק מחקים יכול לגרום הניזק לדנ"א מחסום ATR/Chk1-mediated במערכת תמצית ביצת Xenopus. מופעי 2A דמות שMMS גורם Chk1 זירחון בSer344 (Chk1 P-S344), המהווה אינדיקטור הפעלת קינאז ATR. 2B האיור מראה כי AT70, כמו ה-DNA ניזק מחקי struצלום, גם מפעיל Chk1 זרחון. דגימות Chk1 סך הכל משמשות כטעינת פקדים בשתי הדוגמות.
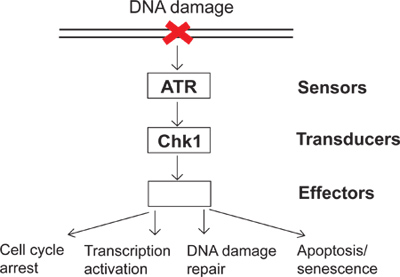
איור 1. תרשים של איתות מחסום הניזק לדנ"א.
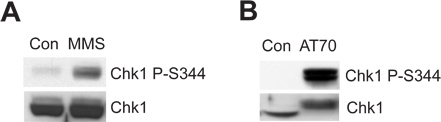
איור 2. Chk1 זירחון מושרה על ידי אחד MMS או AT70 טיפולים בתמציות Xenopus ביצים. () הזרע הכרומטין MMS שהניזוק (MMS) או הכרומטין הזרע הנורמלי (קון) מודגרת בתמציות ביצים עבור 90 דקות. Chk1 זירחון בSer344 (Chk1 P-S344) וChk1 המוחלט בתמציות ביצה נבחנים דרך immunoblotting. (ב) AT70 או מים (קון) מתווסף לתמציות ביצה, בהתאמה. דוגמאות גם מנותחות באמצעות immunoblotting כמו ב().
Access restricted. Please log in or start a trial to view this content.
Discussion
ישנם מספר יתרונות בלימוד מחסום הניזק לדנ"א באמצעות תמציות Xenopus ביצים. השימוש בתמציות ביצה מספק כמות גדולה של תמציות תא חינם מסונכרנות בשלבי ביניים של מחזור התא. ניתן תמציות הביצים בקלות ובזול. זה יחסית קל לפגוע DNA או הכרומטין ולחשוף פגם במחסום הניזק לדנ"א לא?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
עבודה זו נתמכת בחלקו על ידי כספים הניתנים על ידי אוניברסיטת צפון קרוליינה בשארלוט, קרן יסוד Wachovia למצוינות סגל, ומענק מNIGMS (R15GM101571).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| ריאגנטים | |||
| Anti-P-S344 Chk1 נוגדן | איתות תא | 2348L | |
| נוגדן אנטי Chk1 | סנט קרוז | SC7898 | |
| Aprotinin | Biomedicals MP | 0219115880 | |
| Cycloheximide | סיגמא | C7698-5G | |
| Cytochalasin B | EMD | 250233 | |
| Dithiothreitol (DTT) | VWR | JTF780-2 | |
| hCG | סיגמא | CG10-10VL | |
| L-ציסטאין | סיגמא | C7352-1 ק"ג | |
| Leupeptin | VWR | 97063-922 | |
| מתיל methanesulfonate (MMS) | סיגמא | 129925-5G | |
| Nocodazole | סיגמא | M1404-2MG | |
| PMSG | Calbiochem | 367222 | |
| חיץ מדגם | סיגמא | S3401 | |
| Tautomycin | Wako כימיקלי ארה"ב | 209-12041 | |
| ציוד | |||
| דלי להטלת ביצים | מוצרי Rubbermaid המסחריים | 6308 | |
| צנטריפוגה CL2 IEC עם הרוטור דלי מתנדנד | Thermo Scientific | 004260F | |
| הרוטור דלי HB6 נדנוד | Thermo Scientific | 11860 | |
| Sorvall RC6 תוספת צנטריפוגה SuperSpeed | Thermo Scientific | 46910 | |
| crosslinker UV | UVP | 95-0174-01 | |
| פתרונות | |||
| 1x MMR | 100 המ"מימ NaCl, 2 המ"מ KCl, 0.5 mM 4 MgSO, 2.5 המ"מ CaCl 2, 5 HEPES מ"מ, להתאים pH ל -7.8 עם 10 M NaOH | ||
| Aprotinin / מניות Leupeptin | 10 מ"ג / מ"ל כל אחד במים. אחסן 20 aliquots μl ב -80 ° C. | ||
| X החיץ | סוכרוז 0.2 מ ', 80 המ"מ KCl, 15 המ"מ NaCl, 5 המ"מ MgCl 2, 1 mM EDTA, 10 HEPES מ"מ, להתאים pH ל -7.5 ידי HCl | ||
| מניית Cycloheximide | 10 מ"ג / מ"ל במים. החנות 1 aliquots המ"ל ב -20 ° C. | ||
| Cytochalasin B המניות | 5 מ"ג / מ"ל בDMSO. אחסן 20 aliquots μl ב -20 ° C. | ||
| מניית Dithiothreitol (DTT) | M 1 במים. החנות 1 aliquots המ"ל ב -20 ° C. | ||
| ELB | 0.25 סוכרוז M, 1 mM DTT, 50 מיקרוגרם / המ"ל cycloheximide, 2.5 המ"מ MgCl 2, 50 mM KCl, 10 HEPES מ"מ, pH7.7 | ||
| Nocodazole המניות | 10 מ"ג / מ"ל בDMSO. אחסן 5 aliquots μl ב -80 ° C. | ||
| תערובת אנרגיה | פוספט 375 מ"מ קריאטין, 50 mM ATP, ו25 מ"מ MgCl 2. Aliquots נשמרים ב-80 ° C. | ||
| פתרון לצבוע גרעיני | 0.4 מיקרוגרם / המ"ל Hoechst 33258, גליצרול 25%(V / v), ב1x PBS | ||
| מניית Tautomycin | 100 מיקרומטר בDMSO. אחסן 10 aliquots μl ב -80 ° C. |
References
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cimprich, K. A., Cortez, D. ATR: an essential regulator of genome integrity. Nat. Rev. Mol. Cell Biol. 9 (8), 616-627 (2008).
- Lupardus, P. J., Van, C., Cimprich, K. A. Analyzing the ATR-mediated checkpoint using Xenopus egg extracts. Methods. 41 (2), 222-231 (2007).
- Lupardus, P. J., Byun, T., Yee, M. C., Hekmat-Nejad, M., Cimprich, K. A. A requirement for replication in activation of the ATR-dependent DNA damage checkpoint. Genes Dev. 16 (18), 2327-2332 (2002).
- Stokes, M. P., Van Hatten, R., Lindsay, H. D., Michael, W. M. DNA replication is required for the checkpoint response to damaged DNA in Xenopus egg extracts. J. Cell Biol. 158 (5), 863-872 (2002).
- Kato, K., Strauss, B. Accumulation of an intermediate in DNA synthesis by HEp.2 cells treated with methyl methanesulfonate. Proc. Natl. Acad. Sci. U.S.A. 71 (5), 1969-1973 (1974).
- Paulovich, A. G., Hartwell, L. H. A checkpoint regulates the rate of progression through S phase in S. cerevisiae in response to DNA damage. Cell. 82 (5), 841-847 (1995).
- Guo, Z., Kumagai, A., Wang, S. X., Dunphy, W. G. Requirement for Atr in phosphorylation of Chk1 and cell cycle regulation in response to DNA replication blocks and UV-damaged DNA in Xenopus egg extracts. Genes Dev. 14 (21), 2745-2756 (2000).
- Jazayeri, A., Balestrini, A., Garner, E., Haber, J. E., Costanzo, V. Mre11-Rad50-Nbs1-dependent processing of DNA breaks generates oligonucleotides that stimulate ATM activity. EMBO. J. 27 (14), 1953-1962 (2008).
- Kumagai, A., Dunphy, W. G. Claspin, a novel protein required for the activation of Chk1 during a DNA replication checkpoint response in Xenopus egg extracts. Mol. Cell. 6 (4), 839-849 (2000).
- Yan, S., Lindsay, H. D., Michael, W. M. Direct requirement for Xmus101 in ATR-mediated phosphorylation of Claspin bound Chk1 during checkpoint signaling. J. Cell Biol. 173 (2), 181-186 (2006).
- Shiotani, B., Zou, L. Single-stranded DNA orchestrates an ATM-to-ATR switch at DNA breaks. Mol. Cell. 33 (5), 547-558 (2009).
- Tutter, A. V., Walter, J. C. Chromosomal DNA replication in a soluble cell-free system derived from Xenopus eggs. Methods Mol. Biol. 322, 121-137 (2006).
- Cross, M. K., Powers, M. Preparation and Fractionation of Xenopus laevis Egg Extracts. J. Vis. Exp. (18), e891(2008).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved