A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل خلايا الكبد البشرية من قبل خطوتين كولاجيناز الإرواء الداخلي
In This Article
Erratum Notice
Summary
يوصف A-خطوتين الإجراء كولاجيناز نضح تعديل لعزل خلايا الكبد البشرية. ويمكن أيضا أن هذه الطريقة يمكن تطبيقها على كبد الثدييات الأخرى. هي خلايا الكبد معزولة المتاحة في ارتفاع العائد والجدوى، مما يجعلها نموذجا مناسبة للبحث العلمي في مجالات مثل تجديد الكبد، الدوائية والسمية.
Abstract
الكبد، والجهاز مع قدرة استثنائية التجديد، ويحمل مجموعة واسعة من الوظائف، مثل إزالة السموم، والتمثيل الغذائي والتوازن. على هذا النحو، هي خلايا الكبد نموذجا هاما لمجموعة كبيرة ومتنوعة من الأسئلة البحثية. على وجه الخصوص، واستخدام خلايا الكبد البشرية أهمية خاصة في مجالات الدوائية، وعلم السموم، وتجديد الكبد والبحوث متعدية. وبالتالي، فإن هذا الأسلوب نسخة معدلة من على بعد خطوتين الإجراء كولاجيناز نضح لعزل خلايا الكبد كما وصفها Seglen 1.
سابقا، وقد تم عزل خلايا الكبد عن طريق الطرق الميكانيكية. ومع ذلك، فقد ثبت أساليب الأنزيمية لتكون متفوقة كما تحتفظ خلايا الكبد سلامتها الهيكلية وظيفة بعد العزلة. هذه الطريقة المعروضة هنا تتكيف مع أسلوب تصميم من قبل لكبد الفئران إلى الإنسان قطعة الكبد ويؤدي إلى تحقيق عائد كبير من خلايا الكبد مع بقاء 77 ± 10٪. الرئيسيةالفرق في هذا الإجراء هو عملية إقناء؛ إدخال القنية في الأوعية الدموية. علاوة على ذلك، الطريقة الموصوفة هنا يمكن أيضا أن تطبق على كبد من الأنواع الأخرى مع الكبد أو الأوعية الدموية أحجام قابلة للمقارنة.
Introduction
خلية التعليق الكبد يمكن إعدادها من الكبد عن طريق الطرق الميكانيكية أو الأنزيمية. وتشمل الطرق الميكانيكية المستخدمة في إعداد خلايا الكبد كله يجبر الكبد من خلال القماش القطني 2، والهز قطعة الكبد مع الخرز الزجاجي في شاكر خان 3، وذلك باستخدام المجانسة الزجاج مع المطاحن فضفاضة 4،5 الخ على مر السنين، انخفضت الطرق الميكانيكية من صالح بسبب الأضرار التي لحقت أغشية الخلايا وفقدان وظيفة خلايا الكبد من 6،7 معزولة. وبالتالي فإن استخدام طريقة الأنزيمية هو حاليا الوسيلة الرئيسية لعزل خلايا الكبد.
عزل خلايا الكبد باستخدام أسلوب الأنزيمية وقد تحسنت كثيرا عندما بيري وصديق 8 perfused كولاجيناز وهيالورونيداز من خلال الكبد عبر الوريد البابي في الفئران. تستخدم هذه العملية نضح الأوعية الدموية للسماح للالانزيمات لتتلامس الوثيق مع الغالبية العظمى من الخلايا، مما يؤدي إلىزيادة 6 أضعاف في العائد من خلايا الكبد 8. علاوة على ذلك، حققت هذه الطريقة الخلايا التي احتفظت سلامتها الهيكلية، مع عمليا أي التحول من الشبكة الإندوبلازمية في حويصلات معزولة وعدم وجود ضرر الميتوكوندريا 8.
تم تعديل هذه الطريقة من قبل Seglen 1، الذي كان رائدا إجراء نضح من خطوتين لعزل خلايا الكبد. في هذا الإجراء، يتم perfused في كبد الفئران مع كا 2 + عازلة خالية يليه نضح مع العازلة كولاجيناز التي تحتوي على الكالسيوم 2 + 1. إزالة كا 2 + في الخطوة الأولى يساعد على تعطيل desmosomes، في حين أن المطلوب إضافة كا 2 + في الخطوة الثانية للنشاط كولاجيناز الأمثل 1،9.
بالنظر إلى أن الأعمال المنشورة المذكورة أعلاه قد تم تنفيذ في الفئران، وتهدف هذه المقالة لشرح إجراء تعديل والتي يمكن استخدامها لعزل خلايا الكبد مع سلامة عالية من همهمةوالأكباد. استخدام خلايا الكبد البشرية يظل من المهم للبحوث ومتعدية للتحقق من صحة التجارب باستخدام نماذج حيوانية. تم الحصول على قطعة كبد الإنسان المستخدمة في هذه الدراسة مع الموافقة على الحكم من خلال مؤسسة أبحاث الأنسجة البشرية والمحمولة، والتي تسيطر عليها الدولة غير ربحية الأساس 10. بعد إزالة الطبيب الشرعي ما هو مطلوب للتشخيص، تم جمع قطع الكبد من الأنسجة المتبقية. كان الأنسجة مقطوع من قبل الطبيب الشرعي شكليا الأنسجة السليمة التي تم الحصول عليها من هوامش استئصال بعد استئصال الكبد.
Protocol
1. إعداد الإرواء وعزل حلول
- إعداد الحلول اللازمة لنضح من قطعة الكبد وعزل خلايا الكبد وفقا للجدول 1. ويمكن تخزين الحلول في 4 درجات مئوية حتى الاستخدام.
- تصفية العقيمة جميع الحلول باستخدام فلتر 0.22 ميكرون.
- ينبغي لجميع الحلول التي تتلامس مع الكبد تكون معقمة.
2. إعداد معدات الإرواء وحلول
- يجب تعيين المعدات اللازمة لنضح من الكبد حتى قطعة كما هو مبين في الشكل 1.
- يجب تعيين حمام الماء في درجة حرارة مناسبة، والتي تختلف في كل وجه الخصوص التجريبية مجموعة المتابعة، ان هذه الحلول هي في درجة حرارة 37 درجة مئوية عندما تصل قطعة الكبد. في هذه الحالة، يتم تعيين حمام الماء عند 41 درجة مئوية لتدفئة حلول 1 و 2 و 3 و المكثف الزجاج تغلف. يجب أن تكون درجة حرارة تصل إلى 4 الحل37 درجة مئوية في حمام مائي منفصلة للاستخدام للحد من فقدان النشاط كولاجيناز.
- قبل فترة وجيزة من نضح الكبد، بدوره على منظم من خزان الغاز التي تحتوي على 95٪ O 2/5٪ CO 2 إلى الغاز جهاز الأوكسجين (الشكل 1E).
3. نضح من الكبد
- قطعة الكبد مع قدر سليمة محفظة غليسون وقت ممكن وبشكل مثالي مع قطع فقط 1 السطح ينبغي الحصول عليها من الطبيب الشرعي للالارواء.
- وضع هذه القطعة الكبد على قمع بوخنر الذي يحتوي على قرص مرشح مثقب (الشكل 1B).
- يجب أن تستعد نظام نضح مع الحل 1.
- مع معدل تدفق منخفض، يجب أن يتم إدراج منحني حقنة عادية الري مع نصائح الزيتون في الأوعية الدموية الكبيرة على سطح قطع من قطعة الكبد. كما تمسح الدم يخرج من الكبد، ويصبح أخف الأنسجة في المناطق ذات التروية الجيدة. عدد القنيات المستخدمة في مختلف الأحجاممن كبد هو مبين في الشكل 2A. حجم مقياس اختيار ينبغي أن يؤدي إلى نوبة دافئ من شأنها أن عقد حقنة عادية في المكان. ينبغي أن يترك الأوعية الدموية الصغيرة مفتوحة لنضح عازلة لاستنزاف من قطعة الكبد.
- زيادة معدل التدفق على مضخة تحوي ما بين 110-460 مل / دقيقة اعتمادا على حجم الكبد (الشكل 2B). هذه النتائج في معدل تدفق 44 ± 16 مل / دقيقة لكل قنية (الشكل 2C). سرعة اختيار يعتمد على قطعة الكبد وينبغي أن يؤدي إلى النفش حتى طفيف من قطعة الكبد. في بعض الحالات، قد يكون من الضروري اتخاذ اجراءات اغلاق بعض السفن مفتوحة مع المشابك الأوعية الدموية الصغيرة لتحقيق النفش طفيف المذكورة أعلاه. ونضح جيدة يمكن ملاحظتها عندما قطعة الكبد هو لون أخف وزنا طوال الوقت.
- الحفاظ على قطعة رطبة خلال الكبد نضح من خلال تغطية بقطعة من الشاش غارقة في المياه المالحة.
- يروي مع 1 لتر من محلول 1 إلى طرد أي صemaining الدم في قطعة الكبد.
- تغيير السائل نضح إلى الحل 2 ويروي لمدة 10 دقيقة.
- تبديل السائل نضح إلى الحل 3 ويروي مع 0.5 L.
- تغيير السائل نضح إلى الحل 4، والذي يحتوي على 0.1-0.15٪ من كولاجيناز (الجدول 2).
- لهذه الخطوة، ينبغي أن يتم نضح بطريقة إعادة تدوير ل9-12 دقيقة أو حتى يتم هضمها الكبد بما فيه الكفاية، ويجب أن تظهر أنسجة الكبد لتحطيم قليلا تحت الكبسولة في غليسون ويشعر خففت عند بحثها مع الجانب صريحا ل مشرط.
4. عزل خلايا الكبد
- إيقاف المضخة تحوي وإزالة حقنة عادية من قطعة الكبد.
- وضع قطعة الكبد في طبق بلورة تحتوي على 100-200 مل من محلول 5.
- إزالة كبسولة من غليسون بعناية وبلطف نفض الخلايا. إذا كانت هناك مناطق لا و perfused جيدا، مشرط يمكن استخدامها لقطع طريقهذه المناطق للافراج عن الخلايا الموجودة داخل. إضافة المزيد من الحلول 5 حسب الحاجة أثناء العملية.
- إضافة المزيد من الحلول 5 حتى يتم التوصل إلى الحجم النهائي من 500 مل.
- تصفية تعليق الخلية مرتين، أولا من خلال شبكة 210 ميكرون النايلون تليها 70 ميكرومتر شبكة النايلون. المقبل، صب تعليق خلية في 200 مل أنابيب الطرد المركزي.
- الطرد المركزي تعليق خلية في 72 جرام لمدة 5 دقائق في 4 درجات مئوية. طاف نضح وبيليه خلية في resuspend بلطف بلطف في 200 مل من محلول 5.
- تكرار غسل الخطوة رقم 4.6 ثلاث مرات. على الخطوة النهائية أجهزة الطرد المركزي، وخلايا resuspend في حلول التخزين البارد (انظر قائمة المواد). يجب أن تكون الخلايا تقريبا 2-5000000 خلايا الكبد في الملليمتر الواحد لتقييم العائد والجدوى باستخدام التريبان الأزرق الاستبعاد مقايسة القائم على عدادة الكريات.
- لإجراء التريبان الأزرق الاستبعاد مقايسة، إضافة 0.1 مل من الخلايا تضعف بشكل مناسب (2-5000000 ≈ / مل) إلى أنبوب microfuge تحتوي على 0.5 مل من soluti الأزرق التريبانعلى (0.4٪ التريبان الأزرق الذائبة في الفوسفات مخزنة المالحة (PBS)) و 0.4 مل من برنامج تلفزيوني. بعد خلط تعليق خلية بدقة، تحميل عدادة الكريات مع تعليق ودراسة تحت المجهر في التكبير 100X. تحت المجهر، وسوف تكون ملطخة الخلايا الميتة الأزرق في حين تظهر الخلايا الحية غير ملوثين. حساب عدد الخلايا الحية وإجمالي في كل من 1 مم 2 شبكات ملحوظ على عدادة الكريات. الجدوى (٪)، العائد من الخلايا الحية (خلايا الكبد مليون لكل مل حل التخزين البارد (CSS) أو خلايا الكبد مليون في الكبد ز) يمكن حسابها باستخدام الصيغ أدناه.
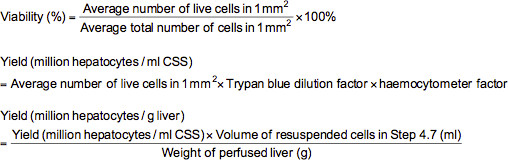
ملاحظة: في هذه الحالة، فإن عامل التخفيف التريبان الأزرق هو 10 وعامل عدادة الكريات هو 10،000.
النتائج
الإعداد التروية
يجب تعيين المعدات اللازمة لنضح الكبد حتى وفقا لالشكل 1.
الجدوى والعائد من خلايا الكبد البشرية المعزولة
كان متوسط بقاء خلايا الك...
Discussion
النتائج هذا البروتوكول في عزلة خلايا الكبد البشرية مع قابلية عالية ونقاء. من أجل تحقيق هذه النتائج، فمن المهم أن تبدأ مع قطعة مناسبة من الكبد. قطعة من الكبد وينبغي أن يكون الكبسولة سليمة غليسون على جميع الأسطح باستثناء 1 قطع السطح. عامل مهم آخر هو دفعة معينة من كولاجين...
Disclosures
وقد تم تمويل الاستفادة المثلى من هذا البروتوكول جزئيا عن طريق منحة من Hepacult GmbH المزيد. الدكتور وولفغانغ Thasler هو واحد من مؤسسي Hepacult GmbH المزيد ويظل واحدا من أعضاء المجلس في هذه الشركة. توظيف Maresa Demmel هو جزئيا Hepacult. يعمل بواسطة ماريا Hauner Hepacult GmbH المزيد. Hepacult هو العرضية شركة التكنولوجيا الحيوية من جامعة، والتي تقدم خلايا الكبد البشرية بموافقة والوصول المفتوح لأغراض البحث.
Acknowledgements
وقدم هذا العمل ممكن من الأنسجة والخلايا مؤسسة البحوث الإنسان، مما يجعل الأنسجة البشرية المتاحة للبحوث. وكان في استقبال الدعم المالي لهذا العمل من الوزارة الاتحادية للتعليم والبحوث (اسم المنحة: شبكة الكبد الظاهري، عدد المنح: 0315759) وHepacult GmbH المزيد. نتوجه بالشكر أيضا إلى المساعدين التقنيين من البنك الأنسجة مستشفى Großhadern لللجمع عينات الكبد والمساعدين التقنيين من مرفق الأساسية عزل خلية لتنفيذ نضح الكبد والكبدية العزلة. على وجه الخصوص، نود أن نشكر Natalja فندق Löwen لإثبات هذا الإجراء في شريط الفيديو. أخيرا، نود أن نشكر Natalja فندق Löwen وEdeltraud Hanesch لخلق الرسوم التوضيحية لالشكل 1 والأرقام في نظرة عامة التخطيطي للفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| Bubble trap | Gaßner Glastechnik | ||
| Glass jacketed condenser | Gaßner Glastechnik | ||
| 41 °C Water bath | Julabo | 35723-H24/EG | |
| 37 °C Water bath | GFL | 1083 | |
| Compressed gas cylinder (95 % O2/5 % CO2) | Linde | ||
| Gas permeable tubing | Neolab | 2-4440 | |
| Peristaltic pump | Ismatec | IP65 | |
| Scalpel | Feather | 320010 | |
| Forceps | Omnilab | 5171014 | |
| Conical flasks 1 L | Schott Duran | 2121654 | |
| Conical flasks 5 L | Schott Duran | 2121673 | |
| Beakers | Schott Duran | 2110654 | |
| 200 ml centrifuge tubes | Becton Dickinson | 352075 | |
| Crystallizing dish | Omnilab | 5144063 | |
| Curved irrigation cannulae with ball tips | Ernst Kratz GmbH | 1464LL/ 1465LL A+B/ 1472LL | |
| Micro vascular clamps | Ernst Kratz GmbH | ||
| Büchner funnel | Carl Roth | HT38.1 | |
| Nylon mesh 210 μm | Neolab | 4-1413 | |
| Nylon mesh 70 μm | Neolab | 4-1419 | |
| 0.22 μm sterile filters | Peske | 99505 | |
| 500 ml bottles | Schott Duran | 2180144 | |
| 1 L bottles | Schott Duran | 2180154 | |
| Hemocytometer | Peske | 06-0001 | |
| 1.5 ml tubes | Eppendorf | 0030 120,086 | |
| 50 ml conical tubes | BD Biosciences | 352070 | |
| Ice bucket | Neolab | 1508454 | |
| Sterile Pasteur pipettes | Brand | 747715 | |
| Motorised pipette filler (Pipette boy acu) | Integra | 155017 | |
| Refridgerated centrifuge | Eppendorf | 5810R | |
| Laminar flow | Kendro | Hera safe-KS9 | |
| Aspirator (Low-flow surgical suction pump) | Atmos | C361 | |
| Laboratory Gas Burner | Integra | Fire Boy eco | |
| Disposable laboratory coat | Paperlynen GmbH | MD0202414 | |
| Surgical mask with visor | Kimberly-Clark | 48247 | |
| Surgical hood | Barrier | 42072 | |
| Latex gloves | Semper Care | CE0321 | |
| Collagenase (Batch number NB 4G) | Serva | 17465 | |
| Calcium chloride dihydrate | Merck | 2382 | |
| EGTA | Sigma | E4378 | |
| Sodium chloride | Roth | 9265.2 | |
| Hepes | Roth | 9105.3 | |
| Potassium chloride | Serva | 26868 | |
| Albumin | Biomol | 01400-2 | |
| Glucose | Serva | 22700 | |
| Sodium hydrogen carbonate | Serva | 30180 | |
| 0.4% Trypan blue solution | Lonza | 17-942E | |
| Cold storage solution | Hepacult GmbH |
References
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Schneider, W. C., Potter, V. R. The assay of animal tissues for respiratory enzymes II. Succinic dehydrogenase and cytochrome oxidase. J. Biol. Chem. 149, 217-227 (1943).
- Aubin, P. M. G., Bucher, N. L. R. A Study of Binucleate Cell Counts in Resting and Regenerating Rat Liver Employing a Mechanical Method for the Separation of Liver Cells. Anat. Rec. 112, 797-809 (1952).
- Anderson, N. G. The Mass Isolation of Whole Cells from Rat Liver. Science. 117, 627-628 (1953).
- Jacob, S. T., Bhargava, P. M. New Method for Preparation of Liver Cell Suspensions. Experimental Cell Research. 27 (62), 453-467 (1962).
- Berry, M. N. Metabolic Properties of Cells Isolated from Adult Mouse Liver. Journal of Cell Biology. 15, 1-8 (1962).
- Laws, J. O., Stickland, L. H. Metabolism of Isolated Liver Cells. Nature. 178, 309-310 (1038).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. The Journal of Cell Biology. 43, 506-520 (1969).
- Seglen, P. O. Preparation of Rat-Liver Cells .3. Enzymatic Requirements for Tissue Dispersion. Experimental Cell Research. 82 (73), 391-398 (1973).
- Thasler, W. E., et al. Charitable State-Controlled Foundation Human Tissue and Cell Research: Ethic and Legal Aspects in the Supply of Surgically Removed Human Tissue For Research in the Academic and Commercial Sector in Germany. Cell and Tissue Banking. 4, 49-56 (2003).
- Queral, A. E., DeAngelo, A. B., Garrett, C. T. Effect of different collagenases on the isolation of viable hepatocytes from rat liver. Analytical Biochemistry. 138, 235-237 (1984).
- Smedsrod, B., Pertoft, H. Preparation of Pure Hepatocytes and Reticuloendothelial Cells in High-Yield from a Single-Rat Liver by Means of Percoll Centrifugation and Selective Adherence. J. Leukocyte Biol. 38, 213-230 (1985).
- Cantrell, E., Bresnick, E. Benzpyrene Hydroxylase-Activity in Isolated Parenchymal and Nonparenchymal Cells of Rat-Liver. Journal of Cell Biology. 52, 316-321 (1972).
- Weiskirchen, R., Gressner, A. M. Isolation and culture of hepatic stellate cells. Methods in Molecular Medicine. 117, 99-113 (2005).
- Baccarani, U., et al. Steatotic versus cirrhotic livers as a source for human hepatocyte isolation. Transplant P. 33, 664-665 (2001).
- Renz, J. F., et al. Utilization of extended donor criteria liver allografts maximizes donor use and patient access to liver transplantation. Annals of Surgery. 242, 556-563 (2005).
- Schemmer, P., et al. Extended donor criteria have no negative impact on early outcome after liver transplantation: a single-center multivariate analysis. Transplant Proc. 39, 529-534 (2007).
- Alexandre, E., et al. Influence of pre-, intra- and post-operative parameters of donor liver on the outcome of isolated human hepatocytes. Cell and Tissue Banking. 3, 223-233 (2002).
- Spotnitz, W. D., Burks, S. State-of-the-art review: Hemostats, sealants, and adhesives II: Update as well as how and when to use the components of the surgical toolbox. Clinical and applied thrombosis/hemostasis : official journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis. 16, 497-514 (2010).
- Spotnitz, W. D., Burks, S. Hemostats, sealants, and adhesives III: a new update as well as cost and regulatory considerations for components of the surgical toolbox. Transfusion. 52, 2243-2255 (2012).
- Toriumi, D. M., Raslan, W. F., Friedman, M., Tardy, M. E. Histotoxicity of cyanoacrylate tissue adhesives. A comparative study. Archives of otolaryngology--head & neck surgery. 116, 546-550 (1990).
- Vinters, H. V., Galil, K. A., Lundie, M. J., Kaufmann, J. C. The histotoxicity of cyanoacrylates. A selective review. Neuroradiology. 27, 279-291 (1985).
- Bhogal, R. H., et al. Isolation of primary human hepatocytes from normal and diseased liver tissue: a one hundred liver experience. PloS ONE. 6, e18222 (2011).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regul. Toxicol. Pharm. 32, 56-67 (2000).
- Koebe, H. G., Pahernik, S. A., Sproede, M., Thasler, W. E., Schildberg, F. W. Porcine hepatocytes from slaughterhouse organs. An unlimited resource for bioartificial liver devices. ASAIO Journal. 41, 189-193 (1995).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
Erratum
Formal Correction: Erratum: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
Posted by JoVE Editors on 7/01/2016. Citeable Link.
A correction was made to: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
The changes listed below have been made to Table 1.
1). In the recipe for Solution 2, the Final Concentration of EGTA has been changed from:
| EGTA | 0.1mM |
to:
| EGTA | 1mM |
2). In the recipes for Solution 3 and 4, the Final Concentration of Calcium chloride dihydrate has been changed from:
| Calcium chloride dihydrate | 0.5µM |
to:
| Calcium chloride dihydrate | 5mM |
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved