Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение гепатоцитов человека два-ступенчатой коллагеназы процедуры перфузионный
В этой статье
Erratum Notice
Резюме
Модифицированная двухэтапной процедуры коллагеназы перфузии для изоляции гепатоцитов человека описывается. Этот метод может быть также применен к другим печени млекопитающих. Выделенные гепатоциты доступны с высоким выходом и жизнеспособности, что делает их удобной моделью для научных исследований в таких областях, как регенерации печени, фармакокинетики и токсикологии.
Аннотация
Печень, орган с исключительной мощностью регенерации, выполняет широкий спектр функций, таких как детоксикации, метаболизма и гомеостаза. Таким образом, гепатоциты являются важной моделью для большого разнообразия исследовательских вопросов. В частности, использование человеческих гепатоцитов особенно важно в области фармакокинетики, токсикологии, регенерации печени и трансляционных исследований. Таким образом, этот способ представляет собой модифицированную версию процедуры коллагеназы перфузии двухступенчатой чтобы изолировать гепатоциты, как описано Seglen 1.
Ранее, гепатоциты были выделены с помощью механических методов. Тем не менее, ферментативные способы, как было показано, чтобы быть выше как гепатоциты сохраняют свою структурную целостность и функцию после выделения. Этот метод представлен здесь адаптирует метод, предназначенный ранее для печени крыс к человеческим кусочки печени и приводит к большим выходом гепатоцитов с жизнеспособностью 77 ± 10%. ОсновнойРазница в этой процедуре является процесс cannulization кровеносных сосудов. Кроме того, способ, описанный здесь, также могут быть применены к печени от других видов с печени или кровеносных сосудов, сравнимых размеров.
Введение
Суспензию клеток печени могут быть получены из печени с помощью механических или ферментативными методами. Механические методы, используемые для получения целые клетки печени включают заставляя печень через марлю 2, качая кусок печени со стеклянными шариками в шейкере Кан 3, используя стеклянные гомогенизаторы со свободными пестики 4,5 и т.д. На протяжении многих лет, механические методы выпали из пользу в связи с повреждением клеточных мембран и потери функции изолированных гепатоцитов 6,7. Следовательно, использование ферментативного метода в настоящее время является основным методом изоляции гепатоцитов.
Выделение гепатоцитов с использованием способа ферментативной была значительно улучшена, когда Берри и друзья 8 перфузии коллагеназы и гиалуронидазы через печень через портальную вену у крыс. Этот процесс перфузии использовали сосудистую чтобы позволить ферменты входить в тесный контакт с большинством клеток, что приводит кувеличение в 6 раз с выходом гепатоцитов 8. Кроме того, этот метод дает клетки, которые сохранили свои структурную целостность, практически без трансформации эндоплазматической сети в изолированных пузырьков и без повреждений митохондриальной 8.
Этот метод был модифицирован Seglen 1, который впервые процедуру двухэтапного перфузии для выделения клеток печени. В этой процедуре печени крысы перфузии с Ca 2 + свободного буфера с последующим перфузии буфер коллагеназы, содержащего Са 2 + 1. Удаление Ca 2 + на первой стадии помогает разрушить десмосомы, в то время как добавление Ca 2 + на втором этапе требуется для оптимальной активности коллагеназы 1,9.
Учитывая, что опубликованная работа описано выше была выполнена на крысах, эта статья призвана продемонстрировать, модифицированной методики, которую можно использовать для выделения гепатоцитов с высокой жизнеспособностью от гулаА.Н. печень. Использование гепатоцитов человека остается важным для трансляционных исследований и для проверки эксперименты с использованием животных моделей. Человеческие частей печени используемые в этом исследовании были приобретены с согласия для управления через ткани человека и Cell Research Foundation в, контролируемой государством некоммерческого фонда 10. После патологоанатом удалены, что требовалось для диагностики, куски печени были собраны из оставшейся ткани. Ткань секционного патологоанатом был морфологически здоровые ткани получают из резекции после резекции печени.
протокол
1. Подготовка перфузии и изоляция Решения
- Подготовка растворов, необходимых для перфузии части печени и выделения гепатоцитов соответствии с таблицей 1. Растворы можно хранить при 4 ° С до использования.
- Стерильный фильтр все решения с использованием 0,22 мкм.
- Все растворы, которые вступают в контакт с печени должны быть стерильными.
2. Подготовка перфузии оборудования и решений
- Оборудование для перфузии части печени должны быть созданы, как показано на рисунке 1.
- Водяная баня должна быть установлена при соответствующей температуре, которая отличается в каждом конкретном экспериментальной установки, например, что решения при температуре 37 ° С, когда они достигают кусок печени. В этом случае водяной бани устанавливается на 41 ° С, чтобы нагреть растворов 1, 2 и 3 и рубашкой стекло конденсатора. Решение 4 должны быть прогреты до37 ° C в отдельном водяной бане в течение использования, чтобы уменьшить потери активности коллагеназы.
- Незадолго до перфузии печени, включите регулятора газового резервуара, содержащего 95% O 2/5% CO 2 на газ оксигенации аппарат (рис. 1д).
3. Перфузия печени
- Кусок печени с такой же неповрежденной капсулы Глиссона насколько возможно, а в идеале с только 1 поверхности разреза должно быть получено от патологоанатома для перфузии.
- Поместите этот кусок печени на воронке Бюхнера, который содержит перфорированную фильтра диск (рис. 1В).
- Система перфузии следует загрунтовать Решение 1.
- С низкой скоростью потока, изогнутые орошения канюли с оливковыми советы должны быть вставлены в больших кровеносных сосудов на поверхности разреза куска печени. Как кровь вымывает из печени, ткань становится светлее в местах с хорошей перфузии. Используется для различных размеров количество канюлииз печени показано на рисунке 2А. Размер калибра выбрали должно привести к плотного прилегания, который будет содержать канюли на месте. Меньшие кровеносные сосуды следует оставить открытым для буфера перфузии для слива из куска печени.
- Увеличение скорости потока на перистальтического насоса к между 110-460 мл / мин в зависимости от размера печени (рис. 2В). Это приводит к средней скорости потока 44 ± 16 мл / мин на канюли (рис. 2в). Скорость выбирается в зависимости от куска печени и должно привести к небольшим уплотняет до куска печени. В некоторых случаях это может быть необходимо, чтобы зажать закрыть некоторые из открытых сосудах с микро сосудистых зажимов для достижения небольшое уплотняет упомянутую выше. Хороший перфузии можно наблюдать, когда часть печени является светлый цвет во всем.
- Держите кусок печени влажный во перфузии с помощью покрытия из кусочком марли, смоченной в солевом растворе.
- Заливать 1 л раствора 1, чтобы избавиться от любого гemaining кровь в куске печени.
- Изменение перфузионной жидкости к раствору 2 и заливать в течение 10 мин.
- Переключите перфузии жидкости для решения 3 и заливать 0,5 L.
- Изменение перфузионной жидкости к решению 4, который содержит 0,1-0,15% от коллагеназы (табл. 2).
- На этом этапе, перфузии следует проводить в рециркуляционной образом в течение 9-12 мин или до тех пор, печень не достаточно переваривается; ткани печени должен появиться распадаться слегка под капсулой Глиссона и чувствовать размягчается при зондировании тупой стороной скальпель.
4. Выделение гепатоцитов
- Выключите перистальтического насоса и снимите канюли из куска печени.
- Поместите часть печени в кристаллизатор, содержащей 100-200 мл раствора 5.
- Осторожно снимите капсулу в Глиссона и осторожно вытряхнуть клетки. Если есть регионы, которые недостаточно хорошо перфузии, скальпель может быть использован, чтобы прорезатьэти регионы, чтобы освободить клетки, содержащиеся в. Добавьте больше решение 5, как необходимо в процессе.
- Добавить еще решение 5 до конечного объема 500 мл пока не будет достигнута.
- Фильтр клеточной суспензии дважды: сначала через 210 мкм нейлоновую сетку с последующим нейлоновое сито 70 мкм. Затем залить клеточной суспензии в 200 мл центрифужные пробирки.
- Центрифуга клеточной суспензии в 72 г в течение 5 мин при 4 ° С. Аспирируйте супернатант и осторожно ресуспендируют осадок клеток осторожно в 200 мл раствора 5.
- Повторите стиральную номер шага 4,6 три раза. На последнем шаге центрифуги, ресуспендирования клеток в холодной решение для хранения данных (см. перечень материалов). Клетки должны быть примерно 2-5 млн. гепатоциты на миллилитр для оценки вылова и жизнеспособности с помощью гемоцитометра основе трипановым голубым.
- Для проведения теста с трипановым голубым, добавить 0,1 мл соответственно разбавленных клеток (млн. ≈ 2-5 / мл) в пробирке, содержащей 0,5 мл трипанового синего Solutiна (0,4% трипанового синего растворяли в фосфатно-солевом буфере (PBS)) и 0,4 мл PBS. После перемешивания клеточной суспензии тщательно, загрузить гемоцитометра с подвеской и исследовать под микроскопом при 100-кратном увеличении. Под микроскопом, мертвые клетки будут окрашен в голубой цвет в то время как живые клетки появляются неокрашенными. Подсчитайте количество живых и общего числа клеток в каждом из 1 мм 2 сеток, отмеченных на гемоцитометре. Жизнеспособность (%), выход живых клеток (млн. гепатоциты в мл раствора холодильной (CSS) или миллион гепатоциты в г печени) можно рассчитать, используя приведенные ниже формулы.
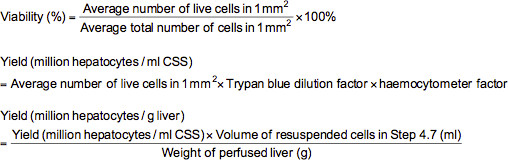
Примечание: В этом случае трипанового синего коэффициент разбавления 10 и фактор гемоцитометр составляет 10000.
Результаты
Перфузии установки
Оборудование, необходимое для перфузии печени должны быть созданы в соответствии с рисунком 1.
Жизнеспособность и Выход выделенного гепатоциты человека
Средняя жизнеспособность изолированных гепатоци?...
Обсуждение
Этот протокол приводит к выделению гепатоцитов человека с высокой жизнеспособности и чистоты. Для достижения этих результатов, важно, чтобы начать с соответствующим кусочком печени. Кусок печени должны иметь капсулу нетронутыми Глиссона в на всех поверхностях в течение 1 поверхности ...
Раскрытие информации
Оптимизация этого протокола было частично финансируется за счет гранта от Hepacult GmbH. Д-р Вольфганг Thasler является одним из основателей Hepacult GmbH и остается одним из членов совета в этой компании. Применение Maresa Demmel является частично Hepacult. Мария Hauner работает на Hepacult GmbH. Hepacult является спин-офф биотехнологический фирма из университета, который предлагает гепатоциты человека с согласия и открытый доступ для исследовательских целей.
Благодарности
Эта работа стала возможной благодаря человеческому тканей и клеток Research Foundation, который делает ткани человека для исследований. Финансовая поддержка для этой работы было получено от Федерального министерства образования и научных исследований (имя грант: Виртуальный печени сети, номер гранта: 0315759) и Hepacult GmbH. Мы также благодарим техническим помощников из ткани банка Гроссхадерн больницы для сбора образцов печени и технических помощников из клетки изоляции основной комплекс для проведения перфузии печени и изоляцию гепатоцитов. В частности, мы хотели бы поблагодарить Наталья Löwen для демонстрации эту процедуру на видео. Наконец, мы хотели бы поблагодарить Наталья Löwen и Edeltraud Hanesch для создания иллюстрации к рис.1 и цифры в схематический обзор видео.
Материалы
| Name | Company | Catalog Number | Comments |
| Bubble trap | Gaßner Glastechnik | ||
| Glass jacketed condenser | Gaßner Glastechnik | ||
| 41 °C Water bath | Julabo | 35723-H24/EG | |
| 37 °C Water bath | GFL | 1083 | |
| Compressed gas cylinder (95 % O2/5 % CO2) | Linde | ||
| Gas permeable tubing | Neolab | 2-4440 | |
| Peristaltic pump | Ismatec | IP65 | |
| Scalpel | Feather | 320010 | |
| Forceps | Omnilab | 5171014 | |
| Conical flasks 1 L | Schott Duran | 2121654 | |
| Conical flasks 5 L | Schott Duran | 2121673 | |
| Beakers | Schott Duran | 2110654 | |
| 200 ml centrifuge tubes | Becton Dickinson | 352075 | |
| Crystallizing dish | Omnilab | 5144063 | |
| Curved irrigation cannulae with ball tips | Ernst Kratz GmbH | 1464LL/ 1465LL A+B/ 1472LL | |
| Micro vascular clamps | Ernst Kratz GmbH | ||
| Büchner funnel | Carl Roth | HT38.1 | |
| Nylon mesh 210 μm | Neolab | 4-1413 | |
| Nylon mesh 70 μm | Neolab | 4-1419 | |
| 0.22 μm sterile filters | Peske | 99505 | |
| 500 ml bottles | Schott Duran | 2180144 | |
| 1 L bottles | Schott Duran | 2180154 | |
| Hemocytometer | Peske | 06-0001 | |
| 1.5 ml tubes | Eppendorf | 0030 120,086 | |
| 50 ml conical tubes | BD Biosciences | 352070 | |
| Ice bucket | Neolab | 1508454 | |
| Sterile Pasteur pipettes | Brand | 747715 | |
| Motorised pipette filler (Pipette boy acu) | Integra | 155017 | |
| Refridgerated centrifuge | Eppendorf | 5810R | |
| Laminar flow | Kendro | Hera safe-KS9 | |
| Aspirator (Low-flow surgical suction pump) | Atmos | C361 | |
| Laboratory Gas Burner | Integra | Fire Boy eco | |
| Disposable laboratory coat | Paperlynen GmbH | MD0202414 | |
| Surgical mask with visor | Kimberly-Clark | 48247 | |
| Surgical hood | Barrier | 42072 | |
| Latex gloves | Semper Care | CE0321 | |
| Collagenase (Batch number NB 4G) | Serva | 17465 | |
| Calcium chloride dihydrate | Merck | 2382 | |
| EGTA | Sigma | E4378 | |
| Sodium chloride | Roth | 9265.2 | |
| Hepes | Roth | 9105.3 | |
| Potassium chloride | Serva | 26868 | |
| Albumin | Biomol | 01400-2 | |
| Glucose | Serva | 22700 | |
| Sodium hydrogen carbonate | Serva | 30180 | |
| 0.4% Trypan blue solution | Lonza | 17-942E | |
| Cold storage solution | Hepacult GmbH |
Ссылки
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Schneider, W. C., Potter, V. R. The assay of animal tissues for respiratory enzymes II. Succinic dehydrogenase and cytochrome oxidase. J. Biol. Chem. 149, 217-227 (1943).
- Aubin, P. M. G., Bucher, N. L. R. A Study of Binucleate Cell Counts in Resting and Regenerating Rat Liver Employing a Mechanical Method for the Separation of Liver Cells. Anat. Rec. 112, 797-809 (1952).
- Anderson, N. G. The Mass Isolation of Whole Cells from Rat Liver. Science. 117, 627-628 (1953).
- Jacob, S. T., Bhargava, P. M. New Method for Preparation of Liver Cell Suspensions. Experimental Cell Research. 27 (62), 453-467 (1962).
- Berry, M. N. Metabolic Properties of Cells Isolated from Adult Mouse Liver. Journal of Cell Biology. 15, 1-8 (1962).
- Laws, J. O., Stickland, L. H. Metabolism of Isolated Liver Cells. Nature. 178, 309-310 (1038).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. The Journal of Cell Biology. 43, 506-520 (1969).
- Seglen, P. O. Preparation of Rat-Liver Cells .3. Enzymatic Requirements for Tissue Dispersion. Experimental Cell Research. 82 (73), 391-398 (1973).
- Thasler, W. E., et al. Charitable State-Controlled Foundation Human Tissue and Cell Research: Ethic and Legal Aspects in the Supply of Surgically Removed Human Tissue For Research in the Academic and Commercial Sector in Germany. Cell and Tissue Banking. 4, 49-56 (2003).
- Queral, A. E., DeAngelo, A. B., Garrett, C. T. Effect of different collagenases on the isolation of viable hepatocytes from rat liver. Analytical Biochemistry. 138, 235-237 (1984).
- Smedsrod, B., Pertoft, H. Preparation of Pure Hepatocytes and Reticuloendothelial Cells in High-Yield from a Single-Rat Liver by Means of Percoll Centrifugation and Selective Adherence. J. Leukocyte Biol. 38, 213-230 (1985).
- Cantrell, E., Bresnick, E. Benzpyrene Hydroxylase-Activity in Isolated Parenchymal and Nonparenchymal Cells of Rat-Liver. Journal of Cell Biology. 52, 316-321 (1972).
- Weiskirchen, R., Gressner, A. M. Isolation and culture of hepatic stellate cells. Methods in Molecular Medicine. 117, 99-113 (2005).
- Baccarani, U., et al. Steatotic versus cirrhotic livers as a source for human hepatocyte isolation. Transplant P. 33, 664-665 (2001).
- Renz, J. F., et al. Utilization of extended donor criteria liver allografts maximizes donor use and patient access to liver transplantation. Annals of Surgery. 242, 556-563 (2005).
- Schemmer, P., et al. Extended donor criteria have no negative impact on early outcome after liver transplantation: a single-center multivariate analysis. Transplant Proc. 39, 529-534 (2007).
- Alexandre, E., et al. Influence of pre-, intra- and post-operative parameters of donor liver on the outcome of isolated human hepatocytes. Cell and Tissue Banking. 3, 223-233 (2002).
- Spotnitz, W. D., Burks, S. State-of-the-art review: Hemostats, sealants, and adhesives II: Update as well as how and when to use the components of the surgical toolbox. Clinical and applied thrombosis/hemostasis : official journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis. 16, 497-514 (2010).
- Spotnitz, W. D., Burks, S. Hemostats, sealants, and adhesives III: a new update as well as cost and regulatory considerations for components of the surgical toolbox. Transfusion. 52, 2243-2255 (2012).
- Toriumi, D. M., Raslan, W. F., Friedman, M., Tardy, M. E. Histotoxicity of cyanoacrylate tissue adhesives. A comparative study. Archives of otolaryngology--head & neck surgery. 116, 546-550 (1990).
- Vinters, H. V., Galil, K. A., Lundie, M. J., Kaufmann, J. C. The histotoxicity of cyanoacrylates. A selective review. Neuroradiology. 27, 279-291 (1985).
- Bhogal, R. H., et al. Isolation of primary human hepatocytes from normal and diseased liver tissue: a one hundred liver experience. PloS ONE. 6, e18222 (2011).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regul. Toxicol. Pharm. 32, 56-67 (2000).
- Koebe, H. G., Pahernik, S. A., Sproede, M., Thasler, W. E., Schildberg, F. W. Porcine hepatocytes from slaughterhouse organs. An unlimited resource for bioartificial liver devices. ASAIO Journal. 41, 189-193 (1995).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
Erratum
Formal Correction: Erratum: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
Posted by JoVE Editors on 7/01/2016. Citeable Link.
A correction was made to: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
The changes listed below have been made to Table 1.
1). In the recipe for Solution 2, the Final Concentration of EGTA has been changed from:
| EGTA | 0.1mM |
to:
| EGTA | 1mM |
2). In the recipes for Solution 3 and 4, the Final Concentration of Calcium chloride dihydrate has been changed from:
| Calcium chloride dihydrate | 0.5µM |
to:
| Calcium chloride dihydrate | 5mM |
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены