Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement des hépatocytes humains par un deux-étape collagénase procédure de perfusion
Dans cet article
Erratum Notice
Résumé
Une procédure en deux étapes de la collagénase de perfusion modifié pour l'isolement d'hépatocytes humains est décrit. Cette méthode peut également être appliquée à d'autres foies de mammifères. Les hépatocytes isolés sont disponibles en haute rendement et la viabilité, les un modèle approprié pour la recherche scientifique dans des domaines tels que la régénération du foie, la pharmacocinétique et la toxicologie faire.
Résumé
Le foie, un organe d'une capacité de régénération exceptionnelle, effectue un large éventail de fonctions, telles que la désintoxication, le métabolisme et l'homéostasie. En tant que tel, les hépatocytes sont un modèle important pour une grande variété de questions de recherche. En particulier, l'utilisation d'hépatocytes humains est particulièrement important dans les domaines de la pharmacocinétique, la toxicologie, la régénération du foie et de la recherche de translation. Ainsi, ce procédé présente une version modifiée d'une procédure de perfusion de collagénase en deux étapes pour isoler les hépatocytes, comme décrit par une Seglen.
Auparavant, les hépatocytes ont été isolés par des méthodes mécaniques. Cependant, les méthodes enzymatiques ont été montré supérieur hépatocytes conservent leur intégrité et leur fonction structurale après isolement. Cette méthode présentée ici adapte le procédé précédemment conçu pour les foies de rats à des pièces et des résultats de foie humain dans un grand rendement des hépatocytes avec une viabilité de 77 ± 10%. Le principaldifférence de ce procédé est le processus de cannulization des vaisseaux sanguins. En outre, le procédé décrit ici peut également être appliquée à des foies provenant d'autres espèces avec foie ou des vaisseaux sanguins de tailles comparables.
Introduction
Une suspension de cellules de foie peut être préparé à partir du foie par des méthodes mécaniques ou enzymatiques. Les méthodes mécaniques utilisées pour préparer les cellules du foie entier comprennent forcer le foie à travers une étamine 2, secouant un morceau de foie avec des perles de verre dans un shaker Kahn 3, en utilisant des homogénéisateurs de verre avec des pilons en vrac 4,5 etc Au fil des ans, les méthodes mécaniques ont baissé de favoriser raison des dommages à la membrane cellulaire et la perte de la fonction des hépatocytes isolés 6,7. Par conséquent, l'utilisation d'un procédé enzymatique est actuellement la principale méthode pour l'isolement d'hépatocytes.
L'isolement des hépatocytes en utilisant une méthode enzymatique a été considérablement améliorée lorsque Berry et Friend 8 perfusées la collagénase et la hyaluronidase dans le foie via la veine porte chez des rats. Ce processus de perfusion utilisé le système vasculaire pour permettre aux enzymes de venir en contact étroit avec la majorité des cellules, conduisant àune augmentation de 6 fois le rendement des hépatocytes 8. En outre, cette méthode a donné des cellules qui ont conservé leur intégrité structurelle, avec pratiquement aucune transformation de réticulum endoplasmique dans des vésicules isolées et aucun dommage mitochondrial 8.
Cette méthode a été modifiée par une Seglen, pionnier une procédure de perfusion en deux étapes pour l'isolation des cellules du foie. Dans cette procédure, le foie de rat est perfusé avec un tampon 2 + Ca libre suivie d'une perfusion avec un tampon contenant de la collagénase de Ca 2 + 1. L'élimination de Ca 2 + dans la première étape permet de perturber les desmosomes, tandis que l'addition de Ca 2 + dans la deuxième étape est requise pour l'activité de la collagénase 1,9 optimum.
Étant donné que les travaux publiés décrite ci-dessus a été réalisée chez le rat, cet article vise à démontrer une procédure modifiée qui peut être utilisé pour l'isolement des hépatocytes avec une grande viabilité de bourdonnementun foie. L'utilisation d'hépatocytes humains reste important pour la recherche de translation et de validation des expériences utilisant des modèles animaux. Les morceaux de foie humain utilisés dans cette étude ont été acquis avec le consentement de la gouvernance à travers la Fondation de tissus humains et de cellules de recherche, une fondation contrôlée par l'État à but non lucratif 10. Après un pathologiste supprimé ce qui était nécessaire pour le diagnostic, des morceaux de foie ont été prélevés dans le tissu restant. Le tissu sectionnée par le pathologiste était morphologiquement tissus sains obtenus à partir des marges de résection après résection hépatique.
Protocole
Une. Préparation de la perfusion et l'isolement Solutions
- Préparer les solutions nécessaires pour la perfusion de la pièce de foie et de l'isolement des hépatocytes, conformément au tableau 1. Les solutions peuvent être stockées à 4 ° C jusqu'à utilisation.
- Filtre stérile toutes les solutions en utilisant un filtre de 0,22 um.
- Toutes les solutions qui viennent en contact avec le foie doivent être stériles.
2. Préparation de l'équipement et des solutions de perfusion
- L'équipement pour la perfusion de la pièce de foie doit être mis en place comme représenté sur la figure 1.
- Le bain d'eau doit être réglée à une température appropriée, qui est différent dans chaque montage expérimental particulier, tel que les solutions sont à la température de 37 ° C quand ils atteignent la pièce de foie. Dans ce cas, le bain d'eau est réglée à 41 ° C pour chauffer les solutions 1, 2 et 3 et le condenseur en verre à double enveloppe. Solution 4 doit être réchauffé à37 ° C dans un bain d'eau séparée pour utilisation pour réduire la perte d'activité de la collagénase.
- Peu de temps avant la perfusion du foie, mettez le régulateur du réservoir de gaz contenant 95% d'O 2/5% de CO 2 au gaz de l'appareil d'oxygénation (figure 1E).
3. Perfusion du foie
- Un morceau de foie avec autant capsule intacte de Glisson que possible et idéalement avec une surface de seulement 1 coupe doit être obtenue à partir d'un pathologiste pour perfusion.
- Placer cette pièce de foie sur l'entonnoir Büchner qui contient un disque de filtre perforé (figure 1B).
- Le système de perfusion doit être amorcée avec la solution 1.
- Avec une vitesse d'écoulement faible, incurvée canules d'irrigation avec des embouts d'olive doit être inséré dans les vaisseaux sanguins plus grands sur la surface de la pièce de foie de coupe. Comme le sang évacue par le foie, le tissu devient plus léger dans les zones avec une bonne perfusion. Le nombre de canules utilisées pour différentes taillesdes foies est représenté sur la figure 2A. La taille de la jauge choisie devrait se traduire par un ajustement confortable qui tiendra les canules à la place. Les vaisseaux sanguins plus petits doivent être laissés ouverts pour le tampon de perfusion à s'écouler hors de la pièce de foie.
- Augmenter le débit de la pompe péristaltique à entre 110 à 460 ml / min selon la taille du foie (Figure 2B). Il en résulte un débit moyen de 44 ± 16 ml / min par la canule (figure 2C). La vitesse choisie est fonction de la pièce de foie et devrait se traduire par une légère repulpant place de la pièce de foie. Dans certains cas, il peut être nécessaire de serrer fermer certains des récipients ouverts avec des micro clamps vasculaires pour atteindre la légère repulpant mentionné ci-dessus. Une bonne perfusion peut être observé lorsque la pièce de foie est une couleur plus claire partout.
- Gardez la pièce humide du foie pendant la perfusion en le recouvrant d'un morceau de gaze trempé dans une solution saline.
- Perfuser avec 1 L de solution 1 pour débusquer tout remaining sang dans la pièce du foie.
- Changer le liquide de perfusion à la solution 2 et perfuser pendant 10 min.
- Commuter le liquide de perfusion pour perfuser la solution 3 et avec 0,5 L.
- Changer le liquide de perfusion de la solution 4, qui contient de 0,1 à 0,15% de collagénase (Tableau 2).
- Pour cette étape, la perfusion doit être effectuée de manière à recirculation pour 9-12 minutes ou jusqu'à ce que le foie est suffisamment digéré, le tissu du foie devrait apparaître à briser un peu moins de la capsule de Glisson et sentir ramolli lorsque sondé avec le côté émoussé d'un scalpel.
4. Isolement des hépatocytes
- Arrêter la pompe péristaltique et retirer les canules de la pièce de foie.
- Placez le morceau de foie dans un cristallisoir contenant 100-200 ml de solution 5.
- Retirez la capsule de Glisson soigneusement et secouez doucement les cellules. Si il ya des régions qui ne sont pas bien perfusés, un scalpel peut être utilisé pour couper à traversces régions pour libérer les cellules contenues à l'intérieur. Ajouter plus de solutions 5 au besoin pendant le processus.
- Ajouter plus de solution 5 jusqu'à un volume final de 500 ml est atteinte.
- Filtrer la suspension de cellules à deux reprises, d'abord à travers une maille de 210 um de nylon suivi d'un filet de nylon de 70 um. Ensuite, versez la suspension de cellules dans 200 ml tubes de centrifugation.
- Centrifuger la suspension cellulaire à 72 g pendant 5 min à 4 ° C. Aspirer le surnageant et le culot de cellules doucement remis en suspension doucement dans 200 ml de Solution 5.
- Répéter le lavage numéro de l'étape 4.6 à trois reprises. Sur l'étape de centrifugation finale, les cellules remettre en suspension dans une solution de stockage à froid (voir la liste des matériaux). Les cellules doivent être d'environ 2,5 millions hépatocytes par millilitre pour l'évaluation du rendement et la viabilité en utilisant un trypan test d'exclusion au bleu en fonction de hématimètre.
- Pour effectuer un test d'exclusion au bleu trypan, ajouter 0,1 ml de cellules diluées de manière appropriée (≈ 2-5 millions / ml) dans un tube de centrifugeuse contenant 0,5 ml de soluti bleu trypanle (0,4% de bleu trypan dissous dans une solution saline tamponnée au phosphate (PBS)) et 0,4 ml de PBS. Après avoir mélangé la suspension de cellules à fond, charger un hémocytomètre avec la suspension et examiner au microscope à un grossissement de 100X. En microscopie, les cellules mortes seront colorées en bleu tandis que les cellules vivantes apparaissent sans tache. Compter le nombre de cellules vivantes et totales dans chacun des 1 mm 2 grilles marquées sur la hématimètre. Viabilité (%), le rendement des cellules vivantes (en millions hépatocytes par une solution de stockage à froid ml (CSS) ou million hépatocytes par g de foie) peut être calculé en utilisant les formules ci-dessous.
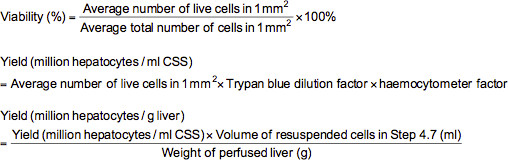
Remarque: Dans ce cas, le bleu trypan facteur de dilution est de 10 et le facteur de hématimètre est 10000.
Résultats
Configuration de perfusion
L'équipement requis pour la perfusion du foie doit être mis en place selon la figure 1.
Viabilité et le rendement des hépatocytes humains isolés
La viabilité moyenne des hépatocytes humains isolés était de 77 ± 10% et le rendement moyen des hépatocytes était de 13 ± 11 millions hépatocytes / g de foie, avec des valeurs exprimées en moyenne ± écart-type. Le nombre d'isoleme...
Discussion
Ce protocole conduit à l'isolement d'hépatocytes humains à forte viabilité et de la pureté. Afin de parvenir à ces résultats, il est important de commencer par une pièce appropriée de foie. Le morceau de foie devrait avoir la capsule de Glisson intact sur toutes les surfaces à l'exception de une surface de coupe. Un autre facteur important est le lot particulier de collagénase utilisée, comme différents lots peuvent entraîner des différences marquées dans les viabilités des hépatocytes apr?...
Déclarations de divulgation
Optimisation de ce protocole a été partiellement financée par une subvention de Hepacult GmbH. Dr. Wolfgang Thasler est l'un des fondateurs de Hepacult GmbH et demeure l'un des membres du conseil d'administration de cette société. L'emploi de Maresa Demmel est partiellement par Hepacult. Maria Hauner est employé par Hepacult GmbH. Hepacult est une société biotechnologique spin-off de l'Université, qui offre des hépatocytes humains avec le consentement et l'accès libre à des fins de recherche.
Remerciements
Ce travail a été rendu possible par la Fondation Human Tissue et recherche sur les cellules, ce qui rend les tissus humains disponibles pour la recherche. Le soutien financier pour ce travail a été reçu par le ministère fédéral de l'éducation et de la recherche (nom de subvention: Virtual foie réseau, le numéro de subvention: 0315759) et Hepacult GmbH. Nos remerciements vont également aux assistants techniques de la banque de tissus Hôpital Grosshadern pour la collecte des échantillons de foie et les assistants techniques de la cellule d'isolement de base Facilité pour la réalisation de la perfusion du foie et de l'isolement des hépatocytes. En particulier, nous tenons à remercier Natalja Löwen pour démontrer cette procédure dans la vidéo. Enfin, nous tenons à remercier Natalja Löwen et Edeltraud Hanesch pour créer des illustrations de la Figure 1 et les chiffres dans la vue d'ensemble schématique de la vidéo.
matériels
| Name | Company | Catalog Number | Comments |
| Bubble trap | Gaßner Glastechnik | ||
| Glass jacketed condenser | Gaßner Glastechnik | ||
| 41 °C Water bath | Julabo | 35723-H24/EG | |
| 37 °C Water bath | GFL | 1083 | |
| Compressed gas cylinder (95 % O2/5 % CO2) | Linde | ||
| Gas permeable tubing | Neolab | 2-4440 | |
| Peristaltic pump | Ismatec | IP65 | |
| Scalpel | Feather | 320010 | |
| Forceps | Omnilab | 5171014 | |
| Conical flasks 1 L | Schott Duran | 2121654 | |
| Conical flasks 5 L | Schott Duran | 2121673 | |
| Beakers | Schott Duran | 2110654 | |
| 200 ml centrifuge tubes | Becton Dickinson | 352075 | |
| Crystallizing dish | Omnilab | 5144063 | |
| Curved irrigation cannulae with ball tips | Ernst Kratz GmbH | 1464LL/ 1465LL A+B/ 1472LL | |
| Micro vascular clamps | Ernst Kratz GmbH | ||
| Büchner funnel | Carl Roth | HT38.1 | |
| Nylon mesh 210 μm | Neolab | 4-1413 | |
| Nylon mesh 70 μm | Neolab | 4-1419 | |
| 0.22 μm sterile filters | Peske | 99505 | |
| 500 ml bottles | Schott Duran | 2180144 | |
| 1 L bottles | Schott Duran | 2180154 | |
| Hemocytometer | Peske | 06-0001 | |
| 1.5 ml tubes | Eppendorf | 0030 120,086 | |
| 50 ml conical tubes | BD Biosciences | 352070 | |
| Ice bucket | Neolab | 1508454 | |
| Sterile Pasteur pipettes | Brand | 747715 | |
| Motorised pipette filler (Pipette boy acu) | Integra | 155017 | |
| Refridgerated centrifuge | Eppendorf | 5810R | |
| Laminar flow | Kendro | Hera safe-KS9 | |
| Aspirator (Low-flow surgical suction pump) | Atmos | C361 | |
| Laboratory Gas Burner | Integra | Fire Boy eco | |
| Disposable laboratory coat | Paperlynen GmbH | MD0202414 | |
| Surgical mask with visor | Kimberly-Clark | 48247 | |
| Surgical hood | Barrier | 42072 | |
| Latex gloves | Semper Care | CE0321 | |
| Collagenase (Batch number NB 4G) | Serva | 17465 | |
| Calcium chloride dihydrate | Merck | 2382 | |
| EGTA | Sigma | E4378 | |
| Sodium chloride | Roth | 9265.2 | |
| Hepes | Roth | 9105.3 | |
| Potassium chloride | Serva | 26868 | |
| Albumin | Biomol | 01400-2 | |
| Glucose | Serva | 22700 | |
| Sodium hydrogen carbonate | Serva | 30180 | |
| 0.4% Trypan blue solution | Lonza | 17-942E | |
| Cold storage solution | Hepacult GmbH |
Références
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Schneider, W. C., Potter, V. R. The assay of animal tissues for respiratory enzymes II. Succinic dehydrogenase and cytochrome oxidase. J. Biol. Chem. 149, 217-227 (1943).
- Aubin, P. M. G., Bucher, N. L. R. A Study of Binucleate Cell Counts in Resting and Regenerating Rat Liver Employing a Mechanical Method for the Separation of Liver Cells. Anat. Rec. 112, 797-809 (1952).
- Anderson, N. G. The Mass Isolation of Whole Cells from Rat Liver. Science. 117, 627-628 (1953).
- Jacob, S. T., Bhargava, P. M. New Method for Preparation of Liver Cell Suspensions. Experimental Cell Research. 27 (62), 453-467 (1962).
- Berry, M. N. Metabolic Properties of Cells Isolated from Adult Mouse Liver. Journal of Cell Biology. 15, 1-8 (1962).
- Laws, J. O., Stickland, L. H. Metabolism of Isolated Liver Cells. Nature. 178, 309-310 (1038).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. The Journal of Cell Biology. 43, 506-520 (1969).
- Seglen, P. O. Preparation of Rat-Liver Cells .3. Enzymatic Requirements for Tissue Dispersion. Experimental Cell Research. 82 (73), 391-398 (1973).
- Thasler, W. E., et al. Charitable State-Controlled Foundation Human Tissue and Cell Research: Ethic and Legal Aspects in the Supply of Surgically Removed Human Tissue For Research in the Academic and Commercial Sector in Germany. Cell and Tissue Banking. 4, 49-56 (2003).
- Queral, A. E., DeAngelo, A. B., Garrett, C. T. Effect of different collagenases on the isolation of viable hepatocytes from rat liver. Analytical Biochemistry. 138, 235-237 (1984).
- Smedsrod, B., Pertoft, H. Preparation of Pure Hepatocytes and Reticuloendothelial Cells in High-Yield from a Single-Rat Liver by Means of Percoll Centrifugation and Selective Adherence. J. Leukocyte Biol. 38, 213-230 (1985).
- Cantrell, E., Bresnick, E. Benzpyrene Hydroxylase-Activity in Isolated Parenchymal and Nonparenchymal Cells of Rat-Liver. Journal of Cell Biology. 52, 316-321 (1972).
- Weiskirchen, R., Gressner, A. M. Isolation and culture of hepatic stellate cells. Methods in Molecular Medicine. 117, 99-113 (2005).
- Baccarani, U., et al. Steatotic versus cirrhotic livers as a source for human hepatocyte isolation. Transplant P. 33, 664-665 (2001).
- Renz, J. F., et al. Utilization of extended donor criteria liver allografts maximizes donor use and patient access to liver transplantation. Annals of Surgery. 242, 556-563 (2005).
- Schemmer, P., et al. Extended donor criteria have no negative impact on early outcome after liver transplantation: a single-center multivariate analysis. Transplant Proc. 39, 529-534 (2007).
- Alexandre, E., et al. Influence of pre-, intra- and post-operative parameters of donor liver on the outcome of isolated human hepatocytes. Cell and Tissue Banking. 3, 223-233 (2002).
- Spotnitz, W. D., Burks, S. State-of-the-art review: Hemostats, sealants, and adhesives II: Update as well as how and when to use the components of the surgical toolbox. Clinical and applied thrombosis/hemostasis : official journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis. 16, 497-514 (2010).
- Spotnitz, W. D., Burks, S. Hemostats, sealants, and adhesives III: a new update as well as cost and regulatory considerations for components of the surgical toolbox. Transfusion. 52, 2243-2255 (2012).
- Toriumi, D. M., Raslan, W. F., Friedman, M., Tardy, M. E. Histotoxicity of cyanoacrylate tissue adhesives. A comparative study. Archives of otolaryngology--head & neck surgery. 116, 546-550 (1990).
- Vinters, H. V., Galil, K. A., Lundie, M. J., Kaufmann, J. C. The histotoxicity of cyanoacrylates. A selective review. Neuroradiology. 27, 279-291 (1985).
- Bhogal, R. H., et al. Isolation of primary human hepatocytes from normal and diseased liver tissue: a one hundred liver experience. PloS ONE. 6, e18222 (2011).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regul. Toxicol. Pharm. 32, 56-67 (2000).
- Koebe, H. G., Pahernik, S. A., Sproede, M., Thasler, W. E., Schildberg, F. W. Porcine hepatocytes from slaughterhouse organs. An unlimited resource for bioartificial liver devices. ASAIO Journal. 41, 189-193 (1995).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
Erratum
Formal Correction: Erratum: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
Posted by JoVE Editors on 7/01/2016. Citeable Link.
A correction was made to: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
The changes listed below have been made to Table 1.
1). In the recipe for Solution 2, the Final Concentration of EGTA has been changed from:
| EGTA | 0.1mM |
to:
| EGTA | 1mM |
2). In the recipes for Solution 3 and 4, the Final Concentration of Calcium chloride dihydrate has been changed from:
| Calcium chloride dihydrate | 0.5µM |
to:
| Calcium chloride dihydrate | 5mM |
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon