Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung von humanen Hepatozyten durch eine Zwei-Schritt-Verfahren Collagenase Perfusion
In diesem Artikel
Erratum Notice
Zusammenfassung
Eine modifizierte Zwei-Schritt-Kollagenase-Perfusion Verfahren zur Isolierung von humanen Hepatozyten beschrieben. Dieses Verfahren kann auch auf andere Säugetierlebern, angewendet werden. Die isolierten Hepatozyten sind in hoher Ausbeute und Lebensfähigkeit, so dass sie ein geeignetes Modell für die wissenschaftliche Forschung in Bereichen wie der Leberregeneration, Pharmakokinetik und Toxikologie.
Zusammenfassung
Die Leber, ein Organ mit einer außergewöhnlichen Regenerationsfähigkeit, führt eine breite Palette von Funktionen, wie zB Entgiftung, Stoffwechsel und Homöostase. Als solche sind Hepatozyten ein wichtiges Modell für eine große Vielfalt von Forschungsfragen. Insbesondere ist die Verwendung von humanen Hepatozyten in den Bereichen Pharmakokinetik, Toxikologie, Leberregeneration und translationale Forschung besonders wichtig. Somit stellt dieses Verfahren eine modifizierte Version einer Zwei-Schritt-Verfahren, um Collagenase-Perfusion isoliert Hepatozyten durch Seglen 1 beschrieben.
Früher wurden Hepatozyten durch mechanische Methoden isoliert. Allerdings haben enzymatischen Methoden wurde gezeigt, überlegen zu sein, wie Hepatozyten nach Isolierung behalten ihre strukturelle Integrität und Funktion. Das hier vorgestellte Verfahren passt sich das Verfahren bisher für Rattenlebern der menschlichen Leber Teile und führt zu einer großen Ausbeute von Hepatozyten mit einer Lebensfähigkeit von 77 ± 10% bestimmt. Der HauptUnterschied in diesem Verfahren ist das Verfahren der cannulization der Blutgefäße. Weiterhin kann das hier beschriebene Verfahren auch auf andere Arten von Lebern mit vergleichbaren Leber-und Blutgefäßgrößen angewendet werden.
Einleitung
Eine Leberzellsuspension aus der Leber durch mechanische oder enzymatische Verfahren hergestellt werden. Mechanische Verfahren verwendet werden, um ganze Leberzellen herzustellen, umfassen die Leber zwingt durch Gaze 2, schüttelt ein Leberstück mit Glasperlen in einem Kahn Schüttler 3, mit Glas-Homogenisatoren mit losen Stößel 4,5 usw. Im Laufe der Jahre haben mechanische Methoden aus gefallen begünstigen aufgrund der Schäden an Zellmembranen und der Verlust der Funktion der isolierten Hepatozyten 6,7. Folglich ist die Verwendung eines enzymatischen Verfahrens derzeit die wichtigste Methode zur Isolierung von Hepatozyten.
Isolation von Hepatozyten mit einem enzymatischen Verfahren wurde stark verbessert, wenn Berry und Friend 8 durchströmt Kollagenase und Hyaluronidase durch die Leber über die Pfortader in Ratten. Dieses Verfahren verwendet die Perfusion Gefßsystem zu ermöglichen, dass die Enzyme in engen Kontakt mit der Mehrzahl der Zellen kommen, was zueine 6-fache Zunahme der Ausbeute an Hepatozyten 8. Weiterhin ergab diese Methode Zellen, die ihre strukturelle Integrität beibehalten, praktisch ohne Transformation des endoplasmatischen Reticulum in isolierte Bläschen und ohne mitochondriale Schädigungen 8.
Diese Methode wurde von Seglen 1, die eine Zwei-Schritt-Verfahren für die Durchblutung der Leber Zellisolierung Pionier modifiziert. In diesem Verfahren wird der Rattenleber mit einem Ca 2 +-freien Puffer, gefolgt von einer Perfusion mit Kollagenase-Puffer, enthaltend Ca 2 + 1 perfundiert. Die Entfernung von Ca 2 + in der ersten Stufe hilft dabei, Desmosomen zu stören, während die Zugabe von Ca 2 + in der zweiten Stufe ist für eine optimale Collagenaseaktivität 1,9 erforderlich.
Da die oben beschriebenen veröffentlichte Arbeit wurde bei Ratten durchgeführt wurde, versucht dieser Artikel ein modifiziertes Verfahren, die für die Isolierung von Hepatozyten mit hoher Rentabilität von Summen verwendet werden können, zeigen,Leber ein. Die Verwendung von humanen Hepatozyten bleibt wichtig für die translationale Forschung und für die Validierung von Versuchen mit Tiermodellen. Die menschliche Leber Stücke in dieser Studie verwendet wurden mit Zustimmung der Governance durch das Human Tissue and Cell Research Foundation, einer staatlich kontrollierten Non-Profit-Stiftung 10 erworben. Nach ein Pathologe entfernt, was für die Diagnose erforderlich ist, wurden Leberstücke aus dem verbleibenden Gewebe gesammelt. Die durch den Pathologen geschnittene Gewebe wurde morphologisch nach Leberresektion von Resektionsränder erhalten gesunden Gewebe.
Protokoll
1. Vorbereitung der Perfusion und Isolation Lösungen
- Vorbereitung der für die Durchblutung der Leber Stück und die Isolierung von Hepatozyten nach Tabelle 1 erforderlichen Lösungen. Lösungen bei 4 ° C bis zur Verwendung gelagert werden.
- Sterilfilter alle Lösungen mit einem 0,22 um Filter.
- Alle Lösungen, die in Kontakt mit der Leber kommen sollte steril sein.
2. Vorbereitung der Perfusion Geräte und Lösungen
- Die Ausrüstung für die Durchblutung der Leber Stück sollte wie in Abbildung 1 gezeigt, eingestellt werden.
- Das Wasserbad sollte bei einer geeigneten Temperatur, die in jedem einzelnen Versuchsaufbau unterschiedlich ist, so eingestellt werden, dass die Lösungen bei der Temperatur von 37 ° C, wenn sie die Leber Stück zu erreichen. In diesem Fall wird das Wasserbad auf 41 ° C eingestellt, um die Lösungen 1, 2 und 3 und die ummantelten Glaskühler wärmen. Lösung 4 sollte erwärmt werden37 ° C in einem separaten Wasserbad für den Verlust von Kollagenase-Aktivität zu reduzieren.
- Kurz vor Leberperfusion, schalten Sie den Regler der Gastank mit 95% O 2/5% CO 2, um die Sauerstoffgerät (1E) Gas.
3. Perfusion der Leber
- Eine Leberstück mit so viel Glisson-Kapsel intakt wie möglich und im Idealfall mit nur 1 Schnittfläche sollte von einem Pathologen zur Perfusion erzielt werden.
- Legen Sie diese Leber Stück auf der Büchner-Trichter, die einen perforierten Filterscheibe (Abbildung 1B) enthält.
- Die Perfusion System sollte mit der Lösung 1 grundiert werden.
- Mit einer niedrigen Flussrate sollte gekrümmte Bewässerung Kanülen mit Oliven-Tipps in die größeren Blutgefäße auf der Schnittfläche der Leber Stück eingesetzt werden. Wie Blut spült aus der Leber wird das Gewebe leichter in Gebieten mit guter Durchblutung. Die Anzahl der Kanülen für verschiedene Größen verwendetder Leber ist in 2A gezeigt. Die Spurgröße gewählt werden sollte in einer Passform, die die Kanülen in Position zu halten die Folge. Die kleineren Blutgefäßen sollte für die Perfusion Puffer aus der Leber Stück abtropfen offen gelassen werden.
- Erhöhung der Strömungsgeschwindigkeit an der peristaltischen Pumpe zwischen 110 bis 460 ml / min in Abhängigkeit von der Größe der Leber (Fig. 2B). Dies führt zu einer mittleren Strömungsrate von 44 ± 16 ml / min pro Kanüle (Fig. 2C). Die gewählte Geschwindigkeit hängt von der Leber Stück und sollte in einem leichten Hyalurosmooth Stück der Leber führen. In einigen Fällen kann es notwendig sein, zu klemmen herunter einige der offene Behälter mit Mikrogefäßklemmen, die oben erwähnte leichte Aufpolsterung erzielen. Eine gute Durchblutung beobachtet werden kann, wenn die Leber Stück ist eine hellere Farbe ganz.
- Halten Sie das Leberstück feucht während der Perfusion durch Abdecken mit einem Stück Gaze in Kochsalzlösung eingeweicht.
- Perfundieren mit 1 l Lösung 1 zu spülen, keine remaining Blut in der Leber Stück.
- Ändern Sie den Perfusionsfluid zur Lösung 2 und Perfusion für 10 min.
- Schalten Sie das Perfusionsfluid zu Lösung 3 und Perfusion mit 0,5 L.
- Ändern Sie den Perfusionsfluid zu Lösung 4, die von 0,1 bis 0,15% Kollagenase (Tabelle 2) enthält.
- Für diesen Schritt, Perfusion sollte in einer Umlauf Weise für 9-12 Minuten durchgeführt werden kann oder bis die Leber ausreichend verdaut, das Lebergewebe erscheinen soll unter der Glisson-Kapsel zu leicht auseinander brechen und fühlen sich weich, wenn sie mit der stumpfen Seite einer sondiert Skalpell.
4. Isolierung von Hepatozyten
- Schalten Sie die Schlauchpumpe und Kanülen entfernen aus der Leber Stück.
- Legen Sie das Stück Leber in eine Kristallisationsschale mit 100-200 ml Lösung 5.
- Entfernen der Glisson-Kapsel vorsichtig und sanft schütteln die Zellen. Wenn es Regionen gibt, die nicht gut durchblutet sind, kann ein Skalpell durchtrennt werdendiese Regionen zu den Zellen enthaltenen freizugeben. Fügen Sie weitere Lösung 5 während des Prozesses, wie gebraucht.
- Noch Lösung 5 bis ein Endvolumen von 500 ml erreicht ist.
- Filter Zellsuspension zweimal, zunächst durch einen 210 um Nylon-Mesh, gefolgt von einer 70 um Nylon-Mesh. Weiter, gießen Sie die Zellsuspension in 200 ml-Zentrifugenröhrchen.
- Zentrifugieren der Zellsuspension bei 72 g für 5 min bei 4 ° C. Überstand wird abgesaugt und vorsichtig resuspendieren Zellpellet vorsichtig in 200 ml Lösung 5.
- Wiederholen Sie den Waschschritt Nummer 4.6 dreimal. Am letzten Zentrifugen Schritt resuspendieren Zellen in Kühllösung (siehe Liste der Materialien). Die Zellen sind etwa 2,5 Millionen Leberzellen pro Milliliter für die Bewertung von Ertrag und Rentabilität mit einer Zählkammer-basierte Trypanblau-Ausschluss-Test sein.
- Zur Durchführung einer Trypanblau-Ausschluss-Assay, fügen Sie 0,1 ml der entsprechend verdünnten Zellen (≈ 2,5 Millionen / ml) zu einem Mikrozentrifugenröhrchen mit 0,5 ml Trypanblau Löauf (0,4% Trypanblau in mit Phosphat gepufferter Salzlösung (PBS) gelöst) und 0,4 ml PBS. Nach dem Mischen der Zellsuspension gründlich, legen Sie eine Zählkammer mit der Suspension und überprüfen unter dem Mikroskop bei 100-facher Vergrößerung. Unter Mikroskopie, werden die toten Zellen blau gefärbt werden, während die lebenden Zellen ungefärbt erscheinen. Zählen Sie die Anzahl der lebenden Zellen und insgesamt in jedem der 1 mm 2 Gitter auf der Hämozytometers markiert. Die Lebensfähigkeit (%), die Ausbeute an lebenden Zellen (Hepatozyten Millionen pro ml kaltem Speicherlösung (CSS) oder Millionen Hepatozyten pro g Leber) können mit den nachfolgenden Formeln berechnet werden.
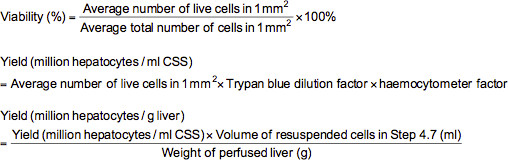
Anmerkung: In diesem Fall ist 10 die Trypanblau-Verdünnungsfaktor und die Zählkammer Faktor beträgt 10.000.
Ergebnisse
Perfusion-Setup
Die Leberdurchblutung erforderliche Ausrüstung sollte nach 1 gesetzt werden.
Die Lebensfähigkeit und Rendite von isolierten menschlichen Hepatozyten
Die durchschnittliche Lebensfähigkeit von isolierten humanen Hepatozyten betrug 77 ± 10% und die durchschnittliche Rendite der Hepatozyten war 13 ± 11 Millionen Hepatozyten / g Leber, mit Werten als Mittelwert ± Standardabweichung. Die Zahl der Hepatozyten...
Diskussion
Dieses Protokoll führt zu der Isolierung von humanen Hepatozyten mit hohen Lebensfähigkeit und Reinheit. Um diese Ergebnisse zu erzielen, ist es wichtig, mit einem geeigneten Stück Leber starten. Das Stück Leber sollte intakt Glisson-Kapsel auf allen Oberflächen außer ein Schnittfläche haben. Ein weiterer wichtiger Faktor ist die bestimmte Charge von Collagenase verwendet werden, wie verschiedene Chargen können deutliche Unterschiede in der Lebensfähigkeit von Hepatozyten nach Aufschluss 11 führen. ...
Offenlegungen
Optimierung des Protokolls wurde teilweise durch einen Zuschuss aus hepacult GmbH finanziert. Dr. Wolfgang Thasler ist einer der Gründer der hepacult GmbH und bleibt eines der Mitglieder des Vorstandes in dieser Gesellschaft. Die Beschäftigung von Maresa Demmel ist teilweise durch hepacult. Maria Hauner wird durch hepacult GmbH beschäftigt. Hepacult ist ein Spin-off biotechnologische Firma aus der Universität, der humanen Hepatozyten mit Zustimmung und offenen Zugang zu Forschungszwecken bietet.
Danksagungen
Diese Arbeit von der Human Tissue and Cell Research Foundation, die menschliche Gewebe für die Forschung macht möglich gemacht. Und hepacult GmbH Finanzielle Unterstützung für diese Arbeit wurde vom Bundesministerium für Bildung und Forschung (: Virtual Liver Network, Förderkennzeichen 0315759 Zuschuss Name) erhalten. Unser Dank gilt auch den technischen Assistenten aus dem Klinikum Großhadern Gewebebank für die Sammlung der Leberproben und die technischen Assistenten aus der Zellisolierung Core Facility für die Durchführung der Leberdurchblutung und Hepatozyten Isolation zu gehen. Insbesondere möchten wir Natalja Löwen für den Nachweis dieses Verfahren in dem Video zu danken. Schließlich möchten wir Natalja Löwen und Edeltraud Hanesch für die Erstellung der Illustrationen für Abbildung 1 und die Zahlen in der schematischen Überblick über die Video danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Bubble trap | Gaßner Glastechnik | ||
| Glass jacketed condenser | Gaßner Glastechnik | ||
| 41 °C Water bath | Julabo | 35723-H24/EG | |
| 37 °C Water bath | GFL | 1083 | |
| Compressed gas cylinder (95 % O2/5 % CO2) | Linde | ||
| Gas permeable tubing | Neolab | 2-4440 | |
| Peristaltic pump | Ismatec | IP65 | |
| Scalpel | Feather | 320010 | |
| Forceps | Omnilab | 5171014 | |
| Conical flasks 1 L | Schott Duran | 2121654 | |
| Conical flasks 5 L | Schott Duran | 2121673 | |
| Beakers | Schott Duran | 2110654 | |
| 200 ml centrifuge tubes | Becton Dickinson | 352075 | |
| Crystallizing dish | Omnilab | 5144063 | |
| Curved irrigation cannulae with ball tips | Ernst Kratz GmbH | 1464LL/ 1465LL A+B/ 1472LL | |
| Micro vascular clamps | Ernst Kratz GmbH | ||
| Büchner funnel | Carl Roth | HT38.1 | |
| Nylon mesh 210 μm | Neolab | 4-1413 | |
| Nylon mesh 70 μm | Neolab | 4-1419 | |
| 0.22 μm sterile filters | Peske | 99505 | |
| 500 ml bottles | Schott Duran | 2180144 | |
| 1 L bottles | Schott Duran | 2180154 | |
| Hemocytometer | Peske | 06-0001 | |
| 1.5 ml tubes | Eppendorf | 0030 120,086 | |
| 50 ml conical tubes | BD Biosciences | 352070 | |
| Ice bucket | Neolab | 1508454 | |
| Sterile Pasteur pipettes | Brand | 747715 | |
| Motorised pipette filler (Pipette boy acu) | Integra | 155017 | |
| Refridgerated centrifuge | Eppendorf | 5810R | |
| Laminar flow | Kendro | Hera safe-KS9 | |
| Aspirator (Low-flow surgical suction pump) | Atmos | C361 | |
| Laboratory Gas Burner | Integra | Fire Boy eco | |
| Disposable laboratory coat | Paperlynen GmbH | MD0202414 | |
| Surgical mask with visor | Kimberly-Clark | 48247 | |
| Surgical hood | Barrier | 42072 | |
| Latex gloves | Semper Care | CE0321 | |
| Collagenase (Batch number NB 4G) | Serva | 17465 | |
| Calcium chloride dihydrate | Merck | 2382 | |
| EGTA | Sigma | E4378 | |
| Sodium chloride | Roth | 9265.2 | |
| Hepes | Roth | 9105.3 | |
| Potassium chloride | Serva | 26868 | |
| Albumin | Biomol | 01400-2 | |
| Glucose | Serva | 22700 | |
| Sodium hydrogen carbonate | Serva | 30180 | |
| 0.4% Trypan blue solution | Lonza | 17-942E | |
| Cold storage solution | Hepacult GmbH |
Referenzen
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Schneider, W. C., Potter, V. R. The assay of animal tissues for respiratory enzymes II. Succinic dehydrogenase and cytochrome oxidase. J. Biol. Chem. 149, 217-227 (1943).
- Aubin, P. M. G., Bucher, N. L. R. A Study of Binucleate Cell Counts in Resting and Regenerating Rat Liver Employing a Mechanical Method for the Separation of Liver Cells. Anat. Rec. 112, 797-809 (1952).
- Anderson, N. G. The Mass Isolation of Whole Cells from Rat Liver. Science. 117, 627-628 (1953).
- Jacob, S. T., Bhargava, P. M. New Method for Preparation of Liver Cell Suspensions. Experimental Cell Research. 27 (62), 453-467 (1962).
- Berry, M. N. Metabolic Properties of Cells Isolated from Adult Mouse Liver. Journal of Cell Biology. 15, 1-8 (1962).
- Laws, J. O., Stickland, L. H. Metabolism of Isolated Liver Cells. Nature. 178, 309-310 (1038).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. The Journal of Cell Biology. 43, 506-520 (1969).
- Seglen, P. O. Preparation of Rat-Liver Cells .3. Enzymatic Requirements for Tissue Dispersion. Experimental Cell Research. 82 (73), 391-398 (1973).
- Thasler, W. E., et al. Charitable State-Controlled Foundation Human Tissue and Cell Research: Ethic and Legal Aspects in the Supply of Surgically Removed Human Tissue For Research in the Academic and Commercial Sector in Germany. Cell and Tissue Banking. 4, 49-56 (2003).
- Queral, A. E., DeAngelo, A. B., Garrett, C. T. Effect of different collagenases on the isolation of viable hepatocytes from rat liver. Analytical Biochemistry. 138, 235-237 (1984).
- Smedsrod, B., Pertoft, H. Preparation of Pure Hepatocytes and Reticuloendothelial Cells in High-Yield from a Single-Rat Liver by Means of Percoll Centrifugation and Selective Adherence. J. Leukocyte Biol. 38, 213-230 (1985).
- Cantrell, E., Bresnick, E. Benzpyrene Hydroxylase-Activity in Isolated Parenchymal and Nonparenchymal Cells of Rat-Liver. Journal of Cell Biology. 52, 316-321 (1972).
- Weiskirchen, R., Gressner, A. M. Isolation and culture of hepatic stellate cells. Methods in Molecular Medicine. 117, 99-113 (2005).
- Baccarani, U., et al. Steatotic versus cirrhotic livers as a source for human hepatocyte isolation. Transplant P. 33, 664-665 (2001).
- Renz, J. F., et al. Utilization of extended donor criteria liver allografts maximizes donor use and patient access to liver transplantation. Annals of Surgery. 242, 556-563 (2005).
- Schemmer, P., et al. Extended donor criteria have no negative impact on early outcome after liver transplantation: a single-center multivariate analysis. Transplant Proc. 39, 529-534 (2007).
- Alexandre, E., et al. Influence of pre-, intra- and post-operative parameters of donor liver on the outcome of isolated human hepatocytes. Cell and Tissue Banking. 3, 223-233 (2002).
- Spotnitz, W. D., Burks, S. State-of-the-art review: Hemostats, sealants, and adhesives II: Update as well as how and when to use the components of the surgical toolbox. Clinical and applied thrombosis/hemostasis : official journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis. 16, 497-514 (2010).
- Spotnitz, W. D., Burks, S. Hemostats, sealants, and adhesives III: a new update as well as cost and regulatory considerations for components of the surgical toolbox. Transfusion. 52, 2243-2255 (2012).
- Toriumi, D. M., Raslan, W. F., Friedman, M., Tardy, M. E. Histotoxicity of cyanoacrylate tissue adhesives. A comparative study. Archives of otolaryngology--head & neck surgery. 116, 546-550 (1990).
- Vinters, H. V., Galil, K. A., Lundie, M. J., Kaufmann, J. C. The histotoxicity of cyanoacrylates. A selective review. Neuroradiology. 27, 279-291 (1985).
- Bhogal, R. H., et al. Isolation of primary human hepatocytes from normal and diseased liver tissue: a one hundred liver experience. PloS ONE. 6, e18222 (2011).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regul. Toxicol. Pharm. 32, 56-67 (2000).
- Koebe, H. G., Pahernik, S. A., Sproede, M., Thasler, W. E., Schildberg, F. W. Porcine hepatocytes from slaughterhouse organs. An unlimited resource for bioartificial liver devices. ASAIO Journal. 41, 189-193 (1995).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
Erratum
Formal Correction: Erratum: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
Posted by JoVE Editors on 7/01/2016. Citeable Link.
A correction was made to: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
The changes listed below have been made to Table 1.
1). In the recipe for Solution 2, the Final Concentration of EGTA has been changed from:
| EGTA | 0.1mM |
to:
| EGTA | 1mM |
2). In the recipes for Solution 3 and 4, the Final Concentration of Calcium chloride dihydrate has been changed from:
| Calcium chloride dihydrate | 0.5µM |
to:
| Calcium chloride dihydrate | 5mM |
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten