A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד של hepatocytes האנושי על ידי שני שלבים Collagenase זלוף נוהל
In This Article
Erratum Notice
Summary
הליך זלוף collagenase שני שלבים שונה לבידוד של hepatocytes אדם מתואר. שיטה זו יכולה להיות מיושמת גם לכבדים של יונקים אחרים. Hepatocytes מבודד זמינים בתשואה גבוהה וכדאיות, מה שהופך אותם המודל מתאים למחקר מדעי בתחומים כגון התחדשות כבד, פרמקוקינטיקה וטוקסיקולוגיה.
Abstract
הכבד, איבר עם יכולת התחדשות יוצאת דופן, מבצע מגוון רחב של פונקציות, כגון סילוק רעלים, חילוף חומרים ועל הומאוסטזיס. ככזה, hepatocytes הוא מודל חשוב למגוון רחב של שאלות מחקר. בפרט, השימוש בhepatocytes האנושי הוא חשוב במיוחד בתחומי פרמקוקינטיקה, טוקסיקולוגיה, התחדשות כבד ומחקר translational. לכן, שיטה זו מציגה גרסה שונה של הליך זלוף collagenase שני שלבים לבודד hepatocytes כפי שתואר על ידי 1 Seglen.
בעבר, hepatocytes היה מבודד בשיטות מכאניות. עם זאת, שיטות אנזימטיות הוכחו להיות מעולה כמו hepatocytes לשמור על השלמות המבנית שלהם ותפקוד לאחר בידוד. שיטה זו המוצגת כאן מתאים את עצמו בשיטה שנועדה בעבר לכבדי חולדה לחתיכות כבד אנושיות ותוצאות בתשואה גדולה של הפטוציטים עם כדאיות של 77 10% ±. העיקריהבדל בהליך זה הוא התהליך של cannulization של כלי הדם. יתר על כן, בשיטה שתוארה כאן יכולה להיות מיושמת גם לכבדים ממינים אחרים עם גדלים בכבד או בכלי דם דומים.
Introduction
השעיה תא כבד ניתן להכין מהכבד בשיטות מכאניות או אנזימטי. שיטות מכאניות המשמשות להכנת תאי כבד שלמים כוללות כפייה של כבד דרך הגזה 2, רועד חתיכת כבד עם חרוזי זכוכית שייקרה קאהן 3, באמצעות homogenizers זכוכית עם עלי רופף 4,5 וכו 'במהלך השנים, שיטות מכאניות נפלו מתוך להעדיף בשל הנזק לקרומי תאים ואובדן התפקוד של הפטוציטים המבודדים 6,7. כתוצאה מכך, השימוש בשיטה אנזימטית הוא כיום השיטה העיקרית לבידודה של הפטוציטים.
בידוד של hepatocytes באמצעות שיטה האנזימטית השתפר מאוד כאשר ברי והחבר 8 perfused collagenase וhyaluronidase דרך כבד דרך וריד הפורטל בחולדות. תהליך זה מנוצל זלוף כלי הדם כדי לאפשר לאנזימים לבוא במגע קרוב עם רוב של התאים, מה שמוביל לעלייה של פי 6 בתשואה של hepatocytes 8. יתר על כן, שיטה זו הניבה תאים ששמרו על השלמות המבנית שלהם, עם כמעט ללא שינוי של reticulum endoplasmic לתוך שלפוחית מבודדת ולא נגרם נזק המיטוכונדריה 8.
שיטה זו שונה על ידי 1 Seglen, שהיה חלוץ הליך זלוף שני שלבים לבידוד בתאים כבד. בהליך זה, בכבד חולדת perfused עם 2 + חיץ חופשי Ca אחרי זלוף עם חיץ collagenase המכיל Ca 2 + 1. ההסרה של Ca 2 + בשלב הראשון מסייעת לשבש דסמוזומים, תוך התוספת של Ca 2 + בשלב השני נדרשת לפעילות collagenase אופטימלית 1,9.
בהתחשב בכך שהעבודה שפורסמה שתוארה לעיל בוצעה בחולדות, מאמר זה נועד להדגים הליך שונה שיכול לשמש לבידודה של הפטוציטים עם כדאיות גבוהה מזמזוםכבדים. השימוש בhepatocytes האנושי נשאר חשוב למחקר translational ולאימות ניסויים תוך שימוש במודלים של בעלי חיים. חתיכות הכבד האנושיות השתמשו במחקר זה נרכשו בהסכמה לממשל דרך הקרן לחקר רקמות ותאים אנושיים, קרן ללא כוונת רווח בשליטה ממשלתית 10. לאחר הפתולוג הסיר את מה שנדרש לאבחון, חתיכות כבד נאספו מהרקמות שנותרו. הרקמה מחולק על ידי פתולוג הייתה מורפולוגית רקמה בריאה המתקבלת משולי כריתה לאחר כריתת כבד.
Protocol
1. הכנה של פתרונות זלוף ובידוד
- הכן את הפתרונות דרושים לטפטוף של חתיכת הכבד והבידוד של hepatocytes לפי טבלת 1. ניתן לאחסן את פתרונות על 4 מעלות צלזיוס עד לשימוש.
- סינון סטרילי כל הפתרונות באמצעות מסנן 0.22 מיקרומטר.
- כל הפתרונות שבאים במגע עם הכבד צריכים להיות סטרילי.
2. הכנת זלוף הציוד ופתרונות
- הציוד לטפטוף של פיסת הכבד יש להגדיר כפי שמוצגים באיור 1.
- אמבט המים צריך להיות מוגדר בטמפרטורה מתאימה, שהוא שונה בכל ניסיוני הגדרה מסוימת, כך שהפתרונים נמצאים בטמפרטורה של C ° 37 כאשר הם מגיעים לחתיכת הכבד. במקרה זה, אמבט המים מוגדר 41 מעלות צלזיוס כדי לחמם את הפתרונות 1, 2 ו -3 וקבל זכוכית במעיל. פתרון 4 יש לחמם עד37 מעלות צלזיוס באמבט מים נפרד לשימוש כדי להפחית את האובדן של פעילות collagenase.
- זמן קצר לפני זלוף הכבד, להדליק את הרגולטור של מיכל הדלק המכיל 95% O 2/5% CO 2 לגז מנגנון החמצון (איור 1E).
3. טפטוף של הכבד
- יש לקבל חתיכת כבד עם כמה שיותר הקפסולה של Glisson שלמה ככל האפשר ואופן אידיאלי עם משטח רק 1 לחתוך מפתולוג לזלוף.
- מניחים חתיכת הכבד הזה במשפך ביכנר המכיל מסנן דיסק מחורר (איור 1).
- מערכת זלוף צריכה להיות דרוכה עם פתרון 1.
- עם קצב זרימה נמוך, cannulae השקיה המעוגל עם טיפים זית צריך להיות מוכנס לתוך כלי דם גדולים יותר על פני השטח החתך של פיסת הכבד. הדם שוטף החוצה מן הכבד, הרקמות הופכת להיות קלות יותר באזורים עם זלוף טוב. מספר cannulae משמש לגדלים שוניםשל כבדים מוצג באיור 2 א. גודל מד נבחר צריך לגרום להתאמה הדוקה שתחזיק cannulae במקום. יש להשאיר כלי הדם הקטנים יותר פתוחים לחיץ זלוף לניקוז מחוץ לחתיכת הכבד.
- להגדיל את קצב הזרימה במשאבת peristaltic לבין 110-460 מיליליטר / דקה בהתאם לגודל של הכבד (איור 2). התוצאה היא קצב זרימה של 44 ± 16 ממוצע מיליליטר / דקה לצינורית (איור 2 ג). המהירות שנבחרה תלויה בחתיכת הכבד וצריכה לגרום להתפחה עד קלה של חתיכת הכבד. במקרים מסוימים, ייתכן שיהיה צורך להדק את שהחלק מכלי השיט הפתוח עם מלחציים בכלי דם מיקרו על מנת להשיג את ההתפחה הקלה שהוזכר לעיל. זלוף טוב ניתן להבחין כאשר חתיכת הכבד היא צבע בהיר יותר לאורך כל דרך.
- שמור על פיסה הלחה הכבד במהלך זלוף על ידי כיסוי אותו עם פיסת הגזה הספוגה בתמיסת מלח.
- Perfuse עם 1 ליטר של פתרון 1 כדי לשטוף את כל remaining דם בחתיכת הכבד.
- לשנות את נוזל זלוף לפתרון 2 וינקב עבור 10 דקות.
- לעבור את נוזל זלוף לפתרון 3 וינקב עם 0.5 L.
- לשנות את נוזל זלוף ל4 פתרון, אשר מכיל .1-0.15% מcollagenase (טבלה 2).
- לצעד זה, זלוף צריך להתבצע באופן מחזוריות ל9-12 דקות או עד שהכבד מתעכל מספיק; רקמת הכבד אמורה להופיע להתפרק מעט מתחת הכמוסה של Glisson ולהרגיש התרכך כשמשש עם הצד הקהה של אזמל.
4. בידוד של hepatocytes
- כבה את משאבת peristaltic ולהסיר cannulae מחתיכת הכבד.
- מניחים את חתיכת הכבד בצלחת מתגבשת המכילה 100-200 מיליליטר של פתרון 5.
- הסר את הקפסולה של Glisson בזהירות ובעדינות לנער את התאים. אם ישנם אזורים שאינם perfused היטב, אזמל יכול לשמש כדי לחתוךאזורים אלה כדי לשחרר את התאים בתוך. הוסף עוד פתרון 5 צורך כבמהלך התהליך.
- הוסף עוד פתרון 5 עד לנפח סופי של 500 מיליליטר.
- סנן השעיה תא פעמיים; ראשון דרך רשת 210 ניילון מיקרומטר ואחריו רשת ניילון 70 מיקרומטר. , הבא לשפוך את ההשעיה התא לתוך 200 צינורות צנטריפוגה מיליליטר.
- צנטריפוגה ההשעיה התא ב72 גרם במשך 5 דקות ב 4 ° C. לשאוב supernatant ותא גלולה בעדינות resuspend בעדינות ב200 מיליליטר של פתרון 5.
- חזור על מספר שלב הכביסה 4.6 שלוש פעמים. על המדרגה צנטריפוגות הסופית, תאי resuspend בפתרון אחסון קר (ראו רשימה של חומרים). תאים צריכים להיות כ 2-5,000,000 hepatocytes למיליליטר להערכה של תשואה וכדאיות באמצעות assay הרחקת trypan הכחול מבוסס hemocytometer.
- כדי לבצע את assay הרחקת trypan הכחול, להוסיף 0.1 מיליליטר של תאים בדילול כראוי (2-5,000,000 ≈ / מיליליטר) לצינור microfuge מכיל 0.5 מיליליטר של soluti trypan הכחולב( 0.4% trypan הכחולים מומס בפוספט שנאגרו מלוח (PBS)) ו0.4 מיליליטר של PBS. לאחר ערבוב ההשעיה התא ביסודיות, טען hemocytometer עם ההשעיה ולבחון תחת מיקרוסקופ בהגדלה 100X. תחת מיקרוסקופ, התאים המתים יהיו מוכתמים כחולים ואילו תאי החיים מופיעים בלא כתם. לספור את מספר תאי חיים ומוחלט בכל אחד ממ"מ 2 הרשתות 1 מסומנת על hemocytometer. כדאיות (%), תשואה של תאי חיים (מיליון hepatocytes למיליליטר פתרון אחסון קר (CSS) או מיליון hepatocytes לכבד ז) יכולה להיות מחושבת באמצעות נוסחאות שלהלן.
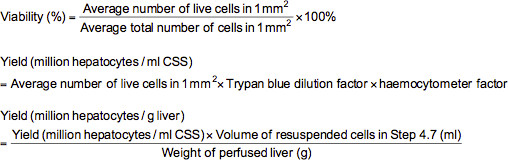
הערה: במקרה זה, גורם לדילול trypan הכחול הוא 10 וגורם hemocytometer הוא 10,000.
תוצאות
התקנת זלוף
הציוד הדרוש לזלוף כבד יש להגדיר על פי איור 1.
כדאיות ותשואה של hepatocytes אדם מבודד
הכדאיות הממוצעת של hepatocytes אדם הבודד הייתה 77 ± 10% והתשואה המ?...
Discussion
פרוטוקול זה גורם לבידוד של hepatocytes האנושי עם כדאיות גבוהה ובטהרה. על מנת להשיג את התוצאות הללו, חשוב להתחיל עם חתיכת הכבד מתאימה. חתיכת הכבד צריכה הכמוסה של Glisson שלמות על כל המשטחים, פרט למשטח לחתוך 1. גורם חשוב נוסף הוא אצווה המסוים של collagenase משמש, כפי שקבוצות שונות יכולו...
Disclosures
אופטימיזציה של פרוטוקול זה מומנה בחלקו על ידי מענק מHepacult GmbH. ד"ר וולפגנג Thasler הוא אחד ממייסדי Hepacult GmbH ונשאר אחד מחברי הדירקטוריון בחברה זו. העסקת Maresa Demmel היא באופן חלקי על ידי Hepacult. מריה Hauner הוא מועסק על ידי Hepacult GmbH. Hepacult היא חברת ספין אוף בתחום הביוטכנולוגיה באוניברסיטה, אשר מציעה hepatocytes אדם בהסכמה וגישה פתוחה למטרות מחקר.
Acknowledgements
עבודה זו התאפשרה הודות לקרן הרקמה האנושית וחקר תא, מה שהופך את הרקמות אנושיות זמינות למחקר. תמיכה כספית עבור עבודה זו קיבלה מהמשרד הפדרלי לחינוך ולמחקר (שם מענק: כבד רשת וירטואלית, מספר מענק: 0,315,759) וHepacult GmbH. תודתנו גם ללכת לעוזרים הטכניים מבנק רקמות Grosshadern בית החולים לאיסוף הדגימות הכבד והעוזרים הטכניים ממתקן Core בידוד תא לביצוע זלוף הכבד ובידוד הפטוציט. בפרט, אנו רוצים להודות לNatalja Löwen עבור הוכחת בהליך זה בווידאו. לבסוף, ברצוננו להודות לNatalja Löwen וEdeltraud Hanesch ליצירת האיורים לאיור 1 ודמויות בסקירה סכמטית של הווידאו.
Materials
| Name | Company | Catalog Number | Comments |
| Bubble trap | Gaßner Glastechnik | ||
| Glass jacketed condenser | Gaßner Glastechnik | ||
| 41 °C Water bath | Julabo | 35723-H24/EG | |
| 37 °C Water bath | GFL | 1083 | |
| Compressed gas cylinder (95 % O2/5 % CO2) | Linde | ||
| Gas permeable tubing | Neolab | 2-4440 | |
| Peristaltic pump | Ismatec | IP65 | |
| Scalpel | Feather | 320010 | |
| Forceps | Omnilab | 5171014 | |
| Conical flasks 1 L | Schott Duran | 2121654 | |
| Conical flasks 5 L | Schott Duran | 2121673 | |
| Beakers | Schott Duran | 2110654 | |
| 200 ml centrifuge tubes | Becton Dickinson | 352075 | |
| Crystallizing dish | Omnilab | 5144063 | |
| Curved irrigation cannulae with ball tips | Ernst Kratz GmbH | 1464LL/ 1465LL A+B/ 1472LL | |
| Micro vascular clamps | Ernst Kratz GmbH | ||
| Büchner funnel | Carl Roth | HT38.1 | |
| Nylon mesh 210 μm | Neolab | 4-1413 | |
| Nylon mesh 70 μm | Neolab | 4-1419 | |
| 0.22 μm sterile filters | Peske | 99505 | |
| 500 ml bottles | Schott Duran | 2180144 | |
| 1 L bottles | Schott Duran | 2180154 | |
| Hemocytometer | Peske | 06-0001 | |
| 1.5 ml tubes | Eppendorf | 0030 120,086 | |
| 50 ml conical tubes | BD Biosciences | 352070 | |
| Ice bucket | Neolab | 1508454 | |
| Sterile Pasteur pipettes | Brand | 747715 | |
| Motorised pipette filler (Pipette boy acu) | Integra | 155017 | |
| Refridgerated centrifuge | Eppendorf | 5810R | |
| Laminar flow | Kendro | Hera safe-KS9 | |
| Aspirator (Low-flow surgical suction pump) | Atmos | C361 | |
| Laboratory Gas Burner | Integra | Fire Boy eco | |
| Disposable laboratory coat | Paperlynen GmbH | MD0202414 | |
| Surgical mask with visor | Kimberly-Clark | 48247 | |
| Surgical hood | Barrier | 42072 | |
| Latex gloves | Semper Care | CE0321 | |
| Collagenase (Batch number NB 4G) | Serva | 17465 | |
| Calcium chloride dihydrate | Merck | 2382 | |
| EGTA | Sigma | E4378 | |
| Sodium chloride | Roth | 9265.2 | |
| Hepes | Roth | 9105.3 | |
| Potassium chloride | Serva | 26868 | |
| Albumin | Biomol | 01400-2 | |
| Glucose | Serva | 22700 | |
| Sodium hydrogen carbonate | Serva | 30180 | |
| 0.4% Trypan blue solution | Lonza | 17-942E | |
| Cold storage solution | Hepacult GmbH |
References
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Schneider, W. C., Potter, V. R. The assay of animal tissues for respiratory enzymes II. Succinic dehydrogenase and cytochrome oxidase. J. Biol. Chem. 149, 217-227 (1943).
- Aubin, P. M. G., Bucher, N. L. R. A Study of Binucleate Cell Counts in Resting and Regenerating Rat Liver Employing a Mechanical Method for the Separation of Liver Cells. Anat. Rec. 112, 797-809 (1952).
- Anderson, N. G. The Mass Isolation of Whole Cells from Rat Liver. Science. 117, 627-628 (1953).
- Jacob, S. T., Bhargava, P. M. New Method for Preparation of Liver Cell Suspensions. Experimental Cell Research. 27 (62), 453-467 (1962).
- Berry, M. N. Metabolic Properties of Cells Isolated from Adult Mouse Liver. Journal of Cell Biology. 15, 1-8 (1962).
- Laws, J. O., Stickland, L. H. Metabolism of Isolated Liver Cells. Nature. 178, 309-310 (1038).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. The Journal of Cell Biology. 43, 506-520 (1969).
- Seglen, P. O. Preparation of Rat-Liver Cells .3. Enzymatic Requirements for Tissue Dispersion. Experimental Cell Research. 82 (73), 391-398 (1973).
- Thasler, W. E., et al. Charitable State-Controlled Foundation Human Tissue and Cell Research: Ethic and Legal Aspects in the Supply of Surgically Removed Human Tissue For Research in the Academic and Commercial Sector in Germany. Cell and Tissue Banking. 4, 49-56 (2003).
- Queral, A. E., DeAngelo, A. B., Garrett, C. T. Effect of different collagenases on the isolation of viable hepatocytes from rat liver. Analytical Biochemistry. 138, 235-237 (1984).
- Smedsrod, B., Pertoft, H. Preparation of Pure Hepatocytes and Reticuloendothelial Cells in High-Yield from a Single-Rat Liver by Means of Percoll Centrifugation and Selective Adherence. J. Leukocyte Biol. 38, 213-230 (1985).
- Cantrell, E., Bresnick, E. Benzpyrene Hydroxylase-Activity in Isolated Parenchymal and Nonparenchymal Cells of Rat-Liver. Journal of Cell Biology. 52, 316-321 (1972).
- Weiskirchen, R., Gressner, A. M. Isolation and culture of hepatic stellate cells. Methods in Molecular Medicine. 117, 99-113 (2005).
- Baccarani, U., et al. Steatotic versus cirrhotic livers as a source for human hepatocyte isolation. Transplant P. 33, 664-665 (2001).
- Renz, J. F., et al. Utilization of extended donor criteria liver allografts maximizes donor use and patient access to liver transplantation. Annals of Surgery. 242, 556-563 (2005).
- Schemmer, P., et al. Extended donor criteria have no negative impact on early outcome after liver transplantation: a single-center multivariate analysis. Transplant Proc. 39, 529-534 (2007).
- Alexandre, E., et al. Influence of pre-, intra- and post-operative parameters of donor liver on the outcome of isolated human hepatocytes. Cell and Tissue Banking. 3, 223-233 (2002).
- Spotnitz, W. D., Burks, S. State-of-the-art review: Hemostats, sealants, and adhesives II: Update as well as how and when to use the components of the surgical toolbox. Clinical and applied thrombosis/hemostasis : official journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis. 16, 497-514 (2010).
- Spotnitz, W. D., Burks, S. Hemostats, sealants, and adhesives III: a new update as well as cost and regulatory considerations for components of the surgical toolbox. Transfusion. 52, 2243-2255 (2012).
- Toriumi, D. M., Raslan, W. F., Friedman, M., Tardy, M. E. Histotoxicity of cyanoacrylate tissue adhesives. A comparative study. Archives of otolaryngology--head & neck surgery. 116, 546-550 (1990).
- Vinters, H. V., Galil, K. A., Lundie, M. J., Kaufmann, J. C. The histotoxicity of cyanoacrylates. A selective review. Neuroradiology. 27, 279-291 (1985).
- Bhogal, R. H., et al. Isolation of primary human hepatocytes from normal and diseased liver tissue: a one hundred liver experience. PloS ONE. 6, e18222 (2011).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regul. Toxicol. Pharm. 32, 56-67 (2000).
- Koebe, H. G., Pahernik, S. A., Sproede, M., Thasler, W. E., Schildberg, F. W. Porcine hepatocytes from slaughterhouse organs. An unlimited resource for bioartificial liver devices. ASAIO Journal. 41, 189-193 (1995).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
Erratum
Formal Correction: Erratum: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
Posted by JoVE Editors on 7/01/2016. Citeable Link.
A correction was made to: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
The changes listed below have been made to Table 1.
1). In the recipe for Solution 2, the Final Concentration of EGTA has been changed from:
| EGTA | 0.1mM |
to:
| EGTA | 1mM |
2). In the recipes for Solution 3 and 4, the Final Concentration of Calcium chloride dihydrate has been changed from:
| Calcium chloride dihydrate | 0.5µM |
to:
| Calcium chloride dihydrate | 5mM |
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved