Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El aislamiento de hepatocitos humanos por una colagenasa perfusión Procedimiento de dos pasos
En este artículo
Erratum Notice
Resumen
Se describe un procedimiento de perfusión con colagenasa de dos etapas modificado para el aislamiento de hepatocitos humanos. Este método también se puede aplicar a otros hígados de mamíferos. Los hepatocitos aislados están disponibles con un alto rendimiento y la viabilidad, por lo que un modelo adecuado para la investigación científica en áreas como la regeneración hepática, farmacocinética y toxicología.
Resumen
El hígado, un órgano con una capacidad de regeneración excepcional, lleva a cabo una amplia gama de funciones, tales como la desintoxicación, el metabolismo y la homeostasis. Como tal, los hepatocitos son un modelo importante para una gran variedad de preguntas de investigación. En particular, el uso de hepatocitos humanos es especialmente importante en los campos de la farmacocinética, la toxicología, la regeneración del hígado y la investigación de translación. Por lo tanto, este método presenta una versión modificada de un procedimiento de perfusión con colagenasa de dos etapas para aislar los hepatocitos como se ha descrito por Seglen 1.
Anteriormente, los hepatocitos han sido aislados por métodos mecánicos. Sin embargo, los métodos enzimáticos han demostrado ser superior como hepatocitos conservan su integridad y función estructural después del aislamiento. Este método que aquí se presenta se adapta el método previamente diseñado para hígados de rata a pedazos de hígado humano y los resultados en un gran rendimiento de hepatocitos con una viabilidad de 77 ± 10%. La principaldiferencia en este procedimiento es el proceso de cannulization de los vasos sanguíneos. Además, el método descrito aquí también se puede aplicar a los hígados de otras especies con tamaños de hígado o de los vasos sanguíneos comparables.
Introducción
Una suspensión de células de hígado puede prepararse a partir del hígado por métodos mecánicos o enzimáticos. Los métodos mecánicos utilizados para preparar las células del hígado enteros incluyen obligar al hígado a través de una gasa 2, agitando un trozo de hígado con perlas de vidrio en un agitador de Kahn 3, utilizando homogeneizadores de vidrio con morteros sueltas 4,5 etc Con los años, los métodos mecánicos han caído en favor debido a los daños a las membranas celulares y la pérdida de función de los hepatocitos aislados 6,7. En consecuencia, el uso de un método enzimático es actualmente el principal método para el aislamiento de hepatocitos.
Aislamiento de hepatocitos utilizando un método enzimático mejoró notablemente cuando Berry y Friend 8 perfundidos colagenasa y hialuronidasa a través del hígado a través de la vena porta en ratas. Este proceso utiliza la perfusión de la vasculatura para permitir que las enzimas entran en estrecho contacto con la mayoría de las células, conduciendo aun aumento de 6 veces en el rendimiento de hepatocitos 8. Además, este método produjo células que conservan su integridad estructural, prácticamente sin transformación del retículo endoplásmico en vesículas aisladas y ningún daño mitocondrial 8.
Este método se modificó por Seglen 1, que fue pionero en un procedimiento de perfusión en dos etapas para el aislamiento de células del hígado. En este procedimiento, el hígado de la rata se perfunde con un tampón de Ca2 + libre seguido de la perfusión con un tampón de colagenasa que contiene Ca 2 + 1. La eliminación de Ca 2 + en la primera etapa ayuda a romper los desmosomas, mientras que se requiere la adición de Ca 2 + en el segundo paso para la actividad de la colagenasa óptimo 1,9.
Dado que el trabajo publicado descrito anteriormente se ha realizado en ratas, este artículo tiene como objetivo demostrar un procedimiento modificado que se puede utilizar para el aislamiento de hepatocitos con alta viabilidad de zumbidoun hígados. El uso de hepatocitos humanos sigue siendo importante para la investigación traslacional y para la validación de los experimentos con modelos animales. Los pedazos de hígado humano utilizados en este estudio fueron obtenidas con el consentimiento de la gobernanza a través de la Fundación Tejido Humano y la investigación con células, una fundación sin fines de lucro controladas por el Estado 10. Después de un patólogo elimina lo que se requiere para el diagnóstico, pedazos de hígado se recogieron a partir del tejido restante. El tejido seccionado por el patólogo era morfológicamente tejido sano obtenido a partir de los márgenes de resección después de la resección hepática.
Protocolo
1. Preparación de la perfusión y el aislamiento Soluciones
- Preparar las soluciones necesarias para la perfusión de la pieza hígado y el aislamiento de hepatocitos de acuerdo a la Tabla 1. Las soluciones pueden ser almacenadas a 4 ° C hasta su uso.
- Filtro estéril todas las soluciones utilizando un filtro de 0,22 micras.
- Todas las soluciones que entran en contacto con el hígado deben ser estériles.
2. Preparación de equipos y soluciones para infusión
- Equipamiento para la perfusión de la pieza de hígado debe establecerse como se muestra en la Figura 1.
- El baño de agua se establece a una temperatura apropiada, que es diferente en cada particular, experimental, de tal manera que las soluciones están a la temperatura de 37 ° C cuando llegan a la pieza de hígado. En este caso, el baño de agua se fijó en 41 ° C para calentar las soluciones 1, 2 y 3 y el condensador de vidrio con camisa. Solución 4 debe calentarse hasta37 ° C en un baño de agua separada para su uso para reducir la pérdida de actividad de la colagenasa.
- Poco antes de la perfusión del hígado, encienda el regulador del tanque de gas que contiene 95% O 2/5% CO 2 a gas del aparato de oxigenación (Figura 1E).
3. Perfusión del Hígado
- Un trozo de hígado con tanto cápsula intacta de Glisson posible e idealmente con superficie sólo 1 de corte se debe obtener de un patólogo para perfusión.
- Coloque esta pieza de hígado en el embudo Büchner que contiene un disco de filtro perforada (Figura 1B).
- El sistema de perfusión debe ser cebado con la solución 1.
- Con un caudal bajo, cánulas de irrigación curvo con punta de oliva se debe insertar en los vasos sanguíneos más grandes en la superficie de corte de la pieza de hígado. Cuando la sangre limpia las del hígado, el tejido se vuelve más claro en áreas con buena perfusión. El número de cánulas utilizado para diversos tamañosde hígados se muestra en la Figura 2A. El tamaño relativa elegida debe resultar en un ajuste cómodo que sostendrá la cánula en su lugar. Los vasos sanguíneos más pequeños se deben dejar abiertos para el tampón de perfusión para drenar fuera de la pieza de hígado.
- Aumentar la tasa de flujo en la bomba peristáltica a entre 110 a 460 ml / min dependiendo del tamaño del hígado (Figura 2B). Esto se traduce en una tasa media de flujo de 44 ± 16 ml / min por cánula (Figura 2C). La velocidad elegida depende de la pieza de hígado y debe resultar en un plumping ligero de la pieza de hígado. En algunos casos, puede ser necesario para sujetar cerró algunos de los vasos abiertos con pinzas vasculares micro para lograr el ligero voluminizador mencionado anteriormente. Una buena perfusión se puede observar cuando el pedazo de hígado es un color más claro en todo.
- Mantenga la pieza de hígado húmedo durante la perfusión cubriéndola con una gasa empapada en solución salina.
- Perfundir con 1 l de solución 1 para eliminar cualquier remaining sangre en la pieza de hígado.
- Cambiar el fluido de perfusión a la Solución 2 y perfundir durante 10 min.
- Cambie el líquido de perfusión a la Solución 3 y perfundir con 0,5 L.
- Cambiar el fluido de perfusión a la Solución 4, que contiene 0,1-0,15% de la colagenasa (Tabla 2).
- Para este paso, la perfusión debe llevarse a cabo de una manera de recirculación para 9-12 min o hasta que el hígado está lo suficientemente digerido; el tejido hepático debería aparecer a separarse ligeramente debajo de la cápsula de Glisson y sentir ablandado cuando se sondearon con el lado romo de un bisturí.
4. Aislamiento de los hepatocitos
- Apague la bomba peristáltica y extraiga las cánulas de la pieza de hígado.
- Colocar la pieza de hígado en un plato de cristalización que contiene 100-200 ml de solución 5.
- Retire la cápsula de Glisson con cuidado y suavidad sacudir las células. Si hay regiones que no están bien perfundidos, un bisturí se puede utilizar para cortar a travésestas regiones para liberar las células que contiene. Añadir más Solución 5 según sea necesario durante el proceso.
- Añadir más solución de 5 hasta que se alcanza un volumen final de 500 ml.
- Filtrar la suspensión celular dos veces; primero a través de una malla de 210 micras de nylon seguido de una malla de nylon 70 micras. A continuación, se vierte la suspensión celular en tubos de 200 ml de centrífuga.
- Centrifugar la suspensión celular a 72 g durante 5 min a 4 ° C. Aspirar el sobrenadante y resuspender el sedimento celular suavemente suavemente en 200 ml de solución 5.
- Repita el paso número lavado 4.6 tres veces. En el paso de centrifugación final, volver a suspender las células en una solución de almacenamiento en frío (ver la lista de materiales). Las células deben ser aproximadamente de 2-5 million hepatocitos por mililitro para la evaluación del rendimiento y la viabilidad mediante un ensayo de azul tripán exclusión basada en hemocitómetro.
- Para llevar a cabo un ensayo de exclusión con azul de tripano, añadir 0,1 ml de células diluidas adecuadamente (≈ 2-5 million / ml) a un tubo de microcentrífuga que contiene 0,5 ml de azul de tripano solutien (0,4% de azul de tripano disolvió en solución salina tamponada con fosfato (PBS)) y 0,4 ml de PBS. Después de mezclar la suspensión de células a fondo, cargar un hemocitómetro con la suspensión y examinar bajo un microscopio a un aumento de 100X. Al examen microscópico, las células muertas se tiñen azul, mientras que las células vivas aparecen sin teñir. Contar el número de células vivas y totales en cada una de las 1 mm 2 cuadrículas marcadas en el hemocitómetro. Viabilidad (%), el rendimiento de las células vivas (millones de hepatocitos por la solución de almacenamiento en frío ml (CSS) o millones de hepatocitos por g de hígado) puede calcularse utilizando las fórmulas siguientes.
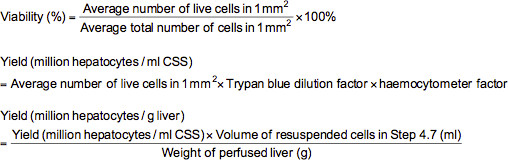
Nota: En este caso, el factor de dilución de azul de tripano es 10 y el factor de hemocitómetro es 10.000.
Resultados
Configuración de perfusión
El equipo necesario para la perfusión hepática debe establecerse de acuerdo con la figura 1.
Viabilidad y Rentabilidad de hepatocitos aislados de humanos
La viabilidad media de hepatocitos humanos aislados fue de 77 ± 10% y el rendimiento promedio de los hepatocitos fue de 13 ± 11 millones hepatocitos / g de hígado, con los valores expresados como medias ± desviación estándar. El n...
Discusión
Este protocolo da como resultado el aislamiento de hepatocitos humanos con una alta viabilidad y pureza. Con el fin de alcanzar estos resultados, es importante comenzar con una pieza adecuada de hígado. El trozo de hígado debe tener la cápsula de Glisson intacta en todas las superficies excepto por 1 superficie de corte. Otro factor importante es el lote particular de colagenasa utilizado, como diferentes lotes pueden dar lugar a marcadas diferencias en viabilidades de los hepatocitos después de la digestión 1...
Divulgaciones
La optimización de este protocolo fue parcialmente financiado por una subvención del Hepacult GmbH. Dr. Wolfgang Thasler es uno de los fundadores de Hepacult GmbH y sigue siendo uno de los miembros de la junta directiva de esta empresa. El empleo de Maresa Demmel es parcialmente por Hepacult. Maria Hauner es empleado por Hepacult GmbH. Hepacult es un spin-off de la firma biotecnológica de la Universidad, que ofrece los hepatocitos humanos con el consentimiento y el libre acceso con fines de investigación.
Agradecimientos
Este trabajo ha sido posible gracias a la Fundación de tejidos y células humanas de Investigación, lo que hace que los tejidos humanos disponibles para la investigación. Se recibió apoyo financiero para este trabajo por parte del Ministerio Federal de Educación e Investigación (nombre subvención: Virtual Network hígado, el número de concesión: 0.315.759) y Hepacult GmbH. También damos las gracias a los asistentes técnicos del Banco de tejidos Großhadern hospital para la recogida de las muestras de hígado y los asistentes técnicos del Fondo para el Core aislamiento de células para llevar a cabo la perfusión del hígado y el aislamiento de hepatocitos. En particular, nos gustaría dar las gracias a Natalja Löwen para demostrar este procedimiento en el video. Por último, nos gustaría dar las gracias a Natalja Löwen y Edeltraud Hanesch para la creación de las ilustraciones de la figura 1 y las figuras en el resumen esquemático del video.
Materiales
| Name | Company | Catalog Number | Comments |
| Bubble trap | Gaßner Glastechnik | ||
| Glass jacketed condenser | Gaßner Glastechnik | ||
| 41 °C Water bath | Julabo | 35723-H24/EG | |
| 37 °C Water bath | GFL | 1083 | |
| Compressed gas cylinder (95 % O2/5 % CO2) | Linde | ||
| Gas permeable tubing | Neolab | 2-4440 | |
| Peristaltic pump | Ismatec | IP65 | |
| Scalpel | Feather | 320010 | |
| Forceps | Omnilab | 5171014 | |
| Conical flasks 1 L | Schott Duran | 2121654 | |
| Conical flasks 5 L | Schott Duran | 2121673 | |
| Beakers | Schott Duran | 2110654 | |
| 200 ml centrifuge tubes | Becton Dickinson | 352075 | |
| Crystallizing dish | Omnilab | 5144063 | |
| Curved irrigation cannulae with ball tips | Ernst Kratz GmbH | 1464LL/ 1465LL A+B/ 1472LL | |
| Micro vascular clamps | Ernst Kratz GmbH | ||
| Büchner funnel | Carl Roth | HT38.1 | |
| Nylon mesh 210 μm | Neolab | 4-1413 | |
| Nylon mesh 70 μm | Neolab | 4-1419 | |
| 0.22 μm sterile filters | Peske | 99505 | |
| 500 ml bottles | Schott Duran | 2180144 | |
| 1 L bottles | Schott Duran | 2180154 | |
| Hemocytometer | Peske | 06-0001 | |
| 1.5 ml tubes | Eppendorf | 0030 120,086 | |
| 50 ml conical tubes | BD Biosciences | 352070 | |
| Ice bucket | Neolab | 1508454 | |
| Sterile Pasteur pipettes | Brand | 747715 | |
| Motorised pipette filler (Pipette boy acu) | Integra | 155017 | |
| Refridgerated centrifuge | Eppendorf | 5810R | |
| Laminar flow | Kendro | Hera safe-KS9 | |
| Aspirator (Low-flow surgical suction pump) | Atmos | C361 | |
| Laboratory Gas Burner | Integra | Fire Boy eco | |
| Disposable laboratory coat | Paperlynen GmbH | MD0202414 | |
| Surgical mask with visor | Kimberly-Clark | 48247 | |
| Surgical hood | Barrier | 42072 | |
| Latex gloves | Semper Care | CE0321 | |
| Collagenase (Batch number NB 4G) | Serva | 17465 | |
| Calcium chloride dihydrate | Merck | 2382 | |
| EGTA | Sigma | E4378 | |
| Sodium chloride | Roth | 9265.2 | |
| Hepes | Roth | 9105.3 | |
| Potassium chloride | Serva | 26868 | |
| Albumin | Biomol | 01400-2 | |
| Glucose | Serva | 22700 | |
| Sodium hydrogen carbonate | Serva | 30180 | |
| 0.4% Trypan blue solution | Lonza | 17-942E | |
| Cold storage solution | Hepacult GmbH |
Referencias
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Schneider, W. C., Potter, V. R. The assay of animal tissues for respiratory enzymes II. Succinic dehydrogenase and cytochrome oxidase. J. Biol. Chem. 149, 217-227 (1943).
- Aubin, P. M. G., Bucher, N. L. R. A Study of Binucleate Cell Counts in Resting and Regenerating Rat Liver Employing a Mechanical Method for the Separation of Liver Cells. Anat. Rec. 112, 797-809 (1952).
- Anderson, N. G. The Mass Isolation of Whole Cells from Rat Liver. Science. 117, 627-628 (1953).
- Jacob, S. T., Bhargava, P. M. New Method for Preparation of Liver Cell Suspensions. Experimental Cell Research. 27 (62), 453-467 (1962).
- Berry, M. N. Metabolic Properties of Cells Isolated from Adult Mouse Liver. Journal of Cell Biology. 15, 1-8 (1962).
- Laws, J. O., Stickland, L. H. Metabolism of Isolated Liver Cells. Nature. 178, 309-310 (1038).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. The Journal of Cell Biology. 43, 506-520 (1969).
- Seglen, P. O. Preparation of Rat-Liver Cells .3. Enzymatic Requirements for Tissue Dispersion. Experimental Cell Research. 82 (73), 391-398 (1973).
- Thasler, W. E., et al. Charitable State-Controlled Foundation Human Tissue and Cell Research: Ethic and Legal Aspects in the Supply of Surgically Removed Human Tissue For Research in the Academic and Commercial Sector in Germany. Cell and Tissue Banking. 4, 49-56 (2003).
- Queral, A. E., DeAngelo, A. B., Garrett, C. T. Effect of different collagenases on the isolation of viable hepatocytes from rat liver. Analytical Biochemistry. 138, 235-237 (1984).
- Smedsrod, B., Pertoft, H. Preparation of Pure Hepatocytes and Reticuloendothelial Cells in High-Yield from a Single-Rat Liver by Means of Percoll Centrifugation and Selective Adherence. J. Leukocyte Biol. 38, 213-230 (1985).
- Cantrell, E., Bresnick, E. Benzpyrene Hydroxylase-Activity in Isolated Parenchymal and Nonparenchymal Cells of Rat-Liver. Journal of Cell Biology. 52, 316-321 (1972).
- Weiskirchen, R., Gressner, A. M. Isolation and culture of hepatic stellate cells. Methods in Molecular Medicine. 117, 99-113 (2005).
- Baccarani, U., et al. Steatotic versus cirrhotic livers as a source for human hepatocyte isolation. Transplant P. 33, 664-665 (2001).
- Renz, J. F., et al. Utilization of extended donor criteria liver allografts maximizes donor use and patient access to liver transplantation. Annals of Surgery. 242, 556-563 (2005).
- Schemmer, P., et al. Extended donor criteria have no negative impact on early outcome after liver transplantation: a single-center multivariate analysis. Transplant Proc. 39, 529-534 (2007).
- Alexandre, E., et al. Influence of pre-, intra- and post-operative parameters of donor liver on the outcome of isolated human hepatocytes. Cell and Tissue Banking. 3, 223-233 (2002).
- Spotnitz, W. D., Burks, S. State-of-the-art review: Hemostats, sealants, and adhesives II: Update as well as how and when to use the components of the surgical toolbox. Clinical and applied thrombosis/hemostasis : official journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis. 16, 497-514 (2010).
- Spotnitz, W. D., Burks, S. Hemostats, sealants, and adhesives III: a new update as well as cost and regulatory considerations for components of the surgical toolbox. Transfusion. 52, 2243-2255 (2012).
- Toriumi, D. M., Raslan, W. F., Friedman, M., Tardy, M. E. Histotoxicity of cyanoacrylate tissue adhesives. A comparative study. Archives of otolaryngology--head & neck surgery. 116, 546-550 (1990).
- Vinters, H. V., Galil, K. A., Lundie, M. J., Kaufmann, J. C. The histotoxicity of cyanoacrylates. A selective review. Neuroradiology. 27, 279-291 (1985).
- Bhogal, R. H., et al. Isolation of primary human hepatocytes from normal and diseased liver tissue: a one hundred liver experience. PloS ONE. 6, e18222 (2011).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regul. Toxicol. Pharm. 32, 56-67 (2000).
- Koebe, H. G., Pahernik, S. A., Sproede, M., Thasler, W. E., Schildberg, F. W. Porcine hepatocytes from slaughterhouse organs. An unlimited resource for bioartificial liver devices. ASAIO Journal. 41, 189-193 (1995).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
Erratum
Formal Correction: Erratum: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
Posted by JoVE Editors on 7/01/2016. Citeable Link.
A correction was made to: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
The changes listed below have been made to Table 1.
1). In the recipe for Solution 2, the Final Concentration of EGTA has been changed from:
| EGTA | 0.1mM |
to:
| EGTA | 1mM |
2). In the recipes for Solution 3 and 4, the Final Concentration of Calcium chloride dihydrate has been changed from:
| Calcium chloride dihydrate | 0.5µM |
to:
| Calcium chloride dihydrate | 5mM |
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados