É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de hepatócitos humanos por duas etapas Collagenase Perfusão Procedimento
Neste Artigo
Erratum Notice
Resumo
Um procedimento de duas etapas de perfusão de colagenase modificado para isolamento de hepatócitos humanos é descrita. Este método também pode ser aplicado a outros fígados de mamíferos. Os hepatócitos isolados estão disponíveis em alto rendimento e viabilidade, tornando-os um modelo adequado para a investigação científica em áreas como a regeneração do fígado, farmacocinética e toxicologia.
Resumo
O fígado, um órgão com capacidade de regeneração excepcional, realiza uma ampla gama de funções, como a desintoxicação, metabolismo e homeostase. Como tal, os hepatócitos são um modelo importante para uma grande variedade de questões de pesquisa. Em particular, o uso de hepatócitos humanos é especialmente importante nas áreas de farmacocinética, a toxicologia, a regeneração do fígado e investigação de translação. Assim, este método apresenta uma versão modificada de um procedimento de perfusão com colagenase em dois passos para isolar hepatócitos como descrito por Seglen 1.
Anteriormente, os hepatócitos foram isolados por métodos mecânicos. No entanto, os métodos enzimáticos têm sido mostrados como sendo superior como hepatócitos mantêm a sua integridade estrutural e a função, depois do isolamento. Este método aqui apresentado adapta o método concebido anteriormente para os fígados de ratos aos pedaços de fígado humano e resulta num grande rendimento de hepatócitos com uma viabilidade de 77 ± 10%. A principaldiferença neste processo é o processo de canulação dos vasos sanguíneos. Além disso, o método aqui descrito também pode ser aplicado a partir de fígados de outras espécies com tamanhos do fígado ou dos vasos sanguíneos comparáveis.
Introdução
A suspensão de células de fígado pode ser preparado a partir do fígado por meio de métodos mecânicos ou enzimáticos. Os métodos mecânicos usados para preparar as células do fígado integrais incluem forçando o fígado através de gaze 2, agitando um pedaço de fígado com contas de vidro em uma coqueteleira Kahn 3, utilizando homogeneizadores de vidro com pilões soltas 4,5 etc Ao longo dos anos, os métodos mecânicos caíram fora do favorecem, devido à lesão das membranas das células e a perda da função dos hepatócitos isolados 6,7. Por conseguinte, a utilização de um método enzimático é actualmente o principal método para o isolamento de hepatócitos.
Isolamento de hepatócitos, utilizando um método enzimático aumentou quando Berry e amigo 8 perfusão colagenase e hialuronidase através do fígado através da veia porta em ratos. Este processo de perfusão utilizado vasculatura para permitir que os enzimas a entrar em contacto estreito com a maioria das células, o que leva aum aumento de 6 vezes no rendimento de hepatócitos 8. Além disso, este método produziu células que retinham a sua integridade estrutural, com virtualmente nenhuma transformação do retículo endoplasmático em vesículas isoladas e sem dano mitocondrial 8.
Este método foi modificado por Seglen 1, que foi pioneiro de um procedimento de perfusão de duas etapas para o isolamento das células do fígado. Neste procedimento, o fígado de rato é perfundido com uma Ca2 + livre tampão seguido por perfusão com um tampão de colagenase contendo Ca 2 + 1. A remoção de Ca 2 + no primeiro passo ajuda a romper desmossomas, enquanto a adição de Ca 2 + no segundo passo é necessário para a actividade da colagenase ideal 1,9.
Dado que os trabalhos publicados acima descrito foi realizado em ratos, este artigo destina-se a demonstrar um procedimento modificado, que pode ser usado para isolamento de hepatócitos com alta viabilidade de zumbidoum fígado. O uso de hepatócitos humanos continua a ser importante para a investigação de translação e para a validação de experimentos com modelos animais. Os pedaços de fígado humano utilizados neste estudo foram adquiridos com o consentimento para a governança por meio da Fundação de Pesquisa de Tecidos Humanos e celular, uma fundação sem fins lucrativos controlada pelo Estado 10. Depois de um patologista removido o que era necessário para o diagnóstico, pedaços de fígado foram coletadas a partir do tecido remanescente. O tecido seccionado pelo patologista foi morfologicamente tecido saudável obtida a partir de margens de ressecção após a ressecção hepática.
Protocolo
1. Preparação da perfusão e isolamento Solutions
- Preparar as soluções necessárias para a perfusão do pedaço de fígado e o isolamento de hepatócitos de acordo com a Tabela 1. As soluções podem ser armazenadas a 4 ° C até à sua utilização.
- Filtrar em condições estéreis todas as soluções que utilizam um filtro de 0,22 um.
- Todas as soluções que entram em contato com o fígado deve ser estéril.
2. Preparação de Perfusão Equipamentos e Soluções
- O equipamento para a perfusão do pedaço de fígado deve ser configurado como mostrado na Figura 1.
- O banho de água deve ser ajustado a uma temperatura apropriada, que é diferente em cada um determinado conjunto experimental, de modo a que as soluções são a uma temperatura de 37 ° C quando atingem o pedaço de fígado. Neste caso, o banho de água é ajustado a 41 ° C para aquecer as soluções 1, 2 e 3 e do condensador de vidro encamisado. Solução 4 deve ser aquecido até37 ° C em um banho de água para uso separado para reduzir a perda da actividade da colagenase.
- Pouco antes da perfusão hepática, ligue o regulador do tanque de gás contendo 95% de O 2/5% de CO2 para abastecer o aparelho de oxigenação (Figura 1E).
3. Perfusão do fígado
- Um pedaço do fígado com tanto intacto cápsula de Glisson quanto possível e de preferência com superfície de apenas 1 corte deve ser obtida a partir de um patologista para perfusão.
- Colocar este pedaço de fígado num funil de Buchner que contém um disco de filtro perfurado (Figura 1B).
- O sistema de perfusão que devem ser iniciadas com a solução 1.
- Com uma baixa taxa de fluxo, as cânulas de irrigação curvo com pontas de azeitona deve ser inserido dentro de vasos sanguíneos maiores na superfície de corte do pedaço de fígado. Como o sangue libera fora do fígado, o tecido se torna mais leve em áreas com boa perfusão. O número de cânulas usadas para vários tamanhosde fígados é mostrado na Figura 2A. O tamanho calibre escolhido deve resultar em um ajuste confortável que irá realizar as cânulas no lugar. Os vasos sanguíneos mais pequenos devem ser deixados em aberto para o tampão de perfusão para drenar para fora do pedaço de fígado.
- Aumentar a taxa de fluxo na bomba peristáltica, a entre 110-460 ml / min, dependendo do tamanho do fígado (Figura 2B). Isto resulta numa velocidade de fluxo média de 44 ± 16 ml / min por uma cânula (Figura 2C). A velocidade escolhida depende do pedaço de fígado e deve resultar num ligeiro plumping do pedaço de fígado. Em alguns casos, pode ser necessário a braçadeira fechada uma parte dos vasos abertos com grampos vasculares micro para atingir o ligeiro plumping mencionado acima. Uma boa perfusão pode ser observada quando o pedaço de fígado é uma cor mais clara em toda.
- Mantenha o pedaço de fígado úmido durante a perfusão, cobrindo-o com um pedaço de gaze embebida em solução salina.
- Perfundir com 1 L de Solução 1 para expulsar qualquer remaining sangue no pedaço de fígado.
- Mude o líquido de perfusão para a Solução 2 e perfuse por 10 min.
- Mude o líquido de perfusão para a Solução 3 e aspergir com 0,5 L.
- Alterar o fluido de perfusão à solução 4, que contém de 0,1-0,15% de colagenase (Tabela 2).
- Para esta etapa, a perfusão deve ser levada a cabo de uma forma de recirculação para 9-12 minutos ou até que o fígado está suficientemente digerida, o tecido de fígado deveriam aparecer a separar ligeiramente sob a cápsula de Glisson e sentir amolecida, quando sondada com o lado sem corte de um bisturi.
4. O isolamento de hepatócitos
- Desligue a bomba peristáltica e remover cânulas do pedaço de fígado.
- Coloque o pedaço de fígado em um prato de cristalização, contendo 100-200 mL de solução 5.
- Retire a cápsula de Glisson com cuidado e agite para fora das células. Se há regiões que não são bem perfundidos, um bisturi pode ser utilizada para cortar atravésessas regiões para liberar as células contidas. Adicionar mais Solution 5 conforme for necessário durante o processo.
- Adicionar mais 5 solução até um volume final de 500 ml foi atingido.
- Filtrar a suspensão de célula duas vezes: em primeiro lugar através de uma malha de nylon de 210 mM seguido por uma malha de nylon de 70 ^ m. Em seguida, despeje a suspensão de células em tubos de 200 ml de centrífuga.
- Centrifugar a suspensão de células a 72 g durante 5 min a 4 ° C. Aspirar o sobrenadante e ressuspender o sedimento de células suavemente suavemente em 200 ml de solução 5.
- Repita o passo número lavagem 4,6 três vezes. Na etapa final centrífuga, Ressuspender as células em solução de armazenamento a frio (ver lista de materiais). As células devem ser de aproximadamente 2-5.000.000 hepatócitos por mililitro de avaliação de rendimento e viabilidade através de um teste de exclusão de azul de tripan baseada em hemocitômetro.
- Para realizar um ensaio de exclusão com azul de tripano, adicionar 0,1 ml de células diluídas de forma apropriada (≈ 2-5.000.000 / ml) para um tubo de microcentrífuga contendo 0,5 ml de solução que tripano azulem (0,4% de azul de tripano dissolvido em solução salina tamponada com fosfato (PBS)), e 0,4 ml de PBS. Após a mistura da suspensão de células cuidadosamente, carregar um hemocitómetro com a suspensão e examinar ao microscópio a uma ampliação de 100X. Na microscopia, as células mortas será manchada azul, enquanto as células vivas aparecem sem mácula. Contar o número de células vivas e total em cada um dos 1 milímetro 2 grades marcadas no hemocitômetro. Viabilidade (%), rendimento de células vivas (milhões de hepatócitos por ml de solução de armazenamento a frio (CSS) ou milhões de hepatócitos por g de fígado) pode ser calculado através das fórmulas abaixo.
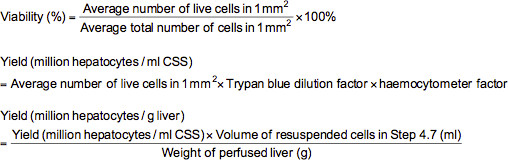
Nota: Neste caso, o factor de diluição do azul de tripano é 10 e o factor de hemocitómetro é 10.000.
Resultados
Configuração de Perfusão
Os equipamentos necessários para a perfusão hepática deve ser configurado de acordo com a Figura 1.
Viabilidade e Rendimento de isolado hepatócitos humanos
A viabilidade média de hepatócitos humanos isolados foi de 77 ± 10% eo rendimento médio dos hepatócitos foi de 13 ± 11 milhões de hepatócitos / g de fígado, com valores expressos em média ± desvio padrão. O número de isolament...
Discussão
Este protocolo resulta no isolamento de hepatócitos humanos com alta viabilidade e pureza. Para atingir estes resultados, é importante para começar com um pedaço de fígado adequado. O pedaço de fígado deve ter cápsula intacta de Glisson em todas as superfícies, exceto para 1 superfície de corte. Outro fator importante é o lote especial de colagenase utilizada, como lotes diferentes podem resultar em diferenças marcantes em viabilidades de hepatócitos após digestão 11. Portanto, diferentes lotes...
Divulgações
Otimização deste protocolo foi parcialmente financiado por uma concessão do Hepacult GmbH. Dr. Wolfgang Thasler é um dos fundadores da Hepacult GmbH e continua sendo um dos membros do conselho nesta empresa. O emprego de Maresa Demmel é parcialmente por Hepacult. Maria Hauner é empregado por Hepacult GmbH. Hepacult é um spin-off empresa biotecnológica da Universidade, que oferece hepatócitos humanos com o consentimento e acesso aberto para fins de pesquisa.
Agradecimentos
Este trabalho foi possível graças a Fundação de Pesquisa de células e tecidos humanos, o que torna tecidos humanos disponíveis para a pesquisa. O apoio financeiro para este trabalho foi recebido do Ministério Federal de Educação e Pesquisa (nome concessão: Fígado de Rede Virtual, número de concessão: 0315759) e Hepacult GmbH. Nossos agradecimentos vão também para os assistentes técnicos do Banco de tecidos Grosshadern Hospital para a recolha das amostras do fígado e dos assistentes técnicos do Núcleo instalação de isolamento celular para a realização da perfusão hepática e isolamento dos hepatócitos. Em particular, gostaríamos de agradecer Natalja Löwen para demonstrar este procedimento no vídeo. Finalmente, gostaríamos de agradecer Natalja Löwen e Edeltraud Hanesch para criar as ilustrações para a Figura 1 e as figuras na visão esquemática do vídeo.
Materiais
| Name | Company | Catalog Number | Comments |
| Bubble trap | Gaßner Glastechnik | ||
| Glass jacketed condenser | Gaßner Glastechnik | ||
| 41 °C Water bath | Julabo | 35723-H24/EG | |
| 37 °C Water bath | GFL | 1083 | |
| Compressed gas cylinder (95 % O2/5 % CO2) | Linde | ||
| Gas permeable tubing | Neolab | 2-4440 | |
| Peristaltic pump | Ismatec | IP65 | |
| Scalpel | Feather | 320010 | |
| Forceps | Omnilab | 5171014 | |
| Conical flasks 1 L | Schott Duran | 2121654 | |
| Conical flasks 5 L | Schott Duran | 2121673 | |
| Beakers | Schott Duran | 2110654 | |
| 200 ml centrifuge tubes | Becton Dickinson | 352075 | |
| Crystallizing dish | Omnilab | 5144063 | |
| Curved irrigation cannulae with ball tips | Ernst Kratz GmbH | 1464LL/ 1465LL A+B/ 1472LL | |
| Micro vascular clamps | Ernst Kratz GmbH | ||
| Büchner funnel | Carl Roth | HT38.1 | |
| Nylon mesh 210 μm | Neolab | 4-1413 | |
| Nylon mesh 70 μm | Neolab | 4-1419 | |
| 0.22 μm sterile filters | Peske | 99505 | |
| 500 ml bottles | Schott Duran | 2180144 | |
| 1 L bottles | Schott Duran | 2180154 | |
| Hemocytometer | Peske | 06-0001 | |
| 1.5 ml tubes | Eppendorf | 0030 120,086 | |
| 50 ml conical tubes | BD Biosciences | 352070 | |
| Ice bucket | Neolab | 1508454 | |
| Sterile Pasteur pipettes | Brand | 747715 | |
| Motorised pipette filler (Pipette boy acu) | Integra | 155017 | |
| Refridgerated centrifuge | Eppendorf | 5810R | |
| Laminar flow | Kendro | Hera safe-KS9 | |
| Aspirator (Low-flow surgical suction pump) | Atmos | C361 | |
| Laboratory Gas Burner | Integra | Fire Boy eco | |
| Disposable laboratory coat | Paperlynen GmbH | MD0202414 | |
| Surgical mask with visor | Kimberly-Clark | 48247 | |
| Surgical hood | Barrier | 42072 | |
| Latex gloves | Semper Care | CE0321 | |
| Collagenase (Batch number NB 4G) | Serva | 17465 | |
| Calcium chloride dihydrate | Merck | 2382 | |
| EGTA | Sigma | E4378 | |
| Sodium chloride | Roth | 9265.2 | |
| Hepes | Roth | 9105.3 | |
| Potassium chloride | Serva | 26868 | |
| Albumin | Biomol | 01400-2 | |
| Glucose | Serva | 22700 | |
| Sodium hydrogen carbonate | Serva | 30180 | |
| 0.4% Trypan blue solution | Lonza | 17-942E | |
| Cold storage solution | Hepacult GmbH |
Referências
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Schneider, W. C., Potter, V. R. The assay of animal tissues for respiratory enzymes II. Succinic dehydrogenase and cytochrome oxidase. J. Biol. Chem. 149, 217-227 (1943).
- Aubin, P. M. G., Bucher, N. L. R. A Study of Binucleate Cell Counts in Resting and Regenerating Rat Liver Employing a Mechanical Method for the Separation of Liver Cells. Anat. Rec. 112, 797-809 (1952).
- Anderson, N. G. The Mass Isolation of Whole Cells from Rat Liver. Science. 117, 627-628 (1953).
- Jacob, S. T., Bhargava, P. M. New Method for Preparation of Liver Cell Suspensions. Experimental Cell Research. 27 (62), 453-467 (1962).
- Berry, M. N. Metabolic Properties of Cells Isolated from Adult Mouse Liver. Journal of Cell Biology. 15, 1-8 (1962).
- Laws, J. O., Stickland, L. H. Metabolism of Isolated Liver Cells. Nature. 178, 309-310 (1038).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. The Journal of Cell Biology. 43, 506-520 (1969).
- Seglen, P. O. Preparation of Rat-Liver Cells .3. Enzymatic Requirements for Tissue Dispersion. Experimental Cell Research. 82 (73), 391-398 (1973).
- Thasler, W. E., et al. Charitable State-Controlled Foundation Human Tissue and Cell Research: Ethic and Legal Aspects in the Supply of Surgically Removed Human Tissue For Research in the Academic and Commercial Sector in Germany. Cell and Tissue Banking. 4, 49-56 (2003).
- Queral, A. E., DeAngelo, A. B., Garrett, C. T. Effect of different collagenases on the isolation of viable hepatocytes from rat liver. Analytical Biochemistry. 138, 235-237 (1984).
- Smedsrod, B., Pertoft, H. Preparation of Pure Hepatocytes and Reticuloendothelial Cells in High-Yield from a Single-Rat Liver by Means of Percoll Centrifugation and Selective Adherence. J. Leukocyte Biol. 38, 213-230 (1985).
- Cantrell, E., Bresnick, E. Benzpyrene Hydroxylase-Activity in Isolated Parenchymal and Nonparenchymal Cells of Rat-Liver. Journal of Cell Biology. 52, 316-321 (1972).
- Weiskirchen, R., Gressner, A. M. Isolation and culture of hepatic stellate cells. Methods in Molecular Medicine. 117, 99-113 (2005).
- Baccarani, U., et al. Steatotic versus cirrhotic livers as a source for human hepatocyte isolation. Transplant P. 33, 664-665 (2001).
- Renz, J. F., et al. Utilization of extended donor criteria liver allografts maximizes donor use and patient access to liver transplantation. Annals of Surgery. 242, 556-563 (2005).
- Schemmer, P., et al. Extended donor criteria have no negative impact on early outcome after liver transplantation: a single-center multivariate analysis. Transplant Proc. 39, 529-534 (2007).
- Alexandre, E., et al. Influence of pre-, intra- and post-operative parameters of donor liver on the outcome of isolated human hepatocytes. Cell and Tissue Banking. 3, 223-233 (2002).
- Spotnitz, W. D., Burks, S. State-of-the-art review: Hemostats, sealants, and adhesives II: Update as well as how and when to use the components of the surgical toolbox. Clinical and applied thrombosis/hemostasis : official journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis. 16, 497-514 (2010).
- Spotnitz, W. D., Burks, S. Hemostats, sealants, and adhesives III: a new update as well as cost and regulatory considerations for components of the surgical toolbox. Transfusion. 52, 2243-2255 (2012).
- Toriumi, D. M., Raslan, W. F., Friedman, M., Tardy, M. E. Histotoxicity of cyanoacrylate tissue adhesives. A comparative study. Archives of otolaryngology--head & neck surgery. 116, 546-550 (1990).
- Vinters, H. V., Galil, K. A., Lundie, M. J., Kaufmann, J. C. The histotoxicity of cyanoacrylates. A selective review. Neuroradiology. 27, 279-291 (1985).
- Bhogal, R. H., et al. Isolation of primary human hepatocytes from normal and diseased liver tissue: a one hundred liver experience. PloS ONE. 6, e18222 (2011).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regul. Toxicol. Pharm. 32, 56-67 (2000).
- Koebe, H. G., Pahernik, S. A., Sproede, M., Thasler, W. E., Schildberg, F. W. Porcine hepatocytes from slaughterhouse organs. An unlimited resource for bioartificial liver devices. ASAIO Journal. 41, 189-193 (1995).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
Erratum
Formal Correction: Erratum: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
Posted by JoVE Editors on 7/01/2016. Citeable Link.
A correction was made to: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
The changes listed below have been made to Table 1.
1). In the recipe for Solution 2, the Final Concentration of EGTA has been changed from:
| EGTA | 0.1mM |
to:
| EGTA | 1mM |
2). In the recipes for Solution 3 and 4, the Final Concentration of Calcium chloride dihydrate has been changed from:
| Calcium chloride dihydrate | 0.5µM |
to:
| Calcium chloride dihydrate | 5mM |
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados