このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
二段階コラゲナーゼ灌流手順によって、ヒト肝細胞の分離
Erratum Notice
要約
ヒト肝細胞の単離のための修飾された二工程コラゲナーゼ灌流手順が記載されている。この方法はまた、他の哺乳動物の肝臓にも適用することができる。単離された肝細胞は、それらのような肝臓の再生、薬物動態および毒物学などの分野での科学的研究に適したモデル作り、高い収率および生存度で提供されています。
要約
肝臓、例外的な再生能力を有する器官は、解毒、代謝及び恒常性などの機能の広い範囲を実行する。このように、肝細胞は、研究課題の多種多様のための重要なモデルである。特に、ヒト肝細胞の使用は、薬物動態、毒性、肝再生および翻訳研究の分野で特に重要である。したがって、この方法は、Seglen 1によって記載されるように肝細胞を単離するために2段階コラゲナーゼ灌流手順の修正版を提示する。
以前に、肝細胞は、機械的な方法によって単離されている。しかし、酵素法は、肝細胞が分離した後にその構造的完全性と機能を保持するように優れていることが示されている。ここで紹介するこの方法は、77±10%の生存と肝細胞の大規模な収率でヒトの肝臓片と結果に対するラットの肝臓のために以前に設計された方法を適応させる。メインこの手順の違いは、血管のカニューレ挿入するプロセスである。また、ここで説明する方法はまた、匹敵する肝臓または血管サイズを有する他の種由来の肝臓に適用することができる。
概要
肝細胞懸濁液を機械的または酵素的方法によって肝臓から調製することができる。全体の肝細胞を調製するために使用される機械的な方法は、チーズクロス2を介して肝臓を強制カーンシェーカー3におけるガラスビーズの肝臓片を振盪、長年にわたりなど緩い乳棒4,5有するガラスホモジナイザーを用いて、機械的な方法は、外に落ちて含むにより、細胞膜の損傷と単離肝細胞6,7の機能喪失に有利に働く。したがって、酵素的方法の使用は、現在、肝細胞の単離のための主要な方法である。
ベリーと友達8は 、ラットにおける門脈経由で肝臓をコラゲナーゼおよびヒアルロニダーゼを灌流したとき、酵素法を用いて肝細胞の単離は大きく改善されました。この灌流過程を導く、酵素は細胞の大部分に密着できるようにするために血管系を利用した肝細胞8の収量の6倍の増加。さらに、この方法は、事実上孤立小胞への小胞体の変換なしなしミトコンドリア損傷8で、その構造的完全性を保持された細胞が得られた。
この方法は、肝細胞の単離のために二段階灌流手順を開拓Seglen 1によって改変した。この手順では、ラットの肝臓のCa 2 +を含有する1コラゲナーゼ緩衝液で灌流、続いてのCa 2 +を含まない緩衝液で灌流される。第二工程におけるCa 2 +の添加は、最適なコラゲナーゼ活性1,9に必要とされている間第一工程におけるCa 2 +の除去は、デスモソームを破壊するのに役立つ。
上記の発表された研究は、ラットで行われたことを考えると、この記事では、ハムから高い生存して肝細胞の単離に使用することができます変更された手順を実証することを目的と肝臓。ヒト肝細胞の使用は、トランスレーショナル研究のための動物モデルを用いた実験を検証するための重要なままです。本研究で用いたヒト肝臓片を、ヒト組織および細胞研究基金、国営の非営利財団10を通じてガバナンスの同意を得て取得した。病理学者は、診断のために必要であったものを除去した後、肝臓片を残りの組織から採取した。病理学者によって区画さ組織は、形態学的に肝切除後の切除縁から得た健康な組織だった。
プロトコル
1。灌流および分離された溶液の調製
- 肝臓片と、表1によると、肝細胞の単離灌流のために必要なソリューションを準備します。溶液は使用時まで4℃で保存することができる。
- 無菌フィルター0.22μmのフィルターを使用して、すべてのソリューションを提供しています。
- 肝臓と接触するすべてのソリューションは無菌でなければならない。
2。灌流機器とソリューションの作成
- 図1に示すように、肝臓片の灌流のための機器は、セットアップする必要があります。
- 水浴は、それらが肝臓片に到達したときに溶液が37℃の温度であるように、各特定の実験設定で異なる適切な温度に設定されるべきである。この場合には、水浴を溶液1,2および3とジャケット付きガラス凝縮器を温めるために41°Cに設定されている。溶液4に温めべきであるコラゲナーゼ活性の損失を低減するために使用するための別個の水浴中で37℃で。
- まもなく肝灌流の前に、酸素化装置( 図1E)をガスに95%のO 2/5%CO 2を含むガスのタンクのレギュレータをオンにします。
3。肝臓の灌流
- 肝臓ピースできるだけ多くそのままグリソン鞘と、理想的には唯一の1切断面には、灌流のための病理学者から入手する必要があります。
- 有孔フィルターディスク( 図1B)が含まれてブフナー漏斗上、この肝臓ピースを置きます。
- 灌流システムは、ソリューション1で下塗りする必要があります。
- 低流量で、オリーブ先端を有する湾曲灌注カニューレは、肝臓片の切断面に大きな血管内に挿入されるべきである。血液が肝臓から洗い流すように、組織はよい潅流地域で軽くなる。様々なサイズのために使用さカニューレの数肝臓の図2Aに示されている。選択されたゲージのサイズが所定の位置にカニューレを保持するぴったりフィットをもたらすべきである。小さい血管が肝臓片の外に排出する灌流液のためオープンにしてください。
- 肝臓( 図2B)のサイズに応じて、ml /分110-460の間に蠕動ポンプでの流量を増加させる。これは、カニューレあたり44±16 ml /分( 図2C)の平均流量をもたらす。選択した速度は、肝臓片に依存し、肝臓片のわずかにプランピングアップにつながるはずです。いくつかの場合においては、上述したわずかなプランピングを達成するために、微小血管クランプを備えた開放血管の一部を遮断クランプする必要があるかもしれない。肝臓片は全体を通して明るい色である場合に良好な灌流を観察することができる。
- 生理食塩水に浸したガーゼで覆うことにより、灌流中の湿った肝作品を保管してください。
- 任意のRを洗い流すためのソリューション1 1Lで灌流肝臓枚で血をemaining。
- 解決策2に灌流液を変更し、10分間灌流する。
- 解決策3に潅流液を切り替えて、0.5 Lで灌流
- コラゲナーゼ( 表2)の0.1から0.15パーセントを含む溶液4に灌流液を変更します。
- 肝臓が十分に消化されるまで、このステップでは、灌流は9月12日分の再循環方法で実施あるいはすべきである肝組織はグリソン鞘の下に離れて少し破っての鈍側でプローブ時に軟化感じるように表示されます小刀。
4。肝細胞を単離する
- 蠕動ポンプの電源を切り、肝臓片からカニューレを取り外します。
- ソリューション5 100〜200 mlを含む結晶皿で肝ピースを置きます。
- 慎重にグリソン鞘を外し、静かにセルを横に振る。よく灌流されていない領域がある場合は、外科用メスを介して切断するために使用することができるこれらの領域は、中に含まれる細胞を放出する。プロセス中に必要に応じてより多くのソリューション5を追加します。
- 500ミリリットルの最終体積に達するまで、より多くのソリューションの追加5。
- 二回細胞懸濁液をフィルタリング、最初の70ミクロンのナイロンメッシュに続いて210ミクロンのナイロンメッシュ。次に、30mlを200ml遠心管に細胞懸濁液を注ぐ。
- 4℃で5分間、72 gで細胞懸濁液を遠心分離上清を吸引し、ゆっくりと溶液5の200ミリリットル中に静かに細胞ペレットを再懸濁します。
- 洗浄工程数4.6 3回繰り返します。最後の遠心分離ステップで、(材料のリストを参照)低温貯蔵溶液中で細胞を再懸濁。細胞は血球計数器ベースのトリパンブルー排除アッセイを用いて収量と生存性の評価のためのミリリットル当たり約2から5000000肝細胞である必要があります。
- トリパンブルー排除アッセイを実施するために、パンブルーsolutiの0.5ミリリットルを含む微量遠心管に(≈2から5000000 / ml)を適切に希釈した細胞の0.1ミリリットルを追加オン(リン酸緩衝生理食塩水(PBS)に溶解し、0.4%トリパンブルー)と0.4mlのPBS。完全に細胞懸濁液を混合した後、懸濁液を血球計数器をロードし、100Xの倍率で顕微鏡下で調べる。生きた細胞は染色されていない表示されている間、顕微鏡下では、死んだ細胞が青く染色されます。血球計数器上にマークさ1ミリメートル2のグリッドのそれぞれに住んでいて、全細胞の数を数える。生存率(%)、生細胞(中低温貯蔵溶液あたり百万肝細胞(CSS)又はg肝臓肝細胞あたり百万)の収率は以下の式を用いて計算することができる。
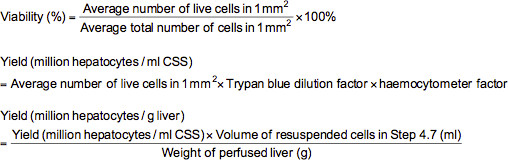
注:この場合には、トリパンブルー希釈係数は10であり、血球計係数は、10,000である。
結果
灌流セットアップ
肝灌流に必要な機器は、 図1に応じて設定する必要があります。
単離されたヒト肝細胞の生存率および収量
単離されたヒト肝細胞の平均生存率は77±10%であった肝細胞の平均収量は、平均値±標準偏差として表される値を使用して、13±1100万肝細胞/ g肝臓であった。肝細胞の単離の数は、648アイソレーシ?...
ディスカッション
このプロトコルは、高い生存率および純度のヒト肝細胞を単離することになる。これらの結果を達成するためには、肝臓の適切な個数で開始することが重要である。肝臓の一部は、1切断面を除くすべての表面上でそのままグリソン鞘を持つ必要があります。別の重要な要因は、異なるバッチの消化後11肝細胞の生存率の著しい違いをもたらすことができるように、使用されるコラゲ?...
開示事項
このプロトコルの最適化は、部分的にHepacult社からの助成金によって賄われていた。博士ヴォルフガングThaslerはHepacult社の創設者の1であり、この会社では取締役会のメンバーの一つである。 Maresa Demmelの雇用がHepacultにより部分的にである。マリアHaunerはHepacult GmbHが採用されている。 Hepacultは同意と研究目的のためのオープンアクセスをヒト肝細胞を提供しています大学からスピンオフバイオテクノロジー会社である。
謝辞
この作品は、研究のためのヒト組織を利用できるようになり、ヒト組織および細胞研究財団、によって可能になりました。そしてHepacult社、この仕事のための財政支援は、連邦教育研究省(:バーチャル肝ネットワーク、助成金番号0315759助成名)から受信されました。私たちのおかげで、また肝灌流および肝細胞の分離を実施するための肝臓サンプルおよび細胞単離基盤施設からの技術的なアシスタントの収集のためGrosshadern病院組織バンクからの技術的なアシスタントにアクセスしてください。特に、我々はビデオでこの手順を実証するためのNataljaレーヴェンに感謝したいと思います。最後に、我々は、ビデオの概略の図1のためのイラストや図形を作成するためのNataljaレーヴェンとEdeltraud Haneschに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Bubble trap | Gaßner Glastechnik | ||
| Glass jacketed condenser | Gaßner Glastechnik | ||
| 41 °C Water bath | Julabo | 35723-H24/EG | |
| 37 °C Water bath | GFL | 1083 | |
| Compressed gas cylinder (95 % O2/5 % CO2) | Linde | ||
| Gas permeable tubing | Neolab | 2-4440 | |
| Peristaltic pump | Ismatec | IP65 | |
| Scalpel | Feather | 320010 | |
| Forceps | Omnilab | 5171014 | |
| Conical flasks 1 L | Schott Duran | 2121654 | |
| Conical flasks 5 L | Schott Duran | 2121673 | |
| Beakers | Schott Duran | 2110654 | |
| 200 ml centrifuge tubes | Becton Dickinson | 352075 | |
| Crystallizing dish | Omnilab | 5144063 | |
| Curved irrigation cannulae with ball tips | Ernst Kratz GmbH | 1464LL/ 1465LL A+B/ 1472LL | |
| Micro vascular clamps | Ernst Kratz GmbH | ||
| Büchner funnel | Carl Roth | HT38.1 | |
| Nylon mesh 210 μm | Neolab | 4-1413 | |
| Nylon mesh 70 μm | Neolab | 4-1419 | |
| 0.22 μm sterile filters | Peske | 99505 | |
| 500 ml bottles | Schott Duran | 2180144 | |
| 1 L bottles | Schott Duran | 2180154 | |
| Hemocytometer | Peske | 06-0001 | |
| 1.5 ml tubes | Eppendorf | 0030 120,086 | |
| 50 ml conical tubes | BD Biosciences | 352070 | |
| Ice bucket | Neolab | 1508454 | |
| Sterile Pasteur pipettes | Brand | 747715 | |
| Motorised pipette filler (Pipette boy acu) | Integra | 155017 | |
| Refridgerated centrifuge | Eppendorf | 5810R | |
| Laminar flow | Kendro | Hera safe-KS9 | |
| Aspirator (Low-flow surgical suction pump) | Atmos | C361 | |
| Laboratory Gas Burner | Integra | Fire Boy eco | |
| Disposable laboratory coat | Paperlynen GmbH | MD0202414 | |
| Surgical mask with visor | Kimberly-Clark | 48247 | |
| Surgical hood | Barrier | 42072 | |
| Latex gloves | Semper Care | CE0321 | |
| Collagenase (Batch number NB 4G) | Serva | 17465 | |
| Calcium chloride dihydrate | Merck | 2382 | |
| EGTA | Sigma | E4378 | |
| Sodium chloride | Roth | 9265.2 | |
| Hepes | Roth | 9105.3 | |
| Potassium chloride | Serva | 26868 | |
| Albumin | Biomol | 01400-2 | |
| Glucose | Serva | 22700 | |
| Sodium hydrogen carbonate | Serva | 30180 | |
| 0.4% Trypan blue solution | Lonza | 17-942E | |
| Cold storage solution | Hepacult GmbH |
参考文献
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Schneider, W. C., Potter, V. R. The assay of animal tissues for respiratory enzymes II. Succinic dehydrogenase and cytochrome oxidase. J. Biol. Chem. 149, 217-227 (1943).
- Aubin, P. M. G., Bucher, N. L. R. A Study of Binucleate Cell Counts in Resting and Regenerating Rat Liver Employing a Mechanical Method for the Separation of Liver Cells. Anat. Rec. 112, 797-809 (1952).
- Anderson, N. G. The Mass Isolation of Whole Cells from Rat Liver. Science. 117, 627-628 (1953).
- Jacob, S. T., Bhargava, P. M. New Method for Preparation of Liver Cell Suspensions. Experimental Cell Research. 27 (62), 453-467 (1962).
- Berry, M. N. Metabolic Properties of Cells Isolated from Adult Mouse Liver. Journal of Cell Biology. 15, 1-8 (1962).
- Laws, J. O., Stickland, L. H. Metabolism of Isolated Liver Cells. Nature. 178, 309-310 (1038).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. The Journal of Cell Biology. 43, 506-520 (1969).
- Seglen, P. O. Preparation of Rat-Liver Cells .3. Enzymatic Requirements for Tissue Dispersion. Experimental Cell Research. 82 (73), 391-398 (1973).
- Thasler, W. E., et al. Charitable State-Controlled Foundation Human Tissue and Cell Research: Ethic and Legal Aspects in the Supply of Surgically Removed Human Tissue For Research in the Academic and Commercial Sector in Germany. Cell and Tissue Banking. 4, 49-56 (2003).
- Queral, A. E., DeAngelo, A. B., Garrett, C. T. Effect of different collagenases on the isolation of viable hepatocytes from rat liver. Analytical Biochemistry. 138, 235-237 (1984).
- Smedsrod, B., Pertoft, H. Preparation of Pure Hepatocytes and Reticuloendothelial Cells in High-Yield from a Single-Rat Liver by Means of Percoll Centrifugation and Selective Adherence. J. Leukocyte Biol. 38, 213-230 (1985).
- Cantrell, E., Bresnick, E. Benzpyrene Hydroxylase-Activity in Isolated Parenchymal and Nonparenchymal Cells of Rat-Liver. Journal of Cell Biology. 52, 316-321 (1972).
- Weiskirchen, R., Gressner, A. M. Isolation and culture of hepatic stellate cells. Methods in Molecular Medicine. 117, 99-113 (2005).
- Baccarani, U., et al. Steatotic versus cirrhotic livers as a source for human hepatocyte isolation. Transplant P. 33, 664-665 (2001).
- Renz, J. F., et al. Utilization of extended donor criteria liver allografts maximizes donor use and patient access to liver transplantation. Annals of Surgery. 242, 556-563 (2005).
- Schemmer, P., et al. Extended donor criteria have no negative impact on early outcome after liver transplantation: a single-center multivariate analysis. Transplant Proc. 39, 529-534 (2007).
- Alexandre, E., et al. Influence of pre-, intra- and post-operative parameters of donor liver on the outcome of isolated human hepatocytes. Cell and Tissue Banking. 3, 223-233 (2002).
- Spotnitz, W. D., Burks, S. State-of-the-art review: Hemostats, sealants, and adhesives II: Update as well as how and when to use the components of the surgical toolbox. Clinical and applied thrombosis/hemostasis : official journal of the International Academy of Clinical and Applied Thrombosis/Hemostasis. 16, 497-514 (2010).
- Spotnitz, W. D., Burks, S. Hemostats, sealants, and adhesives III: a new update as well as cost and regulatory considerations for components of the surgical toolbox. Transfusion. 52, 2243-2255 (2012).
- Toriumi, D. M., Raslan, W. F., Friedman, M., Tardy, M. E. Histotoxicity of cyanoacrylate tissue adhesives. A comparative study. Archives of otolaryngology--head & neck surgery. 116, 546-550 (1990).
- Vinters, H. V., Galil, K. A., Lundie, M. J., Kaufmann, J. C. The histotoxicity of cyanoacrylates. A selective review. Neuroradiology. 27, 279-291 (1985).
- Bhogal, R. H., et al. Isolation of primary human hepatocytes from normal and diseased liver tissue: a one hundred liver experience. PloS ONE. 6, e18222 (2011).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regul. Toxicol. Pharm. 32, 56-67 (2000).
- Koebe, H. G., Pahernik, S. A., Sproede, M., Thasler, W. E., Schildberg, F. W. Porcine hepatocytes from slaughterhouse organs. An unlimited resource for bioartificial liver devices. ASAIO Journal. 41, 189-193 (1995).
- Russell, W. M. S., Burch, R. L. . The principles of humane experimental technique. , (1959).
Erratum
Formal Correction: Erratum: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
Posted by JoVE Editors on 7/01/2016. Citeable Link.
A correction was made to: Isolation of Human Hepatocytes by a Two-step Collagenase Perfusion Procedure
The changes listed below have been made to Table 1.
1). In the recipe for Solution 2, the Final Concentration of EGTA has been changed from:
| EGTA | 0.1mM |
to:
| EGTA | 1mM |
2). In the recipes for Solution 3 and 4, the Final Concentration of Calcium chloride dihydrate has been changed from:
| Calcium chloride dihydrate | 0.5µM |
to:
| Calcium chloride dihydrate | 5mM |
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved