A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعداد مقسمة ميكروتثبول لدراسة الاقتراحات وانطلاقا من تفكيك أنيبيب ينتهي
In This Article
Summary
الأنابيب الدقيقة هي بطبيعتها غير مستقرة البوليمرات، والتبديل ما بين النمو والسمن العشوائية ويصعب السيطرة عليها. نحن هنا تصف البروتوكولات باستخدام الأنابيب الدقيقة مجزأة مع قبعات استقرار photoablatable. يمكن أن تسبب التحلل من الأنابيب الدقيقة مجزأة مع القرار الزماني والمكاني عالية، مما يساعد تحليل الاقتراحات مع نهايات أنيبيب تفكيك.
Abstract
يمكن أنيبيب التحلل توفير القوة لنقل مجمعات البروتين المختلفة والخرز المغلفة البروتين في المختبر. ويعتقد أن الآليات الكامنة لتلعب دورا حيويا في الاقتراحات التي تعتمد على كروموسوم أنيبيب خلال انقسام الخلايا، ولكن البروتينات ذات الصلة ودورها المحدد وغير محددة. وبالتالي، هناك حاجة متزايدة لتطوير المقايسات التي لدراسة مثل هذه الحركة في المختبر باستخدام مكونات النقي وتعريف الوسط البيوكيميائية. الأنابيب الدقيقة، ومع ذلك، هي بطبيعتها غير مستقرة البوليمرات؛ التبديل ما بين النمو والسمن العشوائية ويصعب السيطرة عليها. البروتوكولات وصفنا هنا الاستفادة من الأنابيب الدقيقة مجزأة التي يتم إجراؤها مع photoablatable استقرار مباراة دولية. يمكن أن تسبب التحلل من هذه الأنابيب الدقيقة مجزأة مع القرار الزماني والمكاني عالية، مما يساعد دراسات الحركة في نهايات أنيبيب تفكيك. هذه التقنية يمكن استخدامها لكاليفورنياRRY بإجراء تحليل كمي لعدد من الجزيئات في المجمعات البروتين fluorescently المسمى، والتي تتحرك processively مع أنيبيب ديناميكية ينتهي. لتحسين نسبة الإشارة إلى الضوضاء في هذه وغيرها من المقايسات الفلورسنت الكمي، ينبغي أن يعامل coverslips للحد من امتصاص البروتينات القابلة للذوبان غير محدد من fluorescently المسمى. وتقدم بروتوكولات مفصلة إلى أن تأخذ في الاعتبار تفاوت إضاءة الفلورسنت، وتحديد كثافة من fluorophore واحد باستخدام تناسب التمويه على مسافة واحدة. أخيرا، نحن تصف استخدام الأنابيب الدقيقة مجزأة لدراسة الاقتراحات التي تعتمد على أنيبيب من بلي المغلفة البروتين، وتوفير نظرة ثاقبة قدرة المحركات المختلفة وأية محرك البروتينات لزوجين التحلل أنيبيب لحركة البضائع processive.
Introduction
وحفظا للغاية ميكروتثبول الهياكل هيكل الخلية التي تعتبر مهمة للهندسة المعمارية الخلوية، حركية الخلية، وانقسام الخلايا، والنقل داخل الخلايا 1. هذه البوليمرات الحيوية التجمع من تويولين في حضور GTP، ويحولون بشكل عفوي بين النمو وتقصير 2. الأنابيب الدقيقة هي رقيقة جدا (فقط 25 نانومتر في القطر) وبالتالي تقنيات بصرية خاصة لتعزيز وينبغي أن تستخدم المقابل لمراقبة الأنابيب الدقيقة مع المجهر الخفيفة. فحص العمل السابق مع هذه البوليمرات سلوكهم الديناميكية باستخدام النقيض تدخل الفرق (DIC) 3. وكشفت هذه الدراسات ومماثلة في المختبر أنه في ظل الظروف التجريبية النموذجية، والأنابيب الدقيقة الخضوع كارثة والتحول إلى التحلل إلا نادرا، مرة واحدة كل 5-15 دقيقة (هذا التردد هو 7-15 ملي تركيز تويولين ذوبان درست في 28-32 درجة مئوية ) 4. وهكذا تم اقتراح تقنيات مختلفة لinducه أنيبيب التحلل في الطريقة التي تسيطر عليها. يمكن أن تسبب أنيبيب تقصير من قبل تجرف تويولين للذوبان 5،6، وقطع الأنابيب الدقيقة مع شعاع ليزر 7، أو باستخدام الأنابيب الدقيقة 8 مجزأة، كما هو موضح هنا. العمل السابق باستخدام الأنابيب الدقيقة مجزأة، فضلا عن البوليمرات التحول عشوائيا، وقد وجدت أن الشحنات داخل الخلايا الصغيرة، مثل الكروموسومات، الحويصلات، وحبات المغلفة البروتين، يمكن ان تتحرك في نهايات الأنابيب الدقيقة تقصير 9-13. ويعتقد أن هذه الظاهرة أن يكون لها تأثير مباشر على الاقتراحات الصبغي في الخلايا الإنقسامية، والآليات الكامنة ويجري حاليا التحقيق نشط 14-16.
في الآونة الأخيرة، وتقنيات تستند الفلورسنت، بما في ذلك مجموع مضان انعكاس الداخلي (TIRF) المجهري، وقد استخدمت لدراسة حركية ديناميكية مع أنيبيب ينتهي 17-24. ميزة هذا النهج هو أنه يتيح فحص التفاعلق بين الأنابيب الدقيقة والبروتينات ملزمة أنيبيب في الوقت الحقيقي باستخدام البروتينات المسمى مع fluorophores مختلفة. تم العثور على العديد من المجمعات البروتين لنقل processively مع التمطيط و / أو تقصير نهايات أنيبيب. وتشمل هذه البروتينات المرتبطة أنيبيب Dam1 10،12،18، 19 Ska1، وXMAP215 20، وكذلك المحركات كينيسين Kif18A 21،22، 23 و MCAK CENP-E 24. هذه البروتينات تظهر processive بلاغ تتبع، والتي تختلف اختلافا جوهريا عن ذلك من البروتينات تتبع غيض الكلاسيكية مثل EB1 25. على الرغم من أن جزيئات EB1 والشركاء المرتبطة تظهر أن تظل المرتبطة ثابت مع أنيبيب ديناميكية ينتهي، تبقى الجزيئات الفردية ملزمة لطرف أنيبيب فقط ~ 0.8 ثانية، تبادل بسرعة مع تجمع ذوبان 26. في المقابل، processive بلاغ بتتبع، مثل Dam1، السفر مع أنيبيب تنتهي لكثير من ميكرون، وارتباطهم نصائح أنيبيب يمكن أن تستمر لم أي ثواني. غيض الوقت تكوين الجمعيات، فضلا عن معدل الناتج من تتبع، يعتمد بشدة على عدد من الجزيئات التي تشكل تتبع طرف مجمع 27. الفرق أكبر من البروتين وعادة ما تكون أفضل بكثير بلاغ بتتبع. على سبيل المثال، مثل جمعيات معقدة مثل kinetochores الخميرة يمكن أن تبقى معزولة إلى جانب أنيبيب ينتهي لساعات 28. بعض البروتينات ملزمة أنيبيب، مثل Ndc80 بروتين معقد الحيز الحركي، وقد وجد أن تكون قادرة على تعقب مع أنيبيب ينتهي عند مستوى جزيء واحد، ولكن Ndc80 هي فعالة جدا في اقتران حركة البضائع حبة 19،29-31. وبالتالي، لفهم آلية بلاغ تتبع عن طريق المجمعات البروتين المختلفة، فضلا عن قدرتها على التنوع الأدوار، فمن المهم دراسة بلاغ تتبع بوصفها وظيفة من عدد الجزيئات في مجمع تتبع الحافة، وكذلك لتحديد قدرة هذه المجمعات لعرض الحركة الجماعية على سطح حبة البضائع.
> فيما يلي نقدم بروتوكولات وإجراءات تفصيلية لإعداد وإجراء التجارب مع الأنابيب الدقيقة مجزأة (الشكل 1A). أولا، يتم تعديل الشرائح الزجاجية المتاحة تجاريا لأنابيب البولي ايثيلين إرفاق قصيرة (بروتوكول 1). ثم يتم تجميعها وقابلة لإعادة الاستخدام غرفة التدفق المجهري من هذه الشريحة وتنظيفها البلازما وساترة silanized (بروتوكول 2) 32-34 كيميائيا أو. حجم الغرفة الناتج هو فقط 20-25 ميكرولتر (أو صغيرة مثل 15 ميكرولتر، انظر الملاحظة 3 في البروتوكول 1)، بما في ذلك حجم الأنبوب مدخل. ويمكن أيضا تدفق غرف متوفرة تجاريا استخدامها، ولكن حجمها عادة ما يكون أكبر، مما أدى إلى إهدار غير ضروري للبروتينات. إذا استخدمت غرفة أكبر، وينبغي تحجيم حجم كل الحلول في البروتوكولات أدناه نسبيا. ثم يتم إعداد البذور أنيبيب، على سبيل المثال باستخدام المتحللة ببطء GTP التناظرية، GMPCPP (غوانوزين-5'-[(α، β) methyleno] ثلاثي) (بروتوكول 3، انظر أيضا هيمان <م> وآخرون 35). ويجمد البذور على ساترة تنظيفها ويتم حظر السطح في وقت لاحق لمنع امتصاص غير محدد من البروتينات الأخرى 32 (4 بروتوكول يصف الشلل باستخدام بذور digoxigenin). ويمكن بعد ذلك الأنابيب الدقيقة مجزأة تكون مستعدة باستخدام بروتوكول 5. والمبرر الرئيسي لهذا النهج هو أن البوليمرات أنيبيب الديناميكية، والتي تشكل في وجود GTP، يمكن أن يستقر مؤقتا عن طريق إضافة "قبعات" قصيرة من قطاعات تويولين مستقرة، والتي تحتوي على GMPCPP. تحتوي هذه القبعات أيضا تويولين رودامين المسمى، بحيث يمكن إزالتها ببساطة عن طريق إلقاء الضوء على مجال الرؤية مع ليزر 530-550 نانومتر أو مصباح الزئبق قوس (البروتوكول 6) 36. ويمكن بعد ذلك كثافة مضان للإشارة بلاغ تتبع استخدامها لتقدير عدد الجزيئات التي تسافر مع نهايات أنيبيب تفكيك، مع الأخذ بعين الاعتبار التفاوت في مجال الإضاءة المجهر (بروتوكول 7). ويمكن استخدام نهج مماثللدراسة التفاعلات بين الأنابيب الدقيقة depolymerizing وحبات المغلفة البروتين، أعد كما هو موضح في 27 (بروتوكول 8). وربط بعض البروتينات بسهولة على جدران الأنابيب الدقيقة مجزأة، ولكن يمكن أيضا ملاقط الليزر يمكن استخدامها لعقد حبة بالقرب من الجدار أنيبيب، وبالتالي تعزيز ملزمة لها.
Access restricted. Please log in or start a trial to view this content.
Protocol
المعدات المطلوبة: التجارب الموضحة أدناه تتطلب مجهر الضوء مجهزة لمدينة دبي للإنترنت والتصوير مضان (الجدول 1). ويمكن استخدام حقل مشرق الصمام الإضاءة لتحسين كبير في الكشف عن بذور أنيبيب المرفقة ساترة 37، التي يصعب مراقبة مع مصباح الهالوجين العادية. للسيطرة على تدفق السائل في غرف المجهر، يجب أن يتم تبادل الحلول مع مضخة تحوي قادرة على سرعات تدفق 10-100 ميكرولتر / دقيقة. ويمكن أيضا أن تستخدم ضخ حقنة ولكن يجب توخي الحذر لتجنب فقاعات الهواء التي قد تشكل عند تغيير سرعة تدفق فجأة. للتعامل مع حبات المغلفة البروتين، على سبيل المثال لجعلها على مقربة من الجدار أنيبيب مجزأة، ويمكن إدخال 1،064 نانومتر موجة مستمرة شعاع الليزر إلى المحور البصري المجهر وركز مع هدف الفتحة العددية عالية (1.3 أو أعلى) لإنتاج الفخ. للتحليل الكمي من الفلورسنتكثافة الجزيئات واحدة وينبغي توفير ضوء الإثارة من مصدر الليزر قاعدة منذ شدة هذا مصدر الضوء هو أكثر استقرارا من تلك التي تم إنشاؤها بواسطة مصباح الزئبق. لتقليل الاهتزازات الميكانيكية، ويجب وضع المجهر على طاولة البصرية. كان مطلوبا معدات أكثر تطورا لدراسة حركة من الخرز مع أنيبيب depolymerizing ينتهي تحت قوة ثابتة، وقياس قوة الاشارات احد بالرصاص 11،38،39، وسيتم وصف هذه الأساليب في مكان آخر.
1. تصنيع الدوائر التي يعاد استخدامها تدفق
ويمكن طلب الشرائح الزجاجية للغرف تدفق قابلة لإعادة الاستخدام من الزجاج منشأة لتصنيع محلية باستخدام الخطط في الشكل 1B (انظر الجدول 2 للحصول على تفاصيل حول مورد لدينا). مع الطحن بالموجات فوق الصوتية العادية تعديل الشرائح المجهر (75 مم × 25 مم، 1.0 مم) لجعل اثنين من الأخاديد 15 ± 1 مم طويل، 1.0 ± 0.1 ملم واسعة و 0.8 ± 0.05 ملم عميقة.يجب أن تكون المسافة بين أقرب ينتهي 14 ± 1 مم؛ هذه المسافة هو الأمثل لغرفة تجميعها مع 22 ملم × 22 ملم ساترة. انظر الجدول رقم 2 للحصول على قائمة من المواد الأخرى.
- وضع 100 ملم البولي ايثيلين أنبوب طويل (OD 0.61 مم، الجدول 2) في كل أخدود في الشريحة، وترك ~ 5 مم يتدلى في نهايات الداخلي من الأخاديد. إصلاح الأنابيب داخل الأخاديد مع لاصقة cyanoacrylate، دمج الأنابيب تماما داخل الأخاديد.
- ملء الأخاديد مع الغراء الايبوكسي، مع تجنب إراقة الغراء داخل الأنابيب. السماح للالغراء لتجف ~ 1 اليوم.
- بشفرة حلاقة حادة تقطع طدت الغراء الشامل 3-4 ملم من النهاية البعيدة من كل موقع المرفق، وإزالة الأجزاء الأقرب إلى وسط الشريحة. ينبغي أن تظل أنابيب داخل الأخاديد بهم. وإزالة الأجزاء القريبة أيضا قطع وإزالة يتدلى الداخلية، وخلق سطح مستو مع اثنين من فتحات أنبوب.
- ملء حقنة بالماء واختبارإذا كانت أنابيب تعمل بشكل صحيح. إذا كانت التدفقات السائلة بحرية، وضعت قطرة من الغراء الايبوكسي (~ 5 مم في القطر) في نهايات الخارجي للبساتين وجافة لمدة 1 يوم (1D الشكل). وهذا سيجعل من غرف أكثر دواما، بحيث يمكن استخدامها مرارا وتكرارا لعدة شهور.
ملاحظة 1: لجعل غرفة للمجهر مقلوب، يجب أن يتم تعديل الشرائح بالإضافة إلى تقديم اثنين من الثقوب الصغيرة في طرفي نقيض من الأخاديد (الشكل 1C). إدراج أنابيب من خلال الفتحات الموجودة في الشريحة، ثني الأنابيب ويصلح لهم بإحكام داخل الأخاديد (الشكل 1E). اتبع الخطوات من 1،2-1،4، ولكن إزالة الغراء الايبوكسي من على سطح الأرض بأكمله، والتي سيتم استخدامها لجعل غرفة التدفق.
ملاحظة 2: لتقليل حجم الغرفة، استخدم الطحن لجعل اثنين من المسافات البادئة 0.050 ± 0.005 مم عميق، وترك الجزء الأوسط من الشريحة 5.0 ± 0.5 ملم واسعة ومرتفعة قليلا (انظر "المناطق محفورا" على الأرقام 1B و 1C). عندما ريتم تجميعها انه تدفق غرفة (كما هو موضح أدناه)، ضع الشريط على الوجهين داخل هذه الفجوات.
ملاحظة 3: لإعادة استخدام هذه الشرائح تعديل، بعد الانتهاء من التجارب إزالة ساترة والشريط على الوجهين باستخدام شفرة حلاقة. إزالة تسرب عن طريق تقشير تشغيله ومسح الشريحة مع الايثانول 70٪. ضع الشريحة في وعاء مع 1-2٪ من المنظفات مختبر غسل الاطباق، ونعلق أنابيب إلى مضخة تحوي ويروي 50-70 مل، اتبع مع حجم مساو من الماء منزوع الأيونات وجافة وتخزينها في حجرة خالية من الغبار.
2. إعداد Coverslips
هذا البروتوكول يستغرق 6-8 ساعة وسوف تساعد على إعداد 12 coverslips. وسوف تحتاج واحد حامل ساترة السيراميك و 3 ساترة تلطيخ الجرار مع الأغطية، وينبغي أن يكون حجم جرة 15 مل، لذلك كل ستعقد 4 coverslips مكدسة معا. وعاء زجاجي مع غطاء (250 مل) وينبغي أن تستخدم لاحتضان coverslips مع سيلاني. استخدام الزجاج coverslips NO.1 العادية (22 ملم × 22 ملم أو 22 مم × 30 مم، انظر الجدولين 2 و 3 للحصول على قائمة من المواد). وينبغي إجراء جميع الخطوات في غطاء الدخان، في حين يرتدي قفازات.
- وضعت لل coverslips في تلطيخ الجرار الزجاج ساترة وملء الجرار مع الأسيتون. احتضان لمدة 1 ساعة، ويغسل 10X مع الماء منزوع الأيونات.
- لاحتضان coverslips 10 دقيقة مع الإيثانول ويغسل مرة أخرى 10X مع الماء منزوع الأيونات.
- إعداد "سمكة البيرانا" الحل. وضع 60 مل من محلول بيروكسيد الهيدروجين (30٪ في الماء) في إناء من الزجاج المقاوم للحرارة وببطء إضافة 100 مل من حمض الكبريتيك (نسبة النهائية للحمض إلى محلول بيروكسيد الهيدروجين هو 5:3). والحل تسخين، وهذا أمر طبيعي ولكن توخي الحذر. حل سمكة البيرانا هو تآكل للغاية! استخدام المختبر سميكة معطف وقفازات ونظارات واقية!
- ملء الجرار ساترة تلطيخ مع "البيرانا" حل، وإغلاق الأغطية ووضع الجرار في حمام مائي مسخن إلى 90 درجة مئوية لمدة 1 ساعة.
- تخلصي من "سمكة البيرانا" solutiعلى وتجاهل وفقا لتعليمات وأنظمة السلامة في مكان عملك. غسل coverslips 10X مع الماء منزوع الأيونات.
- ملء الجرار تلطيخ ساترة مع 0.1 M KOH، واحتضان 10 دقيقة، ويغسل 10X مع الماء منزوع الأيونات. وهذا تحييد أي بقايا اليسار على حمض لل coverslips بعد العلاج "سمكة البيرانا".
- coverslips الجافة في وقت واحد من خلال عقد كل ساترة مع تفلون المغلفة ملاقط مسطح ذو حدين (لتقليل الضرر على سطح الزجاج)، وحين تهب ضغط النيتروجين الجاف. تأكد من أن coverslips يتم تجفيفها تماما، لأن الحل هو سيلاني شديدة التفاعل مع الماء.
- كومة لل coverslips المجففة في أصحاب السيراميك (12 coverslips في حامل)، والتي ينبغي predried تماما مع النيتروجين. الحفاظ على أصحاب السيراميك تغطيتها لتجنب الغبار من الالتصاق إلى السطح ساترة.
- تغطية الجزء السفلي من 250 مل جرة زجاجية (6 سم في القطر) مع المناخل الجزيئية، الصف 564، لامتصاص الماء.
- ملء جرة مع 200 مل منPlusOne صد سيلان حل وتزج ببطء حامل السيراميك مع coverslips في جرة، إغلاق الغطاء واحتضان لمدة 5 دقائق في درجة حرارة الغرفة. هذا سيخلق طلاء مسعور على سطح ساترة.
- إزالة ببطء مع حامل coverslips من الجرة ونقل coverslips واحد في وقت واحد في الجرار ساترة تلطيخ مليئة الميثانول.
- وضع المعدن أو الزجاج رمى في خزان للمياه من حمام الصوتية، بحيث جرة ساترة تلطيخ مغمورة ل 2/3 من ارتفاعها. يصوتن في 70 W لمدة 20 دقيقة، وتغيير الحل الميثانول كل 5 دقائق، ثم يشطف 10X مع الماء منزوع الأيونات. إذا كان silanization عمل بشكل صحيح، سوف تظهر لل coverslips الجافة عند إزالتها من المياه.
- تماما إزالة أي المياه المتبقية باستخدام النيتروجين، على النحو الوارد أعلاه.
- Interlay لل coverslips مع Kimwipes لتجنب الاتصال السطح إلى السطح بين لل coverslips. ويمكن تخزين Coverslips في حاوية مغلقة لعدة أسابيع في درجة حرارة الغرفة.
NOTE 1: الخطوات 2،1-2،6 يمكن الاستعاضة عن طريق تنظيف لل coverslips مع منظف البلازما لمدة 15 دقيقة في 30 W، الحد بشكل كبير من الوقت اللازم لإعداد الإجمالية. تم تعيين الضغط داخل غرفة التنظيف في mTorr 100-200. يمكن استخدامها على حد سواء الأكسجين في الغلاف الجوي ومضغوط. كومة لل coverslips تنظيفها البلازما في أصحاب السيراميك وانتقل إلى الخطوة 2.7.
3. إعداد بذور أنيبيب GMPCPP استقرت-
وهذا الإجراء يتخذ ~ 1 ساعة والبذور الناتجة أنيبيب مستقرة لمدة 1-2 أيام في درجة حرارة الغرفة. انظر الجدول 4 للحصول على قائمة من الكواشف.
- خلط على الجليد:
- 10 ميكرولتر غير المسماة تويولين (100 ميكرومتر، الجدول 4) في BRB-80 العازلة (80 ملي أنابيب، 1 ملم EGTA، 4 ملي MgCl 2، ودرجة الحموضة 6.9 مع KOH؛ الملحق مع 1-2 ملي DTT باستخدام قسامة جديدة لكل تجربة).
- 2.6 ميكرولتر المسمى digoxigenin تويولين (الجدول 4). ضبط مستوى الصوت اعتمادا على إعداد وان هذه النسبة النهائية للوصفت لتويولين أونلبلد هو ~ 01:10. تخلط جيدا من قبل pipetting.
- 1.4 ميكرولتر 10 ملي GMPCPP (تركيز النهائي 1 ملم)
- احتضان 15 دقيقة عند 35 درجة مئوية، والبذور تنمو 2-3 ميكرومتر طويلة. ضبط الوقت إذا كان المطلوب طول أنيبيب مختلفة.
- إضافة 35 ميكرولتر BRB-80 (prewarmed إلى 35 درجة مئوية)، ومزيج من قبل pipetting، وأجهزة الطرد المركزي لمدة 15 دقيقة في 25،000 x ج لتكوير البذور في درجة حرارة الغرفة.
- تجاهل طاف، ويغسل بيليه عن طريق إضافة وإزالة بلطف 50 ميكرولتر من BRB-80 دافئ.
- بيليه resuspend جيدا في 25 ميكرولتر BRB-80.
4. المرفقات من بذور أنيبيب للل coverslips
سوف البروتوكولات 4 و 5 تتطلب 2-3 ساعة، لذلك تستخدم مجلسين تدفق يوميا.
- تجميع غرفة تدفق وفقا لتعليمات الشركة الصانعة باستخدام coverslips silanized وانتقل إلى الخطوة 4.2. إذا باستخدام coverslips حسب الطلب (بروتوكول 1)، اتبع الخطوات بيلآه.
- نعلق قطعتين من الشريط على الوجهين (5 ملم × 30 ملم) على طول المنطقة الوسطى ملم واسعة ~ 5، ووضع ساترة silanized فوق الشريط، اضغط بحزم.
- ملء الغرفة مع BRB-80 من خلال واحدة من الأنابيب وتوصيل الأنابيب مع كل من المسواك الجولة.
- يسجل قطرة صغيرة من اللون اثنين كويك المصبوب تسرب على رأس طبق بتري بلاستيكية صغيرة، وتخلط بسرعة ولكن بدقة باستخدام المسواك. سوف تسرب يتحول إلى اللون الأخضر، وتطبيق على الفور، وختم بعناية جميع حواف ساترة. إذا تسرب تخترق عميقا تحت ساترة، فتح واحد من الأنابيب عن طريق إزالة المكونات مسواك وتطبيق ضغط لطيف لمنع تسرب تسرب من داخل الأنابيب.
- السماح للغرفة جافة لمدة 10 دقيقة وتأكد من أن تدفق لا يقتصر قبل المضي قدما.
- وضع غرفة على المسرح المجهر prewarmed إلى 32 درجة مئوية ونعلق واحدة من أنابيب إلى المضخة، والتي سوف ضخ السائل خارج. طول أنبوب مدخليجب أن يكون الحد الأدنى لتجنب وقوع خسائر لا داعي لها من الكواشف: طول الموصى بها هي 5-7 سم. تزج هذه الغاية في قارورة 0.5 مل مع BRB-80 العازلة. هذا وجميع الحلول أدناه ينبغي prewarmed إلى 32-35 درجة مئوية.
- تطبيق ضغط لطيف مع مضخة أو ببساطة رفع نهاية الأنبوب منفذا للضغط على فقاعات الهواء، والتي قد تشكل في بعض الأحيان عندما تتم إزالة المكونات أنبوب مدخل.
- تعيين معدل ضخ 100 ميكرولتر في / دقيقة. تغسل مع 2 مجلدات غرفة الأجسام المضادة لمكافحة digoxigenin المخفف في 1:30 BRB-80، واحتضان 15 دقيقة للسماح الضد الامتزاز.
- تغسل مع 5-10 مجلدا غرفة BRB-80 الدافئ، واحتضان 10 دقيقة مع 1٪ بلورونيك F-127 في BRB-80 لمنع سطح مسعور silanized ساترة.
- تغسل مع 5-10 مجلدا غرفة عازلة حركية (BRB-80 تستكمل مع 0.4 ملغ / مل من الكازين).
- تقليل سرعة المضخة إلى 10 ميكرولتر / دقيقة ويروي بذور أنيبيب المخفف 1:200-1:600 في 30-40 ميكرولتر العازلة حركية. احتضان 15 ميلن لتعزيز ملزم من البذور إلى الأجسام المضادة كثف ساترة.
- يغسل غرفة في 100 ميكرولتر / دقيقة مع 400 ميكرولتر من العازلة حركية لإزالة أي مادة غير منضم.
ملاحظة 1: كثافة الناتجة من البذور يجب أن يكون 10-30 في مجال المجهر (الشكل 2A). لاستكشاف، استخدم تويولين fluorescently المسمى خلال البلمرة (الخطوة 3.1) للكشف أسهل من البذور المرفقة ساترة.
ملاحظة 2: يمكن أيضا Axonemes أعدت من كلاميدوموناس 40 أو المصادر البيولوجية الأخرى، فضلا عن pellicles خلايا رباعية الغشاء هي lysed وdeciliated 41 أن تستخدم أنيبيب nucleators. هذه هي nucleators مفيدة لإنشاء صفائف أنيبيب صغيرة، ويفضل عندما تريد ميكروتثبول مع عدد محدد من protofilaments (GMPCPP nucleates البذور أنيبيب واحد يحتوي على 14 protofilaments ≥ 42). يمكن أن تعلق هذه الهياكل للل coverslips تنظيفها عن طريق الامتصاص غير محددة، ولكن عطاchment عادة ما يكون أقل استقرارا مقارنة مع المرفقات القائم على الأجسام المضادة، وبخاصة عند استخدام لل coverslips silanized.
5. إعداد مقسمة ميكروتثبول
كافة وحدات التخزين حل أدناه هي لحجم الغرفة 15-20 ميكرولتر، وزيادة نسبيا إذا تم استخدام غرفة أكبر.
- Prewarm مزيج تويولين أونلبلد (45 ميكرولتر العازلة الحركة تستكمل مع 1 ملي المغنيسيوم GTP ومع 10-15 ميكرومتر غير المسماة تويولين) لمدة 30 ثانية في 35 درجة مئوية. يروي في 30 ميكرولتر / دقيقة.
- رصد النمو أنيبيب مع البصريات DIC (الشكل 2B، فيديو 1). خلال 5-7 دقيقة الحضانة ميكروتثبول عادة ما تنمو ~ 10 ميكرومتر طويلة.
- تحضير مزيج رودامين تويولين (65 ميكرولتر العازلة الحركة تستكمل مع 0.5 ملي GMPCPP و2-5 ميكرومتر من تويولين رودامين المسمى مع 0.5-1 نسبة المولي من رودامين لتويولين) ودافئة الحل في 35 درجة مئوية لمدة 30 ثانية.
- يروي الفور في 30 μلتر / دقيقة. احتضان لمدة 8-10 دقيقة لتعزيز تشكيل قبعات الفلورسنت مستقرة على نصائح أنيبيب. سوف شرائح أنيبيب مستقرة nucleate أيضا بشكل عفوي وسوف تكون واضحة مع عدسات مدينة دبي للإنترنت.
- غسل الغرفة جيدا مع 100 ميكرولتر من العازلة الحركة في 20 ميكرولتر / دقيقة لإزالة tubulins والنيوكليوتيدات، وكذلك شظايا أنيبيب القابلة للذوبان.
- مع مدينة دبي للإنترنت، تأكد من أن الأنابيب الدقيقة مرئية (الشكل 2D)؛ عددهم، ومع ذلك، يجب أن تنخفض لأن العديد من الأنابيب الدقيقة تفكيك خلال وضع حد أقصى (فيديو 2 يظهر حقل نموذجي مع الأنابيب الدقيقة مجزأة).
ملاحظة 1: مجزأة ميكروتثبول هي مستقرة جدا، ويمكن استخدامها لمدة 2 ساعة على الأقل. ومع ذلك، فإن عمر هذه الأنابيب الدقيقة يتناقص مع تبادل حل المفرطة، أو إذا تم استخدام 2 المركابتويثانول في المخزن المؤقت التصوير.
6. مراقبة التجريبية للتتبع البروتين مع Depolymerizing أنيبيب ينتهي
- انترودفوسي 30-50 ميكرولتر من الفلورسنت البروتين (0،1 حتي 20 نانومتر) في غرفة في 10 ميكرولتر / دقيقة. إذا البروتين التمسك ساترة هو واضح، تكملة العازلة حركية مع 4-8 ملغ / مل BSA. يتطلب Alexa488-Dam1 تتبع غيض بالإضافة إلى 10 ملي DTT أو 0.5-1٪ βME 10.
- تحد من مجال الإضاءة باستخدام الحجاب الحاجز الحقل المجهر لتجنب التبييض لا لزوم لها وتفكيك من الأنابيب الدقيقة.
- بدء اقتناء الفيديو باستخدام مرشح GFP مكعب، ثم التبديل إلى رودامين مرشح المكعب دون مقاطعة تسجيل الصورة. ينبغي للقطاعات الأحمر في نهايات أنيبيب تكون واضحة للعيان، بل سيبدأ في التلاشي وتتفكك بسرعة (فيديو 3).
- مواصلة لإلقاء الضوء حتى تختفي تقريبا قبعات (عادة لمدة 10-20 ثانية ولكن هذه المرة سوف تكون أطول بالنسبة للقبعات نمت مع انخفاض نسبة وضع العلامات رودامين)، ويعود مرة أخرى إلى القناة GFP لتسجيل البروتين تتبع مع أنيبيب التفكيك.
- تحليلمما أدى تسلسلات بناء kymographs والصور أي ثنائي الأبعاد التي تظهر كثافة مضان على طول محور أنيبيب لأوقات مختلفة خلال المراقبة) باستخدام MetaMorph، متاحة بحرية يماغيج أو غيرها من برامج معالجة الصور (الشكل 2E).
ملاحظة 1: يجب أن يتم ضبط معدل اقتناء تبعا لتوقيت الأحداث الملاحظة. معدل الموصى بها هي 2-3 لقطة في الثانية (fps) لتسير بخطى بطيئة، الدائري الحجم Dam1 مجمعات 27 ولكن اكتساب الوقت للجزيئات واحدة يجب أن تكون> 20 إطارا في الثانية 19.
ملاحظة 2: EMCCD حساسة للغاية، على سبيل المثال ANDOR iXon3، مطلوب من أجل تسجيل سريع للأحداث تتبع طرف مع ميكروتثبول depolymerizing. الإعدادات الموصى بها للكاميرا أندور iXon3 هي: 5X الكسب، كسب EM 200، 1 ميغاهيرتز سرعة قراءات، ووضع أجهزة الاستشعار 16 بت، 80 ميللي ثانية زمن التعرض.
ملاحظة 3: استخدام TIRF المجهري وتحسين نسبة الإشارة إلى الضوضاء، ومع ذلك، ينبغي استخدام الأنابيب الدقيقة أقصر، مثل ثار تبقى القبعات استقرار الفلورسنت في متناول الحقل زائل.
7. التحليل الكمي لحجم الجزيئي للأنيبيب مجمعات تلميح تتبع
الأساس المنطقي لهذا النهج هو لتحديد عدد من الجزيئات في مجمع تتبع غيض من خلال إيجاد نسبة من الكل كثافة الفلورسنت من مجمع تتبع تلميح إلى كثافة من fluorophore واحد. ويمكن تطبيق هذا النهج لاندماج GFP البروتين والبروتينات المسمى مع الأصباغ الفلورية، ولكن قد نقلل من عدد الجزيئات في المجمعات بلاغ تتبع إذا كان بعض جزيئات البروتين في التحضيرات لم الفلورسنت.
- سجل حركية photobleaching من لجزيئات البروتين fluorescently المسمى.
- تجميع الغرفة العادية باستخدام المجهر شريحة زجاجية nonmodified، قطعتين من الشريط على الوجهين، وساترة نظيفة، والتي يمكن إعدادها باستخدام بروتوكول كامل 2، أو الخطوات 2،1-2،6 هذا فقطالبروتوكول.
- إضافة حوالي 50 نانومتر البروتين في المخزن على الحركة، وغسل لفترة وجيزة مع العازلة الحركة وختم الغرفة مع VALAP (الجدول 4). تحسين تركيز البروتين للحصول على الميدان مع بقع فرقت بالتساوي (الشكل 3A)، وتمثل الجزيئات واحدة والمجاميع حجمها (أرتب وtetramers، والتي قد تشكل عفويا في الحل أو قد تظهر عند العديد من الجزيئات واحدة هي قريبة من بعضها البعض والتي لا يمكن حلها) . هذه الخطوة مهمة جدا للحصول على توزيع متعددة الذروة من photobleaching من الخطوات وتحديد دقيق لحجم الخطوة (أنظر أدناه).
- تقليل كثافة الليزر والإضاءة التي البقع الفلورسنت الفردية لا تزال مرئية؛ مع انخفاض الإضاءة وتمديد الوقت photobleaching من، لذلك يعد photobleaching من آثار يمكن الحصول عليها. تقليل زمن التعرض أيضا للحد من احتمال أكثر من واحد تبيض fluorophore خلال إطار واحد. الإعداد الموصى بهلأندور iXon3 الكاميرا: مكاسب 5.0X، EM الحصول على 999، 10 ميجا هرتز سرعة قراءات، 50-100 ميللي ثانية زمن التعرض.
- التركيز على سطح ساترة، إغلاق مصراع الكاميرا والإضاءة، والتحرك إلى حقل جديد، فتح مصراع الإضاءة والحصول على صور حتى المبيضة جميع المجمعات (المشار إليها باسم IMG بعد ذلك (س، ص)).
- تصحيح الصور المكتسبة لتفاوت إضاءة (الشكل 3B).
- إعداد حل أي fluorophore، على سبيل المثال 1 ميكرومتر فلوريسئين ثيوسيانات (FITC) في BRB-80. مثل هذا الحل يمكن أن تكون معدة مسبقا، aliquoted وتخزينها في -20 درجة مئوية.
- تجميع الغرفة كما هو الحال في القسم 7.1.1 ولكن استخدام ساترة العادية. إضافة الحل fluorophore وختم الغرفة باستخدام VALAP.
- جمع> 50 صور من ميدان المجهر بأكمله: تحريك المرحلة إلى منطقة غير مقصور جديدة بينما يتم إغلاق مصراع الكاميرا والإضاءة، والحصول على الصور مباشرة بعد فتح مصراع.
- إنشاء متوسط إسقاط هذا المكدس وتصنف مع التمويه الضبابي مع دائرة نصف قطرها 5 بكسل باستخدام يماغيج أو برامج أخرى (الشكل 3C). تمثل الصورة الناتجة توزيع شدة الإضاءة من الميدان (Illum (س، ص)، حيث x و y الإحداثيات تتوافق مع بكسل ل).
- تحديد الحد الأقصى للسطوع بكسل من هذه الصورة (ماكس (Illum)).
- مع مصراع الإضاءة المغلقة واستخدام إعدادات الكاميرا نفسها كما في القسم 7.2.3 اكتساب صورة واحدة، تحديد متوسط كثافة بكسل من هذه الصورة، وهذا يتوافق مع قيمة CN، والضوضاء الكاميرا.
- استخدام القيم أعلاه والصورة (Illum (س، ص)) لتطبيع الصورة التجريبية (IMG (س، ص)) باستخدام التعبير التالي:
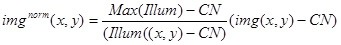
استخدام الصورة الناتجة IMG القاعدة (س، ص) للتحليل الكمي لبريghtness من المجمعات الفلورسنت ثابتة، وأيضا لتطبيع الصور مع مجمعات للتغير اتجاهها طرف (الشكل 3D).
- تحديد كثافة من fluorophore واحد.
- باستخدام الصور تطبيع IMG القاعدة (س، ص) وأي برنامج معالجة الصور حدد مكان الفلورسنت مع منطقة دائرية (5-6 بكسل في القطر) وتحديد شدته لا يتجزأ لجميع الأطر، وتوليد آثار photobleaching من. تجنب نقاط ساطعة جدا (> 5 أضعاف أكثر إشراقا من تلك باهتة).
- باستخدام نفس الأداة منطقة دائرية، حدد لا يقل عن 3 مناطق خالية من بقعة، وتوليد آثار photobleaching من المقابلة، والمتوسط، وتتناسب مع وظيفة الاضمحلال الأسي.
- جدولة هذا المنحنى كثافة الخلفية لتتناسب مع نقاط الوقت التجريبية وتطرحه من منحنيات photobleaching من.
- السلس منحنيات photobleaching من (متوسط مع نافذة انزلاق 3-5 نقطة). تفقد البصر الناتج المنحنيات وتجاهل أي منحنى يظهر زيادة مفاجئة في مضان أو عدم تبيض واضح (الشكل 3E).
- لكل من المنحنيات المتبقية (عادة 50-70٪ من العدد الكلي للمنحنيات)، حدد بصريا الهضبة النهائي، عندما تبييض بقعة الفلورسنت. تقصير هذه الشريحة إلى ترك فقط ~ 100 نقطة ومتوسط شدة هذه. طرح هذه القيمة من منحنى photobleaching من تقصير لتقليل الاختلافات الصغيرة هي مستويات الخلفية والحد من حجم الذروة الخلفية (أدناه).
- رسم بياني لشدة لجميع نقاط زمنية من 20 أو أكثر من منحنيات photobleaching من (> 1،000 نقطة الوقت). الرسم البياني ينبغي أن يحمل على الأقل 4 قمم متميزة (انظر الملاحظة 2).
- تناسب الرسم البياني مع توزيع جاوس مسافة واحدة باستخدام MATLAB 10،43، الرياضيات أو برامج مماثلة (الشكل 3F):
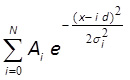
ثهنا وهناك وط σ ط، د و N هي المعلمات المناسب. المعلمات وهناك ط ط σ وتتوافق مع السعة وعرض ط ال الذروة؛ د هو المسافة بين قمم؛ N هو عدد صحيح، والتي تتطابق مع عدد من القمم في التوزيع. إذا المراكز من أول 3 أو أكثر القمم تظهر مباراة جيدة بصريا إلى خط المجهزة، والمسافة بين هذه القمم (المعلمة د) يتوافق مع كثافة الفلورسنت من fluorophore واحد.
ملاحظة 1: عدد النقاط فحص (القسم 7.3.6) ينبغي زيادة إذا كان النظام المجهر يسلك الاهتزازات كبيرة أو أن هناك مصدرا آخر من مصادر الضوضاء (مثل شعاع الليزر غير مستقرة).
ملاحظة 2: من الضروري الحصول على> 3 قمم لتحليل دقيق مع تناسب التمويه على مسافة واحدة. إذا تم الحصول على عدد أقل من القمم، ويمكن الحصول على كاذبة (على سبيل المثال مزدوجة) حجم الخطوةعندما تكون الشروط الإضاءة ليست الأمثل، على سبيل المثال عند النقاط تبييض الخطوات بسرعة كبيرة، واحدة لم يتم حلها بشكل جيد.
- تحديد حجم الجزيئي للمجمع تتبع غيض.
- استخدام الصور التي تم جمعها مع البروتوكول 6 وتحديد الأطر 2-4 الأولى، والتي تم الحصول عليها على الفور بعد فتح مصراع. إذا كانت مضاءة مجال لبعض الوقت قبل وحظ غيض تتبع، وتقدير كثافة الأصلي من حركية photobleaching من تحت نفس الظروف التجريبية.
- متوسط الإطارات المحددة وتطبيع الصورة الناتجة كما في أقسام 7.2.5-7.2.7.
- قياس كثافة لا يتجزأ من المجمع تتبع غيض الفلورسنت باستخدام نفس حجم المنطقة كما هو الحال في القسم 7.3.1.
- قياس كثافة لا يتجزأ من 3 مناطق الخلفية تقع قرب مجمع تتبع نصيحة وباستخدام نفس المنطقة، يبلغ متوسط هذه القيم وطرح من شدة مجمع تتبع غيض من القسم 7.4.3.
- حساب عدد جزيئات fluorophore في مجمع بقسمة كثافة الفلورسنت التي تم الحصول عليها في القسم 7.4.4 من شدة من fluorophore واحد تم الحصول عليها في القسم 7.3.5.
ملاحظة 1: ومن المرغوب فيه أن إعدادات الإضاءة واقتناء لبروتوكول 7.4 هي نفسها كما في بروتوكول 7.1. إذا تم تعديل إما زمن التعرض أو شدة الليزر خلال هذه الخطوات، يجب أن تقاس القيم الفلورسنت الناتجة وفقا لذلك. ومع ذلك، ينبغي التحقق من دقة مثل هذه التحجيم عن طريق التصوير نفس العينة (مثل الوقت الفلورسنت) في ظل هذه الظروف مختلفة واحتساب نسبة من شدة الناتجة عن ذلك.
8. أنيبيب تلميح تتبع من قبل البروتين المغلفة الخرز
- إجراء التجارب مع حبات بلاغ تتبع عن طريق إحداث MT التفكيك كما هو الحال في البروتوكول 6. ينبغي خفض شدة DIC مصدر الضوء لتسمح بعرض رودامين مضان في وقت واحد معمدينة دبي للإنترنت التصوير.
- إعداد حبات كما هو الحال في Grishchuk آخرون 10 واسبوري وآخرون 11 أعرض 30-50 ميكرولتر من التعليق حبة في غرفة في 10 ميكرولتر / دقيقة. تركيز حبة المقترح هو 10 -16 -10 -17 م.
- إذا باستخدام المجهر تستقيم، وإزالة غرفة من مرحلة المجهر وعكس ذلك لمدة 5-10 دقيقة للسماح الخرز لالرواسب في ساترة. هذا يعزز ملزمة أفضل من حبة لميكروتثبول المربوطة إلى ساترة، ولكن هذا الإجراء غير ناجحة مع 0.5 ميكرومتر الخرز البوليسترين، والتي تظهر قليلا الترسيب القائم على خطورة خلال هذا الوقت القصير.
- اختيار حبة أن تعلق على أنيبيب-المربوطة ساترة، وحبة يجب أن تتحرك في شكل قوس واضح 44 (الشكل 4A). يجب أن يكون موجودا حبة المربوطة 1-3 ميكرون بعيدا عن سطح ساترة، والتي هي واضحة للعيان بسبب حبات المرفقة ساترة العرضية التي لا تزال مotionless.
- التبديل إلى رودامين مرشح مكعب والبدء في جمع الصور أثناء استخدام الإضاءة مدينة دبي للإنترنت.
- مصراع مفتوحة لإلقاء الضوء على حقل التصوير (المقيدة مع الحجاب الحاجز الميدان) مع مصباح الزئبق أو 530-550 نانومتر الليزر. مواصلة تسجيل حتى يفصل حبة أو التحركات مع نهاية تفكيك أنيبيب (أرقام 4D أو 4F أو 4G و).
ملاحظة 1: فخ البصرية يمكن استخدامها لتعزيز التفاعل بين الجدار أنيبيب والمغلفة البروتين حبة. وهذا مفيد بشكل خاص عند العمل مع حبات المغلفة مع المحركات كينيسين (أرقام 4E-G). اتبع نفس البروتوكولات على النحو الوارد أعلاه ولكن تكملة العازلة حركية مع 2 ملي المغنيسيوم-ATP. في الخطوة 8.3، التقاط حبة العائمة الحرة مع شعاع الليزر 1،064 نانومتر، حرك مرحلة لجلب حبة المحاصرين أقرب إلى الجدار أنيبيب مجزأة. يبدأ التصوير مع الإضاءة الخافتة ومدينة دبي للإنترنت عبر مرشح مكعب رودامين وانتظر حبة لبدء المشي نحو نهاية أنيبيب توج. الخلفإيه لوحظ حركة حبة الموجهة، وإغلاق مصراع الكاميرا لمحاصرة شعاع وفتح مصراع لإضاءة الفلورسنت. مواصلة تسجيل حتى يفصل حبة أو المسارات مع نهاية أنيبيب تفكيك.
Access restricted. Please log in or start a trial to view this content.
النتائج
البروتين تتبع مع depolymerizing أنيبيب ينتهي. الحيز الحركي الخميرة المكون Dam1 هو إلى حد بعيد أفضل بلاغ تعقب من أنيبيب depolymerizing ينتهي 14. هذا المجمع 10-الوحيدات المسمى مع GFP يمكن التعبير عنها بسهولة وتنقيته من الخلايا البكتيرية 18،38، لذلك نوصي استخدامه كع?...
Access restricted. Please log in or start a trial to view this content.
Discussion
العديد من المقايسات جزيء واحد في الوقت الحاضر تستخدم بشكل روتيني coverslips معاملة خاصة لخفض كبير غير محدد من البروتين الشائكة. الإجراء وصفنا هنا هو تعديل للبروتوكول الأصلي وضعت في مختبر هوارد 32، ونجد أن silanizing لل coverslips تستحق الجهد حتى مع المقايسات حبة مقرها مدينة د?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
والكتاب ليس لديهم ما يكشف.
Acknowledgements
فإن الكتاب أود أن أشكر FI Ataullakhanov للمساعدة في تصميم وتصنيع الدوائر تدفق قابلة لإعادة الاستخدام، N. داشكيفيتش، N. Gudimchuk وA. Korbalev لتوفير الصور للشخصيات، N. Gudimchuk وP. زاخاروف لوضع بروتوكول وتوفير الكواشف ل إعداد البذور أنيبيب المسمى digoxigenin، A. Potapenko للمساعدة في تحرير النص وغيرها من أعضاء Grishchuk المختبر للحصول على نصائح والمناقشات. وأيد هذا العمل في جزء من المعاهد الوطنية للصحة منح R01-GM 098389 ومنحة رائدة من معهد بنسلفانيا العضلات لELG، وهو كيميل الباحث، من خلال RFBR يمنح 12-04-00111 واحد، 13 04-40190-H و 13 -04-40188-H، والأكاديمية الروسية للعلوم رئاسة المنح (آليات الأنظمة الجزيئية والتكامل وبيولوجيا الخلية الجزيئية برامج والجزيئية) لFI Ataullakhanov، المعاهد الوطنية للصحة منح R01 GM033787 جنرال موتورز لJR ماكينتوش، وزمالة ما بعد الدكتوراه مؤسسة ديمتري اسرة زيمين ل VAV
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Table 1. Microscopy and other equipment. | |||
| Microscope | Zeiss Nikon | Axio Imager 2 Eclipse Ti | other microscope models capable of DIC and epifluorescence-imaging can be used |
| Objective | Zeiss Nikon | 420490-9900-000 CFI Apo 100x Oil 1.49 | 100X, DIC, 1.3-1.49 NA |
| Objective heater | Bioptechs | 150803, 150819-19 | |
| Fluorescent filter cube | Chroma | 49004 or 49008 41017 or 49020 | optimized for Rhodamine fluorescence optimized for GFP fluorescence |
| Acquisition software | freeware MicroManager Molecular Devices | not applicable MetaMorph 7.5 | http://valelab.ucsf.edu/~MM/MMwiki/ other software can be used to acquire images and for a particle tracking |
| EMCCD camera | Andor | iXon3, DU-897E-cs0-#BV | Highly sensitive EMCCD camera |
| Trapping laser | IPG Photonics | YLR-10-1064-LP | 1,064 nm laser, 10 W |
| Fluorescence excitation lasers | Coherent, Inc. Coherent, Inc. | Sapphire 488 LP Sapphire 552 LP | excitation of green fluorophores excitation of red fluorophores |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| Commercial flow chambers | Warner Instruments | RC-20 or RC-30 | |
| Perfusion pump | Cole Palmer Harvard Apparatus | Masterflex 77120-52 Pico Plus | Both pumps provide the required rate of liquid flow but a peristaltic pump may pulse at very slow speed. The flow with a syringe pump is more consistent for a wide range of rates but this pump has inertia. |
| Table 2. Microscopy chamber preparation. | |||
| Modified microscope slides for reusable chambers | Precision Glassblowing of Colorado | Custom order www.precisionglassblowing.com | Sonic slots in slides using schematics in Figure 1 |
| Polyethylene tubing | Intramedic | 427410 | I.D. 0.58 mm, O.D. 0.965 mm; use these tubes to connect assembled chamber to the pump and waste container |
| Polyethylene tubing | Intramedic | 427400 | I.D. 0.28 mm, O.D. 0.61 mm; use these tubes to make the reusable chamber |
| Regular microscope slides | VWR | 48312-003 | Other similar slides can be used |
| Coverslips | VWR | 48393-150, 48366-067 | Other similar coverslips can be used |
| Silicon sealant | World Precision Instruments | KIT, SILICON SEALANT 5 MIN CURE | |
| Epoxy glue | Loctite | 83082 | |
| Cyanoacrylate adhesive | Scotch 3M | AD114 | Or cyanoacrylate adhesive from other manufacturers |
| Table 3. Coverslips cleaning and coating. | |||
| Molecular Sieves, Grade 564 | Macron | 4490-04 | |
| Coverglass Staining Jar | Ted Pella, Inc. | 21036 | |
| Coverslip Ceramic Holder | Thomas Scientific | 8542e40 | |
| PlusOne Repel Silane | GE Healthcare Biosciences | 17-1332-01 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Anti-digoxigenin AB | Roche Applied Science | 11093274910 | |
| Table 4. Preparation of seeds and segmented microtubules. | |||
| Tubulin | purified from cow brains Cytoskeleton, Inc | T238P | For purification protocols see 49–51 Unlabeled porcine tubulin |
| Labeled tubulin | Cytoskeleton, Inc Invitrogen Invitrogen | TL590M C1171 (Rhodamine) A-2952 (Digoxigenin) | Rhodamine-labeled porcine tubulin Tubulin can be labeled with any amine-reactive dye as in reference52. |
| GMPCPP | Jena Biosciences | NU-405 | Aliquot and store at -70 °C |
| VALAP | Vaseline, lanolin, and paraffin at 1:1:2 by mass | see reference9 | |
References
- Desai, A., Mitchison, T. J. Microtubule polymerization dynamics. Ann. Rev. Cell Dev. Biol. 13, 83-117 (1997).
- Mitchison, T. M., Kirschner, M. W. Dynamic instability of microtubule growth. Nature. 312 (15), 237-242 (1984).
- Walker, R. A., Brien, O., et al. Dynamic Instability of Individual Microtubules Analyzed by Video Light Microscopy: Rate Constants and Transition Frequencies. J. Cell Biol. 107, 1437-1448 (1988).
- Gardner, M. K., Zanic, M., Gell, C., Bormuth, V., Howard, J. Depolymerizing Kinesins Kip3 and MCAK Shape Cellular Microtubule Architecture by Differential Control of Catastrophe. Cell. 147 (5), 1092-1103 (2011).
- Lombillo, V. A., Stewart, R. J., McIntosh, J. R. Minus-end-directed motion of kinesin-coated microspheres driven by microtubule depolymerization. Nature. 373, 161-164 (1995).
- Franck, A. D., Powers, A. F., Gestaut, D. R., Gonen, T., Davis, T. N., Asbury, C. L. Tension applied through the Dam1 complex promotes microtubule elongation providing a direct mechanism for length control in mitosis. Nat. Cell Biol. 9 (7), 832-837 (2007).
- Tran, P. T., Walker, R. A., Salmon, E. D. A metastable intermediate state of microtubule dynamic instability that differs significantly between plus and minus ends. J. Cell Biol. 138 (1), 105-117 (1997).
- Grishchuk, E. L., Molodtsov, M. I., Ataullakhanov, F. I., McIntosh, J. R. Force production by disassembling microtubules. Nature. 438, 384-388 Forthcoming.
- Coue, M., Lombillo, A., Richard, J. Microtubule Depolymerization Promotes Particle and Chromosome Movement In Vitro. J. Cell Biol. 112 (6), 1165-1175 (1991).
- Grishchuk, E. L., Spiridonov, I. S., et al. Different assemblies of the DAM1 complex follow shortening microtubules by distinct mechanisms. Proc. Natl. Acad. Sci. U.S.A. 105 (19), 6918-6923 (2008).
- Asbury, C. L., Gestaut, D. R., Powers, A. F., Franck, A. D., Davis, T. N. The Dam1 kinetochore complex harnesses microtubule dynamics to produce force and movement. Proc. Natl. Acad. Sci. U.S.A. 103 (26), 9873-9878 (2006).
- Westermann, S., Wang, H. -W., Avila-Sakar, A., Drubin, D. G., Nogales, E., Barnes, G. The Dam1 kinetochore ring complex moves processively on depolymerizing microtubule ends. Nature. 440 (7083), 565-569 (2006).
- Grissom, P. M., Fiedler, T., Grishchuk, E. L., Nicastro, D., West, R. R., Mcintosh, J. R. Kinesin-8 from Fission Yeast A Heterodimeric , Plus-End – directed Motor that Can Couple Microtubule Depolymerization to Cargo Movement. Mol. Biol. Cell. 20, 963-972 (2009).
- McIntosh, J. R., Volkov, V., Ataullakhanov, F. I., Grishchuk, E. L. Tubulin depolymerization may be an ancient biological motor. J. Sci. 123, 3425-3434 (2010).
- Grishchuk, E. L., McIntosh, J. R., Molodtsov, M. I., Ataullakhanov, F. I. Force generation by dynamic microtubule polymers. Compr. Biophys. 4, 93-117 (2012).
- Asbury, C. L., Tien, J. F., Davis, T. N. Kinetochores' gripping feat: conformational wave or biased diffusion. Trends Cell Biol. (1), 38-46 (2011).
- Tien, J. F., Umbreit, N. T., et al. Cooperation of the Dam1 and Ndc80 kinetochore complexes enhances microtubule coupling and is regulated by aurora B. Cell Biol. 189 (4), 713-723 (2010).
- Gestaut, D. R., Graczyk, B., et al. Phosphoregulation and depolymerization-driven movement of the Dam1 complex do not require ring formation. Nat. Biol. 10 (4), 407-414 (2008).
- Schmidt, J. C., Arthanari, H., et al. The Kinetochore-Bound Ska1 Complex Tracks Depolymerizing Microtubules and Binds to Curved Protofilaments. Dev. Cell. 23 (5), 968-980 (2012).
- Brouhard, G. J., Stear, J. H., et al. XMAP215 is a processive microtubule polymerase. Cell. 132 (1), 79-88 (2008).
- Stumpff, J., Du, Y., et al. A Tethering Mechanism Controls the Processivity and Kinetochore-Microtubule Plus-End Enrichment of the Kinesin-8 Kif18A. Mol. Cell. 43 (5), 764-775 (2011).
- Su, X., Qui, W., Gupta, M., Pereira-Leal, J., Reck-Peterson, S. L., Pellman, D. Mechanisms underlying the dual-mode regulation of microtubule dynamics by Kip3/kinesin-8. Mol. Cell. 43 (5), 751-763 (2011).
- Helenius, J., Brouhard, G., Kalaidzidis, Y., Diez, S., Howard, J. The depolymerizing kinesin MCAK uses lattice diffusion to rapidly target microtubule ends. Nature. 441 (7089), 115-119 (2006).
- Gudimchuk, N., Vitre, B., et al. Kinetochore kinesin CENP-E is a processive bi-directional tracker of dynamic microtubule tips. Nat. Cell Biol. 15 (9), 1079-1088 (2013).
- Akhmanova, A., Steinmetz, M. Microtubule +TIPs at a glance. J. Sci. 20 (Pt 20), 3415-3419 (2010).
- Dixit, R., Barnett, B., Lazarus, J., Tokito, M., Goldman, Y., Holzbaur, E. Microtubule plus-end tracking by CLIP-170 requires EB1. Proc. Natl. Acad. Sci. U.S.A. 106 (2), 492-497 (2009).
- Grishchuk, E. L., Efremov, A. K., et al. The Dam1 ring binds microtubules strongly enough to be a processive as well as energy-efficient coupler for chromosome motion. Proc. Natl. Acad. Sci. U.S.A. 105 (40), 15423-15428 (2008).
- Akiyoshi, B., Sarangapani, K. K., et al. Tension directly stabilizes reconstituted kinetochore-microtubule attachments. Nature. 468 (7323), 576-579 (2010).
- McIntosh, J. R., Grishchuk, E. L., et al. Fibrils Connect Microtubule Tips with Kinetochores A Mechanism to Couple Tubulin Dynamics to Chromosome Motion. Cell. 135 (2), 322-333 (2008).
- Powers, A. F., Franck, A. D., et al. The Ndc80 kinetochore complex forms load-bearing attachments to dynamic microtubule tips via biased diffusion. Cell. 136 (5), 865-875 (2009).
- Umbreit, N. T., Gestaut, D. R., et al. The Ndc80 kinetochore complex directly modulates microtubule dynamics. Proc. Natl. Acad. Sci. U.S.A. 109 (40), 16113-16118 (2012).
- Gell, C., Bormuth, V., et al. Microtubule Dynamics Reconstituted In Vitro and Imaged by Single-Molecule Fluorescence Microscopy. Methods Biol. 95, 221-245 (2010).
- Dixit, R., Ross, J. L. Studying Plus-End Tracking at Single Molecule Resolution Using TIRF Microscopy. Methods Cell Biol. 95, 543-554 (2010).
- Beausang, F. J., Sun, Y., Quinlan, E. M., Forkey, N. J., Goldman, Y. Construction of Flow Chambers for Polarized Total Internal Reflection Fluorescence Microscopy (polTIRFM). Cold Spring Harbour Protoc. 6, 712-715 (2012).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP Hydrolysis in Microtubule Dynamics: Information from a Slowly Hydrolyzable Analogue, GMPCPP. Mol. Biol. Cell. 3, 1155-1167 (1992).
- Grishchuk, E. L., Ataullakhanov, F. I. In Vitro Assays to Study the Tracking of Shortening Microtubule Ends and to Measure Associated Forces. Methods Cell Biol. 95, 657-676 (2010).
- Gutiérrez-Medina, B., Block, S. M. Visualizing individual microtubules by bright field microscopy. Am. J. Phys. 78 (11), 1152-1159 (2010).
- Volkov, V. A., Zaytsev, A. V., et al. Long tethers provide high-force coupling of the Dam1 ring to shortening microtubules. Proc. Natl. Acad. Sci. U.S.A. 110 (19), 7708-7713 (2013).
- Laan, L., Pavin, N., et al. Cortical dynein controls microtubule dynamics to generate pulling forces that position microtubule asters. Cell. 148 (3), 502-514 (2012).
- Myster, S. H., Knott, J. A., O'Toole, E., Porter, M. E. The Chlamydomonas Dhc1 gene encodes a dynein heavy chain subunit required for assembly of the I1 inner arm complex. Mol. Biol. Cell. 8, 607-620 (1997).
- Lombillo, V. A., Coue, M., McIntosh, J. R. In vitro motility assays using microtubules tethered to Tetrahymena pellicles. Methods Cell Biol. 39, 149-165 (1993).
- Hyman, A., Chrétien, D., Arnal, I., Wade, R. Structural changes accompanying GTP hydrolysis in microtubules: information from a slowly hydrolyzable analogue guanylyl-(alpha,beta)-methylene-diphosphonate. J. Cell Biol. 128 (1-2), 117-125 (1995).
- Park, M., Kim, H., Kim, D., Song, N. W. Counting the Number of Fluorophores Labeled in Biomolecules by Observing the Fluorescence-Intensity Transient of a Single Molecule. Bull. Chem. Soc. Jap. 78, 1612-1618 (2005).
- Welburn, J. P. I., Grishchuk, E. L., Backer, C. B., Wilson-Kubalek, E. M., Yates, J. R., Cheeseman, I. M. The human kinetochore Ska1 complex facilitates microtubule depolymerization-coupled motility. Dev. Cell. 16 (3), 374-385 (2009).
- Efremov, A., Grishchuk, E. L., Mcintosh, J. R., Ataullakhanov, F. I. In search of an optimal ring to couple microtubule depolymerization to processive chromosome motions. Natl. Acad. Sci. U.S.A. (48), 19017-19022 (2007).
- Itoh, T., Hisanaga, S., Hosoi, T., Kishimoto, T., Hotani, H. Phosphorylation states of microtubule-associated protein 2 (MAP2) determine the regulatory role of MAP2 in microtubule dynamics. Biochemistry. 36 (41), 12574-12582 (1997).
- Oguchi, Y., Uchimura, S., Ohki, T., Mikhailenko, S. V., Ishiwata, S. The bidirectional depolymerizer MCAK generates force by disassembling both microtubule ends. Nat. Biol. (6), 1-8 (2011).
- Kishino, A., Yanagida, T. Force measurements by micromanipulation of a single actin filament by glass needles. Nature. 334, 74-76 (1988).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann. NY Acad. Sci. 253, 107-132 (1975).
- Weingarten, M. D., Lockwood, A. H., Hwo, S., Kirschner, M. W. A Protein Factor Essential for Microtubule Assembly. Proc. Natl. Acad. Sci. U.S.A. 72 (5), 1858-1862 (1975).
- Widlund, P. O., Podolski, M., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Mol. Biol. Cell. 23 (22), 4393-4401 (2012).
- Hyman, A., Drechsel, D., et al. Preparation of Modified Tubulins. Methods Enzymol. 196, 478-485 (1991).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved