É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de Segmentadas Microtubules para estudar Moções impulsionado pela desmontagem de microtúbulos Termina
Neste Artigo
Resumo
Os microtúbulos são inerentemente instáveis polímeros, e sua alternância entre crescimento e redução é estocástico e difícil de controlar. Aqui nós descrevemos protocolos utilizando microtúbulos segmentados com tampas de estabilização photoablatable. Despolimerização dos microtúbulos segmentados pode ser acionado com alta resolução temporal e espacial, ajudando assim a análise de movimentos com a desmontagem extremidades dos microtúbulos.
Resumo
Microtubule despolimerização pode fornecer força para o transporte de diferentes complexos de proteínas e pérolas revestidas de proteínas in vitro. Os mecanismos subjacentes são pensados para jogar um papel vital nos movimentos do cromossoma dependente de microtúbulos durante a divisão celular, mas as proteínas relevantes e suas funções exatas são mal definido. Assim, existe uma necessidade crescente de desenvolver ensaios com a qual para estudar tal motilidade in vitro, utilizando os componentes purificados e meio bioquímico definido. Os microtúbulos, no entanto, são intrinsecamente instáveis polímeros, a sua comutação entre crescimento e encurtamento é estocástica e difícil de controlar. Os protocolos que descrevemos aqui aproveitar os microtúbulos segmentados que são feitos com o photoablatable estabilização caps. Despolimerização desses microtúbulos segmentados podem ser acionados com alta resolução temporal e espacial, ajudando assim os estudos de mobilidade nas extremidades desmontagem dos microtúbulos. Esta técnica pode ser usada para carry a uma análise quantitativa do número de moléculas em complexos de proteína fluorescente marcado, que se movem com processively dinâmica dos microtúbulos termina. Para optimizar a relação de sinal-para-ruído neste e em outros ensaios fluorescentes quantitativos, lamelas devem ser tratadas para reduzir a absorção não específica de proteínas marcadas fluorescentemente-solúveis. Protocolos detalhados são fornecidos para ter em conta as irregularidades de iluminação fluorescente, e determinar a intensidade de um único fluoróforo usando ajuste de Gauss equidistante. Finalmente, descreve-se o uso de microtúbulos segmentadas para estudar movimentos das microesferas revestidas com proteínas dependentes de microtúbulos, fornecendo insights sobre a capacidade de diferentes proteínas do motor e não motores a par de microtúbulos despolimerização ao movimento de carga processiva.
Introdução
Os microtúbulos são estruturas altamente conservadas do citoesqueleto, que são importantes para a arquitectura celular, motilidade celular, divisão celular e o transporte intracelular 1. Estes polímeros dinâmicas montar a partir de tubulina na presença de GTP, e que exibir espontaneamente entre crescimento e encurtamento 2. Os microtúbulos são muito finas (apenas 25 nm de diâmetro), portanto, técnicas ópticas especiais para melhorar o contraste deve ser usada para observar microtúbulos com um microscópio de luz. Trabalhos anteriores com esses polímeros examinado seu comportamento dinâmico usando contraste de interferência diferencial (DIC) 3. Este e outros estudos in vitro mostraram que em condições experimentais típicas, os microtúbulos sofrer catástrofe e mude para a despolimerização apenas raramente, uma vez a cada 5-15 min (esta freqüência é de 7-15 mM concentração tubulina solúvel examinado em 28-32 ° C ) 4. Diferentes técnicas têm sido, assim, propôs a induçãoe despolimerização de microtúbulos de maneira controlada. Microtúbulos encurtamento pode ser desencadeada por lavagem para retirar tubulina solúvel 5,6, cortando microtúbulos com um feixe de laser 7, ou usando microtúbulos segmentados 8, tal como descrito aqui. Trabalhos anteriores utilizando microtúbulos segmentados, bem como polímeros estocasticamente de comutação, tem encontrado que as pequenas cargas intracelulares, tais como os cromossomas, vesículas, e pérolas revestidas com proteína, pode mover-se nas extremidades dos microtúbulos encurtamento 9-13. Este fenômeno é pensado para ter uma implicação direta para movimentos cromossômicas em células mitóticas, e os mecanismos subjacentes estão atualmente sob investigação ativa 14-16.
Recentemente, técnicas fluorescentes à base, incluindo o total de fluorescência reflexão interna (TIRF) microscopia, foram utilizados para estudar a motilidade com microtúbulos dinâmica termina 17-24. A vantagem desta abordagem é que ela permite o exame de interacçãos entre os microtúbulos e proteínas de ligação de microtúbulos em tempo real, utilizando as proteínas marcadas com fluoróforos diferentes. Vários complexos de proteínas foram encontradas para mover processively com alongamento e / ou encurtar extremidades dos microtúbulos. Elas incluem as proteínas associadas a microtúbulos Dam1 10,12,18, Ska1 19, e XMAP215 20, bem como motores de cinesina Kif18A 21,22, MCAK 23 e CENP-E 24. Estas proteínas apresentam processive ponta-tracking, que é fundamentalmente diferente daquele das proteínas de rastreamento de ponta clássicos como EB1 25. Embora as moléculas EB1 e os parceiros associados parecem permanecer estavelmente associada com microtúbulos dinâmica termina, as moléculas individuais permanecem ligados à extremidade do microtúbulo para apenas ~ 0,8 seg, rapidamente trocar com a piscina solúvel 26. Em contraste, processive ponta dos trackers, como Dam1, viajar com microtúbulos termina para muitos microns, e sua associação com dicas de microtúbulos pode durar mquaisquer segundos. A ponta do tempo de associação, bem como a taxa resultante de acompanhamento, depende fortemente o número de moléculas que formam o complexo de localização da ponta 27. Maiores conjuntos de proteínas são geralmente muito melhores ponta-trackers. Por exemplo, esses conjuntos complexos como os isolados de levedura cinetócoros pode permanecer acoplada a microtúbulos termina por 28 horas. Algumas proteínas de ligação de microtúbulos, por exemplo, complexo de proteínas kinetochore Ndc80, foram encontrados para ser incapaz de acompanhar com microtúbulos termina no mesmo nível molécula, ainda Ndc80 é muito eficiente em acoplar o movimento de cargas talão 19,29-31. Assim, para compreender o mecanismo de ponta de rastreamento por diferentes complexos de proteínas, bem como os seus papéis biológicos, é importante examinar ponta-rastreamento como uma função do número de moléculas do complexo de rastreamento de ponta, bem como para determinar a capacidade destes complexos para expor motilidade colectivo sobre a superfície de carga do grânulo.
Abaixo fornecemos protocolos detalhados para preparar e conduzir experimentos com microtúbulos segmentados (Figura 1A). Em primeiro lugar, as lâminas de vidro disponíveis no mercado são modificados para fixar tubos de polietileno curto (Protocolo 1). A câmara de fluxo de microscopia reutilizável é, então, montado a partir de tal slide eo limpa-plasma e lamela silanizada (protocolo 2) 32-34 química ou. O volume da câmara resultante é apenas de 20-25 ul (ou tão pequenos quanto 15 ul, ver Nota 3 de protocolo 1), incluindo o volume do tubo de entrada. Câmaras de fluxo comercialmente disponíveis também podem ser utilizados, mas o seu volume é geralmente maior, o que leva ao desperdício desnecessário de proteínas. Se uma câmara maior é empregue, o volume de todas as soluções nos protocolos abaixo deve ser dimensionado proporcionalmente. Sementes de microtúbulos são então preparados, por exemplo, utilizando-se lentamente hidrolisável GTP analógico, GMPCPP (guanosina-5'-[(α, β)-methyleno] trifosfato) (protocolo 3, ver também Hyman et al. 35). As sementes são imobilizadas sobre uma lamela de limpeza e a superfície é bloqueada posteriormente para impedir a absorção não específica de outras proteínas de 32 (protocolo de 4 descreve sementes imobilização utilizando digoxigenina). Os microtúbulos segmentado pode, então, ser preparado utilizando o Protocolo 5. A principal razão para esta abordagem é que os polímeros de microtúbulos dinâmicos, que formam na presença de GTP, podem ser estabilizadas pela adição temporariamente as curtas "tampões" de segmentos de tubulina estáveis, que contêm GMPCPP. Estas cápsulas contêm também tubulina Rodamina marcado, de modo que pode ser removido simplesmente através da iluminação do campo de visão com um laser de 530-550 nm, ou uma lâmpada de arco de mercúrio (Protocolo 6) 36. A intensidade de fluorescência do sinal de ponta-de controlo pode então ser utilizada para estimar o número de moléculas que se deslocam com as extremidades desmontagem de microtúbulos, tendo em conta a irregularidade da iluminação de campo do microscópio (Protocolo 7). Uma abordagem semelhante pode ser usadapara estudar as interacções entre os microtúbulos Despolimerização e pérolas revestidas com proteína, preparado como descrito em 27 (Protocolo 8). Algumas proteínas irão ligar-se facilmente às paredes dos microtúbulos segmentadas, mas pinças a laser também pode ser utilizado para segurar o cordão perto da parede de microtúbulos, promovendo assim a sua ligação.
Protocolo
Equipamentos necessários: As experiências descritas abaixo exigem um microscópio de luz equipado para DIC e imagens de fluorescência (Tabela 1). Campo brilhante iluminação LED pode ser utilizado para melhorar significativamente a detecção dos microtúbulos sementes ligado à lamela 37, que são difíceis de observar com uma lâmpada de halogéneo regular. Para controlar o fluxo de líquido em câmaras de microscopia, as soluções devem ser trocados com uma bomba peristáltica capaz de velocidades de fluxo de 10-100 ul / min. Uma bomba de seringa também pode ser usado, mas deve ser tomado cuidado para evitar bolhas de ar que possam formar, quando a velocidade do fluxo for alterado bruscamente. Para lidar com pérolas revestidas com proteína, por exemplo, para aproximá-los para a parede de microtúbulos segmentada, uma nm feixe de laser de onda contínua 1064 pode ser introduzida no eixo óptico do microscópio e focada com um objectivo de abertura numérica elevada (1.3 ou superior) para produzir um armadilha. Para a análise quantitativa da fluorescênciaintensidade de moléculas individuais da luz de excitação deve ser fornecida por uma fonte de laser de base de uma vez a intensidade desta fonte de luz é mais estável do que a gerada por uma lâmpada de mercúrio. Para minimizar as vibrações mecânicas, o microscópio deve ser colocado sobre uma mesa óptica. Equipamento mais sofisticado é necessário estudar o movimento das esferas com a despolimerização de microtúbulos termina sob uma força constante, e para medir os sinais de força de um único tiro 11,38,39, estes métodos serão descritos noutro local.
1. Manufacturing reutilizáveis Fluxo Chambers
Lâminas de vidro para câmaras de fluxo reutilizáveis pode ser encomendado a partir de uma unidade de fabricação de vidro local usando esquemas da Figura 1B (ver Tabela 2 para obter detalhes sobre o nosso fornecedor). Com moagem ultra-sônica modificar slides comuns do microscópio (75 milímetros x 25 milímetros, 1,0 milímetros de espessura) para fazer duas ranhuras de 15 ± 1 mm de comprimento, 1,0 ± 0,1 mm de largura e 0,8 ± 0,05 milímetros de profundidade.Distância entre as extremidades mais próximas deve ser 14 ± 1 mm, esta distância é óptima para uma câmara montada com 22 milímetros x 22 mm lamela. Ver Tabela 2 para uma lista de outros materiais.
- Coloque um tubo de polietileno de 100 milímetros de comprimento (OD 0,61 milímetros, Tabela 2) em cada uma das ranhuras na corrediça, deixando ~ 5 mm saliências nas extremidades interiores das ranhuras. Fixe os tubos no interior dos sulcos com adesivo de cianoacrilato, a incorporação dos tubos completamente dentro dos sulcos.
- Encha as ranhuras com cola epóxi, enquanto evitando espalhar a cola para dentro dos tubos. Deixe a cola secar por ~ 1 dia.
- Com uma lâmina de barbear afiada cortar a massa solidificada cola 3-4 mm a partir da extremidade distai de cada local de ligação, a remoção das partes proximal para o centro da lâmina. Os tubos devem permanecer dentro de suas ranhuras. Retirar as peças proximais também vai cortar e remover as saliências internas, criando uma superfície plana, com duas aberturas de tubo.
- Encha uma seringa com água e testese os tubos estão funcionando corretamente. Se o líquido se escoa livremente, colocar uma gota de cola epóxi (~ 5 mm de diâmetro) nas extremidades exteriores dos pomares, secas durante 1 dia (Figura 1D). Isso fará com que as câmaras mais durável, de modo que pode ser usado repetidamente por muitos meses.
Nota 1: Para fazer uma câmara de um microscópio invertido, as lâminas devem ser modificado adicionalmente para fazer dois pequenos furos nas extremidades opostas das ranhuras (Figura 1C). Insira os tubos através dos furos no slide, dobre os tubos e encaixá-los firmemente no interior das ranhuras (Figura 1E). Siga passos 1,2-1,4, mas remover a cola epoxi de toda a superfície, o que vai ser usada para fazer uma câmara de fluxo.
Nota 2: Para reduzir o volume da câmara, utilize moagem para fazer dois recortes 0,050 ± 0,005 milímetros de profundidade, deixando a parte central da lâmina de 5,0 ± 0,5 mm de largura e um pouco elevado (ver "áreas gravadas" na Figuras 1B e 1C). Quando tcâmara, o fluxo é montado (como descrito abaixo), coloque a fita dupla face no interior desses recortes.
Nota 3: Para reutilizar esses slides modificados, depois de terminar os experimentos remover a lamela e fita dupla-face usando uma lâmina de barbear. Remover o selante por peeling-lo e limpando o slide com etanol 70%. Coloque o slide em um recipiente com 1-2% de um detergente de lavar louça laboratório, anexar a tubulação a uma bomba peristáltica e perfuse 50-70 ml, siga com igual volume de água deionizada, seco e armazenar em um compartimento livre de poeira.
2. Preparação de Lamelas
Este protocolo leva 6-8 horas e vai ajudar a preparar 12 lamelas. Você vai precisar de um suporte cerâmico e lamela lamela 3 tinas de coloração com tampas; volume de frasco deve ser de 15 ml, então cada um vai realizar 4 lamelas empilhados juntos. Um frasco de vidro com uma tampa (250 ml) deve ser utilizado para incubar lamelas com silano. Use lamelas de vidro No.1 regulares (22 mm x 22 mm ou 2Dois milímetros x 30 mm, ver Quadros 2 e 3 para uma lista de materiais). Todos os passos devem ser realizados numa chaminé de fumos, enquanto que o uso de luvas.
- Coloque as lamelas nas tinas de coloração lamela de vidro e encher os frascos com acetona. Incubar durante 1 hora, lava-10x, com água desionizada.
- Incubar as lamelas 10 min com etanol e lavar novamente 10x com água desionizada.
- Preparar a solução de "piranha". Colocar 60 mL de solução de peróxido de hidrogénio (30% em água) num recipiente de vidro resistente ao calor e adiciona-se lentamente 100 ml de ácido sulfúrico (proporção final de ácido de uma solução de peróxido de hidrogénio é 5,3). Solução vai esquentar, isso é normal, mas tenha cuidado. Solução Piranha é extremamente corrosivo! Use laboratório grosso casaco, luvas e óculos!
- Encher os frascos de coloração lamela com uma solução de "piranha", fechar as tampas e colocar os frascos num banho de água pré-aquecido a 90 ° C durante 1 hora.
- Deitar fora a solução que "piranha"em e descartar conforme as instruções pelas normas de segurança no local de trabalho. Wash lamelas 10x com água deionizada.
- Encher os frascos de coloração de lamelas com 0,1 M KOH, incubar 10 min e lava-10x, com a água desionizada. Isto irá neutralizar qualquer resíduo ácido deixados nas lamelas após tratamento "piranha".
- Lamelas Dry um de cada vez, mantendo cada lamela com pinças planas gumes Teflon revestido (para minimizar os danos a uma superfície de vidro) e ao fundir nitrogênio comprimido seco. Certifique-se de que lamínulas são secos completamente, porque solução de silano é altamente reativo com água.
- Empilhe as lamelas secas em suportes cerâmicos (12 Lamelas por titular), que devem ser cuidadosamente pré-seca com nitrogênio. Mantenha os detentores de cerâmica cobertos para evitar a poeira grude na superfície da lamela.
- Cubra o fundo de 250 ml frasco de vidro (6 cm de diâmetro) com peneiras moleculares, grau 564, para a absorção de água.
- Encha o frasco com 200 ml deSolução PlusOne Repel Silano e mergulhar lentamente um suporte cerâmico com lamelas em um frasco, feche a tampa e incubar por 5 min à temperatura ambiente. Isto irá criar revestimento hidrofóbico na superfície da lamela.
- Lentamente, retire o suporte com lamelas do frasco e transferência lamelas um de cada vez nas tinas de coloração lamela cheios de metanol.
- Coloque um metal ou pedestal de vidro para dentro do reservatório de água de um banho sónico, de modo a que a tina de coloração lamela é imerso durante 2/3 da sua altura. Sonicar a 70 W durante 20 minutos, a mudança solução de metanol a cada 5 minutos, depois enxaguar 10x com água desionizada. Se a silanização funcionou corretamente, as lamelas aparecerá seca, quando removidos da água.
- Completamente remover qualquer água residual com nitrogênio, como acima.
- Interlay as lamelas com Kimwipes para evitar o contato superfície-superfície entre as lamelas. As lamelas podem ser armazenadas em um recipiente vedado durante várias semanas à temperatura ambiente.
Nota 1: Passos 2,1-2,6 pode ser substituído por limpeza das lamelas de limpeza com plasma durante 15 min a 30 W, reduzindo consideravelmente o tempo de preparação total. A pressão no interior da câmara de limpeza é ajustado a 100-200 mTorr. Tanto o oxigénio atmosférico e compactado pode ser usado. Empilhe as lamelas limpo de plasma em suportes de cerâmica e vá para o passo 2.7.
3. Preparação de Sementes de microtúbulos GMPCPP estabilizadas
Este procedimento irá tomar ~ 1 hora e as sementes resultantes microtúbulos são estáveis durante 1-2 dias à temperatura ambiente. Ver Tabela 4 para uma lista de reagentes.
- Misture no gelo:
- 10 ul não marcado tubulina (100 fiM, Tabela 4) em BRB-80 (tampão Pipes 80 mM, EGTA 1 mM, MgCl2 4 mM, pH 6,9 com KOH; suplemento com DTT 1-2 mM usando alíquota fresca para cada experiência).
- 2,6 ul marcada com digoxigenina tubulina (Tabela 4). Ajuste o volume de acordo com a preparação,de tal modo que a razão final de tubulina marcada para não marcado é ~ 1:10. Misture bem por pipetagem.
- 1,4 ul de 10 mM GMPCPP (concentração final 1 mM)
- Incubar 15 min a 35 ° C, as sementes irão crescer 2-3 mM longo. Ajuste o tempo se diferente comprimento de microtúbulos é desejada.
- Adicionar 35 ul BRB-80 (pré-aquecido a 35 ° C), mistura por pipetagem, e centrifuga-se durante 15 min a 25.000 x g para sedimentar as sementes à temperatura ambiente.
- Elimine o sobrenadante, lavagem do sedimento, adicionando suavemente e removendo 50 ul de quente BRB-80.
- Ressuspender o pellet em 25 ul bem BRB-80.
4. Penhora de microtúbulos sementes para as lamelas
Protocolos 4 e 5 vai exigir 2-3 horas, por isso duas câmaras de fluxo são usados por dia.
- Montar câmara de fluxo de acordo com as instruções do fabricante, utilizando lamelas silanizadas e vá para o passo 4.2. Se estiver usando lamínulas custom-made (Protocolo 1), siga o bel passosow.
- Anexar dois pedaços de fita dupla face (5 mm x 30 mm) ao longo do ~ 5 milímetros ampla área central, colocar lamela silanizada sobre a fita, pressione com firmeza.
- Encha a câmara com BRB-80 através de um dos tubos e ligue os dois tubos com palitos redondos.
- Esprema uma pequena gota de duas cores selante Elenco Kwik em cima de uma pequena placa de Petri de plástico, e misture rapidamente, mas cuidadosamente, com um palito. O selante ficará verde; aplicar imediatamente, selando com cuidado todas as bordas da lamela. Se o selante penetra muito profundamente sob a lamela, abra um dos tubos, retirando a ficha palito e aplique uma leve pressão para evitar selante de vazamento no interior dos tubos.
- Deixe secar por 10 minutos câmara e confirme que o fluxo não é restrita antes de prosseguir.
- Coloque a câmara num palco de microscópio pré-aquecido a 32 ° C e anexar um dos tubos para uma bomba, que bombeia o líquido para fora. O comprimento do tubo de entradadeve ser minimizada para evitar a desnecessária perda de reagentes: o comprimento recomendado é de 5-7 cm. Mergulhe neste final de 0,5 ml frasco com BRB-80 buffer. Esta e todas as soluções a seguir, deve ser pré-aquecido a 32-35 ° C.
- Aplicar uma ligeira pressão com uma bomba ou simplesmente levantar a extremidade do tubo de saída para espremer as bolhas de ar, que pode formar-se ocasionalmente quando a tampa do tubo de entrada é removida.
- Defina a taxa de bomba a 100 mL / min. Lava-se com 2 volumes de câmara de anticorpos anti-digoxigenina diluídas 1:30 em BRB-80, incubar 15 min para permitir a adsorção do anticorpo.
- Lavar com 5-10 volumes Câmara de quente BRB-80, incubar 10 min com 1% de Pluronic F-127 no BRB-80 para bloquear a superfície hidrofóbica de lamela silanizada.
- Lavar com 5-10 volumes de câmara de tampão de motilidade (BRB-80 suplementado com 0,4 mg / ml de caseína).
- Reduza a velocidade da bomba a 10 mL / min e perfuse sementes microtúbulos diluído 1:200-1:600 em 30-40 tampão motilidade mL. Incubar 15 min promover a ligação das sementes aos anticorpos adsorvidos-lamela.
- Lava-se a câmara com 100 ul / min com 400 ul de tampão de motilidade para remover qualquer material não ligado.
Nota 1: A densidade resultante das sementes deve ser de 10-30 por campo de microscópio (Figura 2A). Para solucionar problemas, use tubulin fluorescente etiquetado durante a polimerização (passo 3.1) para a detecção mais fácil das sementes ligado à lamela.
Nota 2: axonemas preparados a partir de Chlamydomonas 40 ou de outras fontes biológicas, bem como as películas de células lisadas e deciliated Tetrahymena 41 também pode ser usado como nucleadores de microtúbulos. Estes nucleadores são úteis para a criação de pequenas matrizes de microtúbulos, e são preferidos quando microtúbulos com número específico de protofilamentos são desejados (GMPCPP nucleia sementes um microtúbulos que contém ≥ 14 protofilamentos 42). Estas estruturas podem ser ligados às lamelas limpos por absorção não específica, mas a attachment geralmente é menos estável em comparação com o apego à base de anticorpos, especialmente ao usar as lamelas silanizadas.
5. Preparação de Segmentado Microtubules
Todos os volumes de soluções abaixo são para volume da câmara de 15-20 mL; aumentar proporcionalmente se maior câmara é utilizada.
- Pré-aquecer mistura tubulina não marcado (45 ul de tampão de motilidade, suplementado com 1 mM de Mg-GTP e com 10-15 pM de tubulina não marcado) durante 30 segundos a 35 ° C. Perfundir a 30 ul / min.
- Monitorar o crescimento dos microtúbulos com DIC óptica (Figura 2B, Video 1). Durante 5-7 minutos de incubação, os microtúbulos geralmente crescem ~ 10 m de comprimento.
- Preparar a mistura de Rodamina-tubulina (65 ul de tampão motilidade suplementado com GMPCPP 0,5 mM e 2-5 pM de tubulina Rodamina marcado com 0,5-1 razão molar de Rodamina de tubulina) e aquecer a solução a 35 ° C durante 30 seg.
- Perfundir imediatamente em 30 μl / min. Incubar por 8-10 min para promover a formação de tampas fluorescentes estáveis nas pontas dos microtúbulos. Segmentos de microtúbulos estáveis também núcleos espontaneamente e estará visível com DIC óptica.
- Lava-se a câmara assim com 100 ul de tampão de motilidade em 20 mL / min para remover tubulinas e nucleótidos, bem como os fragmentos solúveis de microtúbulos.
- Com DIC, confirme que os microtúbulos são visíveis (Figura 2D), o seu número, no entanto, deve diminuir, porque muitos microtúbulos desmontar durante tampando (Video 2 mostra um campo típico com microtúbulos segmentadas).
Nota 1: Segmentado microtúbulos são muito estáveis e podem ser utilizadas para, pelo menos, 2 horas. No entanto, o tempo de vida destes microtúbulos diminui com troca da solução em excesso, ou se 2-mercaptoetanol é usado no tampão de imagem.
6. Observação Experimental do Rastreamento Protein com Despolimerização microtúbulos Termina
- Introduce 30-50 ul de proteína fluorescente (0,1-20 nM) para a câmara de 10 mL / min. Se proteína adere à lamela é evidente, completar o buffer motilidade com 4-8 mg / ml BSA. Alexa488-Dam1 rastreamento ponta exige ainda que 10 mM DTT ou 0,5-1% βME 10.
- Limitar o campo de iluminação utilizando um diafragma de campo microscópio para evitar o branqueamento desnecessário e desmontagem dos microtúbulos.
- Comece a aquisição de vídeo usando o cubo de filtro GFP, em seguida, mudar para o cubo de filtro Rhodamine sem interromper a gravação de imagens. Os segmentos vermelhos nas extremidades dos microtúbulos deve ser claramente visível, pois eles vão começar a desaparecer e se desintegram rapidamente (vídeo 3).
- Continue a iluminar até as tampas de quase desaparecer (geralmente para 10-20 segundos, mas desta vez vai ser mais longo para as tampas produzidas com um rácio de rotulagem Rhodamine inferior), e voltar para o canal de GFP para gravar proteína rastreamento com microtúbulos desmontagem.
- Analisar oresultantes seqüências de construção kymographs, ou seja, imagens bidimensionais que mostram a intensidade de fluorescência ao longo do eixo de microtúbulos por várias vezes durante a observação), usando MetaMorph, livremente disponíveis ImageJ ou outro software de processamento de imagem (Figura 2E).
Nota 1: Taxa de aquisição deve ser ajustada de acordo com o calendário dos eventos observados. A taxa recomendada é de 2-3 frames por segundo (fps) para a baixa rotatividade, anel de tamanho Dam1 complexos 27, mas o tempo de aquisição de moléculas individuais deve ser> 20 fps 19.
Nota 2: A EMCCD altamente sensível, por exemplo, ANDOR iXon3, é necessário para a gravação rápida de eventos de rastreamento de ponta com os microtúbulos despolimerizando. As configurações recomendadas para câmera Andor iXon3 são: ganho de 5x, EM ganhar 200, velocidade de leitura de 1 MHz, o modo de sensor de 16-bit, 80 ms de tempo de exposição.
Nota 3: Usando a microscopia TIRF irá melhorar a relação sinal-para-ruído, no entanto, os microtúbulos mais curtos devem ser utilizados, tais that os tampões de estabilização fluorescentes permanecem dentro do alcance do campo evanescente.
7. Análise Quantitativa do Tamanho Molecular de Microtubule Complexos Dica de rastreamento
A justificação para esta abordagem é a de determinar o número de moléculas em um complexo de localização da ponta por encontrar a proporção de intensidade de fluorescência total do complexo de localização da ponta para a intensidade de um único fluoróforo. Esta abordagem pode ser aplicada para fusões de GFP em proteínas e proteínas marcadas com corantes fluorescentes, mas pode subestimar o número de moléculas em complexos de ponta de localização, se algumas moléculas de proteína nas preparações não são fluorescentes.
- Cinética de fotodegradação recorde de moléculas de proteína fluorescente etiquetado.
- Montar câmara microscopia regular usando uma lâmina de vidro não-modificados, duas tiras de fita dupla face, e uma lamela limpa, que pode ser preparado usando todo o Protocolo 2, ou a poucos passos de 2,1-2,6 destaprotocolo.
- Adicionar cerca de 50 nM de proteína em tampão de motilidade, lavar rapidamente com tampão de motilidade e vedar a câmara com valap (Tabela 4). Otimizar concentração de proteína para obter o campo com os pontos uniformemente dispersas (Figura 3A), representando moléculas individuais e seus pequenos agregados (trímeros e tetrâmeros, que podem formar-se espontaneamente na solução ou podem aparecer quando várias moléculas individuais estão juntos e não pode ser resolvido) . Este passo é muito importante para a obtenção de uma distribuição multi-pico de fotodegradativas passos e determinação exacta de um tamanho de passo (ver abaixo).
- Minimizar a intensidade do laser de iluminação na qual as manchas fluorescentes individuais são ainda visíveis, com menor tempo de iluminação do fotobranqueamento é estendido, de modo mais vestígios fotodegradativas pode ser obtido. Também minimizar o tempo de exposição para reduzir a probabilidade de mais do que um fluoróforo branqueamento durante um fotograma. A configuração recomendadapara Andor iXon3 câmera: ganho de 5,0 x, EM ganhar 999, velocidade de leitura de 10 MHz, 50-100 tempo de exposição ms.
- Concentre-se na superfície da lamela, feche o obturador iluminação, mover-se para um campo novo, abra a tampa de iluminação e aquisição de imagens até que todos os complexos têm branqueada (doravante referida como img (x, y)).
- Corrija as imagens adquiridas para desníveis de iluminação (Figura 3B).
- Solução de qualquer fluoróforo preparar, por exemplo, 1 uM de fluoresceína isotiocianato (FITC) em BRB-80. Tal solução pode ser preparada com antecedência, aliquotado e armazenado a -20 ° C.
- Montar uma câmara como na Seção 7.1.1, mas usar uma lamela regular. Adicionar solução fluoróforo e selar a câmara usando valap.
- Colete> 50 imagens do microscópio de campo inteiro: mover o palco para uma nova área crus enquanto o obturador iluminação é fechado, e adquirir as imagens imediatamente após a abertura do obturador.
- Criar projeção média desta pilha e filtrar com Gaussian Blur com raio de 5 pixels usando ImageJ ou outro software (Figura 3C). A imagem resultante representa a distribuição da intensidade de iluminação do campo (Illum (x, y), onde x e y correspondem a coordenadas de pixel).
- Determine o brilho máximo pixel desta imagem (Max (Illum)).
- Com o obturador iluminação fechado e usando as mesmas configurações da câmera como na Seção 7.2.3 adquirir uma imagem, determinar a intensidade média dos pixels da imagem, o valor corresponde ao CN, o ruído da câmera.
- Usar os valores acima e imagem (Illum (x, y)) para normalizar a imagem experimental (img (x, y)), utilizando a seguinte expressão:
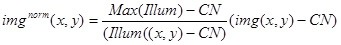
Use o resultando norma imagem img (x, y) para a análise quantitativa do brilho dos complexos fluorescentes estacionárias, e também para normalizar as imagens com complexos ponta-aderência (Figura 3D).
- Determinar a intensidade de um único fluoróforo.
- Usando imagens normalizadas img norma (x, y) e qualquer software de processamento de imagem, selecione uma mancha fluorescente com uma região circular (5-6 pixels de diâmetro) e determinar a sua intensidade integral para todos os quadros, gerando os traços fotodegradação. Evite próprios pontos brilhantes (> 5 vezes mais brilhante do que os dimmer).
- Usando a mesma ferramenta região circular, selecione pelo menos 3 áreas livres de manchas, gerar os traços fotodegradativas correspondentes, média e se encaixam com função de decaimento exponencial.
- Tabule esta intensidade curva do fundo para combinar os momentos experimentais e subtrai-lo a partir das curvas de fotodegradação.
- Suavizar as curvas de fotodegradação (média com a janela deslizante de 3-5 pontos). Inspecione visualmente as curvas resultantes edescartar qualquer curva que mostra um aumento abrupto na fluorescência ou a falta de branqueamento óbvio (Figura 3E).
- Para cada uma das curvas restantes (geralmente 50-70% do número total de curvas), seleccionar visualmente o patamar final, quando a mancha fluorescente foi branqueada. Encurtar esse segmento para deixar apenas a 100 pontos e média dessas intensidades. Subtrair esse valor a partir da curva de fotodegradação encurtado para minimizar pequenas variações são os níveis de fundo e para reduzir o tamanho do pico de fundo (abaixo).
- Traçar um histograma da intensidade de todos os pontos de tempo a partir de 20 ou mais curvas de fotobranqueamento (> 1.000 pontos de tempo). O histograma deve apresentar pelo menos quatro picos distintos (ver nota 2).
- Montar o histograma com equidistante distribuição de Gauss 10,43 usando MATLAB, Mathematica ou software similar (Figura 3F):
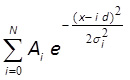
waqui A i e σ i, d e N são parâmetros de ajuste. Parâmetros A i e σ i corresponder a amplitude e a largura dos i-ésimo pico, d é a distância entre os picos, N é o número inteiro que corresponde ao número total de picos na distribuição. Se os centros das primeiras três ou mais picos apresentam uma boa correspondência visual para a linha de ajuste, a distância entre estes picos (parâmetro d) corresponde a uma intensidade de fluorescência de um fluoróforo único.
Nota 1: Número de pontos analisados (Seção 7.3.6) deve ser aumentada se o sistema de microscopia apresenta vibrações significativas ou há outra fonte de ruído (feixe de laser por exemplo instável).
Nota 2: É essencial para obter> 3 picos para análise precisa com ajuste Gaussian equidistante. Se menos picos são obtidos, o (por exemplo double) tamanho passo em falso poderia ser obtidaquando as condições de iluminação não são ideais, por exemplo, quando os pontos branquear passos muito rápidos e simples não são resolvidos assim.
- Determinar o tamanho molecular do complexo de rastreamento de ponta.
- Use imagens recolhidas com o Protocolo 6 e selecionar os primeiros 2-4 quadros, que foram adquiridas imediatamente após a abertura do obturador. Se o campo foi iluminado durante algum tempo antes de se observar o rastreamento ponta, estimar a intensidade original a partir das cinéticas de fotodegradação sob as mesmas condições experimentais.
- Calcular a média dos quadros selecionados e normalizar a imagem resultante como nas Seções 7.2.5-7.2.7.
- Medir a intensidade integrante do complexo de rastreamento de ponta fluorescente usando o mesmo tamanho da região, como na Seção 7.3.1.
- Medir a intensidade integrante de 3 áreas de fundo localizados perto do complexo de rastreamento de ponta e utilizando a mesma região, a média desses valores e subtrair a partir da intensidade do complexo de rastreamento de ponta a partir da Secção 7.4.3.
- Calcular o número de moléculas de fluoróforo no complexo dividindo a intensidade de fluorescência obtida na Secção 7.4.4 pela intensidade do fluoróforo único obtido na Secção 7.3.5.
Nota 1: É desejável que as configurações de iluminação e de aquisição para o protocolo 7.4 são os mesmos que no protocolo 7.1. Se quer o tempo de exposição ou a intensidade do laser foi ajustada durante estes passos, os valores fluorescentes resultantes devem ser dimensionadas em conformidade. No entanto, a precisão de tal dimensionamento deve ser verificada pela imagem da mesma amostra (por exemplo, tempo de fluorescência) sob estas diferentes condições e calculando a razão entre as intensidades resultantes.
8. Microtubule Tip-tracking pela proteína Revestido Beads
- Realizar experimentos com contas ponta de rastreamento, desencadeando MT desmontagem como na protocolo 6. A intensidade da fonte de luz DIC deve ser reduzida para permitir a visualização Rhodamine fluorescência em simultâneo comImagem DIC.
- Prepare os grânulos como no Grishchuk et al. 10 e Asbury et ai. Introduzir 11 30-50 ul de suspensão de esferas para dentro da câmara de 10 mL / min. A concentração de grânulo sugerido é de 10 -16 -10 -17 M.
- Se usando microscópio vertical, remover a câmara da platina do microscópio e inverter durante 5-10 minutos para permitir que os grânulos para sedimentar na lamela. Isto promove uma melhor ligação do talão para os microtúbulos amarrados à lamela, mas este procedimento não for bem sucedida com 0,5 mM esferas de poliestireno, que mostram pouca sedimentação baseada em gravidade durante um tempo tão curto.
- Seleccione um grânulo que está ligado ao cabo de ligação de microtúbulos-lamela, o cordão deve mover-se num arco claro 44 (Figura 4A). O grânulo tethered deve ser localizado 1-3 mM de distância da superfície da lamela, que é claramente visível devido às pérolas ligado à lamela ocasionais que permanecem motionless.
- Mude para o cubo de filtro Rhodamine e começar a coletar imagens ao usar iluminação DIC.
- Abrir obturador para iluminar o campo de imagem (restrito com um diafragma de campo) com uma lâmpada de mercúrio ou a laser 530-550 nm. Continuar a gravar até que o talão separa ou se move com o fim desmontagem dos microtúbulos (Figuras 4D, 4F, e 4G).
Nota 1: armadilha óptico pode ser usado para promover a interacção entre a parede do microtúbulo e proteína do grânulo revestido. Isto é especialmente útil quando se trabalha com esferas revestidas com motores cinesina (Figuras 4E-G). Siga mesmos protocolos que acima, mas complementar tampão motilidade com 2 mM Mg-ATP. No passo 8.3, a captura de um talão de flutuação livre com o feixe de laser de 1.064 nm, mover a etapa de trazer o talão prendido mais perto da parede de microtúbulos segmentada. Comece a imagem com pouca luz DIC e via o cubo filtro Rhodamine e esperar que o talão para começar a caminhar para o fim de microtúbulos tampado. À réer o movimento dirigido talão é observada, fechar o obturador para capturar trave e abrir o obturador para iluminação fluorescente. Continuar a gravar até que o talão destaca ou faixas com o fim de microtúbulos desmontagem.
Resultados
Rastreamento com despolimerizando microtúbulos Protein termina. Yeast kinetochore componente Dam1 é de longe o melhor ponta-tracker do microtúbulos despolimerizando termina 14. O complexo de 10-subunidade marcada com GFP podem ser facilmente expressas e purificadas a partir de células bacterianas 18,38, portanto, recomendado usá-lo como um controlo positivo para o ensaio de localização da ponta. Uma proteína fluorescente que controla o fim da despolimerização de microtúb...
Discussão
Muitos ensaios única molécula hoje em dia usam rotineiramente lamelas especialmente tratadas para reduzir drasticamente a aderência proteína inespecífica. O procedimento que descrevemos aqui é uma modificação do protocolo original desenvolvido no laboratório de Howard 32, e nós achamos que silanizar as lamelas vale bem a pena o esforço, mesmo com ensaios de contas baseadas em DIC, que não utilizam a fluorescência. Câmaras montadas com tais lamelas mostram superfícies muito mais limpas, e os res...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer a FI Ataullakhanov para ajudar a projetar e fabricar câmaras de fluxo reutilizáveis, N. Dashkevich, N. e A. Gudimchuk Korbalev para fornecer imagens para figuras, N. Gudimchuk e P. Zakharov para o desenvolvimento de um protocolo e fornecendo reagentes para preparar sementes de microtúbulos marcadas com digoxigenina, A. Potapenko ajuda com edição de texto e outros membros da Grishchuk laboratório para dicas e discussões. Este trabalho foi financiado em parte pelo NIH conceder GM R01-098389 e uma concessão piloto da Pensilvânia Muscle Instituto ELG, que é um Kimmel Scholar, por RFBR concede 12-04-00111-a, 13-04-40190-H e 13 -04-40188-H, da Academia Russa de Ciências Presidium Grants (Mecanismos do Sistema de Integração Molecular e Biologia Celular Molecular programas e Molecular) para FI Ataullakhanov, NIH conceder GM R01 GM033787 para JR McIntosh, e um pós-doutorado bolsa da Fundação Dmitry Dynasty Zimin para VAV
Materiais
| Name | Company | Catalog Number | Comments |
| Table 1. Microscopy and other equipment. | |||
| Microscope | Zeiss Nikon | Axio Imager 2 Eclipse Ti | other microscope models capable of DIC and epifluorescence-imaging can be used |
| Objective | Zeiss Nikon | 420490-9900-000 CFI Apo 100x Oil 1.49 | 100X, DIC, 1.3-1.49 NA |
| Objective heater | Bioptechs | 150803, 150819-19 | |
| Fluorescent filter cube | Chroma | 49004 or 49008 41017 or 49020 | optimized for Rhodamine fluorescence optimized for GFP fluorescence |
| Acquisition software | freeware MicroManager Molecular Devices | not applicable MetaMorph 7.5 | http://valelab.ucsf.edu/~MM/MMwiki/ other software can be used to acquire images and for a particle tracking |
| EMCCD camera | Andor | iXon3, DU-897E-cs0-#BV | Highly sensitive EMCCD camera |
| Trapping laser | IPG Photonics | YLR-10-1064-LP | 1,064 nm laser, 10 W |
| Fluorescence excitation lasers | Coherent, Inc. Coherent, Inc. | Sapphire 488 LP Sapphire 552 LP | excitation of green fluorophores excitation of red fluorophores |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| Commercial flow chambers | Warner Instruments | RC-20 or RC-30 | |
| Perfusion pump | Cole Palmer Harvard Apparatus | Masterflex 77120-52 Pico Plus | Both pumps provide the required rate of liquid flow but a peristaltic pump may pulse at very slow speed. The flow with a syringe pump is more consistent for a wide range of rates but this pump has inertia. |
| Table 2. Microscopy chamber preparation. | |||
| Modified microscope slides for reusable chambers | Precision Glassblowing of Colorado | Custom order www.precisionglassblowing.com | Sonic slots in slides using schematics in Figure 1 |
| Polyethylene tubing | Intramedic | 427410 | I.D. 0.58 mm, O.D. 0.965 mm; use these tubes to connect assembled chamber to the pump and waste container |
| Polyethylene tubing | Intramedic | 427400 | I.D. 0.28 mm, O.D. 0.61 mm; use these tubes to make the reusable chamber |
| Regular microscope slides | VWR | 48312-003 | Other similar slides can be used |
| Coverslips | VWR | 48393-150, 48366-067 | Other similar coverslips can be used |
| Silicon sealant | World Precision Instruments | KIT, SILICON SEALANT 5 MIN CURE | |
| Epoxy glue | Loctite | 83082 | |
| Cyanoacrylate adhesive | Scotch 3M | AD114 | Or cyanoacrylate adhesive from other manufacturers |
| Table 3. Coverslips cleaning and coating. | |||
| Molecular Sieves, Grade 564 | Macron | 4490-04 | |
| Coverglass Staining Jar | Ted Pella, Inc. | 21036 | |
| Coverslip Ceramic Holder | Thomas Scientific | 8542e40 | |
| PlusOne Repel Silane | GE Healthcare Biosciences | 17-1332-01 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Anti-digoxigenin AB | Roche Applied Science | 11093274910 | |
| Table 4. Preparation of seeds and segmented microtubules. | |||
| Tubulin | purified from cow brains Cytoskeleton, Inc | T238P | For purification protocols see 49–51 Unlabeled porcine tubulin |
| Labeled tubulin | Cytoskeleton, Inc Invitrogen Invitrogen | TL590M C1171 (Rhodamine) A-2952 (Digoxigenin) | Rhodamine-labeled porcine tubulin Tubulin can be labeled with any amine-reactive dye as in reference52. |
| GMPCPP | Jena Biosciences | NU-405 | Aliquot and store at -70 °C |
| VALAP | Vaseline, lanolin, and paraffin at 1:1:2 by mass | see reference9 | |
Referências
- Desai, A., Mitchison, T. J. Microtubule polymerization dynamics. Ann. Rev. Cell Dev. Biol. 13, 83-117 (1997).
- Mitchison, T. M., Kirschner, M. W. Dynamic instability of microtubule growth. Nature. 312 (15), 237-242 (1984).
- Walker, R. A., Brien, O., et al. Dynamic Instability of Individual Microtubules Analyzed by Video Light Microscopy: Rate Constants and Transition Frequencies. J. Cell Biol. 107, 1437-1448 (1988).
- Gardner, M. K., Zanic, M., Gell, C., Bormuth, V., Howard, J. Depolymerizing Kinesins Kip3 and MCAK Shape Cellular Microtubule Architecture by Differential Control of Catastrophe. Cell. 147 (5), 1092-1103 (2011).
- Lombillo, V. A., Stewart, R. J., McIntosh, J. R. Minus-end-directed motion of kinesin-coated microspheres driven by microtubule depolymerization. Nature. 373, 161-164 (1995).
- Franck, A. D., Powers, A. F., Gestaut, D. R., Gonen, T., Davis, T. N., Asbury, C. L. Tension applied through the Dam1 complex promotes microtubule elongation providing a direct mechanism for length control in mitosis. Nat. Cell Biol. 9 (7), 832-837 (2007).
- Tran, P. T., Walker, R. A., Salmon, E. D. A metastable intermediate state of microtubule dynamic instability that differs significantly between plus and minus ends. J. Cell Biol. 138 (1), 105-117 (1997).
- Grishchuk, E. L., Molodtsov, M. I., Ataullakhanov, F. I., McIntosh, J. R. Force production by disassembling microtubules. Nature. 438, 384-388 .
- Coue, M., Lombillo, A., Richard, J. Microtubule Depolymerization Promotes Particle and Chromosome Movement In Vitro. J. Cell Biol. 112 (6), 1165-1175 (1991).
- Grishchuk, E. L., Spiridonov, I. S., et al. Different assemblies of the DAM1 complex follow shortening microtubules by distinct mechanisms. Proc. Natl. Acad. Sci. U.S.A. 105 (19), 6918-6923 (2008).
- Asbury, C. L., Gestaut, D. R., Powers, A. F., Franck, A. D., Davis, T. N. The Dam1 kinetochore complex harnesses microtubule dynamics to produce force and movement. Proc. Natl. Acad. Sci. U.S.A. 103 (26), 9873-9878 (2006).
- Westermann, S., Wang, H. -. W., Avila-Sakar, A., Drubin, D. G., Nogales, E., Barnes, G. The Dam1 kinetochore ring complex moves processively on depolymerizing microtubule ends. Nature. 440 (7083), 565-569 (2006).
- Grissom, P. M., Fiedler, T., Grishchuk, E. L., Nicastro, D., West, R. R., Mcintosh, J. R. Kinesin-8 from Fission Yeast A Heterodimeric , Plus-End – directed Motor that Can Couple Microtubule Depolymerization to Cargo Movement. Mol. Biol. Cell. 20, 963-972 (2009).
- McIntosh, J. R., Volkov, V., Ataullakhanov, F. I., Grishchuk, E. L. Tubulin depolymerization may be an ancient biological motor. J. Sci. 123, 3425-3434 (2010).
- Grishchuk, E. L., McIntosh, J. R., Molodtsov, M. I., Ataullakhanov, F. I. Force generation by dynamic microtubule polymers. Compr. Biophys. 4, 93-117 (2012).
- Asbury, C. L., Tien, J. F., Davis, T. N. Kinetochores' gripping feat: conformational wave or biased diffusion. Trends Cell Biol. (1), 38-46 (2011).
- Tien, J. F., Umbreit, N. T., et al. Cooperation of the Dam1 and Ndc80 kinetochore complexes enhances microtubule coupling and is regulated by aurora B. Cell Biol. 189 (4), 713-723 (2010).
- Gestaut, D. R., Graczyk, B., et al. Phosphoregulation and depolymerization-driven movement of the Dam1 complex do not require ring formation. Nat. Biol. 10 (4), 407-414 (2008).
- Schmidt, J. C., Arthanari, H., et al. The Kinetochore-Bound Ska1 Complex Tracks Depolymerizing Microtubules and Binds to Curved Protofilaments. Dev. Cell. 23 (5), 968-980 (2012).
- Brouhard, G. J., Stear, J. H., et al. XMAP215 is a processive microtubule polymerase. Cell. 132 (1), 79-88 (2008).
- Stumpff, J., Du, Y., et al. A Tethering Mechanism Controls the Processivity and Kinetochore-Microtubule Plus-End Enrichment of the Kinesin-8 Kif18A. Mol. Cell. 43 (5), 764-775 (2011).
- Su, X., Qui, W., Gupta, M., Pereira-Leal, J., Reck-Peterson, S. L., Pellman, D. Mechanisms underlying the dual-mode regulation of microtubule dynamics by Kip3/kinesin-8. Mol. Cell. 43 (5), 751-763 (2011).
- Helenius, J., Brouhard, G., Kalaidzidis, Y., Diez, S., Howard, J. The depolymerizing kinesin MCAK uses lattice diffusion to rapidly target microtubule ends. Nature. 441 (7089), 115-119 (2006).
- Gudimchuk, N., Vitre, B., et al. Kinetochore kinesin CENP-E is a processive bi-directional tracker of dynamic microtubule tips. Nat. Cell Biol. 15 (9), 1079-1088 (2013).
- Akhmanova, A., Steinmetz, M. Microtubule +TIPs at a glance. J. Sci. 20 (Pt 20), 3415-3419 (2010).
- Dixit, R., Barnett, B., Lazarus, J., Tokito, M., Goldman, Y., Holzbaur, E. Microtubule plus-end tracking by CLIP-170 requires EB1. Proc. Natl. Acad. Sci. U.S.A. 106 (2), 492-497 (2009).
- Grishchuk, E. L., Efremov, A. K., et al. The Dam1 ring binds microtubules strongly enough to be a processive as well as energy-efficient coupler for chromosome motion. Proc. Natl. Acad. Sci. U.S.A. 105 (40), 15423-15428 (2008).
- Akiyoshi, B., Sarangapani, K. K., et al. Tension directly stabilizes reconstituted kinetochore-microtubule attachments. Nature. 468 (7323), 576-579 (2010).
- McIntosh, J. R., Grishchuk, E. L., et al. Fibrils Connect Microtubule Tips with Kinetochores A Mechanism to Couple Tubulin Dynamics to Chromosome Motion. Cell. 135 (2), 322-333 (2008).
- Powers, A. F., Franck, A. D., et al. The Ndc80 kinetochore complex forms load-bearing attachments to dynamic microtubule tips via biased diffusion. Cell. 136 (5), 865-875 (2009).
- Umbreit, N. T., Gestaut, D. R., et al. The Ndc80 kinetochore complex directly modulates microtubule dynamics. Proc. Natl. Acad. Sci. U.S.A. 109 (40), 16113-16118 (2012).
- Gell, C., Bormuth, V., et al. Microtubule Dynamics Reconstituted In Vitro and Imaged by Single-Molecule Fluorescence Microscopy. Methods Biol. 95, 221-245 (2010).
- Dixit, R., Ross, J. L. Studying Plus-End Tracking at Single Molecule Resolution Using TIRF Microscopy. Methods Cell Biol. 95, 543-554 (2010).
- Beausang, F. J., Sun, Y., Quinlan, E. M., Forkey, N. J., Goldman, Y. Construction of Flow Chambers for Polarized Total Internal Reflection Fluorescence Microscopy (polTIRFM). Cold Spring Harbour Protoc. 6, 712-715 (2012).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP Hydrolysis in Microtubule Dynamics: Information from a Slowly Hydrolyzable Analogue, GMPCPP. Mol. Biol. Cell. 3, 1155-1167 (1992).
- Grishchuk, E. L., Ataullakhanov, F. I. In Vitro Assays to Study the Tracking of Shortening Microtubule Ends and to Measure Associated Forces. Methods Cell Biol. 95, 657-676 (2010).
- Gutiérrez-Medina, B., Block, S. M. Visualizing individual microtubules by bright field microscopy. Am. J. Phys. 78 (11), 1152-1159 (2010).
- Volkov, V. A., Zaytsev, A. V., et al. Long tethers provide high-force coupling of the Dam1 ring to shortening microtubules. Proc. Natl. Acad. Sci. U.S.A. 110 (19), 7708-7713 (2013).
- Laan, L., Pavin, N., et al. Cortical dynein controls microtubule dynamics to generate pulling forces that position microtubule asters. Cell. 148 (3), 502-514 (2012).
- Myster, S. H., Knott, J. A., O'Toole, E., Porter, M. E. The Chlamydomonas Dhc1 gene encodes a dynein heavy chain subunit required for assembly of the I1 inner arm complex. Mol. Biol. Cell. 8, 607-620 (1997).
- Lombillo, V. A., Coue, M., McIntosh, J. R. In vitro motility assays using microtubules tethered to Tetrahymena pellicles. Methods Cell Biol. 39, 149-165 (1993).
- Hyman, A., Chrétien, D., Arnal, I., Wade, R. Structural changes accompanying GTP hydrolysis in microtubules: information from a slowly hydrolyzable analogue guanylyl-(alpha,beta)-methylene-diphosphonate. J. Cell Biol. 128 (1-2), 117-125 (1995).
- Park, M., Kim, H., Kim, D., Song, N. W. Counting the Number of Fluorophores Labeled in Biomolecules by Observing the Fluorescence-Intensity Transient of a Single Molecule. Bull. Chem. Soc. Jap. 78, 1612-1618 (2005).
- Welburn, J. P. I., Grishchuk, E. L., Backer, C. B., Wilson-Kubalek, E. M., Yates, J. R., Cheeseman, I. M. The human kinetochore Ska1 complex facilitates microtubule depolymerization-coupled motility. Dev. Cell. 16 (3), 374-385 (2009).
- Efremov, A., Grishchuk, E. L., Mcintosh, J. R., Ataullakhanov, F. I. In search of an optimal ring to couple microtubule depolymerization to processive chromosome motions. Natl. Acad. Sci. U.S.A. (48), 19017-19022 (2007).
- Itoh, T., Hisanaga, S., Hosoi, T., Kishimoto, T., Hotani, H. Phosphorylation states of microtubule-associated protein 2 (MAP2) determine the regulatory role of MAP2 in microtubule dynamics. Biochemistry. 36 (41), 12574-12582 (1997).
- Oguchi, Y., Uchimura, S., Ohki, T., Mikhailenko, S. V., Ishiwata, S. The bidirectional depolymerizer MCAK generates force by disassembling both microtubule ends. Nat. Biol. (6), 1-8 (2011).
- Kishino, A., Yanagida, T. Force measurements by micromanipulation of a single actin filament by glass needles. Nature. 334, 74-76 (1988).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann. NY Acad. Sci. 253, 107-132 (1975).
- Weingarten, M. D., Lockwood, A. H., Hwo, S., Kirschner, M. W. A Protein Factor Essential for Microtubule Assembly. Proc. Natl. Acad. Sci. U.S.A. 72 (5), 1858-1862 (1975).
- Widlund, P. O., Podolski, M., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Mol. Biol. Cell. 23 (22), 4393-4401 (2012).
- Hyman, A., Drechsel, D., et al. Preparation of Modified Tubulins. Methods Enzymol. 196, 478-485 (1991).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados