Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка сегментированных микротрубочек исследовать движение приводится в действие разборки микротрубочек Ends
В этой статье
Резюме
Микротрубочки нестабильны полимеры и их переключение между ростом и сокращением является стохастической и трудно контролировать. Здесь мы опишем протокола с сегментированные микротрубочки с photoablatable стабилизирующих колпачками. Деполимеризация сегментированных микротрубочек могут быть вызваны с высоким временным и пространственным разрешением, тем самым способствуя анализ движений с разборки концах микротрубочек.
Аннотация
Микротрубочек деполимеризации может обеспечить силу для перевозки различных белковых комплексов и белковые покрытием бусы в пробирке. Основные механизмы, как полагают, играют жизненно важную роль в микротрубочки зависит движений хромосом во время деления клеток, но соответствующие белки и их точные роли плохо определены. Таким образом, существует растущая потребность в разработке анализов, с которой для изучения такой моторику в пробирке с использованием очищенных компонентов и определенный биохимический среду. Микротрубочки, однако, по сути своей нестабильными полимеры; их переключение между ростом и сокращением является стохастической и трудно контролировать. Протоколы мы описываем здесь воспользоваться сегментированных микротрубочек, которые сделаны с photoablatable стабилизации шапки. Деполимеризация таких сегментированных микротрубочек могут быть вызваны с высоким временным и пространственным разрешением, тем самым способствуя исследования моторики на разборки концах микротрубочек. Этот метод может быть использован до примерноRRY количественный анализ числа молекул в флуоресцентно меченных белковых комплексов, которые движутся поступательно с динамическим микротрубочек заканчивается. Для оптимизации отношения сигнал-шум в этом и других количественных флуоресцентный виды анализа, покровные должны рассматриваться, чтобы уменьшить неспецифическую поглощение растворимых дневно-меченых белков. Подробные протоколы предоставляются учитывать неравномерность флуоресцентного освещения, и определить интенсивность одной флуорофором использованием эквидистантный Gaussian нужным. Наконец, мы опишем использование сегментированных микротрубочек учиться микротрубочек в зависимости от движений микросфер белковых покрытием, обеспечивая полное представление о способности различных моторных и nonmotor белков в пары микротрубочек деполимеризации к поступательного движения грузов.
Введение
Микротрубочки высоко консервативны цитоскелета структур, которые важны для клеточного архитектуры, подвижности клеток, клеточного деления, и внутриклеточного транспорта 1. Эти динамические полимеры собрать из тубулина в присутствии ГТФ, и они спонтанно переключения между ростом и сокращения 2. Микротрубочки являются очень тонкими (всего 25 нм в диаметре), следовательно, специальные оптические методы для повышения контрастности должен быть использован для наблюдения микротрубочки с помощью оптического микроскопа. Предыдущая работа с этих полимеров рассмотрены их динамическое поведение с использованием дифференциальной помехи контраст (DIC) 3. Этот и подобные исследования в пробирке показали, что в типичных условиях эксперимента, микротрубочки пройти катастрофу и перейти к деполимеризации редко, раз в 5-15 мин (эта частота для 7-15 мм растворимого концентрации тубулина рассматриваемой при 28-32 ° С ) 4. Различные методы, таким образом, было предложено индукэ микротрубочек деполимеризации в управляемом режиме. Микротрубочек сокращение может быть вызвано смывая растворимый тубулина 5,6, резка микротрубочки с помощью лазерного луча 7, или с использованием сегментированного микротрубочек 8, как описано здесь. Предыдущие работы с использованием сегментированные микротрубочки, а также стохастически переключения полимеры, было установлено, что небольшие внутриклеточные грузы, такие как хромосом, везикулы и белковых покрытием шариков, можно переместить на концах укорочение микротрубочек 9-13. Это явление, как полагают, прямое влияние на хромосомных движений в митотических клетках, и основные механизмы находятся в стадии активного расследования 14-16.
Недавно люминесцентные основе методики, в том числе полного внутреннего отражения флуоресценции (TIRF) микроскопии, были использованы для изучения моторики с динамическим микротрубочки заканчивается 17-24. Преимущество этого подхода состоит в том, что она позволяет исследование взаимодействияс между микротрубочек и микротрубочек-связывающих белков в режиме реального времени с использованием белков, меченных разными флуорофорами. Несколько белковые комплексы были найдены двигаться поступательно с удлинения и / или сокращения микротрубочек концы. Они включают в себя микротрубочек связанных белков Dam1 10,12,18, Ska1 19, и XMAP215 20, а также кинезин двигатели Kif18A 21,22, MCAK 23 и CENP-E 24. Эти белки обладают поступательного наводку отслеживание, которое принципиально отличается от классических наконечника отслеживания белков, как EB1 25. Хотя EB1 молекулы и связанные с ними партнеры по-видимому, остаются стабильно связан с динамическим микротрубочек заканчивается, отдельные молекулы остаются связанными с наконечником микротрубочек только ~ 0,8 сек, быстро обмена с растворимым бассейне 26. В противоположность этому, поступательного наконечник-трекеры, как Dam1, путешествовать с микротрубочек заканчивается для многих микрон, и их связь с советами микротрубочек может длиться млюбые секунд. Кончик время ассоциация, а также в результате скорость отслеживания, сильно зависит от числа молекул, которые формируют наконечник отслеживания комплекс 27. Большие ансамбли белка, как правило, гораздо лучше наконечник-трекеры. Например, такие сложные агрегаты как изолированных дрожжей кинетохорах может оставаться в сочетании с микротрубочки заканчивается в течение нескольких часов 28. Некоторые микротрубочки-связывающие белки, например кинетохор белкового комплекса Ndc80, как было установлено, не сможет отслеживать с микротрубочки заканчивается на уровне одной молекулы, но Ndc80 очень эффективно в соединительном движение шарика груза 19,29-31. Таким образом, чтобы понять механизм наконечника слежения различными белковыми комплексами, а также их биологических функций, важно изучить наконечник отслеживания в зависимости от числа молекул в наконечнике отслеживания комплекса, а также для определения Способность этих комплексов проявляют коллективную подвижность на поверхности шарика груза.
Ниже мы приводим подробные протоколы для подготовки и проведения экспериментов с сегментированных микротрубочек (рис. 1А). Во-первых, коммерчески доступные предметные стекла были изменены, чтобы прикрепить короткую трубку из полиэтилена (Протокол 1). Многоразовые камеры микроскопии поток затем собирают из такого слайда и химически или плазменный очищены и Силанизированные покровное (протокол 2) 32-34. В результате объем камеры составляет всего 20-25 мкл (или как малые, как 15 мкл, см. примечание 3 в Протоколе 1), в том числе объем впускной трубки. Коммерчески доступные камеры потока также могут быть использованы, но их объем, как правило, больше, что приводит к ненужному белков. Если увеличение размера камера используется, объем всех решений в поле ниже протоколов должны быть расширены пропорционально. Семена микротрубочек затем получают, например, с помощью медленно гидролизуемую аналога ГТФ, GMPCPP (Гуанозин-5'-[(α, β)-methyleno] трифосфат) (протокол 3, см. также Хайман и др.. 35). Семена иммобилизуют на очищенную покровное и поверхность впоследствии заблокирован, чтобы предотвратить неспецифическую абсорбцию других белков 32 (протокол 4 описывает семена иммобилизацию с помощью дигоксигенин). Сегментированного микротрубочки могут быть получены с использованием протокола 5. Основным обоснованием для такого подхода является то, что динамические полимеры микротрубочки, образующие в присутствии ГТФ, можно стабилизировать временно, добавив короткие "шапки" стабильных сегментов тубулина, которые содержат GMPCPP. Эти шапки также содержат Родамин-меченого тубулина, таким образом, они могут быть удалены, просто освещая поле зрения с помощью лазера на 530-550 нм или дуговой ртутной лампы (протокол 6) 36. Интенсивность флуоресценции сигнала наконечник отслеживания затем могут быть использованы для оценки количества молекул, которые путешествуют с разборки концах микротрубочек, принимая во внимание неравномерность освещения поля микроскоп (протокол 7). Аналогичный подход может быть использованизучить взаимодействие между деполимеризации микротрубочек и белка покрытием шариков, полученный, как описано в (27 протокола 8). Некоторые белки будут легко связываются с стенок сегментированных микротрубочек, но лазерные пинцеты также может быть использован для хранения шарик около микротрубочек стене, тем самым способствуя его связывания.
протокол
Необходимое оборудование: Эксперименты, описанные ниже, требуют светового микроскопа оборудованная для ДВС и флуоресцентной томографии (табл. 1). Яркий поле светодиодная подсветка может быть использована, чтобы значительно улучшить обнаружение покровное подключением семян микротрубочек 37, которые трудно наблюдать с обычной галогеновой лампы. Для контроля потока жидкости в камерах микроскопии, растворы должны быть обменены с использованием перистальтического насоса, способного скоростей потока от 10-100 мкл / мин. Шприцевой насос также может быть использован, но следует позаботиться, чтобы избежать воздушных пузырей, которые могут образовывать, когда скорость подачи изменяется резко. Для обработки белковых покрытием шарики, например, чтобы привести их ближе к сегментированной микротрубочек стене, нм лазерный луч незатухающей волны 1064 может быть введен в оптической оси микроскопа и ориентирована с высокой числовой апертуре объектива (1.3 или выше), чтобы получить ловушка. Для количественного анализа флуоресцентногоИнтенсивность одиночных молекул возбуждающий свет должен быть обеспечен лазерного источника базы поскольку интенсивность этого источника света является более стабильным, чем генерируется ртутной лампы. Чтобы свести к минимуму механические вибрации, микроскоп должен быть помещен на оптическом столе. Более сложное оборудование требуется для изучения движения гранул с деполимеризующим микротрубочек заканчивается под постоянной силой, и для измерения сигналов с одного выстрела силы 11,38,39, эти методы будут описаны в другом месте.
1. Производство Многоразовые Проточные камеры
Стеклянные горки для многократного использования проточных камерах можно заказать у местного производственного предприятия стекла с использованием схемы на рисунке 1b (см. таблицу 2 для подробной информации о нашей поставщика). При ультразвуковой фрезерования изменить регулярные микроскопа (75 мм х 25 мм, толщина 1,0 мм), чтобы сделать два паза 15 ± 1 мм длиной, 1,0 ± 0,1 мм широкие и глубокие 0,8 ± 0,05 мм.Расстояние между ближайшими концами должно быть 14 ± 1 мм; это расстояние является оптимальным для камеры в сборе с 22 мм х 22 мм покровное. См. Таблицу 2 для списка других материалов.
- Поставьте длиной 100 мм полиэтиленовую трубу (диаметр 0,61 мм, таблица 2) в каждой канавки на слайде, оставив ~ 5 мм свесы на внутренних концах канавок. Закрепите трубки внутри канавок с цианакрилатного клея, встраивание трубы полностью внутри канавок.
- Заполните канавки с эпоксидным клеем, избегая при этом разлив клей внутри трубок. Пусть клей сухой в течение ~ 1 день.
- С острым лезвием бритвы вырезать затвердевший клей масса 3-4 мм от дистального конца каждого сайта св зывани, удаление части проксимального к центру слайда. Трубы должны оставаться в своих пазах. Удаление проксимальных отделах также вырезать и удалить внутренние свесы, создавая ровную поверхность с двумя отверстиями труб.
- Заполните шприц с водой и испытанияли трубки работают должным образом. Если жидкость течет свободно, капнуть каплю эпоксидного клея (~ 5 мм в диаметре) на внешних концах рощ, сухих на 1 день (Рисунок 1D). Это сделает камеры более долговечны, поэтому они могут быть использованы повторно в течение многих месяцев.
Примечание 1: Чтобы камеру для инвертированного микроскопа, слайды должны быть изменены дополнительно сделать два небольших отверстий на противоположных концах канавок (рис. 1в). Вставьте трубки через отверстия в слайде, согнуть трубки и втулки плотно внутри канавок (рис. 1E). Выполните шаги 1.2-1.4, но удалить эпоксидный клей со всей поверхности, которая будет использоваться, чтобы сделать проточную камеру.
Примечание 2: Для уменьшения объема камеры, использовать фрезерование сделать два углубления 0,050 глубокие ± 0,005 мм, оставляя центральную часть слайда широкий 5,0 ± 0,5 мм и слегка повышенной (см. "травления области" на фиг.1В и 1С). При тон течь камера в сборе (как описано ниже), поместите двухсторонний скотч внутри этих углублений.
Примечание 3: Для повторного использования эти модифицированные слайды, после окончания эксперименты удалить покровное и двухсторонний скотч лезвием бритвы. Снять прокладку путем снятия его прочь и, протерев слайд с 70% этанола. Поместите слайд в контейнер с 1-2% в лаборатории для мытья посуды, приложить трубку к перистальтического насоса и заливать 50-70 мл, следовать с равным объемом деионизированной воды, сухой и хранить в отсеке пыли.
2. Подготовка покровные
Этот протокол занимает 6-8 ч и поможет подготовить 12 покровные. Вам понадобится один керамический держатель покровное и 3 покровного окрашивания банки с крышками, объем банка должно быть 15 мл, так что каждый проведет 4 покровные сложены вместе. Стеклянная банка с крышкой (250 мл) следует использовать для инкубации покровные с силана. Использовать регулярные № 1 покровные стекла (22 мм х 22 мм или 22 х 30 мм, см. таблицы 2 и 3, чтобы получить список материалов). Все шаги должны проводиться в вытяжном шкафу, в перчатках.
- Положите покровные в стекло покровное окрашивания банки и заполнить банки с ацетоном. Инкубировать в течение 1 часа, мыть 10x деионизированной водой.
- Инкубируйте покровные 10 мин с этанолом и снова мыть 10x деионизированной водой.
- Приготовьте раствор "Пиранья". Поместите 60 мл раствора перекиси водорода (30% в воде) в термостойкой стеклянный сосуд и медленно добавляют 100 мл серной кислоты (конечный отношение кислоты к раствору перекиси водорода 5:03). Решение будет нагреваться, это нормально, но будьте осторожны. Пиранья решение чрезвычайно едкий! Используйте толстый халат, перчатки и очки!
- Заполните окрашивания покровное банки с решением "Пиранья", закройте крышки и поместить банки в ванну с водой, предварительно нагретой до 90 ° С в течение 1 часа.
- Слейте "Пиранья" Solutiна и распоряжаться им, как предписано в соответствии с правилами техники безопасности на рабочем месте. Вымойте покровные 10x деионизированной водой.
- Заполните покровное окрашивания банки с 0,1 М КОН, инкубировать 10 мин и промывают 10 раз деионизированной водой. Это нейтрализует любые остатки кислот, оставленные на покровные после "пираньи" лечения.
- Сухие покровные один в то время, удерживая каждый покровное с тефлоновым покрытием плоских краями пинцета (чтобы минимизировать ущерб поверхности стекла) и в то время как дует сжатый сухой азот. Убедитесь, что покровные сушат полностью, потому что силан решение обладает высокой реакционной способностью с водой.
- Стек сушеные покровные в керамических держателей (12 покровные одно держателя), которые должны быть тщательно высушенных азотом. Держите керамические держатели покрытые чтобы избежать пыли от прилипания к поверхности покровного.
- Покройте основание 250 мл стеклянную банку (6 см в диаметре) с молекулярных сит, класс 564, для поглощения воды.
- Заполните банку 200 млРешение PlusOne Repel Силан и медленно опускайте керамический держатель с покровные в банке, закройте крышку и выдержать в течение 5 минут при комнатной температуре. Это создаст гидрофобное покрытие на поверхности покровное.
- Медленно снимите держатель с покровные из банки и передача покровные по одному в окрашивания покровное банок, наполненных метанола.
- Поставьте металла или стекла пьедестал в водохранилище звуковой ванной, такой, что окрашивание покровное кувшин погружают на 2/3 его высоты. Разрушать ультразвуком при 70 Вт в течение 20 мин, изменение метанольного раствора каждые 5 мин, затем смыть 10x деионизированной водой. Если силанизация работал должным образом, покровные появится сухой, когда удаляются из воды.
- Тщательно удаления остаточной воды с использованием азота, как описано выше.
- Прослоить покровные с Kimwipes избежать поверхность-поверхность контакта между покровные. Покровные может храниться в герметичном контейнере в течение нескольких недель при комнатной температуре.
NОТЕ 1: Шаги 2.1-2.6 можно заменить очистки покровные с Plasma чистого течение 15 мин при 30 Вт, что значительно снижает общее время подготовки. Давление внутри камеры очистки устанавливается на 100-200 мторр. Оба атмосферного кислорода и сжатого могут быть использованы. Стек плазменные очисткой покровные в керамических держателей и перейдите к шагу 2.7.
3. Подготовка GMPCPP-стабилизированных микротрубочек Семена
Эта процедура длится около 1 ч, и полученные семена микротрубочек стабильны в течение 1-2 суток при комнатной температуре. См. таблицу 4 для списка реагентов.
- Смешайте на льду:
- 10 мкл немеченный тубулина (100 мкмоль, таблица 4) в BRB-80 буфера (80 мм Трубы, 1 мМ EGTA, 4 мМ MgCl 2, рН 6,9 с КОН; добавка с 1-2 мМ ДТТ свежих аликвоты для каждого эксперимента).
- 2,6 мкл меченных дигоксигенином тубулина (табл. 4). Регулировка громкости в зависимости от подготовки,таким образом, чтобы конечное соотношение помечены, чтобы немеченого тубулина составляет ~ 1:10. Хорошо перемешать с помощью пипетки.
- 1,4 мкл 10 мМ GMPCPP (конечная концентрация 1 мМ)
- Инкубировать 15 мин при 35 ° С, семена будут расти 2-3 мкм в длину. Отрегулируйте время, если различной длины микротрубочек желательно.
- Добавить 35 мкл BRB-80 (предварительно нагретой до 35 ° С), перемешать с помощью пипетки и центрифуги в течение 15 мин при 25000 х г для осаждения семена при комнатной температуре.
- Удалите супернатант, мыть гранул, осторожно добавляя и удаляя 50 мкл теплой BRB-80.
- Ресуспендируют гранул хорошо в 25 мкл BRB-80.
4. Присоединение микротрубочек Семена в покровные
Протоколы 4 и 5 потребует 2-3 ч, так что два проточных камерах используются в день.
- Соберите проточную камеру в соответствии с инструкциями производителя, используя Силанизированные покровные и перейдите к шагу 4.2. При использовании на заказ покровные (Протокол 1), выполните следующие действия белвл.
- Прикрепите две части двухсторонней ленты (5 мм х 30 мм) вдоль центральной ~ 5 мм большой площади, положить Силанизированные покровное на вершине ленты, нажмите твердо.
- Заполнить камеру с BRB-80 через одну из труб и подключить обе трубки с круглыми зубочистки.
- Сожмите небольшую каплю двухцветного Kwik ролях герметика на вершине небольшой пластиковой чашке Петри, и смешать быстро, но тщательно с помощью зубочистки. Герметик станет зеленым; применить немедленно, тщательно герметизировать все края покровного стекла. Если герметик проникает слишком глубоко под покровное, открыть один из труб, удалив зубочистки пробку и нежный давление, чтобы предотвратить герметик от утечки внутри трубок.
- Пусть камеры высохнуть в течение 10 мин и убедитесь, что поток не ограничен прежде чем двигаться дальше.
- Поместите камеру на столик микроскопа нагретого до 32 ° С и прикрепить один из трубок к насосу, который будет качать жидкость из. Длина впускной трубыдолжны быть сведены к минимуму, чтобы избежать ненужных потерь реагентов: рекомендуемая длина составляет 5-7 см. Погрузитесь этой цели в 0,5 мл флакон с BRB-80 буфера. Это и все решения ниже следует предварительно нагретой до 32-35 ° С.
- Нанесите мягкое давление с помощью насоса или просто снять конец выходной трубки, чтобы выдавить пузырьки воздуха, которые могут образовывать иногда, когда вилка впускная труба будет удален.
- Установите скорость насоса при 100 мкл / мин. Промыть 2-х томах палаты по борьбе с дигоксигенин антител разбавленных 1:30 в BRB-80, инкубировать 15 мин, чтобы позволить антител адсорбции.
- Промыть 5-10 объемами камеры теплой BRB-80, инкубировать 10 мин с 1% Pluronic F-127 в BRB-80, чтобы блокировать гидрофобную поверхность силанизированного покровное.
- Промыть 5-10 объемами камеры подвижности буфера (BRB-80 с добавкой 0,4 мг / мл казеина).
- Уменьшите скорость насоса до 10 мкл / мин и заливать семена микротрубочек разводненной 1:200-1:600 в 30-40 мкл буфера подвижности. Выдержите 15 мин содействовать связывание семян до покровного стекла адсорбируют антител.
- Промыть камеру при 100 мкл / мин с 400 мкл буфера подвижности для удаления несвязанного материала.
Примечание 1: В результате плотность семян должна быть 10-30 микроскоп поле (рис. 2А). Для устранения используйте дневно с надписью тубулина в процессе полимеризации (шаг 3.1) для более легкого обнаружения покровное подключением семян.
Примечание 2: аксонем, полученные из Chlamydomonas 40 или других биологических источников, а также Пленочные из лизированных и deciliated Tetrahymena клеток 41 также может быть использован как микротрубочки структурообразователи. Эти нуклеаторов полезны для создания небольших массивов микротрубочек, и являются предпочтительными, когда микротрубочки с определенного числа протофиламентов желательны (GMPCPP семян зарождается один микротрубочек, который содержит ≥ 14 протофиламентов 42). Эти структуры могут быть прикреплены к очищенных покровные по неспецифической абсорбции, но Аттаchment обычно менее стабильны по сравнению с приложением на основе антител, особенно при использовании Силанизированные покровные.
5. Подготовка сегментированной микротрубочек
Все объемы растворов ниже приведены для объем камеры 15-20 мкл; возрастать пропорционально, если используется больше камера.
- Prewarm немеченого тубулина смесь (45 мкл подвижность буфера с добавлением 1 мМ Mg-GTP и 10-15 мкМ немеченого тубулина) в течение 30 сек при 35 ° С Заливать при 30 мкл / мин.
- Монитор рост микротрубочек с ОПК оптики (рис. 2В, видео 1). Во 5-7 мин инкубации микротрубочки обычно растут длиной ~ 10 мкм.
- Подготовка родамин-тубулина смеси (65 мкл подвижность буфера с добавлением 0,5 мМ GMPCPP и 2-5 мкМ родамин-меченого тубулина с 0,5-1 молярном соотношении родамина к тубулина) и нагревают раствор при 35 ° С в течение 30 сек.
- Заливать сразу на 30 μл / мин. Выдержите в течение 8-10 мин, чтобы способствовать формированию устойчивых люминесцентных шапки на кончиках микротрубочек. Стабильные сегменты микротрубочки также зарождаются спонтанно и будут видны с ОПК оптики.
- Промыть камеру и с 100 мкл буфера подвижности при 20 мкл / мин, чтобы удалить тубулина и нуклеотидов, а также растворимых фрагментов микротрубочек.
- С ДВС, подтверждают, что микротрубочки могут видеть (рис. 2D); их число, однако, должна уменьшиться, потому что многие микротрубочки разбирать во время укупорки (Видео 2 показан типичный поле с сегментированных микротрубочек).
Примечание 1: сегментированные микротрубочки являются очень стабильными и могут быть использованы в течение не менее 2 часов. Однако время жизни этих микротрубочек уменьшается при чрезмерном обмене раствора, или, если 2-меркаптоэтанола используется в буфере изображения.
6. Экспериментальное наблюдение Отслеживание белка с деполимеризующих микротрубочек Ends
- IntrodUCE 30-50 мкл флуоресцентного белка (0,1-20 нМ) в камеру на 10 мкл / мин. Если белок придерживаясь покровного стекла видно, дополнить буфер подвижности с 4-8 мг / мл BSA. Alexa488-Dam1 наконечник отслеживания дополнительно требуется 10 мМ DTT или 0,5-1% βME 10.
- Ограничьте поле освещения с использованием микроскопа полевую диафрагму, чтобы избежать ненужного отбеливание и демонтаж микротрубочек.
- Начните приобретение видео с помощью GFP фильтр куб, затем переключиться на родамина фильтра куба, не прерывая записи изображения. Красные сегменты на концах микротрубочек должны быть четко виден; они начнут исчезать и распадаются быстро (Видео 3).
- Продолжить, чтобы осветить до крышки почти не исчезнут (как правило, в течение 10-20 сек, но на этот раз будет больше времени для крышек, выращенных с более низким отношением маркировки родамина), и вернуться к GFP канала для записи белок слежения с микротрубочек разборки.
- АнализПолученные последовательности путем построения kymographs, т.е. двумерные изображения, которые показывают интенсивность флуоресценции вдоль оси микротрубочек течение различных периодов времени во время наблюдения) с помощью Metamorph, свободно доступную ImageJ или другое программное обеспечение для обработки изображений (рис. 2е).
Примечание 1: скорость Приобретение должна быть скорректирована в зависимости от сроков наблюдаемых событий. Рекомендуемая норма составляет 2-3 кадров в секунду (FPS) для медленные, кольцо размера Dam1 комплексы 27 но время приобретение для одиночных молекул должно быть> 20 кадров в секунду 19.
Примечание 2: высокочувствительный EMCCD, например ANDOR iXon3, требуется для быстрой записи наконечника отслеживания событий с деполимеризующих микротрубочек. Рекомендуемые настройки для Андор iXon3 камеры являются: усиления 5x, Е. М. получить 200, 1 МГц скорость считывания, 16-битный режим датчика, 80 мс время экспозиции.
Примечание 3: Использование TIRF микроскопии улучшит отношение сигнал-шум, однако, более короткие микротрубочки должны быть использованы, например, тхат флуоресцентные стабилизирующие колпачки остаются в пределах досягаемости затухающих области.
7. Количественный анализ размера молекул микротрубочек Tip-отслеживания комплексов
Основанием для этого подхода является то, чтобы определить число молекул в наконечник отслеживания комплекса путем нахождения отношение общей интенсивности флуоресценции наконечника отслеживания комплекса к интенсивности одного флуорофора. Этот подход может быть применен к GFP-белок и белков, меченных флуоресцентными красителями, но это может привести к недооценке число молекул в совет-слежения комплексов если некоторые белковые молекулы в подготовке не люминесцентные.
- Запись Фотообесцвечивания кинетика для флуоресцентной меченых молекул белка.
- Сборка регулярного микроскопии камеру с помощью nonmodified предметное стекло, две полоски двухсторонней ленты и чистую покровное, которые могут быть получены с использованием протокола весь 2, или только шаги 2.1-2.6 этогоПротокол.
- Добавьте примерно 50 нМ белка в подвижности буфера, кратко промыть моторики буфера и уплотнения камеры с VALAP (табл. 4). Оптимизация концентрации белка для получения поле с равномерно распределенных пятен (рис. 3А), представляющих одиночных молекул и их маленьких агрегатов (тримеров и тетрамеров, которые могут образовывать спонтанно в растворе или могут появиться, когда несколько одиночные молекулы близко друг к другу и не могут быть решены) . Этот шаг является очень важным для получения мульти-пик распределение фотообесцвечивания шагов и точного определения размером шага (см. ниже).
- Сведение к минимуму лазерный интенсивности освещения, при котором отдельные флуоресцентные пятна все еще видимы; с более низкой освещенности увеличивается время фотообесцвечивание, так больше фотообесцвечивания следы могут быть получены. Также минимизировать время экспозиции, чтобы уменьшить вероятность более одного флуорофора отбеливания в течение одного кадра. Рекомендуемое значениедля Андор iXon3 камеры: усиления 5.0x, Е. М. получить 999, 10 МГц скорость считывания, 50-100 мс время экспозиции.
- Фокус на поверхности покровного стекла, закрыть затвор подсветки, перейти к свежим области, открыть затвор освещения и получать изображения, пока все комплексы не отбеливают (далее упоминается как изображения (х, у)).
- Исправьте полученные изображения для неравномерности освещения (рис. 3В).
- Приготовьте раствор любого флуорофором, например, 1 мкМ Флуоресцеинизотиоцианат (FITC) в BRB-80. Такое решение может быть получено заранее, на аликвоты и хранили при -20 ° С.
- Соберите камеру, как в разделе 7.1.1, но использовать обычный покровное. Добавить флуорофора решение и уплотнения камеры с помощью VALAP.
- Соберите> 50 изображений всему полю микроскопа: двигаться на сцену, чтобы новый небеленой области в то время как освещение затвор закрыт, и приобрести изображения сразу после открытия затвора.
- Создание среднюю проекцию этого стека и фильтр с размывание Гаусса при радиусе 5 пикселей с использованием ImageJ или другое программное обеспечение (рис. 3C). Полученное изображение представляет собой распределение интенсивности освещения поля (Illum (х, у), где х и у соответствуют координатам пикселя).
- Определить максимальную пикселя яркость этого изображения (Max (Illum)).
- С закрытой освещения затвором и с помощью же настройки камеры, как в разделе 7.2.3 приобрести одно изображение, определить среднюю интенсивность пикселя этого изображения; это значение соответствует CN, шума камеры.
- Используйте приведенные выше значения и изображение (Illum (х, у)), чтобы нормализовать экспериментальный изображение (IMG (х, у)), используя следующее выражение:
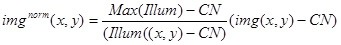
Используйте полученное IMG норму (х, у) для количественного анализа бриghtness стационарных люминесцентных комплексов, а также по нормализации изображения с откидными лавируя комплексов (рис. 3D).
- Определите интенсивность одной флуорофором.
- Использование нормированные изображения IMG норму (х, у) и любое программное обеспечение для обработки изображений выберите флуоресцентный место с круговой области (5-6 пикселей в диаметре) и определить его интегральной интенсивности для всех кадров, создавая фотообесцвечивания следы. Избегайте очень яркий точки (> 5 раз ярче, чем диммер них).
- Используя ту же круглую инструмент область, выберите по крайней мере 3 месте без области, генерировать соответствующие фотообесцвечивания следы, средние и подходят с функцией экспоненциального распада.
- Сведите эту кривую интенсивности фона, чтобы соответствовать экспериментальные точки времени и вычесть его из кривых фотообесцвечивания.
- Гладкая фотообесцвечивания кривые (в среднем с скользящим окном 3-5 баллов). Осмотрите полученные кривые иотбрасывать любую кривую, которая показывает резкое увеличение флуоресценции или отсутствие очевидного отбеливания (рис. 3Е).
- Для каждого из оставшихся кривых (обычно 50-70% от общего количества кривых), визуально выбрать окончательный плато, когда флуоресцентное пятно беленой. Сократить этот сегмент, чтобы оставить только ~ 100 очков и в среднем эти интенсивности. Вычтите это значение из сокращенный фотообесцвечивание кривая минимизировать небольшие вариации является фоновые уровни и уменьшить размер фонового пика (ниже).
- Постройте гистограмму интенсивности для всех временных точках из 20 или более фотообесцвечивания кривых (> 1000 точек время). Гистограмма должны обладать по крайней мере, 4 различных пиков (см. примечание 2).
- Установите гистограмму с равноудаленной распределения Гаусса 10,43 использованием MATLAB, Mathematica или подобное программное обеспечение (рис. 3F):
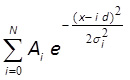
весздесь я и σ I, D и N являются подгоночных параметров. Параметры A I и σ я соответствуют амплитуду и ширину я-го пика, г является расстояние между пиками, N является целым числом, что соответствует общему числу пиков в распределении. Если центры первых 3 или более пиков показать визуально хороший матч с оборудованной линии, расстояние между этими пиками (параметр г) соответствует интенсивности флуоресценции одного флуорофора.
Примечание 1: Количество обследованных точек (раздел 7.3.6) должна быть увеличена, если система микроскопии показывает значительные колебания или есть еще один источник шума (например нестабильной лазерного луча).
Примечание 2: Это имеет важное значение для получения> 3 пика для точного анализа с равноудаленной Гаусса нужным. Если меньше пиков получаются, ложное (например двойной) размер шага может быть полученакогда условия освещения не являются оптимальными, например, когда точки отбелить слишком быстро и отдельные шаги не будут решены хорошо.
- Определение молекулярной размер наконечника отслеживания комплекса.
- Используйте изображений собранных с протокола 6 и выбрать первые 2-4 кадров, которые были приобретены сразу после открытия затвора. Если поле было освещено в течение некоторого времени, прежде чем наблюдалось верхушка слежения, оценить первоначальную интенсивность из кинетики фотообесцвечивания в тех же экспериментальных условиях.
- Среднее значение на основании выбранных кадров и нормализовать полученное изображение как в разделах 7.2.5-7.2.7.
- Измерьте интегральной интенсивности флуоресцентного наконечника отслеживания комплекса, используя тот же размер области, как и в разделе 7.3.1.
- Измерьте интегральной интенсивности 3 фоновых районах, расположенных вблизи наконечника отслеживания комплекса и с использованием тех же регион, в среднем эти значения и вычесть из интенсивности наконечника отслеживания комплекса из раздела 7.4.3.
- Рассчитайте количество молекул флуорофорных в комплексе путем деления интенсивности флуоресценции, полученное в разделе 7.4.4 интенсивностью единого флуорофором полученной в разделе 7.3.5.
Примечание 1: Желательно, чтобы освещение и сбора настройки протокола 7,4 такие же, как в протоколе 7,1. Если либо время экспозиции или интенсивность лазерного во время этих шагов была скорректирована, результирующие значения люминесцентные должны быть расширены соответственно. Однако точность такого масштабирования должна быть уточнена визуализации и тот же образец (например, флуоресцентного времени) при этих различных условий и расчета отношения полученных интенсивностей.
8. Микротрубочек Совет отслеживания белком покрытием бисер
- Провести эксперименты с зонд-слежения бисером, вызывая МТ разборки как в протоколе 6. Интенсивность DIC источника света должна быть снижена, обеспечивающий возможность просмотра флуоресценции родамина одновременно сDIC изображений.
- Подготовьте бисер как в Грищук и др.. 10 и Эсбери и др. 11. Представьте 30-50 мкл из бисера подвески в камеру на 10 мкл / мин. Предложенная концентрация шарик 10 -16 -10 -17 М.
- При использовании прямой микроскоп, извлеките камеру из столике микроскопа и инвертировать его в течение 5-10 мин, чтобы позволить шарики для осаждения на покровное. Это способствует более связывание борта к микротрубочек привязаны к покровным, но эта процедура не успешным с 0,5 мкм полистирольных шариков, которые показывают небольшой тяжести на основе осадка в течение такого короткого промежутка времени.
- Выберите шарик, который прилагается к покровное-привязал микротрубочки; шарик должен двигаться в четкой дуги 44 (рис. 4А). Привязной шарик должен находиться 1-3 мкм от поверхности покровного, что явно видно из-за случайных покровное подключением бисера, которые остаются мotionless.
- Перейти к родамина фильтра куба и начать сбор фотографий, используя DIC освещение.
- Открыть затвор, чтобы осветить поле изображений (ограниченный с полевой диафрагмы) с ртутной лампы или нм лазер 530-550. Продолжить запись, пока борт не отсоединится или движется с конца разборки микротрубочек (рис. 4D, 4F, и 4G).
Примечание 1: оптическая ловушка может быть использован, чтобы способствовать взаимодействию между микротрубочек стены и бортом белка покрытием. Это особенно полезно при работе с шариков, покрытых кинезиновых двигателей (Цифры 4E-G). Следуйте же протоколы, что и выше, а дополняют подвижности буфер 2 мМ Mg-АТФ. На шаге 8.3, захватить свободный плавающий шарик с лазерным лучом 1064 нм, перемещать сцену, чтобы привести захваченных шарик ближе к сегментированной микротрубочек стене. Начните изображений с низкой освещенности ДВС и через фильтрующий куба родамина и ждать борта, чтобы начать ходить к ограничен конце микротрубочек. Кормовойэ наблюдается направленное движение шарика, закрыть затвор для захвата пучка и открыть затвор для флуоресцентного освещения. Продолжить запись, пока борт не отсоединится или треки с разборки конце микротрубочек.
Результаты
Белки слежения с деполимеризующим микротрубочек заканчивается. Дрожжи кинетохор компонент Dam1 на сегодняшний день лучший совет-трекер из деполимеризующих микротрубочки заканчивается 14. Этот 10-субъединица комплекс помечены GFP может быть легко выражено и очищают от бакт...
Обсуждение
Многие одинокие анализы молекул в настоящее время обычно используют специально обработанные покровные резко снизить неспецифическую налипание белка. Процедура мы описываем здесь является модификацией оригинального протокола, разработанного в лаборатории Ховард 32, и мы наход?...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы хотели бы поблагодарить FI Атауллаханов за помощь в разработке и производстве многоразовые камеры потока, Н. Дашкевича, Н. Gudimchuk и А. Korbalev за предоставление фотографий для фигур, Н. Gudimchuk и П. Захарова для разработки протокола и предоставления реагенты подготовить дигоксигенином меченных семена микротрубочек, А. Потапенко за помощь в редактировании текста и других членов Грищук лаборатории для советов и дискуссий. Эта работа была частично поддержана NIH грант GM R01-098389 и пилот грант Пенсильвания мышц института в ELG, который является Киммел Академия, грантов РФФИ 12-04-00111-А, 13-04-40190-H и 13 -04-40188-Н, русский академия наук Президиума грантов (Механизмы молекулярных систем интеграции и молекулярной и молекулярной клеточной биологии программ) в FI Атауллаханов, NIH грант GM R01 GM033787 к JR Макинтош, и докторантуру Фонд Дмитрий Династия Зимин в VAV
Материалы
| Name | Company | Catalog Number | Comments |
| Table 1. Microscopy and other equipment. | |||
| Microscope | Zeiss Nikon | Axio Imager 2 Eclipse Ti | other microscope models capable of DIC and epifluorescence-imaging can be used |
| Objective | Zeiss Nikon | 420490-9900-000 CFI Apo 100x Oil 1.49 | 100X, DIC, 1.3-1.49 NA |
| Objective heater | Bioptechs | 150803, 150819-19 | |
| Fluorescent filter cube | Chroma | 49004 or 49008 41017 or 49020 | optimized for Rhodamine fluorescence optimized for GFP fluorescence |
| Acquisition software | freeware MicroManager Molecular Devices | not applicable MetaMorph 7.5 | http://valelab.ucsf.edu/~MM/MMwiki/ other software can be used to acquire images and for a particle tracking |
| EMCCD camera | Andor | iXon3, DU-897E-cs0-#BV | Highly sensitive EMCCD camera |
| Trapping laser | IPG Photonics | YLR-10-1064-LP | 1,064 nm laser, 10 W |
| Fluorescence excitation lasers | Coherent, Inc. Coherent, Inc. | Sapphire 488 LP Sapphire 552 LP | excitation of green fluorophores excitation of red fluorophores |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| Commercial flow chambers | Warner Instruments | RC-20 or RC-30 | |
| Perfusion pump | Cole Palmer Harvard Apparatus | Masterflex 77120-52 Pico Plus | Both pumps provide the required rate of liquid flow but a peristaltic pump may pulse at very slow speed. The flow with a syringe pump is more consistent for a wide range of rates but this pump has inertia. |
| Table 2. Microscopy chamber preparation. | |||
| Modified microscope slides for reusable chambers | Precision Glassblowing of Colorado | Custom order www.precisionglassblowing.com | Sonic slots in slides using schematics in Figure 1 |
| Polyethylene tubing | Intramedic | 427410 | I.D. 0.58 mm, O.D. 0.965 mm; use these tubes to connect assembled chamber to the pump and waste container |
| Polyethylene tubing | Intramedic | 427400 | I.D. 0.28 mm, O.D. 0.61 mm; use these tubes to make the reusable chamber |
| Regular microscope slides | VWR | 48312-003 | Other similar slides can be used |
| Coverslips | VWR | 48393-150, 48366-067 | Other similar coverslips can be used |
| Silicon sealant | World Precision Instruments | KIT, SILICON SEALANT 5 MIN CURE | |
| Epoxy glue | Loctite | 83082 | |
| Cyanoacrylate adhesive | Scotch 3M | AD114 | Or cyanoacrylate adhesive from other manufacturers |
| Table 3. Coverslips cleaning and coating. | |||
| Molecular Sieves, Grade 564 | Macron | 4490-04 | |
| Coverglass Staining Jar | Ted Pella, Inc. | 21036 | |
| Coverslip Ceramic Holder | Thomas Scientific | 8542e40 | |
| PlusOne Repel Silane | GE Healthcare Biosciences | 17-1332-01 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Anti-digoxigenin AB | Roche Applied Science | 11093274910 | |
| Table 4. Preparation of seeds and segmented microtubules. | |||
| Tubulin | purified from cow brains Cytoskeleton, Inc | T238P | For purification protocols see 49–51 Unlabeled porcine tubulin |
| Labeled tubulin | Cytoskeleton, Inc Invitrogen Invitrogen | TL590M C1171 (Rhodamine) A-2952 (Digoxigenin) | Rhodamine-labeled porcine tubulin Tubulin can be labeled with any amine-reactive dye as in reference52. |
| GMPCPP | Jena Biosciences | NU-405 | Aliquot and store at -70 °C |
| VALAP | Vaseline, lanolin, and paraffin at 1:1:2 by mass | see reference9 | |
Ссылки
- Desai, A., Mitchison, T. J. Microtubule polymerization dynamics. Ann. Rev. Cell Dev. Biol. 13, 83-117 (1997).
- Mitchison, T. M., Kirschner, M. W. Dynamic instability of microtubule growth. Nature. 312 (15), 237-242 (1984).
- Walker, R. A., Brien, O., et al. Dynamic Instability of Individual Microtubules Analyzed by Video Light Microscopy: Rate Constants and Transition Frequencies. J. Cell Biol. 107, 1437-1448 (1988).
- Gardner, M. K., Zanic, M., Gell, C., Bormuth, V., Howard, J. Depolymerizing Kinesins Kip3 and MCAK Shape Cellular Microtubule Architecture by Differential Control of Catastrophe. Cell. 147 (5), 1092-1103 (2011).
- Lombillo, V. A., Stewart, R. J., McIntosh, J. R. Minus-end-directed motion of kinesin-coated microspheres driven by microtubule depolymerization. Nature. 373, 161-164 (1995).
- Franck, A. D., Powers, A. F., Gestaut, D. R., Gonen, T., Davis, T. N., Asbury, C. L. Tension applied through the Dam1 complex promotes microtubule elongation providing a direct mechanism for length control in mitosis. Nat. Cell Biol. 9 (7), 832-837 (2007).
- Tran, P. T., Walker, R. A., Salmon, E. D. A metastable intermediate state of microtubule dynamic instability that differs significantly between plus and minus ends. J. Cell Biol. 138 (1), 105-117 (1997).
- Grishchuk, E. L., Molodtsov, M. I., Ataullakhanov, F. I., McIntosh, J. R. Force production by disassembling microtubules. Nature. 438, 384-388 .
- Coue, M., Lombillo, A., Richard, J. Microtubule Depolymerization Promotes Particle and Chromosome Movement In Vitro. J. Cell Biol. 112 (6), 1165-1175 (1991).
- Grishchuk, E. L., Spiridonov, I. S., et al. Different assemblies of the DAM1 complex follow shortening microtubules by distinct mechanisms. Proc. Natl. Acad. Sci. U.S.A. 105 (19), 6918-6923 (2008).
- Asbury, C. L., Gestaut, D. R., Powers, A. F., Franck, A. D., Davis, T. N. The Dam1 kinetochore complex harnesses microtubule dynamics to produce force and movement. Proc. Natl. Acad. Sci. U.S.A. 103 (26), 9873-9878 (2006).
- Westermann, S., Wang, H. -. W., Avila-Sakar, A., Drubin, D. G., Nogales, E., Barnes, G. The Dam1 kinetochore ring complex moves processively on depolymerizing microtubule ends. Nature. 440 (7083), 565-569 (2006).
- Grissom, P. M., Fiedler, T., Grishchuk, E. L., Nicastro, D., West, R. R., Mcintosh, J. R. Kinesin-8 from Fission Yeast A Heterodimeric , Plus-End – directed Motor that Can Couple Microtubule Depolymerization to Cargo Movement. Mol. Biol. Cell. 20, 963-972 (2009).
- McIntosh, J. R., Volkov, V., Ataullakhanov, F. I., Grishchuk, E. L. Tubulin depolymerization may be an ancient biological motor. J. Sci. 123, 3425-3434 (2010).
- Grishchuk, E. L., McIntosh, J. R., Molodtsov, M. I., Ataullakhanov, F. I. Force generation by dynamic microtubule polymers. Compr. Biophys. 4, 93-117 (2012).
- Asbury, C. L., Tien, J. F., Davis, T. N. Kinetochores' gripping feat: conformational wave or biased diffusion. Trends Cell Biol. (1), 38-46 (2011).
- Tien, J. F., Umbreit, N. T., et al. Cooperation of the Dam1 and Ndc80 kinetochore complexes enhances microtubule coupling and is regulated by aurora B. Cell Biol. 189 (4), 713-723 (2010).
- Gestaut, D. R., Graczyk, B., et al. Phosphoregulation and depolymerization-driven movement of the Dam1 complex do not require ring formation. Nat. Biol. 10 (4), 407-414 (2008).
- Schmidt, J. C., Arthanari, H., et al. The Kinetochore-Bound Ska1 Complex Tracks Depolymerizing Microtubules and Binds to Curved Protofilaments. Dev. Cell. 23 (5), 968-980 (2012).
- Brouhard, G. J., Stear, J. H., et al. XMAP215 is a processive microtubule polymerase. Cell. 132 (1), 79-88 (2008).
- Stumpff, J., Du, Y., et al. A Tethering Mechanism Controls the Processivity and Kinetochore-Microtubule Plus-End Enrichment of the Kinesin-8 Kif18A. Mol. Cell. 43 (5), 764-775 (2011).
- Su, X., Qui, W., Gupta, M., Pereira-Leal, J., Reck-Peterson, S. L., Pellman, D. Mechanisms underlying the dual-mode regulation of microtubule dynamics by Kip3/kinesin-8. Mol. Cell. 43 (5), 751-763 (2011).
- Helenius, J., Brouhard, G., Kalaidzidis, Y., Diez, S., Howard, J. The depolymerizing kinesin MCAK uses lattice diffusion to rapidly target microtubule ends. Nature. 441 (7089), 115-119 (2006).
- Gudimchuk, N., Vitre, B., et al. Kinetochore kinesin CENP-E is a processive bi-directional tracker of dynamic microtubule tips. Nat. Cell Biol. 15 (9), 1079-1088 (2013).
- Akhmanova, A., Steinmetz, M. Microtubule +TIPs at a glance. J. Sci. 20 (Pt 20), 3415-3419 (2010).
- Dixit, R., Barnett, B., Lazarus, J., Tokito, M., Goldman, Y., Holzbaur, E. Microtubule plus-end tracking by CLIP-170 requires EB1. Proc. Natl. Acad. Sci. U.S.A. 106 (2), 492-497 (2009).
- Grishchuk, E. L., Efremov, A. K., et al. The Dam1 ring binds microtubules strongly enough to be a processive as well as energy-efficient coupler for chromosome motion. Proc. Natl. Acad. Sci. U.S.A. 105 (40), 15423-15428 (2008).
- Akiyoshi, B., Sarangapani, K. K., et al. Tension directly stabilizes reconstituted kinetochore-microtubule attachments. Nature. 468 (7323), 576-579 (2010).
- McIntosh, J. R., Grishchuk, E. L., et al. Fibrils Connect Microtubule Tips with Kinetochores A Mechanism to Couple Tubulin Dynamics to Chromosome Motion. Cell. 135 (2), 322-333 (2008).
- Powers, A. F., Franck, A. D., et al. The Ndc80 kinetochore complex forms load-bearing attachments to dynamic microtubule tips via biased diffusion. Cell. 136 (5), 865-875 (2009).
- Umbreit, N. T., Gestaut, D. R., et al. The Ndc80 kinetochore complex directly modulates microtubule dynamics. Proc. Natl. Acad. Sci. U.S.A. 109 (40), 16113-16118 (2012).
- Gell, C., Bormuth, V., et al. Microtubule Dynamics Reconstituted In Vitro and Imaged by Single-Molecule Fluorescence Microscopy. Methods Biol. 95, 221-245 (2010).
- Dixit, R., Ross, J. L. Studying Plus-End Tracking at Single Molecule Resolution Using TIRF Microscopy. Methods Cell Biol. 95, 543-554 (2010).
- Beausang, F. J., Sun, Y., Quinlan, E. M., Forkey, N. J., Goldman, Y. Construction of Flow Chambers for Polarized Total Internal Reflection Fluorescence Microscopy (polTIRFM). Cold Spring Harbour Protoc. 6, 712-715 (2012).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP Hydrolysis in Microtubule Dynamics: Information from a Slowly Hydrolyzable Analogue, GMPCPP. Mol. Biol. Cell. 3, 1155-1167 (1992).
- Grishchuk, E. L., Ataullakhanov, F. I. In Vitro Assays to Study the Tracking of Shortening Microtubule Ends and to Measure Associated Forces. Methods Cell Biol. 95, 657-676 (2010).
- Gutiérrez-Medina, B., Block, S. M. Visualizing individual microtubules by bright field microscopy. Am. J. Phys. 78 (11), 1152-1159 (2010).
- Volkov, V. A., Zaytsev, A. V., et al. Long tethers provide high-force coupling of the Dam1 ring to shortening microtubules. Proc. Natl. Acad. Sci. U.S.A. 110 (19), 7708-7713 (2013).
- Laan, L., Pavin, N., et al. Cortical dynein controls microtubule dynamics to generate pulling forces that position microtubule asters. Cell. 148 (3), 502-514 (2012).
- Myster, S. H., Knott, J. A., O'Toole, E., Porter, M. E. The Chlamydomonas Dhc1 gene encodes a dynein heavy chain subunit required for assembly of the I1 inner arm complex. Mol. Biol. Cell. 8, 607-620 (1997).
- Lombillo, V. A., Coue, M., McIntosh, J. R. In vitro motility assays using microtubules tethered to Tetrahymena pellicles. Methods Cell Biol. 39, 149-165 (1993).
- Hyman, A., Chrétien, D., Arnal, I., Wade, R. Structural changes accompanying GTP hydrolysis in microtubules: information from a slowly hydrolyzable analogue guanylyl-(alpha,beta)-methylene-diphosphonate. J. Cell Biol. 128 (1-2), 117-125 (1995).
- Park, M., Kim, H., Kim, D., Song, N. W. Counting the Number of Fluorophores Labeled in Biomolecules by Observing the Fluorescence-Intensity Transient of a Single Molecule. Bull. Chem. Soc. Jap. 78, 1612-1618 (2005).
- Welburn, J. P. I., Grishchuk, E. L., Backer, C. B., Wilson-Kubalek, E. M., Yates, J. R., Cheeseman, I. M. The human kinetochore Ska1 complex facilitates microtubule depolymerization-coupled motility. Dev. Cell. 16 (3), 374-385 (2009).
- Efremov, A., Grishchuk, E. L., Mcintosh, J. R., Ataullakhanov, F. I. In search of an optimal ring to couple microtubule depolymerization to processive chromosome motions. Natl. Acad. Sci. U.S.A. (48), 19017-19022 (2007).
- Itoh, T., Hisanaga, S., Hosoi, T., Kishimoto, T., Hotani, H. Phosphorylation states of microtubule-associated protein 2 (MAP2) determine the regulatory role of MAP2 in microtubule dynamics. Biochemistry. 36 (41), 12574-12582 (1997).
- Oguchi, Y., Uchimura, S., Ohki, T., Mikhailenko, S. V., Ishiwata, S. The bidirectional depolymerizer MCAK generates force by disassembling both microtubule ends. Nat. Biol. (6), 1-8 (2011).
- Kishino, A., Yanagida, T. Force measurements by micromanipulation of a single actin filament by glass needles. Nature. 334, 74-76 (1988).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann. NY Acad. Sci. 253, 107-132 (1975).
- Weingarten, M. D., Lockwood, A. H., Hwo, S., Kirschner, M. W. A Protein Factor Essential for Microtubule Assembly. Proc. Natl. Acad. Sci. U.S.A. 72 (5), 1858-1862 (1975).
- Widlund, P. O., Podolski, M., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Mol. Biol. Cell. 23 (22), 4393-4401 (2012).
- Hyman, A., Drechsel, D., et al. Preparation of Modified Tubulins. Methods Enzymol. 196, 478-485 (1991).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены