Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sökme Mikrotubul saplı tarafından Driven Hareketleri Eğitim için Segment Mikrotübüller hazırlanması
Bu Makalede
Özet
Mikrotübüller doğal kararsız polimerler, büyüme ve kısalması arasında kendi anahtarlama stokastik ve kontrol etmek zordur. Burada photoablatable stabilize kapaklar ile segmentli mikrotübülleri kullanarak protokolleri açıklar. Parçalara Mikrotübüllerin depolimerizasyonu böylece sökmeden mikrotübül uçları ile hareketleri analizi yardımcı, yüksek zamansal ve mekansal çözünürlük ile tetiklenebilir.
Özet
Mikrotübül depolimerizasyonu, in vitro olarak, farklı protein kompleksleri ve protein-kaplanmış boncuklar taşımak için kuvvet sağlayabilir. Altında yatan mekanizmalar, hücre bölünmesi sırasında mikrotübül bağımlı kromozom hareketleri hayati bir rol oynadığı düşünülmektedir, ancak ilgili proteinler ve onların rolleri kötü tanımlanır. Böylece, saflaştırılmış bileşenler ve tanımlanmış biyokimyasal ortamı kullanılarak in vitro bu hareketliliği incelemek için hangi ile analizi geliştirilmesi için, artan bir ihtiyaç vardır. Mikrotubuller Ancak, doğal olarak istikrarsız polimerler, büyüme ve kısalması arasında kendi anahtarlama stokastik ve kontrol etmek zordur. Biz burada açıklamak protokolleri photoablatable kapaklarını stabilize ile yapılır kesimli mikrotübüllerde yararlanmak. Bu tür kesimli Mikrotübüllerin depolimerizasyonu böylece sökmeden mikrotübül ucunda hareketlilik çalışmaları yardımcı olmak, yüksek zamansal ve mekansal çözünürlük ile tetiklenebilir. Bu teknik, ca için kullanılabilirDinamik mikrotübül uçları processively hareket floresan etiketli protein kompleksleri, moleküllerin sayısının kantitatif analiz iken yapılmalıdır. Bu, bir sinyal-gürültü oranı ve diğer sayısal floresan tahlilleri optimize etmek için, lamelleri çözünür floresan etiketli proteinlerin spesifik olmayan emilmesini azaltmak için tedavi edilmelidir. Ayrıntılı yöntemler, dikkate floresan aydınlatma eşitsizliği almak ve eşit Gauss uyum kullanarak tek bir fluorofor yoğunluğunu belirlemek için sağlanır. Son olarak, ilerleyici yük hareketi etti mikrotübül depolimerizasyonu için farklı motor ve fonksiyonları ilgilendirmeyen proteinlerin yeteneği bakış açıları sağlayan, protein kaplı mikroboncuk mikrotübüle bağlı hareketleri çalışma segmente mikrotübül kullanılmasını tarif eder.
Giriş
Mikrotübüller hücre mimarisi yüksek hücre motilite, hücre bölünmesi ve hücre içi ulaşım 1 için önemli olan hücre iskeleti yapısını muhafaza edilir. Bu dinamik polimerler GTP varlığında tübülin ikinci montaj ve kendiliğinden büyüme ve 2 kısalma arasında geçiş yapma. Mikrotübüller (çapı sadece 25 nm) kontrast ışık mikroskobu ile mikrotübülleri gözlemlemek için kullanılmalıdır geliştirmek için bu nedenle özel optik teknikler çok ince. Bu polimerler ile önceki iş diferansiyel girişim kontrast (DIC) 3 kullanılarak dinamik davranışlarını inceledi. In vitro çalışmalar, bu ve benzeri tipik bir deney koşulları altında, mikrotübüller, sadece nadiren depolimerizasyon için felaket ve geçiş tabi olduğunu ortaya kez her 5-15 dakika (bu frekans 28-32 ° C 'de incelenmiştir 7-15 mM çözünür tubulin konsantrasyonu için ) 4. Farklı teknikler böylece induc ileri sürülmüştürkontrollü bir şekilde e mikrotübül depolimerizasyonu. Mikrotübül kısalma burada açıklandığı gibi, uzak çözünür tubuline 5,6 yıkayan bir lazer ışını 7 mikrotübülleri kesme veya segmentli mikrotübülleri 8 ile tetiklenebilir. Parçalara mikrotübülleri, hem de davranışsal geçiş polimerleri kullanan önceki çalışma, bu kromozom, veziküller ve protein-kaplanmış boncuklar gibi küçük hücre içi yüklerin, katı yağ mikrotübül 9-13 uçlarında hareket edebilir bulmuştur. Bu olgu mitotik hücrelerde kromozom hareketleri için bir doğrudan etkisi olduğu düşünülen ve altta yatan mekanizmalar etkin soruşturma 14-16 halen olmasıdır.
Son zamanlarda, toplam iç yansıma floresan (TIRF) mikroskopi dahil floresan-tabanlı teknikler, dinamik mikrotübül ile hareketliliği incelemek için istihdam edilmiştir 17-24 sona erer. Bu yaklaşımın avantajı sağlar: ki etkileşim incelenmesiFarklı florofor ile etiketlenmiş proteinleri kullanarak gerçek zamanlı olarak mikrotübül ve mikrotübül bağlanma proteinleri arasındaki s. Çeşitli protein kompleksleri mikrotübül uçları uzatma ve / veya katı yağ ile processively hareket bulunmuştur. Bunlar mikrotübüle bağlı proteinler Dam1 10,12,18, 19 Ska1 ve XMAP215 20, hem de kinesin motorlar Kif18A 21,22, 23 ve MCAK CENP-E 24 içerir. Bu proteinler EB1 25 gibi klasik uç-izleme proteinlerin bu temelde farklı süreçsel uç-izleme, sergilerler. EB1 ve ilişkili moleküller ortakları kararlı bir şekilde dinamik mikrotübül ayrı moleküller hızla çözünen havuz 26 ile karşılıklı, sadece yaklaşık 0.8 saniye için mikrotübül ucuna bağlı kalır, uçları ile bağlantılı kalmasını görünse de. Mikrotübül birçok mikron için biter aksine, süreçsel ucu izci, Dam1 gibi, seyahat ve mikrotübül ipuçları ile ilişkisi m sürebilirHerhangi bir saniye. Uç birleştirilmesi zaman yanı sıra izleme edilen oranı, tip-27, izleme kompleks oluşturan moleküllerin sayısına kuvvetle bağlıdır. Büyük protein toplulukları genellikle çok daha iyi uç-izci vardır. Örneğin, izole edilmiş maya kinetekor gibi kompleks düzenekleri mikrotübül bağlanmış kalabilir 28 saat için sona erer. Bazı mikrotübül bağlayıcı proteinler, örneğin Ndc80 kinetochore protein kompleksi, tek bir molekül düzeyinde biter mikrotübül ile izlemek mümkün bulundu, henüz Ndc80 boncuk kargo 19,29-31 hareketini bağlanması çok etkili olmuştur. Bu nedenle, farklı protein kompleksleri, hem de kendi biyolojik rolleri ile uç-izleme mekanizmasını anlamak için, bu tip-izleme kompleks moleküllerin sayısının bir fonksiyonu olarak, uç-izleme incelemek için, hem de belirlemek için önemlidir boncuk yük yüzeyinde toplu hareketliliğini sergilediği bu komplekslerin yeteneği.
Biz Parçalara mikrotübüllere (Şekil 1A) ile deneyler hazırlamak ve yürütmek için ayrıntılı protokoller aşağıda sunmaktayız. İlk olarak, ticari olarak temin edilebilen cam slaytlar kısa bir polietilen boru (Protokol 1) bağlamak için modifiye edilir. Yeniden mikroskopi akış odası o zaman böyle bir slayt monte ve kimyasal veya plazma temizlenmiş ve Silanlanmış lamel (protokol 2) 32-34 edilir. Elde edilen hücre hacmine giriş hortumunun hacmi de dahil olmak üzere 20-25 ul (veya 15 ul kadar küçük, Protokol 1 Not: 3) 'dir. Ticari olarak temin edilebilen akış gözlerinden de kullanılabilir, ancak bunların hacmi proteinlerin gereksiz atık yol açan, genellikle daha büyüktür. Daha büyük bir bölme kullanılması durumunda, aşağıdaki protokol tüm çözümlerin hacim ölçekli orantılı olmalıdır. Mikrotübül tohumlar daha sonra yavaş yavaş hidroliz edilebilir GTP analoğu GMPCPP (Guanozin-5'-[(α, β)-methyleno] trifosfat) (3 protokol kullanılarak, örneğin hazırlanır, Hyman et al. 35). Tohumlar temizlenmiş bir lamel üzerine immobilize edilir ve yüzey, daha sonra, diğer proteinlerin spesifik olmayan emilmesini önlemek için bloke edilir 32 (protokol 4 digoksigenin ile tohum immobilizasyon açıklanmaktadır). Parçalara mikrotübül Protokol'ü ve sonra 5 kullanılarak hazırlanabilir. Bu yaklaşımın temel mantık GTP varlığında meydana dinamik mikrotübül polimerler GMPCPP içeren kararlı tubulin kesimleri, kısa "kapaklar" eklenerek geçici olarak stabilize edilebilir olmasıdır. Bu kapaklar da Rodamin etiketli tubulin içerir, bu nedenle bir 530-550 nm lazer veya cıva ark lambası (Protokol 6) 36 ile görüş alanını aydınlatarak basitçe kaldırılabilir. Ucu-izleme sinyalinin floresan yoğunluğu daha sonra dikkate mikroskop alan aydınlatma (Protokol 7) ve eşitsizliği alarak sökmeden mikrotübül uçları ile seyahat moleküllerin sayısını tahmin etmek için kullanılabilir. Benzer bir yaklaşım kullanılabilir27 (Protokol 8) 'de tarif edildiği gibi hazırlanmıştır mikrotübüllerin depolimerizasyon ve protein-kaplanmış boncuklar arasındaki etkileşimi incelemek için. Bazı proteinler kolayca bölümlere mikrotübül duvarlara bağlanırlar, ancak lazer cımbız da böylece onun bağlanmasını destekleyerek, mikrotübül duvarına yakın boncuk tutmak için kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Gerekli ekipman: Aşağıda tarif edilen deneyler, DIC ve floresan görüntüleme (Tablo 1) donatılmış bir ışık mikroskobu gerektirir. Parlak alan LED aydınlatma ölçüde düzenli bir Halojen lamba ile gözlemlemek zor lamel bağlı mikrotübül tohumların 37, tespiti geliştirmek için kullanılabilir. Mikroskopi odalarında sıvı akışını kontrol etmek için, çözeltiler, 10-100 ml / dak akış hızı kapasitesine sahip bir peristaltik pompa ile değiştirilmelidir. Bir şırınga pompası da kullanılabilir, ancak bakım akış hızı aniden değiştiğinde oluşturabilmektedir hava kabarcıklarını önlemek için önlem alınmalıdır. Protein-kaplanmış boncuklar işleme için, örneğin bölümlere mikrotübül duvara yakın getirmek için, bir 1064 nm aralıksız dalga lazer ışını mikroskop optik eksen sokulur ve üretilmesi için bir yüksek sayısal açıklık objektif (1.3 ya da daha yüksek) ile odaklanabilir bir tuzak. Floresan kantitatif analiz içinikaz ışığı bu ışık kaynağının şiddeti yana lazer temel kaynak tarafından sağlanmalıdır tek moleküllerin yoğunluğu, bir cıva lambası tarafından üretilen daha stabildir. Mekanik titreşimleri en aza indirmek için, bir optik mikroskop masaya yerleştirilmelidir. Daha sofistike ekipmanlar depolimerizasyon mikrotübül sabit bir kuvvet altında uçları boncuk hareketini çalışma ve tek çekim kuvveti sinyalleri 11,38,39 ölçmek için gereklidir, bu yöntemler, başka bir yerde tarif edilecektir.
1.. İmalat Kullanımlık Akış Chambers
Yeniden akış odaları için cam slaytlar (bizim tedarikçi ile ilgili ayrıntılı bilgi için bakınız Tablo 2) Şekil 1B şema kullanarak bir yerel cam üretim tesisi sipariş edilebilir. Ultrasonik freze normal mikroskop iki oluklar 15 ± 1 mm uzunluğunda yapmak için slaytlar (75 mm x 25 mm, kalın 1,0 mm), 1.0 ± 0.1 mm genişliğinde ve derin 0.8 ± 0.05 mm değiştirin.En yakın ucu arasındaki mesafe 14 ± 1 mm olmalıdır, bu mesafe 22 mm x 22 mm'lik bir örtücü cam, ile birleştirilmiş bir bölme için en uygunudur. Diğer malzemelerin bir listesi için Tablo 2'ye bakınız.
- Olukların iç uçlarında ~ 5 mm çıkıntıları bırakarak sürgünün her oluk içinde bir 100 mm uzunlukta polietilen tüp (OD 0.61 mm, Tablo 2) yerleştirin. Yivlerin içine tamamen tüpler gömme, siyanoakrilat yapıştırıcı madde ile olukların içine tüpleri düzeltildi.
- Tüplerin içindeki tutkal dökülüp kaçınarak, epoksi yapıştırıcı ile oluklar doldurun. Tutkal ~ 1 gün boyunca kurumasını bekleyin.
- Keskin bir tıraş bıçağı ile sürgünün merkezine yakın olan parçaları ortadan kaldıracak, her bir birleşme bölgesi distal ucundan katılaşan yapıştırıcı kütle 3-4 mm kesti. Tüpler oluklar içinde kalmalıdır. Proksimal parçaları Çıkarma da kesilmiş ve iki tüp açıklıklar ile düz bir yüzey oluşturarak, iç çıkıntılar kaldıracaktır.
- Su ve bir şırınga testi ile dolduruntüpler düzgün çalışıp çalışmadığını. Serbestçe sıvı akımları, 1 gün (Şekil 1D) için kuru bahçeleri dış uçlarında epoksi tutkal bir damla (~ 5 mm çapında) koyarsanız. Bu odalar daha dayanıklı hale getirecek, bu yüzden aylarca tekrar tekrar kullanılabilir.
Not 1: ters çevrilmiş bir mikroskop için bir bölmeyi yapmak için, slaytlar yivlerin (Şekil 1C) karşıt uçlarında iki küçük delikler yapmak için ilave olarak modifiye edilmelidir. , Slayt deliklerden tüpler yerleştirin tüpleri viraj ve olukların (Şekil 1E) içine sıkıca onları uyar. 1,2-1,4 adımları izleyin, ama bir akış odası yapmak için kullanılacak olan yüzey, gelen epoksi yapıştırıcı çıkarın.
Not 2:, oda hacmini azaltan iki çentikler 0.050 derin ± 0.005 mm yapmak için freze kullanmak, 5.0 ± 0.5 mm genişliğinde ve hafifçe yükseltilmiş slayt orta kısmını bırakarak (Şekil 1B ve 1C "kazınmış alanlar" bakın) için. Ne zaman t(aşağıda açıklandığı gibi) o akış bölmesi monte edilir, bu girinti içine çift taraflı bant yerleştirin.
Not 3: Bu modifiye slaytları yeniden kullanmak için, deneyler bir jilet kullanarak lamel ve çift taraflı bantı çıkarın bitirdikten sonra. Soyularak tarafından ve% 70 etanol ile slayt silerek mastik çıkarın. Peristaltik bir pompa ile boru eklemek ve 50-70 ml serpmek, tozsuz bölmesine eşit deiyonize su hacmi, kuru ve mağaza ile takip bir laboratuar bulaşık deterjanının% 1-2 olan bir kap içinde slayt yerleştirin.
2. Lameller hazırlanması
Bu protokol, 6-8 saat sürer ve 12 lamelleri hazırlamak için yardımcı olacaktır. Sen kapaklı bir seramik lamel tutucu ve 3 lamel boyama kavanoz gerekir; kavanoz hacmi 15 ml olmalıdır, böylece her bir araya yığılmış 4 lamelleri yapacak. , Bir kapak (250 mi) ile bir cam kavanoz silan ile lamelleri inkübe etmek için kullanılmalıdır. Düzenli No.1 cam lamelleri kullanın (22 mm x 22 mm veya 2X 30 mm 2 mm) malzeme listesi için masalar 2 ve 3'e bakınız. Eldivenleri giyerek Tüm adımlar, bir çeker ocak içinde yapılmalıdır.
- Cam lamel boyama kavanoz içine lamelleri koyun ve aseton ile kavanozları doldurun. 1 saat boyunca inkübe edilir, deiyonize su ile 10x yıkayın.
- Etanol ile lamelleri 10 dakika inkübe edin ve deiyonize su ile tekrar 10x yıkayın.
- "Piranha" çözüm hazırlayın. Isıya dayanıklı bir cam kap içinde hidrojen peroksit çözeltisi (su içinde% 30) 60 ml koyun ve yavaş yavaş sülfürik asit 100 ml (hidrojen peroksit çözeltisine asit nihai oran 05:03 olduğunu). Çözüm, ısınır bu normaldir ama dikkatli kullanın. Piranha çözümü son derece yıpratıcıdır! Kalın laboratuvar mont, eldiven ve gözlük kullanın!
- Kapakları kapatmak ve 1 saat boyunca 90 ° C'ye ısıtılmış bir su banyosu içinde yer kavanoz, "pirana" çözelti ile lamel boyama kavanozları doldurun.
- "Piranha" soluti off dökünişyerinde güvenlik kurallarına tarafından talimat olarak ve üzerine atın. Yıkama, deiyonize su ile 10x lamelleri.
- , 0.1 M KOH ile lamel boyama kavanozları doldurun 10 dakika inkübe edilir ve deiyonize su ile 10x yıkayın. Bu, "pirana" tedavi sonrasında lamelleri kalan herhangi bir asit kalıntılarını nötralize eder.
- Kuru lamelleri Teflon kaplı düz kenarlı cımbız (cam yüzeyine zarar en aza indirmek için) her lamel tutarak bir seferde bir ve sıkıştırılmış kuru azot üflerken. Silan çözelti su ile son derece reaktif olduğundan, lamelleri tamamen kurutulur emin olun.
- Iyice azot ile kurutmaya tabi olmalıdır seramik sahiplerine (tutucu başına 12 lamelleri), içinde kurutulmuş lamelleri yığını. Lamel yüzeyine yapışmasını önlemek için toz kaplı seramik sahipleri tutun.
- Moleküler Elek, Sınıf 564, su emme ile 250 ml cam kavanoz içinde (çapı 6 cm) alt kapak.
- 200 ml ile kavanoz doldurunPlusOne Repel Silan çözeltisi ve yavaşça kapağı kapatın ve oda sıcaklığında 5 dakika inkübe edilir, bir kavanoza lamelleri ile bir seramik tutucu bırakın. Bu lamel yüzeyinde hidrofobik kaplamaya yaratacaktır.
- Yavaşça kavanoz lamelleri ile yuvasını çıkarın ve transfer metanol ile dolu lamel boyama kavanoz içine bir anda lamelleri.
- Lamel boyama kavanoz yüksekliğinin 2/3 için batırılır böyle bir sonik banyo, su haznesi içine bir metal ya da cam kaide yerleştirin. 20 dakika boyunca 70 W de sonikasyon, metanol solüsyonu 5 dakikada bir değiştirme, daha sonra deiyonize su ile 10x yıkayın. Silanlaştıncı düzgün çalıştı ise sudan kaldırıldı zaman, lamelleri kuru görünecektir.
- İyice yukarıda belirtildiği gibi, azot kullanılarak bir artık suyun ayrılması.
- Lamelleri arasında yüzey-yüzeye temas önlemek için Kimwipes lamelleri Interlay. Lameller, oda sıcaklığında birkaç hafta boyunca mühürlü bir kap içinde saklanabilir.
NOT 1: 2.1-2.6 ölçüde toplam hazırlık süresini azaltarak, 30 W 15 dakika boyunca Plazma Temizleyici ile lamelleri temizleyerek değiştirilebilir Adımlar. Temizleme odası içindeki basınç, 100-200 mTorr ayarlanır. Her ikisi de, atmosferik basınçlı, oksijen ve kullanılabilir. Seramik tutucular plazma temizlenmiş lamelleri yığını ve 2.7 adıma geçin.
3. GMPCPP-mikrotübül stabilize tohumları hazırlanması
Bu prosedür, ~ 1 saat sürer ve elde edilen mikrotübül tohumlar oda sıcaklığında 1-2 gün boyunca stabildir. Reaktiflerin bir listesi için bakınız Tablo 4.
- Buz üzerinde Mix:
- 10 ul BRB-80 tampon tubulin (100 uM, Tablo 4) etiketlenmemiş (80 mM Pipes, 1 mM EGTA, 4 mM MgCI2, KOH ile pH 6.9; takviyesi 1-2 mM DTT ile her bir deney için taze bir kısım kullanılarak) dönüştürülmüştür.
- 2.6 ul digoksigenin-etiketli tubulin (Tablo 4). Hazırlık bağlı olarak ses seviyesini ayarlayın,etiketsiz tubulin etiketli nihai oranı en az yaklaşık 01:10 olduğu şekilde. Pipetleme ile iyice karıştırın.
- 1.4 ul 10 mM GMPCPP (nihai konsantrasyon 1 mM)
- 35 ° C'de 15 dakika inkübe, tohum uzun 2-3 um büyüyecektir. Farklı mikrotübül uzunluğu isteniyorsa saati ayarlayın.
- Oda sıcaklığında tohum pelet için 25.000 x g de 15 dakika boyunca 35 ul BRB-80 (35 ° C'ye önceden ısıtılmış), pipetleme ile karıştırın ve santrifüj ekleyin.
- , Süpernatant atın hafifçe ılık BRB-80, 50 ul ekleyerek ve kaldırarak pelet yıkayın.
- Süspanse 25 ul BRB-80 iyi pelet.
4. Lameller için Mikrotubul tohumları eki
Protokoller 4 ve 5 2-3 saat gerektirir, bu yüzden iki akım odaları günde kullanılır.
- Silanlanmış lamelleri kullanarak üreticinin talimatlarına göre akış odasının birleştirin ve 4.2 adıma geçin. Ismarlama lamelleri kullanıyorsanız (Protokol 1), bel adımları izleyinow.
- , Merkezi ~ 5 mm genişliğinde bir alanda birlikte çift taraflı bant, iki adet (5 mm x 30 mm) takın sıkıca bant, basın tepesinde Silanlanmış lamel koydu.
- Tüplerinden biri aracılığıyla BRB-80 ile odasını doldurmak ve yuvarlak kürdan ile iki tüpü takın.
- Küçük bir plastik Petri kabı üstüne iki-renkli Kwik Cast dolgu küçük bir damla sıkın ve bir kürdan kullanarak hızlı bir şekilde ama iyice karıştırın. Mastik yeşil olur, hemen uygulamak, dikkatli lamel tüm kenarları sızdırmazlık. Mastik coverslip altında çok derinden nüfuz ederse, kürdan fişi çıkararak tüplerden birini açın ve tüpler içinde sızıntı mastik önlemek için hafif bir basınç uygulayın.
- 10 dakika için odayı kuru edelim ve akış daha fazla ilerlemeden önce sınırlı olmadığını onaylayın.
- 32 ° C önceden ısıtılmış bir mikroskop sahnede odasına yerleştirin ve sıvıyı dışarı pompalamak hangi bir pompaya tüplerden birini takın. Giriş borusunun uzunluğuÖnerilen uzunluğu 5-7 cm: reaktiflerin gereksiz kaybını önlemek için en aza düşürülmesi gerekmektedir. Bir 0.5 Bu ucu daldırın ml BRB-80 tamponu ile flakon. Bu ve aşağıdaki tüm çözeltiler 32-35 ° C'ye önceden ısıtılmış olmalıdır
- Bir pompa ile hafif bir baskı uygulayın ya da sadece giriş tüpü fiş çekildiğinde bazen oluşturabilir hava kabarcıklarını dışarı sıkmak için çıkış borusunun ucunu kaldırın.
- 100 ul / dk 'da pompa hızını ayarlayın. , BRB-80 1:30 seyreltilmiş anti-digoksigenin antikorları 2 odacık hacmi ile yıkanır antikor soğrulmasına olanak vermek için 15 dakika inkübe edilir.
- Sıcak, BRB-80 5-10 odası hacimleri ile yıkayın silanize lamel hidrofobik yüzey engellemek için BRB-80 içinde% 1 Pluronic F-127 ile 10 dakika inkübe edilir.
- Motilite tampon 5-10 oda hacimleri (BRB-80 kazein 0.4 mg / ml ile takviye edilmiş) ile yıkayın.
- 10 ul / dk pompa hızını düşürün ve 30-40 ul hareketlilik tamponu 1:200-1:600 seyreltilmiş mikrotübül tohumları serpmek. 15 mi inkübelamel-adsorbe antikorlara tohumların bağlanmasını teşvik etmek için n.
- Herhangi bir bağlanmamış malzemenin bertaraf edilmesi için motilite tampon 400 ul ile 100 ul / dk 'da bölmeyi yıkayın.
Not 1: Elde edilen tohum yoğunluğu 10-30 ortalama alan bir mikroskop (Şekil 2A) olmalıdır. Gidermek için, lamel bağlı tohumların daha kolay tespiti için polimerizasyonu (adım 3.1) sırasında floresan etiketli tubuline kullanın.
Not 2: Chlamydomonas 40 ya da başka biyolojik kaynaklardan, hem de lize edildi ve hücre deciliated Tetrahymena 41 ince zarlar hazırlandı Axonemes da çekirdek oluşturucularının mikrotübül olarak kullanılabilir. Bu çekirdek oluşturucularının küçük mikro tüp dizileri oluşturmak için yararlıdır ve protofilaments belirli sayıda mikrotübülüsleri (GMPCPP tohum çekirdeklenmiştir ≥ 14 protofilaments 42 içeren tek bir mikrotübül) arzu edildiği zaman tercih edilir. Bu yapılar, atta spesifik olmayan emme ile temizlenmiş lamelleri bağlı, ama olabilirchment silanize lamelleri kullanarak, özellikle antikor bazlı bağlanma ile karşılaştırıldığında, genellikle daha az stabildir.
5. Kesimli Mikrotübüller hazırlanması
Altındaki tüm çözüm hacimleri kamara hacmi 15-20 ul içindir; büyük oda kullanılması durumunda orantılı olarak artırmak.
- Ön ısıtılması etiketlenmemiş tubulin karışımı 35 ° C'de 30 saniye boyunca (45 ul tampon motilite 1 mM Mg-GTP ile ve 10-15 uM etiketlenmemiş tübülin ile takviye edilmiş) 30 | il / dk 'da serpmek.
- DIC optik (Şekil 2B, Video 1) ile mikrotübül büyümesini izlemek. 5-7 dk İnkübasyon sırasında mikrotübülüsleri genellikle ~ 10 mikron uzun büyümek.
- Rhodamine-tubulin karışımı (0.5 mM GMPCPP ve tübüline Rodamin, 0.5-1 mol oranı rodamin etiketli tubulin 2-5 uM ile takviye edilmiş 65 ul hareketliliği tamponu) ile hazırlayın ve 30 saniye boyunca 35 ° C 'de sıcak bir çözüm.
- 30 μ hemen serpmekl / dak. Mikrotübül uçları kararlı floresan kapaklar oluşumunu teşvik etmek için 8-10 dakika boyunca inkübe edin. Kararlı mikrotübül kesimleri de kendiliğinden çekirdekleştirmek ve DIC optik ile görünür olacaktır.
- Tübülinler ve nükleotidler, yanı sıra çözünebilir mikrotübül parçalarını almak için 20 ul / dk 'da hareketliliği tampon 100 ul de odası yıkayın.
- DIC, mikrotübülüsleri (Şekil 2B) görülebilir onaylamak; birçok mikrotübülüsleri kapatma sırasında sökmeye çünkü onların sayısı, ancak, (Video 2 segmentli mikrotübüllerle tipik bir alan gösterir) azaltmak gerekir.
Not 1: Segmentli mikrotübüller çok stabil olan ve en az 2 saat boyunca kullanılabilir. Bununla birlikte, bu mikrotübül ömrü aşırı çözelti değişimi ile azalır, ya da 2-mersaptoetanol görüntüleme tampon maddesi kullanılır ise.
6. Depolymerizing Mikrotubul saplı Protein Takibi Deneysel Gözlem
- IntrodUCE 30-50 10 ul / dk 'da odacık içine floresan proteini (0.1-20 nM) ul. Lamel yapışmasını belirgin bir protein ise, 4-8 mg / ml BSA ile motilite tampon takviyesi. Alexa488 Dam1 ucu izleme ayrıca 10 mM DTT veya% 0.5-1 βME 10 gerektirir.
- Mikrotübül gereksiz ağartma ve sökebilme önlemek için bir mikroskop alanında diyafram kullanarak aydınlatma alanını sınırlayın.
- GFP filtre küp kullanarak video satın alma başlayın, daha sonra görüntü kaydını kesmeden Rhodamine filtre küp geçmek. Mikrotübül ucunda kırmızı parça açıkça görünür olmalıdır, onlar (Video 3) solmaya ve hızlı bir şekilde çözülmeye başlayacak.
- Kapaklar neredeyse (genellikle, 10-20 saniye boyunca ama bu sefer daha uzun bir alt Rhodamine etiketleme oranı ile yetiştirilen kapaklar için olacak) kayboluncaya kadar aydınlatmak ve mikrotübül demontaj ile izleme protein kaydetmek için GFP kanala geri dönmek için devam edin.
- AnalizKymographs oluşturarak çıkan diziler, MetaMorph, serbestçe kullanılabilir ImageJ veya diğer görüntü işleme yazılımları (Şekil 2E) kullanılarak) gözlem süresince çeşitli zamanlarda mikrotübül ekseninde floresan yoğunluğunu göstermek, yani iki boyutlu görüntüler.
Not 1: Kazanım oranı gözlenen olayların zamanlamasına bağlı olarak ayarlanabilir olmalıdır. Önerilen oran yavaş hareket için saniye (fps) başına 2-3 kare olduğunu, halka ölçekli Dam1 27 kompleksleri ama tek moleküllerin için toplama süresi> 20 fps 19 olmalıdır.
Not 2: Son derece hassas bir EMCCD, örneğin ANDOR iXon3, depolymerizing mikrotübüllerle uç-izleme olayların hızlı kayıt için gereklidir. Andor iXon3 kamera için önerilen ayarlar şunlardır: kazanç 5x, EM kazanç 200, 1 MHz okuma hızı, 16-bit sensör modu, 80 msn maruz kalma süresi.
Not 3: TIRF mikroskobu kullanarak sinyal-gürültü oranını geliştirmek, ancak, daha kısa mikrotübüller kullanılmalıdır, bu that floresan stabilize kapaklar yiten alanına ulaşılabilecek kalır.
7. Mikrotubul İpucu izleme Kompleksi Moleküler Boyutu Kantitatif Analiz
Bu yaklaşımın mantığı, bir fluorofor yoğunluğuna uç izleme kompleksinin toplam floresan yoğunluğu oranının bularak bir uç izleme kompleks moleküllerin sayısının belirlenmesidir. Bu yaklaşım, GFP-protein füzyonları ve florasan boya ile işaretlenmiş proteinler uygulanabilir, ancak terkiplerde bir protein moleküller flüoresan değilse, bu tip-izleme komplekslerinde molekül sayısını yetersiz kalabilmektedir.
- Floresan etiketli protein molekülleri için kayıt ışıkla ağartma kinetiği.
- Tüm Protokolü'nü 2 kullanılarak hazırlanabilir bir nonmodified cam slayt, çift taraflı iki şerit, ve temiz bir lamel kullanılarak düzenli mikroskopi odasının birleştirin, ya da yalnızca bu 2.1-2.6 adımlarıprotokolü.
- , Hareket tamponunda yaklaşık olarak 50 nM protein ekleyin hareketliliği tamponu ile yıkayın ve kısa bir süre valap (Tablo 4) ile odası kapağını kapatın. (Çözelti içinde kendiliğinden oluşabilir veya birkaç tek moleküller birbirine yakın olan ve çözülemeyen görünebilir trimerleri ve tetramerler) tek moleküller temsil eşit dağılmış noktalar (Şekil 3A) ve kendi küçük agrega ile alanını elde etmek için protein konsantrasyonu optimize . Bu adım, ışıkla adımlar ve adım büyüklüğü doğru belirlenmesi (aşağıya bakınız), çok yoğun dağılımı elde edilmesi için çok önemlidir.
- Tek flüoresan lekelerin hala görünür olduğu da aydınlatma lazer yoğunluğu en aza indirmek, düşük aydınlatma ile ışıkla ağartma uzamış olmaktadır, yani daha uzun ışıkla ağartma izleri elde edilebilir. Ayrıca bir kare içinde birden fazla florofor ağartma olasılığını azaltmak için maruz kalma süresini en aza indirir. Önerilen ayarAndor iXon3 kamera için: kazanç 5.0 x, EM kazanç 999, 10 MHz okuma hızı, 50-100 msn maruz kalma süresi.
- , Aydınlatma deklanşörü kapatmak taze bir alana taşımak, aydınlatma kapağını açın ve tüm komplekslerin (bundan sonra img (x, y olarak anılacaktır)) ağartılmış kadar görüntü elde, lamel yüzeyinde odaklanın.
- Aydınlatma düzensizliğini (Şekil 3B) için elde edilen görüntüleri düzeltin.
- Herhangi bir fluorofor çözeltisi hazırlayın, BRB-80, örneğin 1 uM Fluoresein izotiyosiyanat (FITC). Bu çözelti, önceden hazırlanmış parçalara ayrılmış ve -20 ° C'de saklanabilir
- Bölüm 7.1.1 deki gibi bir odasının birleştirin ama düzenli bir lamel kullanın. Fluorofor çözüm ekleyin ve valap kullanarak odasını sızdırmaz.
- > Tüm mikroskop alanında 50 görüntüleri toplayın: aydınlatma deklanşör kapalı iken yeni ağartılmamış alana sahneye taşımak ve hemen deklanşöre açtıktan sonra görüntü kazanır.
- Bu yığının ortalama projeksiyon oluşturma ve ImageJ veya diğer yazılım (Şekil 3C) kullanılarak 5 piksel yarıçapı ile Gauss bulanıklığı filtre. Elde edilen görüntü alanına (x ve y koordinatları pikselin uygun Illum (x, y)) 'in aydınlatma yoğunluğu dağılımını temsil eder.
- Bu görüntünün (Max (Illum)) maksimum piksel parlaklığı belirler.
- Kapalı aydınlatma obtüratör ve 7.2.3 Edinme Bölüm gibi bir görüntüyü aynı kamera ayarlarını kullanarak, bu görüntünün ortalama piksel yoğunluğunu belirlemek, bu değer CN, kamera sesine karşılık gelir.
- Aşağıdaki ifade kullanılarak deney görseli (img (x, y)) normalleştirmek için, yukarıdaki değerleri ve görüntü (Illum (x, y)) kullanın:
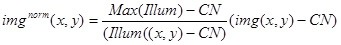
Bri kantitatif analiz için elde edilen görüntü img norm (x, y) kullanınucu-teyel kompleksleri (Şekil 3D) ile görüntüleri normalleştirmek için de sabit floresan kompleksleri, ve ghtness.
- Tek bir floroforun şiddetini belirler.
- Norm (x, y) img normalize görüntüleri kullanarak ve herhangi bir görüntü işleme yazılımı dairesel bir bölgede (çapı 5-6 piksel) ile floresan nokta seçin ve tüm çerçeveler için onun ayrılmaz yoğunluğunu belirlemek, photobleaching izlerini üreten. Çok parlak noktalar (> sönük daha parlak 5 kat) kaçının.
- Aynı dairesel bölge aracını kullanarak, en az 3 nokta-özgür alanları seçmek ortalama gelen ışıkla izlerini oluşturmak ve üstel bozunma fonksiyonu ile uyum.
- Deneysel zaman noktaları maç ve photobleaching eğrileri onu çıkarmak için bu plan yoğunluk eğrisini tablolaştırıyoruz.
- Photobleaching eğrileri (3-5 puan kayar pencere ile ortalama) Pürüzsüz. Görme çıkan eğriler ve denetlemekfloresan veya belirgin beyazlatma (Şekil 3E) eksikliği ani bir artış gösterir herhangi bir eğriyi atın.
- (Eğrilerin toplam sayısı genellikle% 50-70) geri kalan eğrilerinin her biri için, görsel olarak floresan nokta ağartılmış olan son yayla seçin. Sadece ~ 100 puan bırakın ve bu yoğunlukları ortalama bu segmenti kısaltın. Küçük bir varyasyonu en aza indirmek için kısaltılmış ışıkla ağartma eğri arka plan düzeyleri bu değer çıkarma ve arka tepe (aşağıda) boyutunu azaltmak için.
- 20 veya daha fazla photobleaching eğriler (> 1.000 kez puan) tüm zaman noktalarında şiddetlerinin bir histogram çiziniz. Histogram, en azından 4 farklı tepe noktaları (Not 2 ye bakınız) göstermelidir.
- MATLAB, Mathematica veya benzer yazılım (Şekil 3F) kullanarak eşit Gauss dağılımı 10,43 ile histogram Fit:
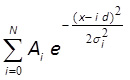
wA i ve σ i, d ve N burada uydurma parametreleri vardır. I genlik karşılık gelen ve genişlik i-th zirve A i ve σ Parametreler d tepe arasındaki mesafedir; N dağılımında tepe noktalarının toplam sayısına karşılık gelen bir tam sayı olduğu. Ilk 3 veya daha fazla tepe merkezleri monte hattına görsel olarak iyi bir eşleşme göstermiştir, bu tepe noktalarının (parametre d) arasındaki mesafe, tek bir floroforun floresan yoğunluğuna karşılık gelir.
Not 1: mikroskopi sistemi önemli titreşimleri sergileyen ya da gürültü (örneğin kararsız lazer ışını) başka bir kaynak varsa incelendiğinde nokta (Bölüm 7.3.6) sayısı artırılmalıdır.
Not 2: Bu> eşit Gauss uyum ile doğru analiz için 3 zirveleri elde etmek esastır. Az zirveler elde ediyorsanız, yanlış (örneğin çift) adım büyüklüğü elde edilebiliraydınlatma koşulları uygun olmadığı zaman, noktalar çok hızlı ve tek adımları ağartmak örneğin çözülmez.
- Ucu-izleme kompleksinin molekül büyüklüğünü belirleyin.
- Protokol 6 toplanan görüntüleri kullanın ve hemen deklanşöre açıldıktan sonra edinilen ilk 2-4 kareleri seçin. Uç-izleme gözlenmiştir önce alan bir süre aydınlatılmıştır, aynı deney koşulları altında, foto ağartıcı kinetikleri orijinal yoğunluğu tahmin ediyoruz.
- Seçilen kareleri ortalamasını ve Bölüm 7.2.5-7.2.7 olarak çıkan görüntü normalleştirmek.
- Bölüm 7.3.1 deki gibi aynı bölgenin boyutunu kullanarak floresan ucu izleme kompleksinin ayrılmaz yoğunluğunu ölçün.
- , Ucu izleme kompleksi yakınında bulunan ve aynı bölgeyi kullanan 3 plan alanlarının ayrılmaz yoğunluğunu ölçmek bu değerleri ortalama ve Bölüm 7.4.3 gelen uç-izleme kompleksinin yoğunluğu çıkarma.
- Bölüm 7.3.5 'de elde edilen bir fluorofor yoğunluğu ile Bölüm 7.4.4' de elde edilen floresan yoğunluğunu bölünmesiyle komplekse florofor molekül sayısını hesaplayın.
Not 1: Bu protokol 7.4 için aydınlatma ve satın alma ayarları protokol 7.1 'de olduğu gibi aynı olması arzu edilir. Maruz kalma süresi ve lazer yoğunluk ya da bu aşamalar sırasında ayarlandı, elde edilen flüoresan değerleri buna göre ölçeklenmiştir olmalıdır. Bununla birlikte, bu ölçekleme doğruluğu bu farklı koşullar altında, aynı örnek (örneğin flüoresan süresi) görüntüleme ve elde edilen yoğunluklarının oranı hesaplanarak doğrulanmalıdır.
8. Protein Kaplı Boncuk tarafından mikrotübül İpucu izleme
- Protokolü 6 olarak MT sökme tetikleyerek tip izleme boncuklar ile deneyler yürütmek. DIC, ışık kaynağının yoğunluğu ile aynı anda Rhodamine floresan görüntülenmesine izin düşürülmelidirDIC görüntüleme.
- 10 ul / dk 'da odacık içine boncuk süspansiyonu 30-50 ul tanıtılması in Grishchuk et al. 10 ve Asbury et al. 11 olarak boncuklar hazırlayın. Önerilen boncuk konsantrasyonu, 10 -16 -10 -17 M. olduğu
- Dik bir mikroskop kullanıyorsanız, mikroskop sahneden bölmeyi kaldırmak ve boncuklar lamel de çöktürmek için izin 5-10 dakika için onu çevirin. Bu lamel gergin mikrotübüle kordonun iyi bir bağlayıcı teşvik, fakat bu prosedür, kısa bir süre içinde çok az ağırlık tabanlı bir sedimantasyon göstermektedir 0,5 um polistiren boncuklar, başarılı değildir.
- Lamel-tethered mikrotübülün bağlı bir boncuk seçin, boncuk net bir yay 44 (Şekil 4A) hareket etmelidir. Gergin boncuk 1-3 mikron uzaklıkta m kalır arada lamel bağlı boncuk nedeniyle açıkça görülebilir lamel yüzeyinden yer olmalıotionless.
- Rodamin filtre küp geçmek ve DIC aydınlatma kullanırken görüntüleri toplamaya başlar.
- Bir cıva lambasından veya 530-550 nm lazer ile (bir alan diyafram ile sınırlı) görüntüleme alanını aydınlatmak için açık deklanşör. Boncuk ayırır veya sökülmesi mikrotübül ucu ile hareket eder (Şekil 4D, 4F ve 4G) kadar kayıt devam ediyor.
Not 1: Optik tuzak mikrotübül duvarı ve protein kaplı boncuk arasındaki etkileşimi teşvik etmek için kullanılabilir. Kinesin motorlar (Şekil 4E-G) ile kaplanmış boncuk ile çalışırken bu özellikle yararlıdır. Yukarıdaki gibi aynı protokolleri uygulayın fakat 2 mM Mg-ATP ile hareketlilik tampon ek. Adımında 8.3, 1.064 nm lazer ışını ile bir serbest yüzen boncuk yakalamak yakın kesimli mikrotübül duvara tuzağa boncuk getirmek için sahneye taşımak. Düşük ışık DIC ve Rhodamine filtre küp aracılığıyla görüntüleme başlar ve şapkalı mikrotübül sonuna doğru yürümeye başlamak için boncuk bekleyin. Kıçtaer yönettiği boncuk hareketi gözlenir, kiriş yakalama için deklanşöre kapatın ve floresan aydınlatma için kapağını açın. Boncuk ayırır veya sökmeden mikrotübül sonuna parçaları kadar kayıt devam ediyor.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Mikrotubulu depolymerizing izlemeyi Protein biter. Maya kinetochore bileşen Dam1 kadar depolymerizing mikrotübülün en uç-tracker 14 biter. GFP ile etiketlenmiş bu 10 alt birim kompleksi kolaylıkla ifade edilen ve bakteri hücrelerinin 18,38 saflaştırılmıştır, bu nedenle uç izleme deneyi için pozitif bir kontrol olarak kullanılmasını tavsiye edilebilir. Bir mikrotübülün depolymerizing ucuyla izleyen bir floresan proteini sürekli lamel bağlı tohum (Vid...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Birçok tek molekül tahliller günümüzde rutin büyük ölçüde non-spesifik protein yapışmasını azaltmak için özel olarak işlenmiş lamelleri kullanın. Biz burada açıklamak prosedür Howard laboratuarda 32 geliştirilen orijinal protokol bir değişiklik olduğunu ve lamelleri Silanizing bile floresan kullanmayın DIC-tabanlı boncuk deneyleri ile çabaya değer olduğunu bulmak. Bu tür lamelleri ile monte Chambers daha temiz yüzeyler göstermektedir, ve çözünür mikrotübül bağlama prot...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Yazarlar bir protokol geliştirme ve reaktiflerin sağlanması için rakamları, N. Gudimchuk ve P. Zakharov görüntüleri sağlamak için, N. Dashkevich, N. Gudimchuk ve A. Korbalev yeniden akışı odaları tasarımı ve üretimi için yardımcı olmak için FI Ataullakhanov teşekkür etmek istiyorum Metin düzenleme ve ipuçları ve tartışmalar için Grishchuk laboratuarında diğer üyeleri ile yardım için digoksigenin etiketli mikrotübül tohum, A. Potapenko hazırlamak. Bu çalışma ile desteklenmiştir NIH hibe R01 GM-098389 ve Kimmel Scholar olduğunu ELG Pennsylvania kas Enstitüsü, bir pilot hibe, RFBR 12-04-00111-a, 13-04-40190 H hibe ve 13 ile -04-40188-H, Bilimleri Başkanlık Hibeler Russian Academy FI Ataullakhanov için (Moleküler Sistem Entegrasyonu ve Molekül ve Moleküler Hücre Biyolojisi programları Mekanizmaları), NIH JR McIntosh GM R01 GM033787 hibe ve Dmitry Zimin Hanedanı Vakfı doktora sonrası bursu için VAV
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Table 1. Microscopy and other equipment. | |||
| Microscope | Zeiss Nikon | Axio Imager 2 Eclipse Ti | other microscope models capable of DIC and epifluorescence-imaging can be used |
| Objective | Zeiss Nikon | 420490-9900-000 CFI Apo 100x Oil 1.49 | 100X, DIC, 1.3-1.49 NA |
| Objective heater | Bioptechs | 150803, 150819-19 | |
| Fluorescent filter cube | Chroma | 49004 or 49008 41017 or 49020 | optimized for Rhodamine fluorescence optimized for GFP fluorescence |
| Acquisition software | freeware MicroManager Molecular Devices | not applicable MetaMorph 7.5 | http://valelab.ucsf.edu/~MM/MMwiki/ other software can be used to acquire images and for a particle tracking |
| EMCCD camera | Andor | iXon3, DU-897E-cs0-#BV | Highly sensitive EMCCD camera |
| Trapping laser | IPG Photonics | YLR-10-1064-LP | 1,064 nm laser, 10 W |
| Fluorescence excitation lasers | Coherent, Inc. Coherent, Inc. | Sapphire 488 LP Sapphire 552 LP | excitation of green fluorophores excitation of red fluorophores |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| Commercial flow chambers | Warner Instruments | RC-20 or RC-30 | |
| Perfusion pump | Cole Palmer Harvard Apparatus | Masterflex 77120-52 Pico Plus | Both pumps provide the required rate of liquid flow but a peristaltic pump may pulse at very slow speed. The flow with a syringe pump is more consistent for a wide range of rates but this pump has inertia. |
| Table 2. Microscopy chamber preparation. | |||
| Modified microscope slides for reusable chambers | Precision Glassblowing of Colorado | Custom order www.precisionglassblowing.com | Sonic slots in slides using schematics in Figure 1 |
| Polyethylene tubing | Intramedic | 427410 | I.D. 0.58 mm, O.D. 0.965 mm; use these tubes to connect assembled chamber to the pump and waste container |
| Polyethylene tubing | Intramedic | 427400 | I.D. 0.28 mm, O.D. 0.61 mm; use these tubes to make the reusable chamber |
| Regular microscope slides | VWR | 48312-003 | Other similar slides can be used |
| Coverslips | VWR | 48393-150, 48366-067 | Other similar coverslips can be used |
| Silicon sealant | World Precision Instruments | KIT, SILICON SEALANT 5 MIN CURE | |
| Epoxy glue | Loctite | 83082 | |
| Cyanoacrylate adhesive | Scotch 3M | AD114 | Or cyanoacrylate adhesive from other manufacturers |
| Table 3. Coverslips cleaning and coating. | |||
| Molecular Sieves, Grade 564 | Macron | 4490-04 | |
| Coverglass Staining Jar | Ted Pella, Inc. | 21036 | |
| Coverslip Ceramic Holder | Thomas Scientific | 8542e40 | |
| PlusOne Repel Silane | GE Healthcare Biosciences | 17-1332-01 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Anti-digoxigenin AB | Roche Applied Science | 11093274910 | |
| Table 4. Preparation of seeds and segmented microtubules. | |||
| Tubulin | purified from cow brains Cytoskeleton, Inc | T238P | For purification protocols see 49–51 Unlabeled porcine tubulin |
| Labeled tubulin | Cytoskeleton, Inc Invitrogen Invitrogen | TL590M C1171 (Rhodamine) A-2952 (Digoxigenin) | Rhodamine-labeled porcine tubulin Tubulin can be labeled with any amine-reactive dye as in reference52. |
| GMPCPP | Jena Biosciences | NU-405 | Aliquot and store at -70 °C |
| VALAP | Vaseline, lanolin, and paraffin at 1:1:2 by mass | see reference9 | |
Referanslar
- Desai, A., Mitchison, T. J. Microtubule polymerization dynamics. Ann. Rev. Cell Dev. Biol. 13, 83-117 (1997).
- Mitchison, T. M., Kirschner, M. W. Dynamic instability of microtubule growth. Nature. 312 (15), 237-242 (1984).
- Walker, R. A., Brien, O., et al. Dynamic Instability of Individual Microtubules Analyzed by Video Light Microscopy: Rate Constants and Transition Frequencies. J. Cell Biol. 107, 1437-1448 (1988).
- Gardner, M. K., Zanic, M., Gell, C., Bormuth, V., Howard, J. Depolymerizing Kinesins Kip3 and MCAK Shape Cellular Microtubule Architecture by Differential Control of Catastrophe. Cell. 147 (5), 1092-1103 (2011).
- Lombillo, V. A., Stewart, R. J., McIntosh, J. R. Minus-end-directed motion of kinesin-coated microspheres driven by microtubule depolymerization. Nature. 373, 161-164 (1995).
- Franck, A. D., Powers, A. F., Gestaut, D. R., Gonen, T., Davis, T. N., Asbury, C. L. Tension applied through the Dam1 complex promotes microtubule elongation providing a direct mechanism for length control in mitosis. Nat. Cell Biol. 9 (7), 832-837 (2007).
- Tran, P. T., Walker, R. A., Salmon, E. D. A metastable intermediate state of microtubule dynamic instability that differs significantly between plus and minus ends. J. Cell Biol. 138 (1), 105-117 (1997).
- Grishchuk, E. L., Molodtsov, M. I., Ataullakhanov, F. I., McIntosh, J. R. Force production by disassembling microtubules. Nature. 438, 384-388 Forthcoming.
- Coue, M., Lombillo, A., Richard, J. Microtubule Depolymerization Promotes Particle and Chromosome Movement In Vitro. J. Cell Biol. 112 (6), 1165-1175 (1991).
- Grishchuk, E. L., Spiridonov, I. S., et al. Different assemblies of the DAM1 complex follow shortening microtubules by distinct mechanisms. Proc. Natl. Acad. Sci. U.S.A. 105 (19), 6918-6923 (2008).
- Asbury, C. L., Gestaut, D. R., Powers, A. F., Franck, A. D., Davis, T. N. The Dam1 kinetochore complex harnesses microtubule dynamics to produce force and movement. Proc. Natl. Acad. Sci. U.S.A. 103 (26), 9873-9878 (2006).
- Westermann, S., Wang, H. -W., Avila-Sakar, A., Drubin, D. G., Nogales, E., Barnes, G. The Dam1 kinetochore ring complex moves processively on depolymerizing microtubule ends. Nature. 440 (7083), 565-569 (2006).
- Grissom, P. M., Fiedler, T., Grishchuk, E. L., Nicastro, D., West, R. R., Mcintosh, J. R. Kinesin-8 from Fission Yeast A Heterodimeric , Plus-End – directed Motor that Can Couple Microtubule Depolymerization to Cargo Movement. Mol. Biol. Cell. 20, 963-972 (2009).
- McIntosh, J. R., Volkov, V., Ataullakhanov, F. I., Grishchuk, E. L. Tubulin depolymerization may be an ancient biological motor. J. Sci. 123, 3425-3434 (2010).
- Grishchuk, E. L., McIntosh, J. R., Molodtsov, M. I., Ataullakhanov, F. I. Force generation by dynamic microtubule polymers. Compr. Biophys. 4, 93-117 (2012).
- Asbury, C. L., Tien, J. F., Davis, T. N. Kinetochores' gripping feat: conformational wave or biased diffusion. Trends Cell Biol. (1), 38-46 (2011).
- Tien, J. F., Umbreit, N. T., et al. Cooperation of the Dam1 and Ndc80 kinetochore complexes enhances microtubule coupling and is regulated by aurora B. Cell Biol. 189 (4), 713-723 (2010).
- Gestaut, D. R., Graczyk, B., et al. Phosphoregulation and depolymerization-driven movement of the Dam1 complex do not require ring formation. Nat. Biol. 10 (4), 407-414 (2008).
- Schmidt, J. C., Arthanari, H., et al. The Kinetochore-Bound Ska1 Complex Tracks Depolymerizing Microtubules and Binds to Curved Protofilaments. Dev. Cell. 23 (5), 968-980 (2012).
- Brouhard, G. J., Stear, J. H., et al. XMAP215 is a processive microtubule polymerase. Cell. 132 (1), 79-88 (2008).
- Stumpff, J., Du, Y., et al. A Tethering Mechanism Controls the Processivity and Kinetochore-Microtubule Plus-End Enrichment of the Kinesin-8 Kif18A. Mol. Cell. 43 (5), 764-775 (2011).
- Su, X., Qui, W., Gupta, M., Pereira-Leal, J., Reck-Peterson, S. L., Pellman, D. Mechanisms underlying the dual-mode regulation of microtubule dynamics by Kip3/kinesin-8. Mol. Cell. 43 (5), 751-763 (2011).
- Helenius, J., Brouhard, G., Kalaidzidis, Y., Diez, S., Howard, J. The depolymerizing kinesin MCAK uses lattice diffusion to rapidly target microtubule ends. Nature. 441 (7089), 115-119 (2006).
- Gudimchuk, N., Vitre, B., et al. Kinetochore kinesin CENP-E is a processive bi-directional tracker of dynamic microtubule tips. Nat. Cell Biol. 15 (9), 1079-1088 (2013).
- Akhmanova, A., Steinmetz, M. Microtubule +TIPs at a glance. J. Sci. 20 (Pt 20), 3415-3419 (2010).
- Dixit, R., Barnett, B., Lazarus, J., Tokito, M., Goldman, Y., Holzbaur, E. Microtubule plus-end tracking by CLIP-170 requires EB1. Proc. Natl. Acad. Sci. U.S.A. 106 (2), 492-497 (2009).
- Grishchuk, E. L., Efremov, A. K., et al. The Dam1 ring binds microtubules strongly enough to be a processive as well as energy-efficient coupler for chromosome motion. Proc. Natl. Acad. Sci. U.S.A. 105 (40), 15423-15428 (2008).
- Akiyoshi, B., Sarangapani, K. K., et al. Tension directly stabilizes reconstituted kinetochore-microtubule attachments. Nature. 468 (7323), 576-579 (2010).
- McIntosh, J. R., Grishchuk, E. L., et al. Fibrils Connect Microtubule Tips with Kinetochores A Mechanism to Couple Tubulin Dynamics to Chromosome Motion. Cell. 135 (2), 322-333 (2008).
- Powers, A. F., Franck, A. D., et al. The Ndc80 kinetochore complex forms load-bearing attachments to dynamic microtubule tips via biased diffusion. Cell. 136 (5), 865-875 (2009).
- Umbreit, N. T., Gestaut, D. R., et al. The Ndc80 kinetochore complex directly modulates microtubule dynamics. Proc. Natl. Acad. Sci. U.S.A. 109 (40), 16113-16118 (2012).
- Gell, C., Bormuth, V., et al. Microtubule Dynamics Reconstituted In Vitro and Imaged by Single-Molecule Fluorescence Microscopy. Methods Biol. 95, 221-245 (2010).
- Dixit, R., Ross, J. L. Studying Plus-End Tracking at Single Molecule Resolution Using TIRF Microscopy. Methods Cell Biol. 95, 543-554 (2010).
- Beausang, F. J., Sun, Y., Quinlan, E. M., Forkey, N. J., Goldman, Y. Construction of Flow Chambers for Polarized Total Internal Reflection Fluorescence Microscopy (polTIRFM). Cold Spring Harbour Protoc. 6, 712-715 (2012).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP Hydrolysis in Microtubule Dynamics: Information from a Slowly Hydrolyzable Analogue, GMPCPP. Mol. Biol. Cell. 3, 1155-1167 (1992).
- Grishchuk, E. L., Ataullakhanov, F. I. In Vitro Assays to Study the Tracking of Shortening Microtubule Ends and to Measure Associated Forces. Methods Cell Biol. 95, 657-676 (2010).
- Gutiérrez-Medina, B., Block, S. M. Visualizing individual microtubules by bright field microscopy. Am. J. Phys. 78 (11), 1152-1159 (2010).
- Volkov, V. A., Zaytsev, A. V., et al. Long tethers provide high-force coupling of the Dam1 ring to shortening microtubules. Proc. Natl. Acad. Sci. U.S.A. 110 (19), 7708-7713 (2013).
- Laan, L., Pavin, N., et al. Cortical dynein controls microtubule dynamics to generate pulling forces that position microtubule asters. Cell. 148 (3), 502-514 (2012).
- Myster, S. H., Knott, J. A., O'Toole, E., Porter, M. E. The Chlamydomonas Dhc1 gene encodes a dynein heavy chain subunit required for assembly of the I1 inner arm complex. Mol. Biol. Cell. 8, 607-620 (1997).
- Lombillo, V. A., Coue, M., McIntosh, J. R. In vitro motility assays using microtubules tethered to Tetrahymena pellicles. Methods Cell Biol. 39, 149-165 (1993).
- Hyman, A., Chrétien, D., Arnal, I., Wade, R. Structural changes accompanying GTP hydrolysis in microtubules: information from a slowly hydrolyzable analogue guanylyl-(alpha,beta)-methylene-diphosphonate. J. Cell Biol. 128 (1-2), 117-125 (1995).
- Park, M., Kim, H., Kim, D., Song, N. W. Counting the Number of Fluorophores Labeled in Biomolecules by Observing the Fluorescence-Intensity Transient of a Single Molecule. Bull. Chem. Soc. Jap. 78, 1612-1618 (2005).
- Welburn, J. P. I., Grishchuk, E. L., Backer, C. B., Wilson-Kubalek, E. M., Yates, J. R., Cheeseman, I. M. The human kinetochore Ska1 complex facilitates microtubule depolymerization-coupled motility. Dev. Cell. 16 (3), 374-385 (2009).
- Efremov, A., Grishchuk, E. L., Mcintosh, J. R., Ataullakhanov, F. I. In search of an optimal ring to couple microtubule depolymerization to processive chromosome motions. Natl. Acad. Sci. U.S.A. (48), 19017-19022 (2007).
- Itoh, T., Hisanaga, S., Hosoi, T., Kishimoto, T., Hotani, H. Phosphorylation states of microtubule-associated protein 2 (MAP2) determine the regulatory role of MAP2 in microtubule dynamics. Biochemistry. 36 (41), 12574-12582 (1997).
- Oguchi, Y., Uchimura, S., Ohki, T., Mikhailenko, S. V., Ishiwata, S. The bidirectional depolymerizer MCAK generates force by disassembling both microtubule ends. Nat. Biol. (6), 1-8 (2011).
- Kishino, A., Yanagida, T. Force measurements by micromanipulation of a single actin filament by glass needles. Nature. 334, 74-76 (1988).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann. NY Acad. Sci. 253, 107-132 (1975).
- Weingarten, M. D., Lockwood, A. H., Hwo, S., Kirschner, M. W. A Protein Factor Essential for Microtubule Assembly. Proc. Natl. Acad. Sci. U.S.A. 72 (5), 1858-1862 (1975).
- Widlund, P. O., Podolski, M., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Mol. Biol. Cell. 23 (22), 4393-4401 (2012).
- Hyman, A., Drechsel, D., et al. Preparation of Modified Tubulins. Methods Enzymol. 196, 478-485 (1991).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır