A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנת Microtubules מקוטע לחקר תנועות מונעים על ידי מסתיים microtubule הפירוק
In This Article
Summary
Microtubules מטבעם פולימרים לא יציבים, ומיתוגם בין הצמיחה וקיצור הוא אקראי וקשה לשליטה. כאן אנו מתארים פרוטוקולים באמצעות microtubules המפולח עם כובעי ייצוב photoablatable. Depolymerization של microtubules המפולח יכול להיות מופעל עם רזולוציה של זמן ומרחב גבוה, ובכך מסייע לניתוח של תנועות עם קצות microtubule פירוק.
Abstract
depolymerization microtubule יכול לספק כוח להובלת קומפלקסי חלבונים שונים וחרוזים מצופים חלבון במבחנה. המנגנונים הם חשבו לשחק תפקיד חיוני בתנועות כרומוזום microtubule תלוי במהלך חלוקת תא, אך החלבונים הרלוונטיים והתפקידים המדויקים שלהם מעורפלים. לפיכך, יש צורך הולך וגדל לפיתוח מבחני שבה ללימודים כגון תנועתיות במבחנה באמצעות רכיבים מטוהרים וסביבה ביוכימית מוגדרת. Microtubules, לעומת זאת, מטבעם פולימרים יציבים; מיתוגם בין הצמיחה וקיצור הוא אקראי וקשה לשליטה. הפרוטוקולים שאנו מתארים כאן לנצל את microtubules המפולח שהם עשו עם photoablatable ייצוב כובעים. Depolymerization של microtubules המפולח כאלה יכולים להיות מופעל עם רזולוציה של זמן ומרחב גבוה, ובכך מסייע ללימודים של תנועתיות בקצות microtubule הפירוק. טכניקה זו יכולה לשמש כדי carry מתוך ניתוח כמותי של מספר המולקולות בקומפלקסי החלבונים שכותרת פלורסנטי, אשר להזיז processively עם microtubule הדינמי מסתיים. כדי לייעל את יחס בזה ואות לרעש מבחני ניאון כמותיים אחרים, יש להתייחס אליהם coverslips כדי להפחית את הספיגה ספציפיות של חלבוני fluorescently שכותרתו מסיסים. פרוטוקולים מפורטים מסופקים לקחת בחשבון את חוסר האחידות של תאורת ניאון, ולקבוע את עוצמת fluorophore יחיד באמצעות כושר גאוס במרחק שווה. לבסוף, אנו מתארים את השימוש של microtubules המפולח ללמוד תנועות microtubule תלוי של microbeads מצופה החלבון, המספקים תובנות על יכולת של חלבוני מנוע וnonmotor שונים לdepolymerization microtubule זוג לתנועת מטענים התהליכית.
Introduction
Microtubules הם מאוד נשמרים מבני cytoskeletal כי הם חשובים לארכיטקטורה הסלולר, תנועתיות תא, חלוקת תא, והובלה תאית 1. פולימרים אלה דינמיים להרכיב מטובולין בנוכחות GTP, והם עוברים באופן ספונטני בין צמיחה וקיצור 2. Microtubules הם דקים מאוד (25 ננומטר רק בקוטר) ולכן טכניקות אופטיות מיוחדות כדי לשפר את צריך לשמש ניגוד להתבונן microtubules עם מיקרוסקופ אור. עבודה קודמת עם פולימרים אלו נבחנת ההתנהגות הדינמית שלהם באמצעות התערבות ההפרש לעומת זאת (DIC) 3. מחקרים במבחנה וזה דומה גילו כי תחת תנאי ניסוי טיפוסיים, microtubules לעבור קטסטרופה ומתג לdepolymerization רק לעתים רחוקות, פעם אחת בכל דקות 5-15 (התדר הזה הוא בשביל 7-15 ריכוז טובולין מסיס מ"מ נבדק ב28-32 ° C ') 4. טכניקות שונות ובכך הוצעו לinducdepolymerization microtubule דואר באופן מבוקר. קיצור microtubule יכול להיות מופעל על ידי שטיפת טובולין מסיס 5,6, חיתוך microtubules עם קרן לייזר 7, או שימוש בmicrotubules מפולחת 8, כפי שמתואר כאן. העבודה קודמת באמצעות microtubules המפולח, כמו גם פולימרים stochastically מיתוג, מצאה כי מטענים קטנים תאיים, כגון כרומוזומים, שלפוחית, וחרוזים מצופים חלבון, יכולים לנוע בקצות microtubules קיצור 9-13. הוא חשב תופעה זו יש השלכה ישירה לתנועות כרומוזום בתאי mitotic, והמנגנונים שבבסיס נמצאים כעת תחת חקירה פעילה 14-16.
לאחרונה, טכניקות מבוססות פלורסנט, כוללים הקרינה הכוללת הפנימית ההשתקפות (TIRF) מיקרוסקופיה, כבר מועסקים ללמוד תנועתיות עם microtubule הדינמי מסתיים 17-24. היתרון של גישה זו הוא שהיא מאפשרת בדיקה של אינטראקציהים בין microtubules ומחייב חלבוני microtubule בזמן אמת באמצעות חלבונים שכותרתו עם fluorophores שונה. כמה קומפלקסי חלבונים נמצאו לעבור processively עם מתארך ו / או לקצר קצות microtubule. הם כוללים את חלבוני microtubule הקשורים Dam1 10,12,18, Ska1 19, וXMAP215 20, כמו גם מנועים kinesin Kif18A 21,22, MCAK 23 ו24 CENP-E. חלבונים אלה תערוכת קצה מעקב התהליכית, שהוא שונה מהותי מזו של חלבוני מעקב טיפ הקלאסיים כמו EB1 25. למרות שנראה מולקולות EB1 והשותפים הקשורים להישאר ביציבות קשורים microtubule הדינמי מסתיים, המולקולות בודדות יישארו מחויבות לקצה microtubule רק ~ שניות 0.8, מהירות החלפה עם הבריכה מסיסה 26. לעומת זאת, טיפ עוקבים התהליכית, כמו Dam1, לנסוע עם microtubule מסתיים עבור מיקרון רבים, והקשר שלהם עם עצות microtubule יכול להימשך מ ' כל שניות. קצה זמן עמותה, כמו גם את השיעור של מעקב וכתוצאה מכך, תלוי בחום על מספר המולקולות היוצרים את 27 מורכבות מעקב הקצה. הרכבי חלבון גדולים יותר הם בדרך כלל-עוקבים אחר עצה הרבה יותר טוב. לדוגמא, מכלולים מורכבים כגון kinetochores השמרים המבודד יכולים להישאר מצמידים microtubule מסתיים במשך שעות 28. מחייב חלבוני microtubule מסוימים, למשל חלבון מורכב kinetochore Ndc80, כבר מצאתי להיות מסוגל לעקוב אחר עם microtubule מסתיים ברמת מולקולה בודדת, ובכל זאת Ndc80 הוא יעיל מאוד בצימוד תנועת מטענים חרוז 19,29-31. לכן, כדי להבין את המנגנון של קצה מעקב על ידי מתחמים שונים חלבון, כמו גם התפקידים הביולוגיים שלהם, חשוב לבחון את קצה מעקב כפונקציה של מספר המולקולות במתחם מעקב הקצה, כמו גם כדי לקבוע היכולת של קומפלקסים אלה להציג תנועתיות קולקטיבית על פני השטח של מטען חרוז.
> להלן אנו מספקים פרוטוקולים מפורטים להכין ולערוך ניסויים עם microtubules המפולח (איור 1 א). ראשית, שקופיות זכוכית הזמינות המסחרי שונה כדי לצרף צינורות קצרים פוליאתילן (1 לפרוטוקול). הזרימה מיקרוסקופית החדר לשימוש חוזר לאחר מכן הורכב משקופיות כאלה ו- ניקה פלזמה ו coverslip silanized (פרוטוקול 2) 32-34 כימי או. וכתוצאה מכך נפח התא הוא רק 20-25 μl (או קטן כמו 15 μl, ראה באור 3 ב 1 לפרוטוקול), ובכלל זה היקף צינורות היניקה. יכולים לשמש גם זרימת תאים זמינים באופן מסחרי, אבל הנפח שלהם הוא בדרך כלל גדול יותר, מה שמוביל לבזבוז המיותר של חלבונים. אם חדר גדול יותר הוא מועסק, היקף כל הפתרונות בפרוטוקולים להלן אמור להיות מדורגים באופן יחסי. לאחר מכן זרעי microtubule מוכנים, למשל באמצעות אנלוגי GTP Hydrolysable לאט, (אדנוזין Guanosine-5'-[(α, β)-methyleno]) GMPCPP (פרוטוקול 3, ראה גם היימן et al. 35). הזרעים הם משותקים על coverslip ניקה ועל פני השטח, נחסם לאחר מכן על מנת למנוע קליטה לא ספציפית של חלבונים אחרים 32 (פרוטוקול 4 מתאר חוסר תנועת זרעים באמצעות digoxigenin). אז יכול להיות מוכן microtubules המפולח באמצעות פרוטוקול 5. הרציונל העיקרי לגישה זו הוא כי פולימרים microtubule דינמיים, המהווים בנוכחות GTP, ניתן התייצבו באופן זמני על ידי הוספה "כובעים" קצרים של מגזרי טובולין יציבים, המכילים GMPCPP. כמוסות הללו גם מכילות טובולין שכותרת Rhodamine, כך שניתן יהיה להסירו פשוט על ידי מאיר שדה הראייה בלייזר 530-550 ננומטר או מנורת קשת כספית (פרוטוקול 6) 36. עוצמת הקרינה של אות קצה המעקב לאחר מכן ניתן להשתמש כדי להעריך את מספר המולקולות שנוסעות עם קצות microtubule פירוק, תוך לקיחה בחשבון את חוסר האחידות של התאורה בשדה מיקרוסקופ (7 לפרוטוקול). גישה דומה ניתן להשתמש בםכדי לחקור אינטראקציות בין microtubules depolymerizing וחרוזים מצופה חלבון, שהוכנו כמתואר ב27 (פרוטוקול 8). חלבונים מסוימים בקלות יהיו לאגד את הקירות של microtubules המפולח, אלא גם פינצטה הלייזר יכולה לשמש כדי להחזיק את חרוז ליד קיר microtubule, ובכך לקדם אותה מחייב.
Access restricted. Please log in or start a trial to view this content.
Protocol
ציוד נדרש: הניסויים המתוארים להלן דורשים מיקרוסקופ אור מצוידת לדסק"ש ודימות פלואורסצנטי (טבלת 1). תאורת LED שדה מואר יכולה לשמש כדי לשפר את זיהוי של זרעים ומצורפים coverslip microtubule 37, אשר קשה לצפות עם מנורת הלוגן רגילה באופן משמעותי. כדי לשלוט בזרימת נוזל בתאים במיקרוסקופ, יש להחליף את הפתרונות עם משאבת peristaltic מסוגלת זרימת מהירויות 10-100 μl / min. גם משאבת מזרק ניתן להשתמש בם, אבל צריך להיזהר כדי למנוע בועות אוויר שעלול להיווצר כאשר מהירות הזרימה משתנה בפתאומיות. לטיפול בחרוזים מצופה חלבון, למשל כדי להביא אותם קרובים לקיר microtubule המפולח, קרן לייזר 1,064 ננומטר גל מתמשך יכולה להיות מוחדרת לציר האופטי של המיקרוסקופ וממוקד עם מטרה גבוהה מספרית צמצם (1.3 או גבוהים יותר) כדי לייצר מלכודת. ניתוח כמותי של הניאוןאינטנסיביות של מולקולות בודדות אור העירור צריך להיות מסופק על ידי מקור לייזר בסיס מאז עוצמת מקור אור זה היא יציב יותר מזה שנוצר על ידי מנורת כספית. כדי למזער את התנודות מכאניות, את המיקרוסקופ צריך להיות ממוקם על שולחן אופטי. ציוד מתוחכם יותר נדרש כדי ללמוד את התנועה של החרוזים עם microtubule depolymerizing מסתיים תחת כוח קבוע, וכדי למדוד את אותות כוח יחיד ירה 11,38,39, שיטות אלה יתוארו במקום אחר.
1. צ'יימברס זרימת ייצור לשימוש חוזר
שקופיות זכוכית לזרימת תאים לשימוש חוזר ניתן להזמין ממתקן ייצור זכוכית מקומי באמצעות שרטוטים באיור 1 (ראה טבלה 2 לפרטים על הספק שלנו). עם טחינה קולי לשנות שקופיות רגילות מיקרוסקופ (75 מ"מ x 25 מ"מ, 1.0 מ"מ עובי) כדי להפוך את שני חריצים 15 ± 1 מ"מ ארוך, 1.0 ± 0.1 מ"מ רחבה ו0.8 ± 0.05 מ"מ עמוק.מרחק בין הקצוות הקרובים ביותר צריך להיות 14 ± 1 מ"מ; מרחק זה הוא אופטימלי עבור תא התאסף עם 22 מ"מ x 22 coverslip מ"מ. ראה טבלה 2 לרשימה של חומרים אחרים.
- הנח צינור פוליאתילן ארוך 100 מ"מ (מ"מ 0.61 OD, טבלת 2) בכל חריץ בשקופית, עוזב ~ 5 סככות מ"מ בקצוות הפנימיים של החריצים. לתקן את הצינורות בתוך החריצים עם דבק cyanoacrylate, הטבעת הצינורות לחלוטין בתוך החריצים.
- למלא את החריצים בדבק אפוקסי, תוך הימנעות משפיכת הדבק בתוך הצינורות. תן לדבק להתייבש במשך ~ יום 1.
- בסכין גילוח חד לחתוך את הדבק ההמוני 3-4 מ"מ הקרושה מהקצה הדיסטלי של כל אתר מצורף, הסרת החלקים הפרוקסימלי למרכז השקופית. הצינורות צריכים להישאר בתוך החריצים שלהם. הסרת החלקים הפרוקסימלי גם לחתוך ולהסיר את הסככות הפנימיות, יצירת משטח שטוח עם שני פתחי צינור.
- ממלאי מזרק עם מים ובדיקהאם הצינורות עובדים כמו שצריך. אם הנוזל זורם בחופשיות, לשים טיפה של דבק אפוקסי (~ 5 מ"מ קוטר) בקצוות החיצוניים של המטעים, יבשים ליום 1 (1D איור). זה יגרום לתאים עמידים יותר, כך שניתן יהיה להשתמש שוב ושוב במשך חודשים רבים.
הערה 1: כדי להפוך את החדר למיקרוסקופ הפוכה, צריכה להיות שונה השקופיות בנוסף לעשות שני חורים קטנים בקצוות המנוגדים של החריצים (איור 1 ג). הכנס את הצינורות דרך החורים בשקופית, לכופף את הצינורות ולהתאים אותם בחוזקה בתוך החריצים (איור 1E). בצע את שלבי 1.2-1.4, אבל להסיר את דבק אפוקסי מכל השטח, אשר ישמש כדי להפוך את תא זרימה.
הערה 2: כדי להפחית קאמרי עוצמת קול, השתמש כרסום לעשות שני חריצים 0.050 ± 0.005 מ"מ עמוק, והשאיר חלק מהשקופיות המרכזי 5.0 ± 0.5 מ"מ רחב ומעט מוגבה (ראה "אזורים חרוטים" על האיורים 1B ו 1C). כאשר tהוא תא הזרימה מורכב (כמפורט להלן), הנח את הקלטת דו צדדית בתוך חריצים אלה.
הערה 3: כדי לעשות שימוש חוזר בשקופיות שונה אלה, לאחר שסיים את הניסויים להסיר את coverslip ודבק דו צדדיות באמצעות סכין גילוח. הסר את איטום על ידי הקילוף ועל ידי מנגב את השקופית עם 70% אתנול. מניחים את השקף במכל עם 1-2% מחומר ניקוי לשטיפת כלים במעבדה, חבר צינורות למשאבת peristaltic ותנקב 50-70 מיליליטר, פעל עם נפח שווה של מים deionized, יבש ולאחסן בתא נטול אבק.
2. הכנת Coverslips
פרוטוקול זה לוקח 6-8 שעות ויעזור להכין 12 coverslips. יהיה עליך בעל אחד הקרמיקה coverslip ו3 צנצנות מכתים coverslip עם מכסים; צנצנת נפח צריך להיות 15 מיליליטר, ולכן כל יחזיק 4 coverslips נערם יחד. צנצנת זכוכית עם מכסה (250 מיליליטר) יש להשתמש כדי לדגור coverslips עם silane. השתמש coverslips זכוכית מס '1 הרגיל (מ"מ 22 x 22 מ"מ או 22 מ"מ x 30 מ"מ, ראה לוחות 2 ו -3 לרשימת חומרים). צריכים להתבצע בכל הצעדים במנדף, בעת לבישת כפפות.
- שים את coverslips לתוך הצנצנות מכתים coverslip הזכוכית ולמלא את הצנצנות עם אצטון. דגירה עבור שעה 1, לשטוף 10x עם מים deionized.
- דגירה coverslips 10 דקות עם אתנול ולשטוף שוב 10x עם מים deionized.
- הכן את הפתרון "Piranha". שימו 60 מיליליטר של תמיסה מי חמצן (30% במים) בכלי זכוכית עמיד בחום ולהוסיף באיטיות של חומצה גופרתית 100 מיליליטר (יחס סופי של חומצה לפתרון מי חמצן הוא 05:03). פתרון יהיה לחמם, זה נורמלי, אבל להשתמש בזהירות. פתרון Piranha הוא מאכל מאוד! השתמש במעבדה עבה מעיל, כפפות ומשקפי מגן!
- ממלא את הצנצנות מכתים coverslip עם פתרון "Piranha", סגור את המכסים ומניחים את הצנצנות באמבט מים שחומם מראש ל-C ° 90 במשך שעה 1.
- יוצקים את soluti "Piranha"ובזורק כפי שהורה על ידי תקנות הבטיחות במקום העבודה שלך. לשטוף coverslips 10x עם מים deionized.
- ממלא את הצנצנות מכתים coverslip עם 0.1 M KOH, דגירה 10 דקות, ולשטוף 10x עם מים deionized. זה ינטרל את כל שאריות חומצה שנשארו על coverslips לאחר טיפול "Piranha".
- coverslips יבש אחת בכל פעם על ידי החזקת כל coverslip עם פינצטה עם קצוות שטוחים מצופה טפלון (כדי למזער את הנזק למשטח זכוכית) ובזמן שנושב חנקן יבש דחוס. ודא כי coverslips הם מיובשים לחלוטין, כי פתרון silane הוא תגובתי עם מים.
- סטאק coverslips המיובש במחזיקי קרמיקה (12 coverslips למחזיק), שאמור להיות predried ביסודיות עם חנקן. שמור מחזיקי הקרמיקה מכוסים כדי למנוע אבק יידבק אל פני השטח coverslip.
- מכסה את תחתית 250 צנצנת זכוכית מיליליטר (6 ס"מ קוטר) עם מולקולרי מסננים, כיתה 564, לספיגת מים.
- מלא את הצנצנת ב200 מיליליטר שלפתרון PlusOne להדוף Silane ולטבול באיטיות בעל קרמיקה עם coverslips בצנצנת, לסגור את המכסה ודגירה במשך 5 דקות בטמפרטורת חדר. הפעולה זו תיצור ציפוי הידרופובי על פני השטח coverslip.
- לאט לאט להסיר את בעל עם coverslips מהצנצנת והעברת coverslips אחד בכל פעם לתוך הצנצנות מכתים coverslip מלאים במתנול.
- הנח מתכת או הדום זכוכית לתוך מאגר המים של אמבטיה קולית, כך שהצנצנת מכתים coverslip היא שקועה עבור 2/3 מגובו. Sonicate ב70 W עבור 20 דקות, שינוי פתרון מתנול כל 5 דקות, ולאחר מכן לשטוף עם מים deionized 10x. אם silanization עבד כמו שצריך, coverslips יופיע יבש כאשר הוצאו ממים.
- ביסודיות להסיר את כל מים שיורית באמצעות חנקן, כאמור לעיל.
- Interlay coverslips עם Kimwipes להימנע ממגע משטח אל פנים בין coverslips. ניתן לאחסן coverslips במכל אטום למשך מספר שבועות בטמפרטורת חדר.
N1 OTE: שלבי 2.1-2.6 יכולים להיות מוחלפים על ידי ניקוי coverslips עם מנקה פלזמה במשך 15 דקות ב30 W, הפחתה הכוללת זמן הכנה רבה. לחץ בתוך חדר הניקוי מוגדר ב100-200 mTorr. יכול לשמש הן חמצן אטמוספרי והדחוס. סטאק coverslips לניקוי הפלזמה במחזיקי קרמיקה והמשך לשלב 2.7.
3. הכנת זרעי microtubule התייצבו-GMPCPP
הליך זה ייקח ~ 1 שעות וזרעי microtubule כתוצאה מכך הם יציבים במשך 1-2 ימים בטמפרטורת חדר. ראה טבלה 4 לרשימה של חומרים כימיים.
- מערבבים על קרח:
- 10 μl ללא תווית טובולין (100 מיקרומטר, לוח 4) בBRB-80 חיץ (80 צינורות מ"מ, 1 מ"מ EGTA, 4 מ"מ MgCl 2, pH 6.9 עם KOH; תוסף עם 1-2 מ"מ DTT באמצעות aliquot הטרי עבור כל ניסוי).
- טובולין 2.6 μl שכותרת digoxigenin (לוח 4). להתאים את עוצמת קול בהתאם להכנה,כך שהיחס הסופי של הכותרת לטובולין ללא תווית הוא ~ 1:10. מערבבים היטב על ידי pipetting.
- 1.4 μl 10 מ"מ GMPCPP (מ"מ ריכוז סופי 1)
- דגירה 15 דקות ב 35 ° C, הזרעים יגדלו 2-3 מיקרומטר הארוך. התאם זמן אם אורך microtubule שונה הוא רצוי.
- הוסף 35 μl BRB-80 (prewarmed 35 מעלות צלזיוס), מערבב על ידי pipetting, ו צנטריפוגות במשך 15 דקות ב 25,000 XG כדי גלולה את הזרעים בטמפרטורת חדר.
- בטל supernatant, לשטוף את הכדור בעדינות על ידי הוספה והסרה של μl 50 של BRB-80 החם.
- Resuspend גלולה גם ב25 BRB-80 μl.
4. קובץ מצורף של זרעי microtubule לCoverslips
פרוטוקולי 4 ו -5 ידרשו 2-3 שעות, ולכן שתי זרימת תאים משמשים ליום.
- להרכיב תא זרימה לפי הוראות יצרן משתמשים coverslips silanized והמשך לשלב 4.2. אם אתה משתמש coverslips מחוייט (פרוטוקול 1), בצע את שלבי below.
- חבר את שתי חתיכות של נייר דו צדדי (5 מ"מ x 30 מ"מ) לאורך השטח הרחב מ"מ המרכזי ~ 5, לשים coverslip silanized על גבי הקלטת, לחץ בחוזקה.
- למלא את התא עם BRB-80 דרך אחד הצינורות וחבר את שני הצינורות עם קיסמי שיניים עגולות.
- לסחוט טיפה קטנה של חומר איטום יצוק קוויק שני צבעים על גבי צלחת פטרי פלסטיק קטן, ומערבבים במהירות אך ביסודיות באמצעות קיסם. איטום יהפוך ירוק; להחיל באופן מיידי, איטום בזהירות את כל הקצוות של coverslip. אם איטום חודר עמוק מדי מתחת לcoverslip, לפתוח את אחד הצינורות על ידי הסרת התוספת הקיסם ולהפעיל לחץ עדין כדי למנוע איטום דליפה בתוך הצינורות.
- בואו הקאמרית היבש ל10 דקות ולוודא כי הזרימה אינה מוגבלת לפני שימשיך הלאה.
- מניחים את החדר על במה מיקרוסקופ prewarmed 32 מעלות צלזיוס ולצרף את אחד הצינורות למשאבה, אשר יהיה לשאוב את הנוזל החוצה. אורכו של צינור היניקהצריך להיות ממוזער, כדי למנוע האובדן המיותר של חומרים כימיים: האורך המומלץ הוא 5-7 סנטימטר. לטבול את הקצה הזה ב0.5 מיליליטר בקבוקון עם BRB-80 חיץ. זה וכל הפתרונות שלהלן יש prewarmed ל32-35 ° C.
- החל לחץ עדין עם משאבה או פשוט הרם את הקצה של הצינור לשקע לסחוט את בועות האוויר, העשויים ליצור מדי פעם כאשר תקע צינור היניקה מוסר.
- הגדר את קצב המשאבה ב100 μl / min. לשטוף עם 2 כרכים קאמריים של נוגדנים אנטי digoxigenin מדולל 1:30 בBRB-80, דגירה 15 דקות, כדי לאפשר ספיחת נוגדן.
- לשטוף עם 5-10 כרכי לשכת BRB-80 החם, דגירה 10 דקות עם 1% Pluronic F-127 בBRB-80 לחסום את המשטח ההידרופובי של coverslip silanized.
- לשטוף עם 5-10 כרכים קאמריים של חיץ תנועתיות (BRB-80 תוספת 0.4 מ"ג / מיליליטר של קזאין).
- מנמיך את מהירות משאבה ל10 μl / min ותנקב זרעי microtubule מדוללים 1:200-1:600 ב30-40 חיץ תנועתיות μl. דגירה 15 מיילn כדי לקדם מחייב של הזרעים לנוגדנים-adsorbed coverslip.
- שטוף את החדר ב100 μl / min עם 400 μl של חיץ תנועתיות כדי להסיר כל חומר מאוגד.
הערה 1: הצפיפות של זרעים וכתוצאה מכך צריכה להיות 10-30 שדה מיקרוסקופ ל( איור 2 א). כדי לפתור את הבעיה, השתמש טובולין שכותרתו fluorescently במהלך פילמור (שלב 3.1) לצורך זיהוי קל יותר של זרעים ומצורפים coverslip.
הערה 2: גם Axonemes הוכן מChlamydomonas 40 או מקורות אחרים ביולוגיים, כמו גם pellicles של תאי Tetrahymena lysed וdeciliated 41 יכול לשמש כmicrotubule nucleators. אלה הם nucleators שימושיים ליצירת מערכי microtubule קטנים, והם העדיפו כאשר microtubules עם מספר מסוים של protofilaments הם רצויים (nucleates זרע GMPCPP microtubule אחד המכיל ≥ 14 protofilaments 42). ניתן לחבר את המבנים האלה לcoverslips לנקות על ידי קליטה לא ספציפית, אבל אתאchment הוא בדרך כלל יציב פחות בהשוואה עם קובץ מצורף המבוסס על נוגדנים, במיוחד בעת השימוש בcoverslips silanized.
5. הכנת מקוטעת Microtubules
כל כרכי הפתרון להלן הם לחדר בנפח 15-20 μl; להגדיל באופן יחסי, אם הוא משמש חדר גדול יותר.
- תמהיל טובולין ללא תווית Prewarm (חיץ תנועתיות 45 μl בתוספת 1 מ"מ Mg-GTP ועם 10-15 טובולין ללא תווית מיקרומטר) במשך 30 שניות ב35 ° C. תנקב ב30 μl / min.
- לפקח על גדילת microtubule עם אופטיקה דסק"ש (איור 2 ב, 1 וידאו). במהלך 5-7 דגירה דקות microtubules בדרך כלל לגדול ארוך 10 מיקרומטר ~.
- הכן תערובת Rhodamine-טובולין (65 חיץ תנועתיות μl בתוספת 0.5 מ"מ GMPCPP ו2-5 מיקרומטר של טובולין שכותרת Rhodamine עם 0.5-1 יחס טוחנת של Rhodamine לטובולין) ולחמם את הפתרון ב35 מעלות צלזיוס במשך 30 שניות.
- תנקבו באופן מיידי ב30 μליטר / דקה. דגירה של 8-10 דקות כדי לקדם את היווצרות של פקקי ניאון יציבים בטיפי microtubule. מגזרי microtubule יציבים גם nucleate באופן ספונטני ויהיה גלוי עם אופטיקה DIC.
- שטוף את החדר היטב עם של חיץ תנועתיות 100 μl ב20 μl / min כדי להסיר tubulins ונוקלאוטידים, וכן שברי microtubule מסיסים.
- עם דסק"ש, אשר שmicrotubules גלוי (איור 2 ד); המספר שלהם, לעומת זאת, צריך להקטין בגלל microtubules רבים לפרק במכסה (וידאו 2 מציג שדה טיפוסי עם microtubules המפולח).
הערה 1: microtubules הפרוק הם יציבים מאוד וניתן להשתמש בם לפחות 2 שעות. עם זאת, לכל החיים של microtubules אלה פוחתים עם חילופי פתרון מוגזמים, או אם 2-mercaptoethanol משמש חיץ ההדמיה.
6. תצפית ניסיונית של מעקב החלבון עם צאת microtubule depolymerizing
- Introduce 30-50 μl של חלבון פלואורסצנטי (.1-20 ננומטר) לתוך התא ב10 μl / min. אם חלבון דבק coverslip הוא מאליו, להשלים את חיץ תנועתיות עם 4-8 מ"ג / מיליליטר BSA. Alexa488-Dam1-מעקב טיפ בנוסף דורש 10 מ"מ DTT או 0.5-1% βME 10.
- הגבל את תחום התאורה באמצעות סרעפת שדה מיקרוסקופ כדי להימנע מההלבנה ופירוק המיותרת של microtubules.
- התחל רכישת וידאו באמצעות קוביית מסנן ה-GFP, ולאחר מכן לעבור לקוביית מסנן Rhodamine מבלי להפריע להקלטת התמונה. המגזרים האדומים בקצות microtubule צריכים להיות לעין, הם יתחילו לדעוך ולהתפורר במהירות (וידאו) 3.
- תמשיך להאיר עד כובעים כמעט נעלמים (בדרך כלל ל10-20 שניות, אבל הפעם יהיה ארוך יותר עבור כובעים גדלו עם יחס תיוג Rhodamine נמוך יותר), ולעבור בחזרה לערוץ ה-GFP כדי להקליט חלבון מעקב עם פירוק microtubule.
- נתח אתרצפים וכתוצאה מכך על ידי בניית kymographs, תמונות כלומר דו ממדים המראות עוצמת הקרינה לאורך ציר microtubule לזמנים שונים במהלך תצפית) באמצעות MetaMorph, ImageJ זמין באופן חופשי או תוכנה אחרת לעיבוד תמונה (איור 2E).
הערה 1: שיעור רכישה צריך להיות מותאם בהתאם לעיתוי של האירועים שנצפו. השיעור המומלץ הוא 2-3 במסגרות לשנייה (fps) לאיטי, טבעת בגודל Dam1 קומפלקסי 27 אבל רכישת זמן למולקולות בודדות צריך להיות> 20 fps 19.
הערה 2: EMCCD רגיש מאוד, למשל תידור iXon3, נדרש להקלטה מהירה של אירועי מעקב קצה עם microtubules depolymerizing. ההגדרות המומלצת למצלמה אנדור iXon3 הן: 5x רווח, EM להשיג 200, מהירות MHz 1 קריאת נתונים, מצב חיישן 16 סיביות, 80 זמן חשיפה אלפיות שני.
שים לב 3: שימוש במיקרוסקופיה TIRF ישפר את יחס אות לרעש, לעומת זאת, יש להשתמש microtubules קצר יותר tha, כגוןt כובעי ייצוב הניאון יישארו בהישג ידם של שדה חלוף.
7. ניתוח כמותי של גודל המולקולרי של מכלולי עצה-מעקב microtubule
הרציונל לגישה זו הוא לקבוע את מספר המולקולות במתחם מעקב טיפ על ידי מציאת היחס בין עוצמת ניאון הכוללת של מתחם מעקב טיפ לעוצמת fluorophore אחת. גישה זו יכולה להיות מיושמת על התכה ה-GFP-חלבון וחלבונים שכותרתו עם צבעי ניאון, אבל זה עשוי להמעיט את מספר המולקולות במתחמי קצה המעקב אם כמה מולקולות חלבון בהכנות לא ניאון.
- קינטיקה photobleaching שיא למולקולות חלבון שכותרתו fluorescently.
- להרכיב תא מיקרוסקופית רגיל באמצעות שקופיות זכוכית nonmodified, שתי רצועות של נייר דו צדדי, וcoverslip נקי, שניתן להכין באמצעות כל הפרוטוקול 2, או רק על שלבים 2.1-2.6 של זהפרוטוקול.
- הוסף 50 כ חלבון ננומטר במאגר תנועתיות, לשטוף בקצרה עם חיץ תנועתיות ולאטום את החדר עם VALAP (לוח 4). לייעל את ריכוז חלבון כדי להשיג השדה עם כתמים מפוזרים באופן שווה (איור 3 א), המייצגים את המולקולות בודדות ואגרגטים הקטנים שלהם (trimers וtetramers, שעלולים להיווצר באופן ספונטני בפתרון או עשוי להופיע כאשר מספר מולקולות בודדות הם קרובים זה לזה ולא ניתן לפתור) . שלב זה חשוב מאוד לקבלת הפצה רב שיא של צעדי photobleaching וקביעה מדויקת של גודל צעד (ראה להלן).
- למזער את עוצמת לייזר התאורה שבמקומות המסוימות ניאון עדיין נראים לעין, עם תאורה נמוכה זמן photobleaching מורחב, ניתן להשיג כל כך עקבות עוד photobleaching. גם לצמצם את זמן החשיפה כדי להפחית את ההסתברות להלבנת fluorophore יותר מפעם אחת במהלך מסגרת אחת. ההגדרה המומלצתלמצלמה אנדור iXon3: 5.0x רווח, EM להשיג 999, מהירות קריאת נתונים 10 MHz, 50-100 זמן חשיפה אלפיות שני.
- דגש על פני השטח של coverslip, סגור את תריס התאורה, לעבור לשדה טרי, לפתוח את תריס התאורה ולרכוש תמונות עד שכל מתחמים שמולבנים (המכונה לאחר מכן כלimg (x, y)).
- תקן את התמונות שנרכשו לחוסר אחידות של תאורה (איור 3 ב).
- הכן את הפתרון של כל fluorophore, למשל 1 isothiocyanate מיקרומטר והעמסת (FITC) בBRB-80. פתרון כזה יכול להיות מוכן מראש, aliquoted ומאוחסן ב -20 ° C.
- להרכיב קאמרי בסעיף 7.1.1 אבל להשתמש coverslip רגיל. הוספת פתרון fluorophore ולאטום את החדר באמצעות VALAP.
- אסוף> 50 תמונות של כל שדה מיקרוסקופ: להזיז את הבמה לאזור מולבן חדש תוך תריס התאורה סגור, ולרכוש את התמונות מייד לאחר פתיחת התריס.
- צור הקרנה ממוצעת של מחסנית זו ולסנן עם Gaussian Blur עם 5 רדיוס פיקסל באמצעות ImageJ או תוכנה אחרת (איור 3 ג). התמונה המתקבלת מייצגת את חלוקת עוצמת התאורה של השדה (אילום (x, y), כאשר x ו-y מתאימות לקואורדינטות של פיקסל).
- לקבוע את בהירות פיקסל המקסימלי של תמונה זו (מקס (אילום)).
- עם הצמצם הסגור התאורה ושימוש באותן הגדרות מצלמה כאמורות בסעיף 7.2.3 לרכוש תמונה אחת, לקבוע את עוצמת פיקסל הממוצעת של תמונה זו; ערך זה מתאים לCN, רעש מצלמה.
- השתמש בערכים לעיל והתמונה (אילום (x, y)) לנרמל את התמונה הניסיונית (img (x, y)), תוך שימוש בביטוי הבא:
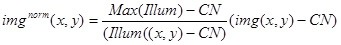
השתמש בנורמה וכתוצאה img תמונה (x, y) לניתוח כמותי של BRIghtness של מתחמים נייחים ניאון, וגם כדי לנרמל את התמונות עם מתחמי tacking-קצה (איור 3D).
- קביעת עוצמת fluorophore אחת.
- שימוש בתמונות מנורמלות img נורמה (x, y) וכל תוכנת עיבוד תמונה לבחור נקודת ניאון עם אזור עגול (5-6 פיקסלים בקוטר) ולקבוע את עוצמתה נפרד לכל המסגרות, שהניבו את עקבות photobleaching. הימנע מאוד נקודות בהירות (> 5 פי בהיר יותר מאלה דימר).
- השימוש באותו כלי האזור מעגלי, בחר לפחות 3 אזורים נטולי מקום, ליצור את עקבות photobleaching המקבילות, ממוצעת ולהשתלב עם פונקצית דעיכה מעריכית.
- לווח עקומת עוצמת רקע זה כדי להתאים את נקודות הזמן הניסיוניות ולהחסיר אותו מעקומות photobleaching.
- להחליק את קימורי photobleaching (ממוצע עם חלון הזזה של 3-5 נקודות). ראייה לבדוק את העקומות וכתוצאה מכךלבטל את כל עקומה שמראה עלייה פתאומית בקרינה או חוסר הלבנת ברורה (איור 3E).
- לכל אחת מהעקומות שנותרו (בדרך כלל 50-70% מהמספר הכולל של עיקולים), מבחינה ויזואלית לבחור את הרמה הסופית, כאשר נקודת הניאון יש מולבנת. לקצר מגזר זה להשאיר רק ~ 100 נקודות ומחשבים את ממוצע העוצמות הללו. לחסר ערך זה מעקום photobleaching קיצר כדי למזער וריאציות קטנות היא רמות הרקע וכדי להקטין את הגודל של שיא הרקע (בהמשך).
- עלילה היסטוגרמה של העוצמות לכל נקודות הזמן מ20 או יותר עקומות photobleaching (> 1,000 נקודות זמן). היסטוגרמה צריכה להפגין לפחות 4 שיאים ברורים (ראה הערה 2).
- התאם את ההיסטוגרמה עם הפצת גאוס במרחק שווה 10,43 באמצעות MATLAB, Mathematica או תוכנה דומה (איור 3F):
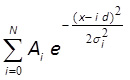
wכאן אני וσ i, d ו-N הם פרמטרים מתאימים. פרמטרי i ו σ i מתאימות למשרעת ורוחב של שיא i-ה; ד הוא מרחק בין פסגות; N הוא מספר שלם, אשר תואם את המספר הכולל של פסגות בהפצה. אם מרכזים של 3 או יותר הפסגות הראשונות מראים התאמה טובה מבחינה ויזואלית לקו המצויד, המרחק בין הפסגות האלה (ד פרמטר) מתאים לעוצמת ניאון של fluorophore אחת.
הערה 1: מספר הנקודות שנבדקו (סעיף 7.3.6) צריך להיות מוגבר אם מערכת מיקרוסקופיה מציגה תנודות משמעותיות או שיש מקור נוסף לרעש (קרן לייזר למשל לא יציבה).
הערה 2: זה חיוני כדי להשיג> 3 פסגות לניתוח מדויק עם כושר גאוס במרחק שווה. אם פחות פסגות מתקבלות, ניתן היה לקבל את גודל השקר (למשל כפול) צעדכאשר תנאי התאורה אינם אופטימליים, למשל, כאשר הנקודות להלבין צעדים מהירים מדי ובודדים לא נפתר היטב.
- לקבוע את הגודל המולקולרי של מתחם מעקב הקצה.
- השתמש בתמונות שנאספו עם פרוטוקול 6 ובחר 2-4 המסגרות הראשונות, שנרכשו מייד לאחר פתיחת התריס. אם השדה היה מואר במשך זמן מה לפני טיפ המעקב נצפה, להעריך את עוצמת המקורית מקינטיקה של photobleaching באותם תנאי הניסוי.
- ממוצע המסגרות שנבחרו ולנרמל את התמונה כמו בסעיפים 7.2.5-7.2.7 וכתוצאה מכך.
- מודד את עוצמת נפרד ממתחם מעקב טיפ הניאון באמצעות אותו גודל האזור, כמו בסעיף 7.3.1.
- מודד את עוצמת נפרד מ3 אזורי רקע ממוקמים בסמוך למתחם מעקב הקצה ומשתמשים באותו האזור, בממוצע ערכים אלה ולהחסיר מהעצמה של מתחם מעקב טיפ מסעיף 7.4.3.
- חשב את מספר מולקולות fluorophore במתחם על ידי חלוקת עוצמת הניאון שהושגה בסעיף 7.4.4 מעוצמת fluorophore הבודד שהושג בסעיף 7.3.5.
הערה 1: רצוי כי הגדרות התאורה ורכישה לפרוטוקול 7.4 הן אותו הדבר כמו בפרוטוקול 7.1. אם גם את זמן החשיפה או עוצמת לייזר הותאם במהלך שלבים אלה, צריכים להיות מדורגים בערכי ניאון וכתוצאה מכך בהתאם. עם זאת, הדיוק של קנה מידה כזה צריך להיות מאומת על ידי ההדמיה המדגם זהה (למשל זמן ניאון) בתנאים השונים הללו וחישוב יחס העוצמות וכתוצאה מכך.
8. Microtubule עצה מעקב על ידי חרוזים החלבון מצופה
- לבצע ניסויים עם חרוזים טיפ מעקב על ידי מפעילה פירוק MT כמו בפרוטוקול 6. עוצמת מקור אור דסק"ש צריכה להיות מופחתת המאפשרת צפייה בו זמנית עם הקרינה Rhodamineההדמיה דסק"ש.
- הכן את חרוזים כמו בGrishchuk et al. 10 ואוסברי et al. 11 להציג 30-50 μl של השעיה חרוז לתוך התא ב10 μl / min. ריכוז חרוז הציע הוא 10 -16 -10 -17 מ '
- אם באמצעות מיקרוסקופ הזקוף, להסיר את התא מבמת מיקרוסקופ ולהפוך אותו ל5-10 דקות, כדי לאפשר חרוזים למשקעים בcoverslip. זה מקדם טוב יותר מחייב של חרוז לmicrotubules קשור לcoverslip, אך הליך זה הוא לא מוצלח עם 0.5 מיקרומטר חרוזי פוליסטירן, אשר מראים שקיעה מבוססת הכבידה מעט בזמן כה קצר.
- בחר חרוז המחובר לmicrotubule-קשור coverslip; חרוז צריך לנוע בקשת ברורה 44 (איור 4 א). חרוז הקשור צריך להיות ממוקם 1-3 מיקרומטר ממשטח coverslip, שנראה בבירור בשל חרוזים מצורפים coverslip מזדמנים שנותרו מ 'otionless.
- לעבור לקוביית מסנן Rhodamine ולהתחיל באיסוף תמונות תוך שימוש בתאורת דסק"ש.
- תריס פתוח כדי להאיר את שדה ההדמיה (מוגבל עם סרעפת שדה) עם מנורת כספית או 530-550 לייזר ננומטר. להמשיך את ההקלטה עד חרוז מתנתק או מהלכים בסוף microtubule פירוק (4D דמויות, 4F, ו4G).
הערה 1: מלכודת אופטית ניתן להשתמש כדי לקדם את האינטראקציה בין קיר microtubule והחרוז מצופה חלבון. זו שימושית במיוחד בעת עבודה עם חרוזים מצופים במנועי kinesin (איורים 4E-G). עקוב אותם פרוטוקולים כאמור לעיל, אלא להשלים את חיץ תנועתיות עם 2 מ"מ Mg-ATP. בשלב 8.3, ללכוד חרוז צף חופשי עם קרן לייזר 1,064 ננומטר, להזיז את הבמה כדי להביא את חרוז הלכוד קרוב יותר לקיר microtubule המפולח. בגין הדמיה עם האור הנמוך דסק"ש ובאמצעות קוביית מסנן Rhodamine ולחכות חרוז להתחיל ללכת לכיוון סוף microtubule כתרים. בירכתי הספינהאה תנועת חרוז המכוונת הוא ציין, סגור את התריס להשמנת קורה ולפתוח את התריס לתאורת ניאון. להמשיך את ההקלטה עד חרוז מתנתק או מסלולים עם סוף microtubule הפירוק.
Access restricted. Please log in or start a trial to view this content.
תוצאות
חלבון מעקב עם depolymerizing microtubule מסתיים. רכיב Dam1 kinetochore שמרים הוא ללא ספק הקצה-הגשש הטוב ביותר של microtubule depolymerizing מסתיים 14. מורכב 10-מקטע זה מסומן עם GFP יכול לבוא לידי ביטוי בקלות ומטוהר מתאי חיידקים 18,38, ולכן אנו ממליצים להשתמש בו כביקורת חיובית עבור assay מ...
Access restricted. Please log in or start a trial to view this content.
Discussion
מבחני מולקולה בודדים רבים בימינו משתמשים באופן שגרתי coverslips טיפול מיוחד כדי להפחית את דבק חלבון ספציפי באופן דרסטי. ההליך שאנו מתארים כאן הוא שינוי של הפרוטוקול המקורי שפותח במעבדה של הווארד 32, ואנו מוצאים כי silanizing coverslips הוא גם שווה את המאמץ אפילו עם מבחני חרוז ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
המחברים מבקשים להודות לFI Ataullakhanov שעזרו לתכנן ולייצר זרימת תאים לשימוש חוזר, נ 'Dashkevich, נ' וא 'Gudimchuk Korbalev למתן תמונות לדמויות, נ' פ 'וGudimchuk זכרוב לפיתוח פרוטוקול ומתן ריאגנטים ל להכין זרעי microtubule כותרת digoxigenin, א Potapenko לעזרה בעריכת טקסט ולחברי הגילדה של המעבדה Grishchuk לעצות ודיונים. עבודה זו נתמכה בחלקו על ידי מענק NIH GM-R01 098,389 ומענק טייס משריר פנסילבניה מכון לELG, שהוא Scholar קימל, על ידי RFBR מעניק 12-04-00,111-, 13-04-40,190-H ו13 -04-40188-H, אקדמיה הרוסית למדעי מענקי נשיאות (מנגנונים של אינטגרציה של המערכות המולקולרית ותוכניות ביולוגיה המולקולרית של תא ומולקולרי) לFI Ataullakhanov, מענק NIH GM R01 GM033787 לJR מקינטוש, ומלגה הבתר דמיטרי Zimin שושלת קרן ל ט"ו
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Table 1. Microscopy and other equipment. | |||
| Microscope | Zeiss Nikon | Axio Imager 2 Eclipse Ti | other microscope models capable of DIC and epifluorescence-imaging can be used |
| Objective | Zeiss Nikon | 420490-9900-000 CFI Apo 100x Oil 1.49 | 100X, DIC, 1.3-1.49 NA |
| Objective heater | Bioptechs | 150803, 150819-19 | |
| Fluorescent filter cube | Chroma | 49004 or 49008 41017 or 49020 | optimized for Rhodamine fluorescence optimized for GFP fluorescence |
| Acquisition software | freeware MicroManager Molecular Devices | not applicable MetaMorph 7.5 | http://valelab.ucsf.edu/~MM/MMwiki/ other software can be used to acquire images and for a particle tracking |
| EMCCD camera | Andor | iXon3, DU-897E-cs0-#BV | Highly sensitive EMCCD camera |
| Trapping laser | IPG Photonics | YLR-10-1064-LP | 1,064 nm laser, 10 W |
| Fluorescence excitation lasers | Coherent, Inc. Coherent, Inc. | Sapphire 488 LP Sapphire 552 LP | excitation of green fluorophores excitation of red fluorophores |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| Commercial flow chambers | Warner Instruments | RC-20 or RC-30 | |
| Perfusion pump | Cole Palmer Harvard Apparatus | Masterflex 77120-52 Pico Plus | Both pumps provide the required rate of liquid flow but a peristaltic pump may pulse at very slow speed. The flow with a syringe pump is more consistent for a wide range of rates but this pump has inertia. |
| Table 2. Microscopy chamber preparation. | |||
| Modified microscope slides for reusable chambers | Precision Glassblowing of Colorado | Custom order www.precisionglassblowing.com | Sonic slots in slides using schematics in Figure 1 |
| Polyethylene tubing | Intramedic | 427410 | I.D. 0.58 mm, O.D. 0.965 mm; use these tubes to connect assembled chamber to the pump and waste container |
| Polyethylene tubing | Intramedic | 427400 | I.D. 0.28 mm, O.D. 0.61 mm; use these tubes to make the reusable chamber |
| Regular microscope slides | VWR | 48312-003 | Other similar slides can be used |
| Coverslips | VWR | 48393-150, 48366-067 | Other similar coverslips can be used |
| Silicon sealant | World Precision Instruments | KIT, SILICON SEALANT 5 MIN CURE | |
| Epoxy glue | Loctite | 83082 | |
| Cyanoacrylate adhesive | Scotch 3M | AD114 | Or cyanoacrylate adhesive from other manufacturers |
| Table 3. Coverslips cleaning and coating. | |||
| Molecular Sieves, Grade 564 | Macron | 4490-04 | |
| Coverglass Staining Jar | Ted Pella, Inc. | 21036 | |
| Coverslip Ceramic Holder | Thomas Scientific | 8542e40 | |
| PlusOne Repel Silane | GE Healthcare Biosciences | 17-1332-01 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Anti-digoxigenin AB | Roche Applied Science | 11093274910 | |
| Table 4. Preparation of seeds and segmented microtubules. | |||
| Tubulin | purified from cow brains Cytoskeleton, Inc | T238P | For purification protocols see 49–51 Unlabeled porcine tubulin |
| Labeled tubulin | Cytoskeleton, Inc Invitrogen Invitrogen | TL590M C1171 (Rhodamine) A-2952 (Digoxigenin) | Rhodamine-labeled porcine tubulin Tubulin can be labeled with any amine-reactive dye as in reference52. |
| GMPCPP | Jena Biosciences | NU-405 | Aliquot and store at -70 °C |
| VALAP | Vaseline, lanolin, and paraffin at 1:1:2 by mass | see reference9 | |
References
- Desai, A., Mitchison, T. J. Microtubule polymerization dynamics. Ann. Rev. Cell Dev. Biol. 13, 83-117 (1997).
- Mitchison, T. M., Kirschner, M. W. Dynamic instability of microtubule growth. Nature. 312 (15), 237-242 (1984).
- Walker, R. A., Brien, O., et al. Dynamic Instability of Individual Microtubules Analyzed by Video Light Microscopy: Rate Constants and Transition Frequencies. J. Cell Biol. 107, 1437-1448 (1988).
- Gardner, M. K., Zanic, M., Gell, C., Bormuth, V., Howard, J. Depolymerizing Kinesins Kip3 and MCAK Shape Cellular Microtubule Architecture by Differential Control of Catastrophe. Cell. 147 (5), 1092-1103 (2011).
- Lombillo, V. A., Stewart, R. J., McIntosh, J. R. Minus-end-directed motion of kinesin-coated microspheres driven by microtubule depolymerization. Nature. 373, 161-164 (1995).
- Franck, A. D., Powers, A. F., Gestaut, D. R., Gonen, T., Davis, T. N., Asbury, C. L. Tension applied through the Dam1 complex promotes microtubule elongation providing a direct mechanism for length control in mitosis. Nat. Cell Biol. 9 (7), 832-837 (2007).
- Tran, P. T., Walker, R. A., Salmon, E. D. A metastable intermediate state of microtubule dynamic instability that differs significantly between plus and minus ends. J. Cell Biol. 138 (1), 105-117 (1997).
- Grishchuk, E. L., Molodtsov, M. I., Ataullakhanov, F. I., McIntosh, J. R. Force production by disassembling microtubules. Nature. 438, 384-388 Forthcoming.
- Coue, M., Lombillo, A., Richard, J. Microtubule Depolymerization Promotes Particle and Chromosome Movement In Vitro. J. Cell Biol. 112 (6), 1165-1175 (1991).
- Grishchuk, E. L., Spiridonov, I. S., et al. Different assemblies of the DAM1 complex follow shortening microtubules by distinct mechanisms. Proc. Natl. Acad. Sci. U.S.A. 105 (19), 6918-6923 (2008).
- Asbury, C. L., Gestaut, D. R., Powers, A. F., Franck, A. D., Davis, T. N. The Dam1 kinetochore complex harnesses microtubule dynamics to produce force and movement. Proc. Natl. Acad. Sci. U.S.A. 103 (26), 9873-9878 (2006).
- Westermann, S., Wang, H. -W., Avila-Sakar, A., Drubin, D. G., Nogales, E., Barnes, G. The Dam1 kinetochore ring complex moves processively on depolymerizing microtubule ends. Nature. 440 (7083), 565-569 (2006).
- Grissom, P. M., Fiedler, T., Grishchuk, E. L., Nicastro, D., West, R. R., Mcintosh, J. R. Kinesin-8 from Fission Yeast A Heterodimeric , Plus-End – directed Motor that Can Couple Microtubule Depolymerization to Cargo Movement. Mol. Biol. Cell. 20, 963-972 (2009).
- McIntosh, J. R., Volkov, V., Ataullakhanov, F. I., Grishchuk, E. L. Tubulin depolymerization may be an ancient biological motor. J. Sci. 123, 3425-3434 (2010).
- Grishchuk, E. L., McIntosh, J. R., Molodtsov, M. I., Ataullakhanov, F. I. Force generation by dynamic microtubule polymers. Compr. Biophys. 4, 93-117 (2012).
- Asbury, C. L., Tien, J. F., Davis, T. N. Kinetochores' gripping feat: conformational wave or biased diffusion. Trends Cell Biol. (1), 38-46 (2011).
- Tien, J. F., Umbreit, N. T., et al. Cooperation of the Dam1 and Ndc80 kinetochore complexes enhances microtubule coupling and is regulated by aurora B. Cell Biol. 189 (4), 713-723 (2010).
- Gestaut, D. R., Graczyk, B., et al. Phosphoregulation and depolymerization-driven movement of the Dam1 complex do not require ring formation. Nat. Biol. 10 (4), 407-414 (2008).
- Schmidt, J. C., Arthanari, H., et al. The Kinetochore-Bound Ska1 Complex Tracks Depolymerizing Microtubules and Binds to Curved Protofilaments. Dev. Cell. 23 (5), 968-980 (2012).
- Brouhard, G. J., Stear, J. H., et al. XMAP215 is a processive microtubule polymerase. Cell. 132 (1), 79-88 (2008).
- Stumpff, J., Du, Y., et al. A Tethering Mechanism Controls the Processivity and Kinetochore-Microtubule Plus-End Enrichment of the Kinesin-8 Kif18A. Mol. Cell. 43 (5), 764-775 (2011).
- Su, X., Qui, W., Gupta, M., Pereira-Leal, J., Reck-Peterson, S. L., Pellman, D. Mechanisms underlying the dual-mode regulation of microtubule dynamics by Kip3/kinesin-8. Mol. Cell. 43 (5), 751-763 (2011).
- Helenius, J., Brouhard, G., Kalaidzidis, Y., Diez, S., Howard, J. The depolymerizing kinesin MCAK uses lattice diffusion to rapidly target microtubule ends. Nature. 441 (7089), 115-119 (2006).
- Gudimchuk, N., Vitre, B., et al. Kinetochore kinesin CENP-E is a processive bi-directional tracker of dynamic microtubule tips. Nat. Cell Biol. 15 (9), 1079-1088 (2013).
- Akhmanova, A., Steinmetz, M. Microtubule +TIPs at a glance. J. Sci. 20 (Pt 20), 3415-3419 (2010).
- Dixit, R., Barnett, B., Lazarus, J., Tokito, M., Goldman, Y., Holzbaur, E. Microtubule plus-end tracking by CLIP-170 requires EB1. Proc. Natl. Acad. Sci. U.S.A. 106 (2), 492-497 (2009).
- Grishchuk, E. L., Efremov, A. K., et al. The Dam1 ring binds microtubules strongly enough to be a processive as well as energy-efficient coupler for chromosome motion. Proc. Natl. Acad. Sci. U.S.A. 105 (40), 15423-15428 (2008).
- Akiyoshi, B., Sarangapani, K. K., et al. Tension directly stabilizes reconstituted kinetochore-microtubule attachments. Nature. 468 (7323), 576-579 (2010).
- McIntosh, J. R., Grishchuk, E. L., et al. Fibrils Connect Microtubule Tips with Kinetochores A Mechanism to Couple Tubulin Dynamics to Chromosome Motion. Cell. 135 (2), 322-333 (2008).
- Powers, A. F., Franck, A. D., et al. The Ndc80 kinetochore complex forms load-bearing attachments to dynamic microtubule tips via biased diffusion. Cell. 136 (5), 865-875 (2009).
- Umbreit, N. T., Gestaut, D. R., et al. The Ndc80 kinetochore complex directly modulates microtubule dynamics. Proc. Natl. Acad. Sci. U.S.A. 109 (40), 16113-16118 (2012).
- Gell, C., Bormuth, V., et al. Microtubule Dynamics Reconstituted In Vitro and Imaged by Single-Molecule Fluorescence Microscopy. Methods Biol. 95, 221-245 (2010).
- Dixit, R., Ross, J. L. Studying Plus-End Tracking at Single Molecule Resolution Using TIRF Microscopy. Methods Cell Biol. 95, 543-554 (2010).
- Beausang, F. J., Sun, Y., Quinlan, E. M., Forkey, N. J., Goldman, Y. Construction of Flow Chambers for Polarized Total Internal Reflection Fluorescence Microscopy (polTIRFM). Cold Spring Harbour Protoc. 6, 712-715 (2012).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP Hydrolysis in Microtubule Dynamics: Information from a Slowly Hydrolyzable Analogue, GMPCPP. Mol. Biol. Cell. 3, 1155-1167 (1992).
- Grishchuk, E. L., Ataullakhanov, F. I. In Vitro Assays to Study the Tracking of Shortening Microtubule Ends and to Measure Associated Forces. Methods Cell Biol. 95, 657-676 (2010).
- Gutiérrez-Medina, B., Block, S. M. Visualizing individual microtubules by bright field microscopy. Am. J. Phys. 78 (11), 1152-1159 (2010).
- Volkov, V. A., Zaytsev, A. V., et al. Long tethers provide high-force coupling of the Dam1 ring to shortening microtubules. Proc. Natl. Acad. Sci. U.S.A. 110 (19), 7708-7713 (2013).
- Laan, L., Pavin, N., et al. Cortical dynein controls microtubule dynamics to generate pulling forces that position microtubule asters. Cell. 148 (3), 502-514 (2012).
- Myster, S. H., Knott, J. A., O'Toole, E., Porter, M. E. The Chlamydomonas Dhc1 gene encodes a dynein heavy chain subunit required for assembly of the I1 inner arm complex. Mol. Biol. Cell. 8, 607-620 (1997).
- Lombillo, V. A., Coue, M., McIntosh, J. R. In vitro motility assays using microtubules tethered to Tetrahymena pellicles. Methods Cell Biol. 39, 149-165 (1993).
- Hyman, A., Chrétien, D., Arnal, I., Wade, R. Structural changes accompanying GTP hydrolysis in microtubules: information from a slowly hydrolyzable analogue guanylyl-(alpha,beta)-methylene-diphosphonate. J. Cell Biol. 128 (1-2), 117-125 (1995).
- Park, M., Kim, H., Kim, D., Song, N. W. Counting the Number of Fluorophores Labeled in Biomolecules by Observing the Fluorescence-Intensity Transient of a Single Molecule. Bull. Chem. Soc. Jap. 78, 1612-1618 (2005).
- Welburn, J. P. I., Grishchuk, E. L., Backer, C. B., Wilson-Kubalek, E. M., Yates, J. R., Cheeseman, I. M. The human kinetochore Ska1 complex facilitates microtubule depolymerization-coupled motility. Dev. Cell. 16 (3), 374-385 (2009).
- Efremov, A., Grishchuk, E. L., Mcintosh, J. R., Ataullakhanov, F. I. In search of an optimal ring to couple microtubule depolymerization to processive chromosome motions. Natl. Acad. Sci. U.S.A. (48), 19017-19022 (2007).
- Itoh, T., Hisanaga, S., Hosoi, T., Kishimoto, T., Hotani, H. Phosphorylation states of microtubule-associated protein 2 (MAP2) determine the regulatory role of MAP2 in microtubule dynamics. Biochemistry. 36 (41), 12574-12582 (1997).
- Oguchi, Y., Uchimura, S., Ohki, T., Mikhailenko, S. V., Ishiwata, S. The bidirectional depolymerizer MCAK generates force by disassembling both microtubule ends. Nat. Biol. (6), 1-8 (2011).
- Kishino, A., Yanagida, T. Force measurements by micromanipulation of a single actin filament by glass needles. Nature. 334, 74-76 (1988).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann. NY Acad. Sci. 253, 107-132 (1975).
- Weingarten, M. D., Lockwood, A. H., Hwo, S., Kirschner, M. W. A Protein Factor Essential for Microtubule Assembly. Proc. Natl. Acad. Sci. U.S.A. 72 (5), 1858-1862 (1975).
- Widlund, P. O., Podolski, M., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Mol. Biol. Cell. 23 (22), 4393-4401 (2012).
- Hyman, A., Drechsel, D., et al. Preparation of Modified Tubulins. Methods Enzymol. 196, 478-485 (1991).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved