JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
분해 미세 소관 엔드에 힘 입어 모션을 연구하기 위해 분단 미세 소관의 준비
요약
미세 소관은 본질적으로 불안정 폴리머, 그리고 성장과 단축 사이에 자신의 전환 확률 통제하기가 어렵습니다. 여기에서 우리는 photoablatable 안정 캡으로 분할 미세 소관을 사용하여 프로토콜을 설명합니다. 분할 된 미세 소관 해중합함으로써 분해 미세 소관의 끝 동작의 분석을 지원, 높은 공간적 해상도로 트리거 될 수 있습니다.
초록
미세 소관 해중합은 체외에서 다른 단백질 복합체 단백질 코팅 비즈를 수송하는 힘을 제공 할 수 있습니다. 기본 메커니즘은 세포 분열 중에 미세 소관 의존 염색체 운동에 중요한 역할을하는 것으로 생각되지만, 관련 단백질과 자신의 정확한 역할은 불분명합니다. 따라서, 정제 된 구성 요소와 정의 생화학 적 환경을 사용하여 체외에서 이러한 운동을 연구하는있는 분석법을 개발하는 요구가 증가하고 있습니다. 미세 소관은, 그러나, 본질적으로 불안정 중합체이다, 성장과 단축 사이에 자신의 전환 확률 통제하기가 어렵습니다. 우리가 여기에서 설명하는 프로토콜은 photoablatable는 캡을 안정으로 만든 분할 된 미세 소관을 활용. 이러한 분할 된 미세 소관 해중합함으로써 분해 미세 소관의 끝에서 운동의 연구를 지원, 높은 공간적 해상도로 트리거 될 수 있습니다. 이 기술은 CA에 사용될 수있다동적 미세 소관은 끝 processively 이동 형광 표지 된 단백질 복합체, 분자의 수의 정량적 인 분석을 RRY. 이것으로 신호 대 잡음 비율 및 기타 정량적 형광 분석법을 최적화하려면, 커버 슬립은 수용성 형광 표지 된 단백질의 비특이적 흡착을 감소하도록 처리한다. 상세한 프로토콜은 고려 형광 조명의 불균일을 취해, 등거리 가우시안 적합하여 하나의 형광의 강도를 결정하기 위해 제공된다. 마지막으로, 우리는 processive화물 운동에 몇 미세 소관 해중합에 다른 모터와 nonmotor 단백질의 기능에 대한 통찰력을 제공하는 단백질 코팅 마이크로 비즈의 미세 소관에 의존하는 동작을 연구하는 분할 된 미세 소관의 사용을 설명합니다.
서문
미세 소관은 높은 세포 구조, 세포 운동성, 세포 분열, 세포 내 수송 1에 중요한 골격 구조를 보존하고 있습니다. 이러한 동적 중합체는 GTP의 존재 튜 불린에서 조립 이들은 자발적 성장이 단축 전환. 미세 소관은 (직경 25 nm의) 콘트라스트가 광학 현미경으로 미세 소관을 관찰하는 데 사용되어야합니다 강화하기 때문에 특별한 광학 기술 매우 얇은입니다. 이러한 폴리머와 이전 작업은 미분 간섭 대비 (DIC)을 3 사용하여 동적 동작을 살펴 보았다. 체외에서 이것과 유사한 연구는 일반적인 실험 조건에서 미세 소관은, 드물게 해중합에 재앙과 스위치를 거쳐야 밝혀마다 5 ~ 15 분 (이 주파수는 28 ~ 32 ° C에서 검사 7-15 밀리미터 용해 튜 불린의 농도입니다 ) 4. 다른 기술은 따라서 인덕턴스에 제안되었다제어 방식으로 전자 미세 소관 해중합. 미세 소관 쇼트닝 여기서 설명한 바와 같이, 거리 수용성 튜 불린 5,6 세척 레이저 광 (7)로 미세 소관을 절단 또는 분할 된 미세 소관 8을 사용하여 발생 될 수있다. 분할 된 미세 소관뿐만 아니라, 확률 론적으로 전환 폴리머를 사용하여 이전 작업은 이러한 염색체, 소포, 단백질 코팅 비즈 작은 세포 내화물은, 단축 미세 소관 9-13의 끝에서 이동할 수 있다는 것을 발견했다. 이러한 현상은 유사 분열 세포의 염색체 운동에 대한 직접적인 의미를 생각하고, 기본 메커니즘이 활성화 연구 14-16에서 현재됩니다.
최근, 총 내부 반사 형광 (TIRF) 현미경 등의 형광 기반 기술, 동적 인 미세 소관과 운동성을 연구하기 위해 사용되었다가 17-24로 끝났습니다. 이 방법의 장점은 허용한다는 것이다 상호 작용의 검토다른 형광 물질로 표지 단백질을 사용하여 실시간으로 미세 소관과 미세 소관 결합 단백질 사이의. 몇몇 단백질 복합체는 미세 소관 단부를 연신 및 / 또는 단축으로 processively 이동 발견되었다. 그들은 미세 소관 관련 단백질 Dam1 10,12,18, Ska1 19 일 및 XMAP215 (20)뿐만 아니라, 키네신 모터 Kif18A 21, 22, MCAK 23 CENP-E (24)이 (가) 있습니다. 이 단백질은 EB1 (25)와 같은 고전적인 팁 추적 단백질의 그것과 근본적으로 다른 processive 팁 추적을 나타낸다. EB1 분자 및 관련 파트너는 안정적으로 동적 미세 소관은 개별 분자가 빠르게 용해 수영장 (26)와 교환 만 ~ 0.8 초 미세 소관 팁에 바인딩 유지, 종료와 관련된 남아있는 것처럼 보이지만. 미세 소관이 많은 마이크론에 끝 반면, processive 팁 추적기, Dam1처럼, 여행, 및 미세 소관 조언과의 관계는 M 지속될 수모든 초. 팁 연관 시간뿐만 아니라, 추적 결과 속도는, 팁 추적 복합체를 형성하는 분자 (27)의 수에 크게 의존한다. 큰 단백질 앙상블은 일반적으로 훨씬 더 팁 추적기입니다. 예를 들어, 분리 된 효모 kinetochores와 같은 복잡한 어셈블리는 미세 소관에 결합 된 상태를 유지할 수는 시간 28 일 끝납니다. 일부 미세 소관 결합 단백질은, 예를 들어 Ndc80 동원체의 단백질 복합체, 단일 분자 수준에서 종료 미세 소관으로 추적 할 수없는 것으로, 아직 Ndc80은 구슬화물 19,29-31의 움직임을 결합에 매우 효율적입니다되었습니다. 따라서, 다른 단백질 복합체뿐만 아니라 생물학적 역할에 의한 팁 추적 메커니즘을 이해하기 위해, 그 팁 추적 복잡한 분자의 개수의 함수로서 팁 추적을 검사 할뿐만 아니라, 결정하는 것이 중요하다 구슬화물의 표면에 집단 운동을 전시하는이 단지의 기능을 제공합니다.
우리가 분할 된 미세 소관 (그림 1A)와 함께 실험을 준비하고 수행 할 수있는 세부적인 프로토콜을 제공하는 아래. 첫째, 상업적으로 이용 가능한 유리 슬라이드 짧은 폴리에틸렌 관 (프로토콜 1)를 첨부하도록 수정됩니다. 재사용 할 수있는 현미경 흐름 챔버는 다음과 같은 슬라이드에서 조립 및 화학적 또는 플라즈마 세정 및 실란 커버 슬립 (프로토콜 2) 32 ~ 34됩니다. 얻어진 챔버 체적은 유입 배관의 용적 등 만 20-25 μL (또는 15 μL 한 작게, 프로토콜 1 주 3 참조)이다. 시판 유동 챔버도 사용될 수 있지만, 그 양이 단백질의 불필요한 낭비로 이어지는, 보통 크다. 큰 챔버가 사용되는 경우, 아래의 프로토콜의 모든 솔루션의 볼륨이 비례 적으로 조정해야한다. 미세 소관의 씨앗이 서서히 가수 분해 GTP 아날로그, GMPCPP (구아노 신-5'-[(α, β) methyleno] 트리 포스페이트) (프로토콜 3 등을 사용하여, 준비, 하이 먼 <도 참조EM> 등. 35). 씨앗 청소 커버 슬립에 고정하고 표면은 이후에 다른 단백질의 비특이적 흡착을 방지하기 위해 차단 32 (프로토콜 4 제닌 사용 씨의 고정화를 설명합니다). 분단 미세 소관은 5 프로토콜을 사용하여 제조 될 수있다. 이 방법의 주된 이론적 근거는 GTP의 존재하에 동적 미세 소관 형성 중합체, GMPCPP 포함될 안정 튜 불린 세그먼트의 짧은 "캡"을 추가하여 일시적으로 안정화 될 수 있다는 것이다. 이 모자는 로다 민 표지 튜 불린을 포함, 그래서 그들은 530-550 nm의 레이저 또는 수은 아크 램프 (프로토콜 6) (36)의 시야를 비추는 것만으로 간단하게 제거 할 수 있습니다. 팁 트래킹 신호의 형광 강도는 고려 현미경 야 조사 (프로토콜 12)의 요철을 가지고, 분해 미세 소관 단부로 여행 분자의 수를 추정하기 위해 사용될 수있다. 유사한 접근법이 사용될 수있다27 (프로토콜 8)에 기술 된 바와 같이 제조 된 해중합의 미세 소관 단백질 코팅 구슬 사이의 상호 작용을 연구합니다. 일부 단백질은 쉽게 분할 된 미세 소관의 벽에 결합하지만, 레이저 핀셋도하여 그 바인딩 홍보, 미세 소관 벽 근처 비드를 보유 할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
필수 장비 : 아래에서 설명하는 실험이 DIC와 형광 이미징 (표 1)에 장착 된 광학 현미경을 필요로합니다. 시야 LED 조명은 크게 일반 할로겐 램프로 관찰하기 어려운 커버 슬립 연결된 미세 소관 씨 (37)의 검출을 향상시키기 위해 사용될 수있다. 현미경 실에서 액체의 흐름을 제어하기 위해, 솔루션은 10 ~ 100 μL / 분에서 흐름의 속도를 낼 수있는 연동 펌프로 교환해야합니다. 주사기 펌프도 이용 될 수 있지만, 치료는 유동 속도가 갑자기 변경 될 때 형성 할 수 있고 기포를 피하기 위해주의해야한다. 단백질 - 코팅 된 비드를 처리하기위한, 예를 들어 분할 된 미세 소관 벽 부근들을 가지고, 1064 nm의 연속파 레이저 광 현미경의 광축에 도입하고 생성하기 위해 높은 개구 수 대물 (1.3 이상)로 집중 될 수있다 함정. 형광의 정량 분석여기 광이 광원의 강도 이후 레이저 계 소스에 의해 제공되어야 단일 분자의 강도는 수은 램프에 의해 생성 된 것보다 더 안정적이다. 기계적 진동을 최소화하기 위해, 현미경 광학 테이블에 배치되어야한다. 더 정교한 장비가 해중합 미세 소관이 일정한 힘에서 끝 구슬의 움직임을 연구하고, 싱글 샷 힘 신호 11,38,39를 측정하고, 이러한 방법은 다른 곳에서 설명한다.
1. 제조 재사용 유량 용기
재사용 할 수있는 유량 용기 용 유리 슬라이드 (우리의 공급자에 대한 자세한 내용은 표 2 참조) 그림 1B의 회로도를 사용하여 로컬 유리 제조 시설에서 주문할 수 있습니다. 초음파 밀링 일반 현미경 2 개의 홈 15 ± 1 밀리 긴 만드는 슬라이드 (75mm X 25mm, 두께 1.0 mm), 1.0 ± 0.1 mm 폭과 깊이 0.8 ± 0.05 mm를 수정합니다.가장 가까운 끝 사이의 거리가 14 ± 1 mm 이상이어야한다이 거리가 X 22mm의 coverslip에 22mm 조립 실에 최적입니다. 다른 물질의 목록은 표 2를 참조하십시오.
- 홈의 내부 끝 ~ 5mm의 오버행을 떠나, 슬라이드의 각 홈에 100 mm 길이의 폴리에틸렌 관 (OD 0.61 mm, 표 2)를 배치합니다. 홈 내부에 완전히 튜브를 삽입, 시아 노 아크릴 레이트 접착제로 홈 내부의 튜브를 고정합니다.
- 튜브 안쪽에 접착제를 흘리고 피하면서, 에폭시 접착제로 홈을 입력합니다. 접착제 ~ 1 일 동안 건조시킵니다.
- 날카로운 면도날 슬라이드의 중심으로 기단 부분을 제거하는, 각 부착 위치의 말단부에서 고화 접착제 질량 3-4밀리미터 자른다. 튜브는 홈 내부에 남아 있어야합니다. 근위 부분을 제거하면 잘라 두 개의 튜브 구멍으로 평평한 표면을 생성, 내부 돌출부를 제거합니다.
- 물과 테스트 주사기를 채우튜브가 제대로 작동하는지. 자유롭게 액체 흐름, 일일 (그림 1D)를위한 건조한 숲의 바깥 쪽 끝,에 에폭시 접착제의 드롭 (~ 직경 5 ㎜)를 넣어합니다. 이 챔버는 더 튼튼한 것, 그래서 그들은 몇 달 동안 반복 사용할 수 있습니다.
주 1 : 거꾸로 현미경 실을하려면, 슬라이드 홈 (그림 1C)의 양단에 두 개의 작은 구멍을 만들기 위해 추가로 수정해야합니다. 슬라이드에있는 구멍을 통해 튜브를 삽입 튜브를 구부려 홈 (그림 1E) 내부에 단단히 그들을 맞습니다. 단계 1.2-1.4를 따르지만 유동 챔버를 만들기 위해 사용되는 전체면에서 에폭시 접착제를 제거한다.
주 2 : 챔버 체적을 감소 개의 톱니 0.050 깊은 ± 0.005 mm를 만들기 위해 맷돌을 사용, 5.0 ± 0.5 mm 폭이 약간 상승 된 슬라이드의 중앙 부분을 떠나 (그림 1B 및 1C에 "에칭 영역"참조). 때 t(아래 설명 참조) 그 흐름 챔버가 조립되어, 이러한 들여 내부에 양면 테이프를 배치합니다.
주 3 :이 수정 된 슬라이드를 다시 사용하기 위해, 실험 면도날을 사용하여 커버 슬립 및 양면 테이프를 제거 마친 후. 을 박리하여 70 % 에탄올로 슬라이드를 닦아 실란트를 제거합니다. 연동 펌프에 튜브를 연결하고 50 ~ 70 ㎖에 perfuse, 먼지가없는 구획 같은 탈 이온수의 양, 건조 및 저장에 따라, 실험실 세제의 1 ~ 2 %로 용기에 슬라이드를 놓습니다.
2. Coverslips는 준비
이 프로토콜은 6 ~ 8 시간을 소요하고 12 커버 슬립을 준비하는 데 도움이 될 것입니다. 당신은 뚜껑으로 한 세라믹 커버 슬립 홀더와 3 coverslip에 염색 항아리가 필요합니다, 단지 규모는 15 ㎖를해야한다, 각각의 스택 함께 4 커버 슬립을 개최한다. 뚜껑 (250 ㎖)와 유리 항아리 실란과 커버 슬립을 배양하는 데 사용되어야한다. 정규 1 번 유리 커버 슬립을 사용 (22mm X 22mm 또는 2X 30mm 2mm가) 재료의 목록은 표 2와 3을 참조하십시오. 장갑을 착용하고있는 동안의 모든 단계, 흄 후드에서 수행되어야한다.
- 유리 coverslip에 염색 항아리에 커버 슬립을 넣고 아세톤으로 항아리를 채우십시오. 1 시간 동안 품어, 탈 이온수로 10 배 씻는다.
- 에탄올의 coverslips 10 분을 품어 탈 이온수로 다시 배를 세척한다.
- "피라니아"솔루션을 준비합니다. 내열 유리 용기에 과산화수소 용액 (물에서 30 %) 60 ㎖를 넣고 천천히 황산 100 ㎖를 추가 (과산화수소 용액에 산의 최종 비율은 5시 3분이다). 솔루션은 가열됩니다 이것은 정상입니다 만,주의하십시오. 피라니아 솔루션은 매우 부식성입니다! 두꺼운 실험실 코트, 장갑과 고글을 사용!
- 뚜껑을 닫고 1 시간 동안 90 °의 C로 예열 물을 욕조에 항아리를 놓고 "피라니아"솔루션으로 커버 슬립 염색 항아리를 채우십시오.
- "피라니아"soluti입니다을 부어직장에서 안전 규정의 지시에 따라와에 버린다. 세척은 탈 이온수로 10 배를 커버 슬립.
- , 0.1 M KOH로 coverslip에 염색 항아리를 채우 10 분을 배양하고, 탈 이온수로 10 배 씻는다. 이것은 "피라니아"치료 후 커버 슬립에 남아있는 산성 잔류 물을 중화합니다.
- 드라이 coverslips를 테플론 코팅 된 편평한 진 핀셋 (유리 표면의 손상을 최소화하기 위해)과 각 커버 슬립을 지주에 의해 한번에 하나씩 압축 건조 질소 불고있다. 실란 용액을 물과 반응성이 매우 높은 때문에, 커버 슬립이 완전히 건조되어 있는지 확인합니다.
- 충분히 질소 사전 건조해야한다 세라믹 홀더 (홀더 당 12의 coverslips)에 건조 된 커버 슬립를 스택. 커버 슬립 표면에 달라 붙는 먼지를 방지하기 위해 적용되는 세라믹 홀더를 유지합니다.
- 분자 체, 학년 564, 수분 흡수를위한 250 ㎖의 유리 항아리 (지름 6cm)의 바닥을 커버.
- 200 ㎖의 항아리 채우기PlusOne 격퇴 실란 솔루션 천천히 뚜껑을 닫고 실온에서 5 분 동안 품어, 항아리에 커버 슬립과 함께 세라믹 홀더를 체험. 이 커버 슬립 표면에 소수성 코팅을 만듭니다.
- 천천히 항아리에서 커버 슬립으로 홀더를 제거하고 전송 메탄올로 가득 coverslip에 염색 항아리에 한 번에 하나의 coverslips.
- 커버 슬립 염색 항아리는 높이의 2 / 3 침지되도록 소닉 욕조의 물이 저수지에 금속 또는 유리 받침대를 놓습니다. 20 분 70 W의 초음파 처리, 메탄올 용액마다 5 분을 변경 한 후 탈 이온수로 10 배를 씻어. 실란 화가 제대로 작동하면 물에서 제거 할 때, 커버 슬립 건조 나타납니다.
- 철저하게 위와 같이, 질소를 사용하여 잔류 물을 제거합니다.
- 커버 슬립 사이의면 대면 접촉을 피하기 위해 킴 와이프와 커버 슬립을 층간. 커버 슬립을 실온에서 몇 주 동안 밀봉 된 용기에 저장 될 수있다.
NOTE 1 : 2.1-2.6 크게 총 제조 시간의 단축, 30 W에서 15 분 동안 플라즈마 세정기로 커버 슬립을 세정에 의해 대체 될 수있는 단계. 청소 챔버 내부의 압력은 100 ~ 200 mTorr로 설정되어 있습니다. 모두 대기와 압축 산소를 사용할 수있다. 세라믹 홀더에 플라즈마 세정의 coverslips 스택 및 2.7 단계로 진행합니다.
3. GMPCPP 안정화 미세 소관의 씨앗 준비
이 절차는 ~ 1 시간이 걸릴 것이며, 그 결과 미세 소관 씨는 실온에서 1-2일 안정이다. 시약의 목록은 표 4를 참조하십시오.
- 얼음에 혼합 :
- 10 μL는 BRB-80 버퍼에 튜 블린 (100 μM, 표 4) 레이블이 지정되지 않은 (80 mM의 파이프, 1 ㎜ EGTA, 4 mM의 MgCl2를, KOH으로 pH 6.9, 보충 1-2 mM의 DTT와 각 실험에 대한 신선한 나누어지는 사용).
- 2.6 μL의 제닌 표지 튜 블린 (표 4). 준비에 따라 볼륨을 조정,비 표지로 표지 된 튜 불린의 최종 비율은 1:10 ~되도록. 피펫으로 잘 섞는다.
- 1.4 ㎕의 10 mM의 GMPCPP (최종 농도 1 ㎜)
- 35 ° C에서 15 분 알을 품다, 종자는 긴 2 ~ 3 μm의 성장할 것입니다. 다른 미세 소관의 길이가 필요한 경우 시간을 조정합니다.
- 실온에서 씨앗을 펠렛 25,000 XG에서 15 분 동안 35 ㎕의 BRB-80 (35 ° C에 데워진가), 피펫으로 혼합하고, 원심 분리기를 추가합니다.
- , 상층 액을 버린다 부드럽게 따뜻한 BRB-80의 50 μl를 추가하고 제거하여 펠렛을 씻으십시오.
- 를 Resuspend 25 μL의 BRB-80에서 잘 펠렛.
4. 커버 슬립에 미세 소관 씨의 첨부
프로토콜 4와 5는 2 ~ 3 시간이 필요합니다, 그래서 두 흐름 챔버는 하루에 사용됩니다.
- 실란의 coverslips를 사용하여 제조 업체의 지침에 따라 유량 용기를 조립하고 4.2 단계로 진행합니다. 주문품의 coverslips를 사용하는 경우 (프로토콜 1) 단계의 벨을 따라아야.
- 중앙 ~ 5mm 광역 함께 양면 테이프 두 조각 (5mm × 30 mm)를 부착 단단히 테이프를 눌러 꼭대기에 실란의 coverslip을 넣어.
- 튜브 중 하나를 통해 BRB-80와 챔버를 입력하고 둥근 이쑤시개와 두 튜브를 연결합니다.
- 작은 플라스틱 페트리 접시 위에 두 색 KWIK 캐스트 실란트의 작은 방울을 짜내, 이쑤시개를 사용하여 신속하게 그러나 철저하게 섞는다. 실란트가 녹색으로 바뀝니다 곧바로 적용 신중하게 커버 슬립의 모든 가장자리를 밀봉. 실란트 커버 슬립 하에서 너무 깊게 침투하는 경우, 이쑤시개 플러그를 제거하여 튜브 중 하나를 열고 튜브 내부 누설을 방지하는 밀봉 완만 한 압력을 적용 할 수있다.
- 10 분 동안 챔버 건조시켜 흐름이 더 진행하기 전에 제한되지 않았 음을 확인합니다.
- 32 ° C에 데워진 현미경 무대에 챔버를 놓고 액체를 펌프 할, 펌프 튜브 중 하나를 첨부합니다. 주입 관의 길이추천 길이 5 ~ 7 cm입니다 : 시약의 불필요한 손실을 방지하기 위해 최소화되어야한다. 0.5이 끝을 담가 ML BRB-80 버퍼 유리 병. 이 아래 모든 솔루션은 32 ~ 35 ℃로 데워진해야
- 펌프 온화한 압력을 적용하거나 단순히 도입 관 마개가 제거 될 때 때때로 형성 될 기포를 밖으로 짜내 배출 튜브의 단부를 엘리베이터.
- 100 μL / 분에서 펌프의 속도를 설정합니다. , BRB-80에 1:30으로 희석 방지 제닌 항체의 2 챔버 볼륨과 세척 항체 흡착을 할 수 있도록 15 분 알을 품다.
- 따뜻한 BRB-80의 5-10 챔버 볼륨과 세척 실란 커버 슬립의 소수성 표면을 차단하는 BRB-80을 1 % 플루로 닉 F-127으로 10 분을 품어.
- 운동 버퍼 5-10 챔버 볼륨 (BRB-80 카제인 0.4 ㎎ / ㎖로 보충)로 세척.
- 10 μL / 분에 펌프 속도를 줄이고 30 ~ 40 ㎕의 운동성 버퍼에 1:200-1:600 희석 미세 소관의 씨앗을 perfuse. 15 마일을 품어coverslip에 흡착 항체 씨의 결합을 촉진하기 위해 N.
- 어떤 결합되지 않은 물질을 제거하는 운동 버퍼 400 μL에 100 μL / 분에서 실을 씻으십시오.
주 1 : 씨앗의 결과 밀도는 10-30 당 현미경 필드 (그림 2A)해야한다. 문제를 해결하려면, coverslip에 부착 된 종자를 쉽게 검출을위한 중합 (3.1 단계) 동안 찬란 튜 불린을 사용합니다.
주 2 : 클라 미도 모나스 (40) 또는 다른 생물학적 소스뿐만 아니라, 용해 및 deciliated Tetrahymena 셀 (41)의 펠리클로부터 제조 Axonemes 또한 nucleators 미세 소관으로 사용될 수있다. 이들은 nucleators 작은 미세 소관 배열을 만들 때 유용하며, protofilaments의 특정 번호와 미세 소관이 (GMPCPP 씨 nucleates ≥ 14 protofilaments (42)를 포함하는 하나의 미세 소관)를 원하는 경우가 바람직하다. 이러한 구조는 ATTA보기 비특이적 흡착에 의한 세정 커버 슬립에 부착 될 수 있지만chment는 실란의 coverslips를 사용하여 특히 항체 기반의 첨부 파일에 비해 일반적으로 덜 안정적이다.
5. 분단 된 미세 소관의 준비
아래의 모든 용액 부피는 챔버 체적 15-20 μL 용; 큰 챔버가 사용되는 경우에 비례하여 증가한다.
- Prewarm 레이블이없는 튜 불린 혼합 후 35 ℃에서 30 초 (45 μL 운동성 버퍼는 1 ㎜의 Mg-GTP와 함께 10 ~ 15 μm의 레이블이없는 튜 불린 보충) 30 μL / 분에서 Perfuse.
- DIC 광학 (그림 2B, 비디오 1)와 미세 소관의 성장을 모니터링합니다. 5-7 분 동안 배양 한 미세 소관은 보통 ~ 10 μm의 길이 성장.
- 로다 민 - 튜 불린 믹스 (0.5 mM의 GMPCPP 및 튜 불린에 로다 민의 0.5 몰비 로다 민 표지 튜 불린의 2-5 μM로 보충 된 65 ㎕의 운동성 버퍼)를 준비하고 30 초 동안 35 ° C에서 솔루션을 따뜻하게.
- 30 μ 즉시 PerfuseL / 분. 미세 소관의 끝을 안정 형광 캡의 형성을 촉진하기 위해 8 ~ 10 분 동안 품어. 안정 미세 소관 세그먼트는 자발적으로 핵하고 DIC 광학과 볼 수 있습니다.
- tubulins 및 뉴클레오티드뿐만 아니라 수용성 미세 소관의 파편을 제거하기 위해 20 μL / 분에서 운동 버퍼 100 μL 잘 챔버를 씻으십시오.
- DIC으로, 미세 소관 (그림 2D)에서 볼 수 있도록 확인, 많은 미세 소관이 모자를 씌우는 동안 분해하기 때문에 자신의 번호는, 그러나, (비디오 2 분할 된 미세 소관으로 일반적인 필드를 보여줍니다) 감소한다.
주 1 : 분단 미세 소관은 매우 안정적이며, 적어도 2 시간 동안 사용할 수있다. 그러나, 이들 미세 소관의 수명은 과도한 용액 과거 감소, 또는 2 - 머 캅토 에탄올이 촬상 버퍼에의 사용.
6. 해중합 미세 소관 엔드와 단백질의 추적 실험 관측
- IntrodUCE 30 ~ 50 10 μL / 분 챔버에 형광 단백질 (0.1 ~ 20 NM)의 μL. 커버 슬립에 붙어 단백질은 분명한 경우 4-8 ㎎ / ㎖ BSA와 운동성 버퍼를 보충. Alexa488 - Dam1 팁 추적은 추가로 10 mM의 DTT 또는 0.5 % βME 10이 필요합니다.
- 미세 소관의 불필요한 표백 및 분해를 방지하기 위해 현미경 필드 다이어프램을 이용한 조명 필드를 제한한다.
- GFP 필터 큐브를 사용하여 비디오 수집을 시작, 다음 이미지 레코딩을 중단하지 않고 로다 민 필터 큐브로 전환합니다. 미세 소관의 끝에서 붉은 부분은 명확하게 볼 수 있어야합니다, 그들은 (비디오 3) 퇴색하고 신속하게 분해하기 시작합니다.
- 모자는 거의 (일반적으로 10 ~ 20 초 동안하지만 이번에는 더 낮은 로다 민 라벨의 비율로 성장 캡 예정) 사라질 때까지 조명하고, 미세 소관 분해와 추적 단백질을 기록 GFP 채널로 전환하기 위해 계속합니다.
- 분석kymographs를 구성하여 결과 시퀀스, Metamorph의, 개방 ImageJ에 또는 다른 이미지 처리 소프트웨어 (도 2E)을 사용하여) 관측 동안 여러 번 미세 소관 축을 따라 형광 강도를 보여 즉 이차원 이미지.
주 1 : 수집 속도는 관찰 이벤트의 타이밍에 따라 조정되어야한다. 권장 속도가 느린 이동 초 (FPS) 2 ~ 3 프레임이다, 반지 크기 Dam1 (27)의 콤플렉스하지만 단일 분자에 대한 수집 시간> 20 FPS 19해야한다.
주 2 : 매우 민감한 EMCCD, 예를 들면 ANDOR iXon3가 해중합 미세 소관과 팁 추적 이벤트의 빠른 기록이 필요합니다. 도르 iXon3 카메라에 권장되는 설정은 다음과 같습니다 이득의 5 배, EM 게인 (200), 1 MHz의 판독 속도, 16 비트 센서 모드, 80 밀리 초 노출 시간.
주 3 : TIRF 현미경을 사용하여 신호 대 잡음비를 향상시킬 수 있지만, 짧은 미세 소관 사용해야 같은 그쪽T 형광 안정화 캡은 사라져가는 필드의 범위 내에서 유지됩니다.
7. 미세 소관 정보 추적 단지의 분자 크기의 정량 분석
이 접근법에 대한 이론적 근거는 단일의 형광 강도에 팁 추적 착체 전체의 형광 강도의 비를 찾아 팁 추적 복잡한 분자의 수를 결정하는 것이다. 이 접근법은 GFP 단백질 융합체 및 형광 염료로 표지 단백질에 적용 할 수 있지만, 수동식 일부 단백질 분자는 형광하지 않은 경우에는 팁 추적 복합체 분자의 수를 과소있다.
- 형광 표지 단백질 분자에 대한 기록 광표백 속도론.
- 전체 프로토콜 2를 사용하여 제조 할 수있는 nonmodified 유리 슬라이드, 양면 테이프의 두 스트립, 깨끗한 커버 슬립을 사용하여 일반 현미경 챔버를 조립하거나이의 2.1-2.6 단계를프로토콜입니다.
- , 운동성 버퍼에 약 50 nm의 단백질을 추가 운동성 버퍼로 간단히 씻어 VALAP (표 4)과 챔버를 밀봉. (솔루션에서 자발적으로 형성 할 수 또는 여러 개의 단일 분자가 서로 가까이과를 해결할 수없는 경우에 나타날 수 있습니다 삼량 체 및 사량) 단일 분자를 나타내는 균일하게 분산 된 지점 (그림 3A), 그들의 작은 집계에 필드를 얻기 위해 단백질 농도를 최적화 . 이 단계는 photobleaching에 단계와 단계 사이즈의 정확한 결정 (아래 참조)의 다중 피크 분포를 얻기 위해 매우 중요합니다.
- 개개의 형광 반점 여전히 볼 수있는에서 조명 레이저 강도를 최소화; 낮은 조명 광표백 시간이 연장되고, 그래서 더 이상 photobleaching에 흔적을 얻을 수있다. 또한 한 프레임 동안 하나 이상의 형광 표백의 가능성을 줄이기 위해, 노광 시간을 최소화한다. 권장 설정도르 iXon3의 카메라 : 게인 5.0 배, EM은 얻기 999, 10 MHz의 판독 속도, 50 ~ 100 밀리 초 노출 시간.
- , 조명 셔터를 닫고 신선한 필드로 이동 조명 셔터를 열고 모든 컴플렉스 (이후 IMG (x, y라고 함))을 표백 할 때까지 이미지를 수집, 커버 슬립의 표면에 초점.
- 조명의 불균형 (그림 3B)의 획득 된 영상을 수정합니다.
- 어떤 형광 용액을 준비, BRB-80의 예를 들어 1 μM 플루오 레세 인 이소 티오 시아 네이트 (FITC). 이러한 솔루션은 사전에 준비 분주하고 -20 ° C.에 저장할 수 있습니다
- 7.1.1 절에서와 같이 챔버를 조립하지만, 일반 커버 슬립을 사용합니다. 형광 솔루션을 추가하고 VALAP를 사용하여 챔버를 밀봉.
- > 전체 현미경 필드 50 이미지를 수집 : 조명 셔터가 닫혀있는 동안 새로운 표백 영역으로 스테이지를 이동하고, 즉시 셔터를 개방 한 후 영상을 획득.
- 이 스택의 평균 투사를 만들고 ImageJ에 나 기타 소프트웨어 (그림 3C)를 사용하여 5 픽셀 반경 가우스 블러와 필터. 결과 이미지는 필드 (x, y는 화소의 좌표에 대응 ILLUM (x, y))의 조도의 분포를 나타낸다.
- 이 이미지 (최대 (ILLUM))의 최대 픽셀의 밝기를 결정합니다.
- 폐쇄 조명 셔터와 7.2.3 획득에게 절에서와 같이 하나의 이미지를 같은 카메라 설정을 사용하여,이 이미지의 평균 픽셀 강도를 결정,이 값은 CN, 카메라의 노이즈에 해당합니다.
- 다음 식을 사용하여 실험 이미지 (IMG (X, Y))를 정상화 위의 가치와 이미지 (ILLUM (X, Y))를 사용하여
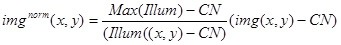
BRI의 정량 분석의 결과 이미지 IMG 규범 (X, Y)를 사용하여팁 압정으로 고정 단지 (그림 3D)와 이미지를 정상화도 고정 형광 복합체, 그리고 ghtness.
- 하나의 형광의 강도를 결정합니다.
- 규범 (x, y)를 IMG 정규화 이미지를 사용하고, 화상 처리 소프트웨어는 원형 영역 (직경 5-6 화소)로 형광 스폿을 선택하고 모든 프레임에 대해 그 적분 강도를 결정 광표백 트레이스를 생성. 매우 밝은 점 (> 디머들보다 밝은 5 배)하지 마십시오.
- 같은 원형 영역 도구를 사용하여, 최소 3 자리가없는 지역을 선택 평균 해당 photobleaching에 흔적을 생성 지수 감쇠 기능에 맞게.
- 실험 시점과 일치하고 광표백 곡선에서 빼기이 배경 강도 곡선을 집계.
- 광표백 곡선 (3-5 점의 슬라이딩 윈도우와 평균을) 부드럽게. 시각적으로 생성 된 곡선과 검사형광 또는 명백한 표백 (그림 3E)의 부족의 급격한 증가를 보여줍니다 어떤 곡선을 버린다.
- (곡선의 총수의 통상 50-70%) 나머지 곡선들 각각에 대해, 외형 형광 반점 표백 내용 최종 고원을 선택한다. 만 ~ 100 점을두고 이러한 강도의 평균이 세그먼트를 줄이십시오. 작은 변화를 최소화하기 위해 단축 광표백 곡선 배경 수준이다 현재 값을 빼고 배경 피크 (아래)의 크기를 줄이기 위해.
- 20 명 이상 광표백 곡선 (> 1,000 시간 지점)의 모든 시간 지점에 대한 강도의 히스토그램을 그린다. 히스토그램은 최소 4 별개의 봉우리 (주 2 참조)를 전시한다.
- MATLAB, 매스 매 티카 또는 유사한 소프트웨어 (그림 3 층)을 사용하여 같은 거리에 가우시안 분포 10,43와 히스토그램에 맞게 :
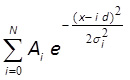
wi와 σ I, D와 N 여기 피팅 매개 변수입니다. 내가 진폭에 대응하고 폭 i 번째 피크의 i와 σ를 매개 변수, D가 봉우리 사이의 거리이며, N은 분포의 피크의 총 수에 해당하는 정수 부분입니다. 처음 3 개 이상의 피크의 중심이 적합 선을 시각적으로 좋은 경기를 보여 주면,이 피크 (매개 변수 D) 사이의 거리가 하나의 형광 물질의 형광 강도에 해당합니다.
주 1 : 현미경 시스템은 상당한 진동을 전시 또는 잡음 (예 : 불안정한 레이저 빔)의 다른 소스가있는 경우 검사 점 (7.3.6)의 수는 증가한다.
주 2 : 그것은> 등거리 가우스 적합와 정확한 분석을 위해 968을 얻기 위해 필수적이다. 닫기 피크가 획득되는 경우, 거짓 (예를 들어 더블) 스텝 사이즈가 얻어 질 수 있었다조명 조건이 최적이 아닌 경우, 도트가 너무 빠르고 하나의 단계를 표백 등이 잘 해결되지 않습니다.
- 팁 추적 복합체의 분자 크기를 결정합니다.
- 프로토콜 6 수집 한 이미지를 사용하여 바로 셔터를 연 후 취득한 제 2-4 프레임을 선택합니다. 팁 추적 관찰되기 전에 필드가 몇 시간 동안 조명 된 경우, 동일한 실험 조건에서 photobleaching에의 반응 속도에서 원래의 강도를 추정한다.
- 선택한 프레임을 평균 및 섹션 7.2.5-7.2.7에서와 같은 결과 이미지를 정상화.
- 7.3.1 절에서와 동일한 영역의 크기를 이용하여 형광 팁 추적 복합체의 적분 강도를 측정한다.
- , 팁 추적 복잡한 근처에 있으며 지역 관광을 사용하여 3 배경 영역의 적분 강도를 측정 이러한 값을 평균과 7.4.3 절에서 끝 추적 복합체의 강도에서 뺍니다.
- 7.3.5 절에서 수득 한 형광 강도에 의해 7.4.4 절에서 얻어진 형광 강도로 나누어 컴플렉스 형광 분자의 수를 계산한다.
주 1 :이 프로토콜 7.4 조명 및 수집 설정 프로토콜 7.1에서와 동일합니다 것이 바람직하다. 노출 시간 또는 레이저 강도 중 하나가이 단계에서 조정 된 경우, 결과 형광 값은 그에 따라 조정되어야한다. 그러나, 이러한 크기 조절의 정확성이 상이한 조건 하에서 동일한 샘플 (예를 들어 형광 시간)을 촬상하고, 생성 된 세기의 비율을 계산하여 검증되어야한다.
8. 단백질 코팅 비즈 미세 소관의 정보 추적
- 프로토콜 6과 MT 분해를 트리거하여 팁 추적 구슬 실험을 수행한다. DIC 광원의 강도와 동시에 로다 민 형광을 볼 수 있도록하기 위하여 감소되어야DIC 영상.
- 10 μL / 분에서 실에 구슬 현탁액의 30 ~ 50 μl를 소개에 Grishchuk 등. 10 애즈 베리 등. 11로 구슬을 준비합니다. 제안 비드 농도는 10 -16 -10 -17 M.입니다
- 직립 현미경을 사용하는 경우, 현미경 단계에서 실을 제거하고 구슬 커버 슬립에 침전 할 수 있도록 5 ~ 10 분 정도를 반전. 이 coverslip에 닿는 미세 소관에 비드의 더 나은 바인딩을 촉진하지만,이 절차는 짧은 시간 동안 약간의 중력 기반의 침전을 보여 0.5 μm의 폴리스티렌 비즈와 성공하지 못합니다.
- 커버 슬립 - 닿는 미세 소관에 부착 된 구슬을 선택, 비드는 분명 아크 44 (그림 4A)에 이동해야합니다. 닿는 구슬은 1-3 μm의 거리 m 남아 가끔 coverslip에 연결된 구슬 때문에 명확하게 볼 수 있습니다 커버 슬립면에서 위치해야otionless.
- 로다 민 필터 큐브로 전환하고 DIC 조명을 사용하는 동안 이미지를 수집하기 시작합니다.
- 수은 램프 또는 530-550 nm의 레이저 (필드 조임으로 제한된) 촬상 필드를 조명하기 위해 오픈 셔터. 비드가 분리 또는 분해의 미세 소관의 끝으로 이동 (그림 4D, 4 층, 그리고 4G)까지 녹음을 계속합니다.
주 1 : 광학 트랩이 미세 소관 벽과 단백질 코팅 구슬 사이의 상호 작용을 촉진하는 데 사용할 수 있습니다. 키네신 모터 (그림 4E-G)로 코팅 구슬로 작업 할 때 특히 유용합니다. 상기와 같은 프로토콜을 수행하지만, 2 밀리미터 밀리그램 - ATP와 운동성 버퍼를 보충합니다. 단계 8.3, 1,064 nm의 레이저 빔을 무료로 떠있는 구슬을 캡처 가까이 분할 된 미세 소관의 벽에 갇혀있는 구슬을 가지고 무대를 이동합니다. 낮은 조명과 DIC와 로다 민 필터 큐브를 통해 영상을 시작하고 출장 미세 소관의 끝으로 걸어 시작 비드를 기다립니다. 선미어 감독 구슬의 움직임이 관찰되고, 빔을 트래핑 셔터를 닫고 형광등 조명에 셔터를 엽니 다. 비드가 분리 또는 분해 미세 소관 끝 트랙까지 녹음을 계속합니다.
Access restricted. Please log in or start a trial to view this content.
결과
미세 소관을 해중합과 추적 단백질이 끝납니다. 효모 동원체 구성 요소 Dam1는 지금까지 해중합 미세 소관의 최고의 팁 트래커 (14)를 종료한다. GFP로 표지이 10-서브 유닛의 복잡한 쉽게 표현 박테리아 세포 18,38에서 정제, 그래서 우리는 끝 추적 분석에 대한 긍정적 인 제어로 사용하는 것을 권장 할 수 있습니다. 미세 소관의 해중합 끝으로 추적 형광 단백질은 꾸?...
Access restricted. Please log in or start a trial to view this content.
토론
대부분의 단일 분자 분석은 오늘날 일상적으로 크게 특이 단백질의 고집을 줄이기 위해 특수 처리 커버 슬립을 사용합니다. 우리가 여기에서 설명하는 절차는 하워드 랩 32에서 개발 된 원래의 프로토콜의 변형이며, 우리는 커버 슬립을 silanizing은도 형광을 사용하지 않는 DIC 기반 비드 분석과 노력의 가치는 사실을 알게 될 것입니다. 이러한 커버 슬립 조립 챔버 훨씬 청소기 표면을 보여?...
Access restricted. Please log in or start a trial to view this content.
공개
저자가 공개하는 게 없다.
감사의 말
저자는 프로토콜을 개발하고 시약을 제공하는 인물, N. Gudimchuk 및 P. Zakharov에 대한 이미지를 제공하기 위해, N. Dashkevich, N. Gudimchuk 및 A. Korbalev을 재사용 할 수있는 유량 용기를 디자인하고 제조하는 데 도움을 위해 FI Ataullakhanov에게 감사의 말씀을 전합니다 텍스트 편집 및 팁 및 토론을위한 Grishchuk 연구소의 다른 회원들과 도움을 제닌 표지 미세 소관 씨, A. Potapenko를 준비합니다. 이 작품은에 의해 부분적으로 지원되었다 NIH 부여 GM R01-098389과 킴멜 학자 ELG 펜실베니아 근육 연구소에서 파일럿 부여, RFBR 12 채로 04-00111-13-04-40190-H를 부여하고 (13) - 04-40188-H, 과학 상임위원회 보조금 러시아 아카데미 FI Ataullakhanov에 (분자 시스템 통합 및 분자 및 분자 세포 생물학 프로그램의 메커니즘), NIH는 JR 매킨토시에 GM R01 GM033787을 부여하고, 드미트리 Zimin 왕조 재단 박사의 교제 VAV
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Table 1. Microscopy and other equipment. | |||
| Microscope | Zeiss Nikon | Axio Imager 2 Eclipse Ti | other microscope models capable of DIC and epifluorescence-imaging can be used |
| Objective | Zeiss Nikon | 420490-9900-000 CFI Apo 100x Oil 1.49 | 100X, DIC, 1.3-1.49 NA |
| Objective heater | Bioptechs | 150803, 150819-19 | |
| Fluorescent filter cube | Chroma | 49004 or 49008 41017 or 49020 | optimized for Rhodamine fluorescence optimized for GFP fluorescence |
| Acquisition software | freeware MicroManager Molecular Devices | not applicable MetaMorph 7.5 | http://valelab.ucsf.edu/~MM/MMwiki/ other software can be used to acquire images and for a particle tracking |
| EMCCD camera | Andor | iXon3, DU-897E-cs0-#BV | Highly sensitive EMCCD camera |
| Trapping laser | IPG Photonics | YLR-10-1064-LP | 1,064 nm laser, 10 W |
| Fluorescence excitation lasers | Coherent, Inc. Coherent, Inc. | Sapphire 488 LP Sapphire 552 LP | excitation of green fluorophores excitation of red fluorophores |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| Commercial flow chambers | Warner Instruments | RC-20 or RC-30 | |
| Perfusion pump | Cole Palmer Harvard Apparatus | Masterflex 77120-52 Pico Plus | Both pumps provide the required rate of liquid flow but a peristaltic pump may pulse at very slow speed. The flow with a syringe pump is more consistent for a wide range of rates but this pump has inertia. |
| Table 2. Microscopy chamber preparation. | |||
| Modified microscope slides for reusable chambers | Precision Glassblowing of Colorado | Custom order www.precisionglassblowing.com | Sonic slots in slides using schematics in Figure 1 |
| Polyethylene tubing | Intramedic | 427410 | I.D. 0.58 mm, O.D. 0.965 mm; use these tubes to connect assembled chamber to the pump and waste container |
| Polyethylene tubing | Intramedic | 427400 | I.D. 0.28 mm, O.D. 0.61 mm; use these tubes to make the reusable chamber |
| Regular microscope slides | VWR | 48312-003 | Other similar slides can be used |
| Coverslips | VWR | 48393-150, 48366-067 | Other similar coverslips can be used |
| Silicon sealant | World Precision Instruments | KIT, SILICON SEALANT 5 MIN CURE | |
| Epoxy glue | Loctite | 83082 | |
| Cyanoacrylate adhesive | Scotch 3M | AD114 | Or cyanoacrylate adhesive from other manufacturers |
| Table 3. Coverslips cleaning and coating. | |||
| Molecular Sieves, Grade 564 | Macron | 4490-04 | |
| Coverglass Staining Jar | Ted Pella, Inc. | 21036 | |
| Coverslip Ceramic Holder | Thomas Scientific | 8542e40 | |
| PlusOne Repel Silane | GE Healthcare Biosciences | 17-1332-01 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Anti-digoxigenin AB | Roche Applied Science | 11093274910 | |
| Table 4. Preparation of seeds and segmented microtubules. | |||
| Tubulin | purified from cow brains Cytoskeleton, Inc | T238P | For purification protocols see 49–51 Unlabeled porcine tubulin |
| Labeled tubulin | Cytoskeleton, Inc Invitrogen Invitrogen | TL590M C1171 (Rhodamine) A-2952 (Digoxigenin) | Rhodamine-labeled porcine tubulin Tubulin can be labeled with any amine-reactive dye as in reference52. |
| GMPCPP | Jena Biosciences | NU-405 | Aliquot and store at -70 °C |
| VALAP | Vaseline, lanolin, and paraffin at 1:1:2 by mass | see reference9 | |
참고문헌
- Desai, A., Mitchison, T. J. Microtubule polymerization dynamics. Ann. Rev. Cell Dev. Biol. 13, 83-117 (1997).
- Mitchison, T. M., Kirschner, M. W. Dynamic instability of microtubule growth. Nature. 312 (15), 237-242 (1984).
- Walker, R. A., Brien, O., et al. Dynamic Instability of Individual Microtubules Analyzed by Video Light Microscopy: Rate Constants and Transition Frequencies. J. Cell Biol. 107, 1437-1448 (1988).
- Gardner, M. K., Zanic, M., Gell, C., Bormuth, V., Howard, J. Depolymerizing Kinesins Kip3 and MCAK Shape Cellular Microtubule Architecture by Differential Control of Catastrophe. Cell. 147 (5), 1092-1103 (2011).
- Lombillo, V. A., Stewart, R. J., McIntosh, J. R. Minus-end-directed motion of kinesin-coated microspheres driven by microtubule depolymerization. Nature. 373, 161-164 (1995).
- Franck, A. D., Powers, A. F., Gestaut, D. R., Gonen, T., Davis, T. N., Asbury, C. L. Tension applied through the Dam1 complex promotes microtubule elongation providing a direct mechanism for length control in mitosis. Nat. Cell Biol. 9 (7), 832-837 (2007).
- Tran, P. T., Walker, R. A., Salmon, E. D. A metastable intermediate state of microtubule dynamic instability that differs significantly between plus and minus ends. J. Cell Biol. 138 (1), 105-117 (1997).
- Grishchuk, E. L., Molodtsov, M. I., Ataullakhanov, F. I., McIntosh, J. R. Force production by disassembling microtubules. Nature. 438, 384-388 Forthcoming.
- Coue, M., Lombillo, A., Richard, J. Microtubule Depolymerization Promotes Particle and Chromosome Movement In Vitro. J. Cell Biol. 112 (6), 1165-1175 (1991).
- Grishchuk, E. L., Spiridonov, I. S., et al. Different assemblies of the DAM1 complex follow shortening microtubules by distinct mechanisms. Proc. Natl. Acad. Sci. U.S.A. 105 (19), 6918-6923 (2008).
- Asbury, C. L., Gestaut, D. R., Powers, A. F., Franck, A. D., Davis, T. N. The Dam1 kinetochore complex harnesses microtubule dynamics to produce force and movement. Proc. Natl. Acad. Sci. U.S.A. 103 (26), 9873-9878 (2006).
- Westermann, S., Wang, H. -W., Avila-Sakar, A., Drubin, D. G., Nogales, E., Barnes, G. The Dam1 kinetochore ring complex moves processively on depolymerizing microtubule ends. Nature. 440 (7083), 565-569 (2006).
- Grissom, P. M., Fiedler, T., Grishchuk, E. L., Nicastro, D., West, R. R., Mcintosh, J. R. Kinesin-8 from Fission Yeast A Heterodimeric , Plus-End – directed Motor that Can Couple Microtubule Depolymerization to Cargo Movement. Mol. Biol. Cell. 20, 963-972 (2009).
- McIntosh, J. R., Volkov, V., Ataullakhanov, F. I., Grishchuk, E. L. Tubulin depolymerization may be an ancient biological motor. J. Sci. 123, 3425-3434 (2010).
- Grishchuk, E. L., McIntosh, J. R., Molodtsov, M. I., Ataullakhanov, F. I. Force generation by dynamic microtubule polymers. Compr. Biophys. 4, 93-117 (2012).
- Asbury, C. L., Tien, J. F., Davis, T. N. Kinetochores' gripping feat: conformational wave or biased diffusion. Trends Cell Biol. (1), 38-46 (2011).
- Tien, J. F., Umbreit, N. T., et al. Cooperation of the Dam1 and Ndc80 kinetochore complexes enhances microtubule coupling and is regulated by aurora B. Cell Biol. 189 (4), 713-723 (2010).
- Gestaut, D. R., Graczyk, B., et al. Phosphoregulation and depolymerization-driven movement of the Dam1 complex do not require ring formation. Nat. Biol. 10 (4), 407-414 (2008).
- Schmidt, J. C., Arthanari, H., et al. The Kinetochore-Bound Ska1 Complex Tracks Depolymerizing Microtubules and Binds to Curved Protofilaments. Dev. Cell. 23 (5), 968-980 (2012).
- Brouhard, G. J., Stear, J. H., et al. XMAP215 is a processive microtubule polymerase. Cell. 132 (1), 79-88 (2008).
- Stumpff, J., Du, Y., et al. A Tethering Mechanism Controls the Processivity and Kinetochore-Microtubule Plus-End Enrichment of the Kinesin-8 Kif18A. Mol. Cell. 43 (5), 764-775 (2011).
- Su, X., Qui, W., Gupta, M., Pereira-Leal, J., Reck-Peterson, S. L., Pellman, D. Mechanisms underlying the dual-mode regulation of microtubule dynamics by Kip3/kinesin-8. Mol. Cell. 43 (5), 751-763 (2011).
- Helenius, J., Brouhard, G., Kalaidzidis, Y., Diez, S., Howard, J. The depolymerizing kinesin MCAK uses lattice diffusion to rapidly target microtubule ends. Nature. 441 (7089), 115-119 (2006).
- Gudimchuk, N., Vitre, B., et al. Kinetochore kinesin CENP-E is a processive bi-directional tracker of dynamic microtubule tips. Nat. Cell Biol. 15 (9), 1079-1088 (2013).
- Akhmanova, A., Steinmetz, M. Microtubule +TIPs at a glance. J. Sci. 20 (Pt 20), 3415-3419 (2010).
- Dixit, R., Barnett, B., Lazarus, J., Tokito, M., Goldman, Y., Holzbaur, E. Microtubule plus-end tracking by CLIP-170 requires EB1. Proc. Natl. Acad. Sci. U.S.A. 106 (2), 492-497 (2009).
- Grishchuk, E. L., Efremov, A. K., et al. The Dam1 ring binds microtubules strongly enough to be a processive as well as energy-efficient coupler for chromosome motion. Proc. Natl. Acad. Sci. U.S.A. 105 (40), 15423-15428 (2008).
- Akiyoshi, B., Sarangapani, K. K., et al. Tension directly stabilizes reconstituted kinetochore-microtubule attachments. Nature. 468 (7323), 576-579 (2010).
- McIntosh, J. R., Grishchuk, E. L., et al. Fibrils Connect Microtubule Tips with Kinetochores A Mechanism to Couple Tubulin Dynamics to Chromosome Motion. Cell. 135 (2), 322-333 (2008).
- Powers, A. F., Franck, A. D., et al. The Ndc80 kinetochore complex forms load-bearing attachments to dynamic microtubule tips via biased diffusion. Cell. 136 (5), 865-875 (2009).
- Umbreit, N. T., Gestaut, D. R., et al. The Ndc80 kinetochore complex directly modulates microtubule dynamics. Proc. Natl. Acad. Sci. U.S.A. 109 (40), 16113-16118 (2012).
- Gell, C., Bormuth, V., et al. Microtubule Dynamics Reconstituted In Vitro and Imaged by Single-Molecule Fluorescence Microscopy. Methods Biol. 95, 221-245 (2010).
- Dixit, R., Ross, J. L. Studying Plus-End Tracking at Single Molecule Resolution Using TIRF Microscopy. Methods Cell Biol. 95, 543-554 (2010).
- Beausang, F. J., Sun, Y., Quinlan, E. M., Forkey, N. J., Goldman, Y. Construction of Flow Chambers for Polarized Total Internal Reflection Fluorescence Microscopy (polTIRFM). Cold Spring Harbour Protoc. 6, 712-715 (2012).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP Hydrolysis in Microtubule Dynamics: Information from a Slowly Hydrolyzable Analogue, GMPCPP. Mol. Biol. Cell. 3, 1155-1167 (1992).
- Grishchuk, E. L., Ataullakhanov, F. I. In Vitro Assays to Study the Tracking of Shortening Microtubule Ends and to Measure Associated Forces. Methods Cell Biol. 95, 657-676 (2010).
- Gutiérrez-Medina, B., Block, S. M. Visualizing individual microtubules by bright field microscopy. Am. J. Phys. 78 (11), 1152-1159 (2010).
- Volkov, V. A., Zaytsev, A. V., et al. Long tethers provide high-force coupling of the Dam1 ring to shortening microtubules. Proc. Natl. Acad. Sci. U.S.A. 110 (19), 7708-7713 (2013).
- Laan, L., Pavin, N., et al. Cortical dynein controls microtubule dynamics to generate pulling forces that position microtubule asters. Cell. 148 (3), 502-514 (2012).
- Myster, S. H., Knott, J. A., O'Toole, E., Porter, M. E. The Chlamydomonas Dhc1 gene encodes a dynein heavy chain subunit required for assembly of the I1 inner arm complex. Mol. Biol. Cell. 8, 607-620 (1997).
- Lombillo, V. A., Coue, M., McIntosh, J. R. In vitro motility assays using microtubules tethered to Tetrahymena pellicles. Methods Cell Biol. 39, 149-165 (1993).
- Hyman, A., Chrétien, D., Arnal, I., Wade, R. Structural changes accompanying GTP hydrolysis in microtubules: information from a slowly hydrolyzable analogue guanylyl-(alpha,beta)-methylene-diphosphonate. J. Cell Biol. 128 (1-2), 117-125 (1995).
- Park, M., Kim, H., Kim, D., Song, N. W. Counting the Number of Fluorophores Labeled in Biomolecules by Observing the Fluorescence-Intensity Transient of a Single Molecule. Bull. Chem. Soc. Jap. 78, 1612-1618 (2005).
- Welburn, J. P. I., Grishchuk, E. L., Backer, C. B., Wilson-Kubalek, E. M., Yates, J. R., Cheeseman, I. M. The human kinetochore Ska1 complex facilitates microtubule depolymerization-coupled motility. Dev. Cell. 16 (3), 374-385 (2009).
- Efremov, A., Grishchuk, E. L., Mcintosh, J. R., Ataullakhanov, F. I. In search of an optimal ring to couple microtubule depolymerization to processive chromosome motions. Natl. Acad. Sci. U.S.A. (48), 19017-19022 (2007).
- Itoh, T., Hisanaga, S., Hosoi, T., Kishimoto, T., Hotani, H. Phosphorylation states of microtubule-associated protein 2 (MAP2) determine the regulatory role of MAP2 in microtubule dynamics. Biochemistry. 36 (41), 12574-12582 (1997).
- Oguchi, Y., Uchimura, S., Ohki, T., Mikhailenko, S. V., Ishiwata, S. The bidirectional depolymerizer MCAK generates force by disassembling both microtubule ends. Nat. Biol. (6), 1-8 (2011).
- Kishino, A., Yanagida, T. Force measurements by micromanipulation of a single actin filament by glass needles. Nature. 334, 74-76 (1988).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann. NY Acad. Sci. 253, 107-132 (1975).
- Weingarten, M. D., Lockwood, A. H., Hwo, S., Kirschner, M. W. A Protein Factor Essential for Microtubule Assembly. Proc. Natl. Acad. Sci. U.S.A. 72 (5), 1858-1862 (1975).
- Widlund, P. O., Podolski, M., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Mol. Biol. Cell. 23 (22), 4393-4401 (2012).
- Hyman, A., Drechsel, D., et al. Preparation of Modified Tubulins. Methods Enzymol. 196, 478-485 (1991).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유