このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
逆アセンブル微小管端部によって駆動される運動を研究するセグメント化微小管の調製
要約
微小管は本質的に不安定なポリマーであり、成長との間の短縮その切り替えは、確率および制御することは困難である。ここでは、photoablatable安定キャップでセグメント化された微小管を使用してプロトコルを記述します。セグメント化された微小管の脱重合することにより、分解、微小管末端を有する運動の分析を支援する、高い時間および空間分解能でトリガすることができる。
要約
微小管の解重合は、 インビトロで異なるタンパク質複合体およびタンパク質被覆ビーズを輸送する力を提供することができる。基本的なメカニズムは、細胞分裂時の微小管依存染色体の運動に重要な役割を果たしていると考えられているが、関連するタンパク質およびそれらの正確な役割は明確に定義されています。したがって、精製された成分と定義され、生化学的環境を用いて、インビトロでそのような運動性を研究するためのものでアッセイを開発する必要性が高まっている。微小管は、しかしながら、本質的に不安定なポリマーであり、成長との間の短縮それらの切り替えは、確率的と制御が困難である。我々はここで説明するプロトコルはphotoablatableがキャップを安定化して作られてセグメント化された微小管を利用しています。そのようなセグメント化された微小管の脱重合することにより、分解、微小管の端部に運動性の研究を補助する、高い時間および空間分解能でトリガすることができる。この技術は、約するために使用することができる動的な微小管が終了するとprocessively移動する蛍光標識されたタンパク質複合体中の分子数の定量分析を行っRRY。このにおける信号対雑音比、および他の定量的蛍光アッセイを最適化するために、カバーガラスを可溶性蛍光標識されたタンパク質の非特異的吸収を減少させるために処理されるべきである。詳細なプロトコルを考慮に蛍光照明ムラを取ると等距離ガウスフィットを使用して、単一のフルオロフォアの強度を決定するために提供される。最後に、進行的貨物の動きに結合する微小管脱重合に異なるモーターと非運動タンパク質の能力への洞察を提供し、タンパク質でコーティングされたマイクロビーズの微小管依存の動きを研究するセグメント化された微小管の使用を記載している。
概要
微小管は高度に細胞構造、細胞運動性、細胞分裂、細胞内輸送および1のために重要である細胞骨格構造が保存されている。これらの動的なポリマーは、GTPの存在下でチューブから組み立て、そして、彼らは自然に成長と2の短縮を切り替える。微小管は、従って、コントラストを高めるために特殊な光学技術は、光学顕微鏡で微小管を観察するために使用されるべきである(直径がわずか25 nm)の非常に薄い。これらのポリマーを用いた以前の研究は、微分干渉コントラスト(DIC)3を使用して動的挙動を調べた。 試験管内でこれと同様の研究は、一般的な実験条件の下で、微小管は、まれにしか解重合に破局し、スイッチを受けていないことを明らかにした一回5〜15分間(この周波数は、28〜32℃で調べた7月15日ミリモル、可溶性チューブリン濃度である)4。異なる技術は、このようにインダクタに提案されている制御された方法でのE微小管脱重合。微小管の短縮は、ここで説明するように、離れて可溶性チューブ5,6を洗浄するレーザ光7と微小管を切断するか、またはセグメント化された微小管8を用いてトリガすることができる。セグメント化された微小管だけでなく、確率的に切り替えるポリマーを使用してこれまでの研究は、このような染色体、小胞、およびタンパク質をコーティングしたビーズのような小さな細胞内貨物は、短縮微小管9月13日の端に移動させることを見出した。この現象は、有糸分裂細胞における染色体の動きのための直接含意を持っていると考えられており、基本的なメカニズムは、アクティブな調査14〜16の下に現在されている。
最近では、全反射蛍光(TIRF)顕微鏡などの蛍光ベースの技術は、動的微小管と運動性を研究するために使用されてきたが17-24を終了します。このアプローチの利点は、相互作用の試験を可能にすることである異なる蛍光で標識したタンパク質を用いて、リアルタイムで微小管と微小管結合タンパク質間のS。いくつかのタンパク質複合体は、微小管末端を伸長及び/又は短縮してprocessively移動することが見出された。彼らは、微小管結合タンパク質DAM1 10,12,18、Ska1 19、およびXMAP215 20だけでなく、キネシンモーターKif18A 21,22、MCAK 23およびCENP-Eの24が含まれています。これらのタンパク質は、EB1 25のような古典的な先端追跡タンパク質のそれとは根本的に異なるセッ先端追跡を呈する。 EB1分子および関連パートナーは、安定的に、動的微小管に結合したままでいるように見えるものの、終了、個々の分子は急速に可溶性のプール26を交換するだけ〜0.8秒間、微小管の先端に結合したまま。これとは対照的に、進行的先端トラッカーは、DAM1のように、微小管との旅行が多くミクロンのために終了し、微小管の先端との関連は、男のために最後にすることができます任意の秒数。先端会合時間だけでなく、追跡の結果率は、先端追跡複雑な27を形成する分子の数に強く依存する。より大きなタンパク質のアンサンブルは、通常、はるかに優れた先端トラッカーです。例えば、単離された酵母動原体のような複雑なアセンブリは、微小管に結合されたままでは時間28で終了。いくつかの微小管結合タンパク質、 例えば Ndc80の動原体タンパク質複合体、微小管は、単一分子レベルで終了し、まだNdc80ビード貨物19,29-31の動きを結合する非常に効率的であるとともに追跡することができないことが見出されている。したがって、異なるタンパク質複合体、ならびにそれらの生物学的役割によって先端追尾のメカニズムを理解するためには、先端追跡複合体中の分子の数の関数としての先端トラッキングを調べるために、ならびに決定することが重要であるビーズ貨物の表面に集合的な運動性を発揮するこれらの複合体の能力。
我々はセグメント化された微小管( 図1A)を用いた実験を準備し、実施するための詳細なプロトコルを提供下。まず、市販のガラススライドは、短いポリエチレンチューブ(プロトコル1)を取り付けるために修飾される。再使用可能な顕微鏡流チャンバは、その後、スライドおよび化学的またはプラズマ洗浄、シラン化カバースリップ(プロトコル2)32-34から組み立てられる。結果として生じるチャンバ容積は、入口管の体積を含むのみ20-25液(又は15μlのできるだけ小さい、プロトコル1の注3を参照)である。市販のフローチャンバーを使用することもできるが、その体積は、タンパク質の不必要な浪費をもたらす、通常は大きくなる。大きなチャンバーを採用した場合は、以下のプロトコルのすべてのソリューションの量が比例して拡大縮小する必要があります。微小管の種子は、その後徐々に加水分解性GTP類似体、GMPCPP(グアノシン-5'-[(α、β)-methyleno]三リン酸)(プロトコル3を使用して調製される、ハイマン<も参照してください。EM>ら35)。種子を洗浄し、カバースリップ上に固定され、表面は、その後、他のタンパク質の非特異的吸収を防ぐためにブロックされている32(プロトコル4を用いてジゴキシゲニン種子の固定化を記載)。セグメント化された微小管は、次いで、プロトコル5を用いて調製することができる。このアプローチの主な根拠は、GTPの存在下で形成動的微小管ポリマーは、GMPCPPを含有する安定なチューブセグメントの短い「キャップ」を付加することによって、一時的に安定させることができることである。これらのキャップはまた、ローダミン標識したチューブリンを含有するので、530〜550 nmのレーザーまたは水銀アークランプ(プロトコル6)36で視野を照明することによって簡単に除去することができる。先端トラッキング信号の蛍光強度は、次いで考慮顕微鏡視野照明(プロトコル7)のばらつきを考慮して、分解、微小管の端部に移動する分子の数を推定するために使用することができる。同様のアプローチを使用することができる微小管脱重合および27に記載したように調製したタンパク質被覆ビーズ(プロトコール8)との間の相互作用を研究する。いくつかのタンパク質は容易にセグメント化された微小管の壁に結合するが、レーザーピンセットはまた、それによって、その結合を促進し、微小管の壁の近くにビードを保持するために使用することができる。
Access restricted. Please log in or start a trial to view this content.
プロトコル
必要な機器:以下の実験は、DICおよび蛍光イメージング( 表1)のために装備光学顕微鏡が必要です。明視野LED照明が大幅に正規ハロゲンランプでは観察するのが困難であるカバースリップ付き微小管の種子37の検出を改善するために使用することができる。顕微鏡チャンバ内の液体の流れを制御するために、溶液は、10〜100μlの/分からの流れの速度が可能で蠕動ポンプと交換されるべきである。シリンジポンプを使用することも可能であるが注意を流速が急激に変化するときに形成し得る気泡を避けるために注意すべきである。タンパク質でコーティングしたビーズを処理するため、例えばセグメント化された微小管の壁の近くにそれらをもたらすために、1064 nmの連続波レーザー光を顕微鏡の光軸に導入して生産する高開口数の対物レンズ(1.3以上)を集束させることができるトラップ。蛍光の定量分析のためのこの光源の強度が水銀ランプによって生成されるよりも安定であるため、励起光がレーザベース光源によって提供されるべき単一分子の強度を測定する。機械的振動を最小限に抑えるために、顕微鏡は、光学テーブル上に置かれるべきである。より洗練された装置は、微小管脱重合が一定の力で終了すると、ビーズの動きを研究するため、および単発力信号11,38,39を測定するために必要とされる、これらの方法は、他の場所で説明する。
1。製造再利用可能なフロー·チェンバース
再利用可能なフローチャンバー用のガラススライドは、(我々のサプライヤーについての詳細は表2を参照)。図1(b)の回路図を使用して、ローカルガラス製造工場から注文することができます。超音波フライスで1.0±0.1ミリメートル、幅0.8±0.05ミリメートルの深さ、長2の溝15±1ミリメートルを作るために、通常の顕微鏡用スライド(厚さ1.0mm X 25ミリメートル75ミリメートルなど)を変更します。最も近い端部間の距離は14±1ミリメートルである必要があります。この距離は、X 22ミリメートルのカバーガラス22ミリメートルと組み立て室に最適です。他の材料のリストについては、表2を参照してください。
- 溝の内側の端に〜5ミリメートルのオーバーハングを残して、スライド内の各溝に100ミリメートル、長ポリエチレンチューブ(外径0.61ミリメートル、 表2)を配置します。溝の内側に完全にチューブを埋め込む、シアノアクリレート系接着剤で溝内部にチューブを固定します。
- 管内のりをこぼし回避しながら、エポキシ接着剤で溝を埋める。接着剤が約1日乾燥させます。
- 鋭利なかみそりの刃でスライドの中心までの近位部分を除去して、各結合部位の先端から固化した接着剤の塊3〜4ミリメートルにカット。チューブはそれらの溝の中に残っている必要があります。近位の部分を削除すると、切断され、二つの管開口部を有する平坦な表面を作成し、インナーオーバーハングを除去します。
- 水やテストで注射器を埋めるチューブが正しく動作しているかどうか。自由に液体が流れた場合は、1日( 図1D)のために、乾燥した畑の外端にエポキシ接着剤(直径〜5ミリメートル)の低下を置く。これはチャンバーは、より耐久性になりますので、何ヶ月も繰り返し使用することができます。
注1:倒立顕微鏡用のチャンバーを作るために、スライドは溝( 図1C)の両端に二つの小さな穴を作るために追加的に変更する必要があります。スライドの穴にチューブを挿入するチューブを曲げて溝の中にしっかりとそれらに合わせます( 図1E)。手順1.2〜1.4に従いますが、フローチャンバーを作るために使用される、全面からエポキシ接着剤を取り除く。
注2:( 図1Bおよび1Cの「エッチングされた領域」を参照)5.0±0.5ミリメートル、幅わずかに上昇し、スライドの中央部を残して、深い2へこみ0.050±0.005ミリメートルをする室容積、利用フライスを低減します。ときはT(下記のように)、彼は流れ室が組み立てられる、これらのくぼみの中に両面テープを配置します。
注3:実験はかみそりの刃を使用してカバースリップし、両面テープをはがし終えた後、これらの改変されたスライドを再利用する。それを剥離し、70%エタノールでスライドを拭いてシール剤を除去します。無塵室等しい脱イオン水の量は、乾燥して保存して、次の蠕動ポンプにチューブを取り付けて50〜70ミリリットル灌流、ラボの食器用洗剤1〜2%で、容器内のスライドを置きます。
2。カバーガラスの作製
このプロトコルは、6〜8時間かかり、12カバーグラスを準備するのに役立ちます。 jarファイル容量が15ミリリットルであるべきなので、それぞれが積み重ね4カバースリップを開催します。あなたはふたで1セラミックカバーガラスホルダーと3カバーガラス染色のjarファイルが必要になります。蓋(250ミリリットル)でガラスジャーは、シランとカバースリップをインキュベートするために使用する必要があります。定期的なNo.1のガラス製カバースリップを使用します(22ミリメートル×22ミリメートル2X 30ミリメートル2mmの材料のリストについては表2および3を参照)。手袋を着用したまますべてのステップは、ドラフト内で実施されるべきである。
- カバーガラス染色ジャーにカバースリップを入れ、アセトンで瓶を埋める。脱イオン水で10倍を洗い、1時間インキュベートする。
- エタノールでカバースリップを10分間インキュベートし、脱イオン水で再び10倍を洗う。
- 「ピラニア」溶液を調製する。耐熱ガラス容器に過酸化水素溶液(水中30%)60mlを入れて、ゆっくりと硫酸100mlを加える(過酸化水素溶液に酸の最終比は5:3)。解決策は、熱くなり、これは正常ですが、注意してください。ピラニア溶液は非常に腐食性である!厚手の白衣、手袋、ゴーグルを使用してください!
- 蓋を閉じて、1時間90℃に予熱した水浴中に瓶を置き、「ピラニア」溶液を用いてカバーガラス染色の瓶を埋める。
- 「ピラニア」solutiを捨てる上とあなたの職場での安全規制に従って廃棄してください。洗浄は、脱イオン水で10倍をカバースリップ。
- 、0.1 M KOHでカバースリップ染色の瓶を埋めるため10分間インキュベートし、脱イオン水で10倍を洗う。これは、「ピラニア」処理後にカバースリップ上に残った任意のアミノ酸残基を中和する。
- ドライカバースリップテフロンコーティングされた平らなエッジのピンセット(ガラス面への損傷を最小限にするため)とのそれぞれのカバーガラスを保持し、圧縮された乾燥窒素を吹き込みながらすることにより、一度に1。シラン溶液は、水との反応性が高いので、カバーグラスが完全に乾いていることを確認します。
- 窒素で完全に予備乾燥されるべきであるセラミックホルダー(ホルダーあたり12カバーグラス)で乾燥させてカバースリップを積み重ねる。カバーガラス表面に付着するほこりを避けるためにカバーされたセラミックホルダーを保つ。
- 水の吸収のために、モレキュラーシーブス、グレード564を有する250mlのガラスジャー(直径6cm)の底部を覆う。
- 200mlで瓶を埋めるプラスワン撃退シラン溶液にゆっくりと蓋を閉め、室温で5分間インキュベート、ジャーカバーグラスセラミックホルダーを浸す。これはカバーガラスの表面に疎水性コーティングを作成します。
- ゆっくりジャーからカバーグラスでホルダーを削除して転送をメタノールで満たされたカバーガラス染色ジャーに一度に1をカバースリップ。
- カバーガラス染色ジャーは、その高さの2/3浸漬されるように、音波浴の貯水槽に金属やガラス台座を置きます。 20分間、70 Wで超音波処理し、脱イオン水で10倍をすすぎ、次いで、メタノール溶液を5分ごとに変化する。シラン化が正常に働いていた場合、水から除去する際、カバーグラスを乾燥されます。
- 徹底的に上記のように、窒素を使用して、任意の残留水を除去。
- カバーグラスの間に面接触を避けるために、キムワイプでカバースリップを間に挿入されたもの。カバースリップを室温で数週間、密閉された容器に保管することができる。
NOTE 1:2.1〜2.6が大きく、総調製時間を低減する、30 Wで15分間プラズマクリーナーでカバーガラスを洗浄することによって置き換えることができるステップ。洗浄チャンバー内の圧力は100〜200ミリトルに設定される。両方の大気及び圧縮酸素を使用することができる。セラミック保有者におけるプラズマ洗浄カバーグラスをスタックと2.7に進みます。
3。 GMPCPP安定化された微小管の種子の調製
この手順は、〜1時間がかかり、結果として微小管の種を室温で1〜2日間安定である。試薬のリストについては、表4を参照してください。
- 氷の上で混ぜる。
- BRB-80バッファー(; 1〜2 DTTでサプリメントは、各実験のために新鮮な分量を使用して、80 mMのパイプ、1mMのEGTA、4のMgCl 2、KOHで6.9)中の10μLの非標識チューブリン(100μM、 表4)。
- 2.6μlのジゴキシゲニン標識チューブリン( 表4)。準備に応じて音量を調整し、非標識チューブリンへの標識の最終的な比率は、約1:10であるようにする。ピペッティングでよく混ぜる。
- 1.4μLの10 mMのGMPCPP(最終濃度1 mM)を
- 種子は2〜3程度長く成長する、35℃で15分間インキュベートします。異なる微小管の長さが必要な場合は、時間を調整してください。
- 室温で種子をペレット化し、(35℃に予熱)35μLBRB-80を追加し、ピペッティングにより混合し、25,000×gで15分間遠心する。
- 上清を捨て、優しく温かいBRB-80の50μLを追加および削除することによって、ペレットを洗浄。
- 再懸濁は、25μlのBRB-80でよくペレット。
4。カバーガラスに微小管の種子の取り付け
プロトコール4及び図5は、2〜3時間を必要とするので、2つのフローチャンバーは、一日あたりに使用される。
- シラン化カバースリップを使用して、製造業者の説明書に従ってフローチャンバーを組み立て、4.2に進みます。カスタムメイドのカバースリップ(プロトコル1)を使用している場合は、ステップBELに従ってくださいOW。
- しっかりと、中央〜5ミリメートルのワイドエリアに沿って両面テープ2枚(X 30ミリメートル5ミリメートル)を取り付け、テープの上にシラン化カバーガラスを入れ、を押します。
- チューブのいずれかを使用して、BRB-80でチャンバーを記入し、丸いつまようじで両方のチューブを差し込みます。
- 小さなプラスチックシャーレの上に2色のクイック·キャストシーラントの小滴を絞ると、爪楊枝を使って素早くますが、完全に混合する。シーラントは緑色になり、すぐに適用され、慎重にカバースリップのすべてのエッジをシールする。シーラントがカバースリップの下であまりにも深く浸透した場合、爪楊枝プラグを削除することにより、チューブの1を開き、チューブの内側に漏れるのシーラントを防ぐために穏やかな圧力を適用します。
- 10分間室内を乾燥させると、流れはさらに進む前に、制限されていないことを確認してください。
- 32℃に温めておい顕微鏡ステージ上室を置き、液体を排出しますポンプにチューブの1を添付してください。吸気管の長さ試薬の不必要な損失を避けるために最小限にする必要があります。推奨される長さ5-7 cmです。 BRB-80バッファーで0.5ミリリットルバイアル中で、この目的を浸す。これと下のすべてのソリューションは、32〜35℃に温めておいする必要があります
- ポンプで穏やかな圧力を適用するか、単純に吸入チューブプラグが除去されると、時々形成することができる気泡を、絞り出すように出口管の端を持ち上げます。
- 100μL/分でポンプ速度を設定します。 BRB-80での1:30に希釈した抗ジゴキシゲニン抗体の2室の容積で洗浄し、抗体の吸着を可能にするために15分間インキュベートする。
- シラン化カバースリップの疎水性表面をブロックするBRB-80の1%プルロニックF-127で10分間インキュベート、暖かいBRB-80の5〜10室の容積で洗浄する。
- 運動性バッファーの5〜10室の容積(BRB-80は、カゼインの0.4 mg / mlの添加)で洗浄する。
- 10μL/分にポンプ速度を低下させ、30〜40μlの運動性バッファーに1:200-1:600に希釈し、微小管の種を灌流。 15マイルをインキュベートカバーガラス吸着抗体に種子の結合を促進するN。
- 未結合の物質を除去するために運動性バッファー400μlの100μL/分でチャンバーを洗ってください。
注1:種子の結果の密度は、10月30日あたりの顕微鏡視野( 図2A)である必要があります。トラブルシューティングを行うには、カバーガラス付種子の検出を容易にするための重合(ステップ3.1)の間に、蛍光標識されたチューブを使用しています。
注2:クラミドモナス40または他の生物学的供給源から調製軸糸、並びに、溶解し、deciliatedテトラヒメナ細胞のペリクル41は、微小管核剤としても使用することができる。これらは核剤(GMPCPP種子が核≥14プロトフィラメント42が含まれている1微小管)の小さい微小管アレイを作成するために有用であり、プロトフィラメントの特定の数と微小管が望ましい場合に好ましい。これらの構造は、非特異的な吸収により洗浄カバーグラスに付着したが、アッタすることができますchmentはシラン化カバースリップを使用する場合は特に、抗体ベースの添付ファイルと比較して通常は安定している。
5。セグメント化された微小管の準備
下のすべてのソリューションのボリュームは室容積、15〜20μLです。大きなチャンバーを使用する場合は比例して増加する。
- 35℃で30秒間予熱し、非標識チューブリンミックス(1 mMのマグネシウム-GTPとし、10〜15μMの非標識チューブリンを補った45μlの運動性バッファー) 30μL/分で灌流。
- DIC光学系( 図2B、ビデオ1)と微小管の成長を監視します。 5-7分のインキュベーションの間、微小管は、通常は〜10ミクロン、長育つ。
- ローダミン-チューブリンミックス(0.5 mMのGMPCPPとチューブリンへのローダミンの0.5〜1モル比ローダミン標識チューブリンの2-5μMで補充65μlの運動性バッファー)を準備し、30秒間、35℃で溶液を温める。
- 30μですぐに灌流リットル/分。微小管の先端で安定した蛍光キャップの形成を促進するために8月10日分間インキュベートする。安定した微小管セグメントはまた、自然発生的に核生成し、微分干渉光学系を見ることができます。
- チューブリンおよびヌクレオチドだけでなく、水溶性の微小断片を除去するために20μL/分で運動性緩衝液100μlとよく室内を洗ってください。
- DICでは、微小管( 図2D)表示されていることを確認して、多くの微小管は、キャッピングの際に分解しているため、その数は、しかし、( ビデオ2はセグメント化された微小管と、一般的なフィールドを示しています)減少するはずである。
注1:セグメント化された微小管は非常に安定であり、少なくとも2時間のために使用することができる。しかしながら、これらの微小管の寿命は、過度の溶液交換に伴って減少する、又は2 - メルカプトエタノールは、撮像バッファに使用されている場合。
6。脱重合微小管末端を有するタンパク質の追跡実験観察
- Introd学UCE 30〜5010μL/分でチャンバ内に蛍光タンパク質(0.1〜20 nm)でμL。カバーガラスに付着したタンパク質が明らかである場合には、4〜8 mg / mlのBSAで運動性バッファーを補足。のAlexa488-DAM1先端追跡は、さらに10のDTTまたは0.5から1パーセントβME10が必要です。
- 微小管の不必要な漂白及び分解を避けるために、顕微鏡視野絞りを用いた照明フィールドを制限します。
- 画像記録を中断することなく、ローダミンフィルターキューブに切り替えた後、GFPフィルターキューブを使用してビデオの取り込みを開始します。微小管の両端の赤いセグメントがはっきりと見えるはず、彼らは( ビデオ3)をフェードインしてすぐに崩壊し始めます。
- キャップは、ほぼ(通常は10から20秒のためではなく、この時間が長く下ローダミン標識率で成長キャップのためになります)消えるまで点灯し、微小管分解を追跡するタンパク質を記録するために、GFPのチャンネルに切り替えるように続けている。
- 分析するをMetaMorph、無料公開のImageJまたは他の画像処理ソフト( 図2E)を用いてkymographs、観察時に種々の時間軸に沿って微小管蛍光強度を示し、すなわち 、二次元画像)を構築することによって配列を生じる。
注1:取得速度が観察されたイベントのタイミングに応じて調整する必要があります。推奨される速度が遅く、移動するため、毎秒2〜3フレーム(fps)で、リングサイズのDAM1は27と錯体を形成するが、単一分子のための取得時間は> 20 FPS 19でなければなりません。
注2:高感度なEMCCD、 例えば ANDOR iXon3は、脱重合微小管とチップ-追跡イベントを迅速に記録するために必要です。アンドールiXon3カメラの推奨設定は、次のとおりです。5Xは、EMは200、1 MHzの読み出し速度、16ビット·センサモード、80ミリ秒の露光時間を得るゲイン。
注3:TIRF顕微鏡法を使用して信号対雑音比を改善するが、より短い微小管を使用する必要があり、そのような股関節T蛍光安定キャップはエバネッセント場の範囲内にとどまる。
7。微小管ヒントトラッキング複合体の分子サイズの定量分析
このアプローチの理論的根拠は、単一のフルオロフォアの強度に先端トラッキング複合体の総蛍光強度の比を求めることにより、先端トラッキング複合体中の分子の数を決定することである。このアプローチは、GFP-タンパク質融合物および蛍光色素で標識されたタンパク質に適用することができるが、製剤中のいくつかのタンパク質分子が蛍光性でない場合、それはチップ·トラッキング複合体中の分子の数を過小評価してもよい。
- 蛍光標識されたタンパク質分子のレコード光退色速度論。
- 全体のプロトコル2を使用して調製することができる非修飾ガラススライド、両面テープの二つのストリップ、すっきりとカバースリップを使用して、定期的な顕微鏡検査室を組み立てる、又はこれだけの2.1〜2.6、手順プロトコル。
- 、運動性緩衝液中で約50 nMのタンパク質を入れる運動性緩衝液で簡単に洗浄し、VALAP( 表4)を用いてチャンバを密封する。 (溶液中で自然発生的に形成してもよく、または複数の単一分子は互いに近接していると解決できない場合に表示されることが三量体および四量体)、単一分子を表す均一に分散したスポット( 図3A)、そしてその小さな集合体のフィールドを取得するためにタンパク質濃度を最適化。このステップは、光退色工程およびステップサイズを正確に決定する(下記参照)のマルチピーク分布を得るために非常に重要である。
- 個々の蛍光スポットが観察されるもので照射レーザー強度を最小化する、より低い照度で光退色時間が延長されるので、より長い光退色のトレースを得ることができる。また、1フレームの間に複数のフルオロフォア漂白の確率を減少させるために露光時間を最小限にする。推奨設定アンドールiXon3カメラ用:ゲイン5.0のx、EMが999、10 MHzの読み出し速度、50〜100ミリ秒の露光時間を得ることができます。
- (その後のimg(x、y)にという)カバースリップの表面に焦点、照明シャッタを閉じ、新鮮なフィールドに移動し、照明シャッタを開いて、すべての複合体が漂白されるまで、画像を取得する。
- 照度むらのために取得された画像( 図3B)を補正。
- 任意のフルオロフォアの溶液を調製し、BRB-80における例えば 1μMのフルオレセインイソチオシアネート(FITC)。このような溶液は、予め用意等分し、-20℃で保存することができる
- セクション7.1.1のように、チャンバを組み立てるが、通常のカバーガラスを使用しています。蛍光団のソリューションを追加し、VALAPを使用してチャンバーを密閉する。
- 全体顕微鏡視野の> 50画像を収集:照明シャッタが閉じている間に、新しい無漂白の領域に、ステージを移動し、すぐにシャッターを開いた後に画像を取得する。
- 5ピクセルのImageJを使用してRADIUSまたは他のソフトウェア( 図3C)とガウスぼかしでこのスタックとフィルタの平均投影を作成します。得られた画像は、(x、yは画素の座標に対応するランプ色の(x、y))フィールドの照明強度の分布を表す。
- この画像( 最大(ランプ色))の最大ピクセルの明るさを決定します。
- 閉じた照明シャッタと、セクション7.2.3と同じカメラ設定を使用して、この画像の平均ピクセル強度を決定する1つの画像を取得し、この値はCN、カメラノイズに対応する。
- 以下の式を用いた実験画像( のimg(x、y)を )正規化するために上記の値と画像( ランプ色の(x、y))を使用します。
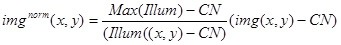
BRIの定量分析のために得られた画像のimg ノルム (x、y)を使用する先端タッキング複合体( 図3D)を使用して画像を正規化する静止蛍光複合体のghtness、また。
- シングルフルオロフォアの強度を決定する。
- ノルム (x、y)を正規化画像のimgを用いて、任意の画像処理ソフトウェアは、円形領域(直径5-6画素)で蛍光スポットを選択して、すべてのフレームに対して、その積分強度を決定し、光退色トレースを生成する。非常に明るいドット(>調光のものより明るい5倍)は避けてください。
- 同じ円形領域のツールを使用し、少なくとも3点のない領域を選択すると、対応する光退色トレースを生成、平均して指数関数的減衰関数でフィットします。
- 実験の時点と一致し、光退色曲線からそれを減算するこのような背景の強度曲線を表に。
- 光退色曲線(3-5点のスライド窓付き平均)を滑らかにする。視覚的に結果の曲線を検査し、蛍光または明白な漂白( 図3E)の欠如の急激な増加を示している任意の曲線を捨てる。
- 残りのカーブ(曲線の総数の通常百分の50から70まで)のそれぞれについて、視覚的に蛍光スポットが漂白されたとき、最終的な高原を選択します。のみ〜100ポイントのままにし、これらの強度を平均化するこのセグメントを短くしてください。小さな変動を最小限にするために短縮され、光退色曲線からこの値を減算すると、バックグラウンドレベルであり、バックグラウンドピーク(下)のサイズを小さくする。
- 20以上の光退色曲線から、全ての時点のために強度のヒストグラムをプロット(>千時点)。ヒストグラムは、少なくとも4つの明確なピーク(注2を参照)を示すべきである。
- MATLAB、Mathematicaのまたは類似のソフトウェア( 図3F)を使用して、等距離ガウス分布10,43とヒストグラムをフィットする:
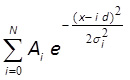
Wここで私とσI、D、Nはフィッティングパラメータである。 iは振幅に対応し、幅i番目のピークのi及びσパラメータであり、dは、ピーク間の距離であり、Nは、分布のピークの合計数に対応する整数である。最初の3以上のピークの中心がフィットラインに視覚的に良い一致を示している場合は、これらのピークの間の距離(パラメータd)は、単一のフルオロフォアの蛍光強度に対応する。
注1:顕微鏡観察システムは、かなりの振動や騒音を呈する( 例えば、不安定なレーザ光 )の他のソースがある場合、検査したドット(セクション7.3.6)の数が増加されるべきである。
注2:これは等距離ガウスフィットと正確な分析のための> 3つのピークを得ることが不可欠である。より少ないピークが得られた場合、偽( 例えば二重)ステップサイズを得ることができ照明条件が最適でない場合には、ドットが速すぎて、単一のステップを、例えば漂白はよく解決されていない。
- 先端追跡複合体の分子サイズを決定します。
- 議定書6で収集された画像を使用して、すぐにシャッターを開いた後に取得した最初の2-4のフレームを選択します。先端トラッキングが観察される前に電界がしばらくの間照射した場合に、同じ実験条件下で光退色の速度論から元の強度を推定する。
- 選択したフレームを平均とセクション7.2.5-7.2.7のように、得られる画像を正規化。
- 7.3.1項と同じ領域サイズを用いた蛍光先端追跡複合体の積分強度を測定します。
- 先端追跡複雑近くにある3背景領域の積分強度を測定し、同じ領域を使用して、これらの値を平均化して、セクション7.4.3から先端追跡複合体の強度から差し引く。
- 7.3.5項で得られた単フルオロフォアの強度によって7.4.4項で得られた蛍光強度を分割することにより、複雑な内発蛍光分子の数を計算します。
注1:これは7.4プロトコルのための照明及び取得の設定は、プロトコル7.1と同じであることが望ましい。露出時間やレーザー強度のどちらかがこれらのステップの間に調整した場合、結果として得られる蛍光値は、それに応じて拡大縮小する必要があります。しかしながら、そのようなスケーリングの精度は、これらの異なる条件の下で、同じサンプル( 例えば 、蛍光時間)を撮像し、得られた強度の比を計算することによって検証されるべきである。
8。タンパク質でコーティングしたビーズによる微小管の先端追跡
- プロトコル6のように、MTの分解を誘発することによって、先端追跡ビーズを用いた実験を行う。 DIC光源の強度と同時にローダミン蛍光を観察可能にするために低減されるべきであるDICイメージング。
- 10μL/分でチャンバ内にビーズ懸濁液30〜50μLを紹介中Grishchuk ら 10、アズベリーら 11としてビーズを準備します。示唆ビーズ濃度は、10 -16 -10 -17 Mである。
- 正立顕微鏡を使用している場合は、顕微鏡ステージからチャンバを削除し、ビーズはカバーガラスで沈降することを可能にするために5〜10分間、それを反転させる。これはカバーガラスにつながれ、微小管へのビーズの良好な結合を促進しますが、この手順では、このような短い時間の間に少し重力ベースの沈降を示して0.5μmのポリスチレンビーズと成功しない。
- カバーガラス係留微小管に結合しているビーズを選択し、ビーズは明らかにアーク44( 図4A)に移動する必要があります。つながれたビーズは、1〜3程度離れメートルのまま時折カバーガラス付ビーズによりはっきりと見えるカバーガラス表面から配置する必要がありますotionless。
- ローダミンフィルターキューブに切り替え、DIC照明を使用しながら、画像の収集を開始。
- 水銀ランプや530から550 nmのレーザーを(視野絞りで制限)撮像視野を照明する開いたシャッター。ビーズが外れる、または逆アセンブルする微小管の端が移動した ( 図4D、4F、および4G)まで記録を継続する。
注1:光トラップは、微小管の壁とタンパク質被覆ビーズとの間の相互作用を促進するために使用することができる。キネシンモーター( 図4E-G)でコーティングされたビーズを扱う場合に特に便利です。上記と同じプロトコルに従うが、2 mMのマグネシウム-ATPで運動性バッファーを補足。ステップ8.3で、1064 nmのレーザー光を浮遊ビーズを捕獲セグメント化された微小管壁に近いトラップされたビーズを持って来るために、ステージを移動します。低照度DICとし、ローダミンフィルターキューブを介して撮像を開始し、蓋をし、微小管の端部に向かって歩いて開始するビーズを待つ。アフトER監督のビーズの動きが観察され、ビームを捕捉するためのシャッターを閉じて、蛍光照明用のシャッターを開け。ビーズが外れる、または逆アセンブルする微小管の端がトラックまで録音を続けます。
Access restricted. Please log in or start a trial to view this content.
結果
微小管脱重合を追跡するタンパク質が終了する。酵母動原コンポーネントDAM1が圧倒的に脱重合微小管のベストのヒント-トラッカーである14を終了します。 GFPで標識されたこの10サブユニット複合体は、容易に発現し、細菌細胞18,38から精製し、私たちは、先端追跡アッセイのポジティブコントロールとして、それを使用することをお勧めすることができます。微...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
多くの単一分子アッセイは、最近日常大幅に非特異的なタンパク質の付着を低減するために、特別に処理カバーグラスを使用しています。我々はここで説明する手順では、ハワード·ラボ32で開発されたオリジナルのプロトコルの変形例であり、我々はカバースリップをシラン化することであっても蛍光を使用していないDICベースのビーズアッセイ、と努力の価値であることがわかり?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、開示することは何もありません。
謝辞
著者らは、プロトコルを開発し、するための試薬を提供するための再利用可能なフローチャンバーを設計·製造を支援するため、FI Ataullakhanov、N. Dashkevich、N. GudimchukとA. Korbalev数字のために画像を提供するため、N. GudimchukとP.ザハロフに感謝したいと思いますテキスト編集やヒントや議論のためのGrishchukラボの他のメンバーと助けをジゴキシゲニン標識微小管の種、A.ポタペンコを準備します。この作品は、によって部分的にサポートされていましたNIH付与GM R01-098389とキンメル学者でELGにペンシルベニア州マッスル研究所からのパイロット助成金、RFBRは、12 04から00111 - 、13 - 04から40190-Hを付与し、13で-04-40188-H、FI Ataullakhanovに科学幹部会補助金(分子システムインテグレーションおよび分子機序および分子細胞生物学プログラム)のロシア科学アカデミー、NIHは、JRマッキントッシュにGM R01 GM033787を付与し、ドミトリーZimin王朝財団ポスドクフェローシップへVAV
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Table 1. Microscopy and other equipment. | |||
| Microscope | Zeiss Nikon | Axio Imager 2 Eclipse Ti | other microscope models capable of DIC and epifluorescence-imaging can be used |
| Objective | Zeiss Nikon | 420490-9900-000 CFI Apo 100x Oil 1.49 | 100X, DIC, 1.3-1.49 NA |
| Objective heater | Bioptechs | 150803, 150819-19 | |
| Fluorescent filter cube | Chroma | 49004 or 49008 41017 or 49020 | optimized for Rhodamine fluorescence optimized for GFP fluorescence |
| Acquisition software | freeware MicroManager Molecular Devices | not applicable MetaMorph 7.5 | http://valelab.ucsf.edu/~MM/MMwiki/ other software can be used to acquire images and for a particle tracking |
| EMCCD camera | Andor | iXon3, DU-897E-cs0-#BV | Highly sensitive EMCCD camera |
| Trapping laser | IPG Photonics | YLR-10-1064-LP | 1,064 nm laser, 10 W |
| Fluorescence excitation lasers | Coherent, Inc. Coherent, Inc. | Sapphire 488 LP Sapphire 552 LP | excitation of green fluorophores excitation of red fluorophores |
| Plasma Cleaner | Harrick Plasma | PDC-001 | |
| Commercial flow chambers | Warner Instruments | RC-20 or RC-30 | |
| Perfusion pump | Cole Palmer Harvard Apparatus | Masterflex 77120-52 Pico Plus | Both pumps provide the required rate of liquid flow but a peristaltic pump may pulse at very slow speed. The flow with a syringe pump is more consistent for a wide range of rates but this pump has inertia. |
| Table 2. Microscopy chamber preparation. | |||
| Modified microscope slides for reusable chambers | Precision Glassblowing of Colorado | Custom order www.precisionglassblowing.com | Sonic slots in slides using schematics in Figure 1 |
| Polyethylene tubing | Intramedic | 427410 | I.D. 0.58 mm, O.D. 0.965 mm; use these tubes to connect assembled chamber to the pump and waste container |
| Polyethylene tubing | Intramedic | 427400 | I.D. 0.28 mm, O.D. 0.61 mm; use these tubes to make the reusable chamber |
| Regular microscope slides | VWR | 48312-003 | Other similar slides can be used |
| Coverslips | VWR | 48393-150, 48366-067 | Other similar coverslips can be used |
| Silicon sealant | World Precision Instruments | KIT, SILICON SEALANT 5 MIN CURE | |
| Epoxy glue | Loctite | 83082 | |
| Cyanoacrylate adhesive | Scotch 3M | AD114 | Or cyanoacrylate adhesive from other manufacturers |
| Table 3. Coverslips cleaning and coating. | |||
| Molecular Sieves, Grade 564 | Macron | 4490-04 | |
| Coverglass Staining Jar | Ted Pella, Inc. | 21036 | |
| Coverslip Ceramic Holder | Thomas Scientific | 8542e40 | |
| PlusOne Repel Silane | GE Healthcare Biosciences | 17-1332-01 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Anti-digoxigenin AB | Roche Applied Science | 11093274910 | |
| Table 4. Preparation of seeds and segmented microtubules. | |||
| Tubulin | purified from cow brains Cytoskeleton, Inc | T238P | For purification protocols see 49–51 Unlabeled porcine tubulin |
| Labeled tubulin | Cytoskeleton, Inc Invitrogen Invitrogen | TL590M C1171 (Rhodamine) A-2952 (Digoxigenin) | Rhodamine-labeled porcine tubulin Tubulin can be labeled with any amine-reactive dye as in reference52. |
| GMPCPP | Jena Biosciences | NU-405 | Aliquot and store at -70 °C |
| VALAP | Vaseline, lanolin, and paraffin at 1:1:2 by mass | see reference9 | |
参考文献
- Desai, A., Mitchison, T. J. Microtubule polymerization dynamics. Ann. Rev. Cell Dev. Biol. 13, 83-117 (1997).
- Mitchison, T. M., Kirschner, M. W. Dynamic instability of microtubule growth. Nature. 312 (15), 237-242 (1984).
- Walker, R. A., Brien, O., et al. Dynamic Instability of Individual Microtubules Analyzed by Video Light Microscopy: Rate Constants and Transition Frequencies. J. Cell Biol. 107, 1437-1448 (1988).
- Gardner, M. K., Zanic, M., Gell, C., Bormuth, V., Howard, J. Depolymerizing Kinesins Kip3 and MCAK Shape Cellular Microtubule Architecture by Differential Control of Catastrophe. Cell. 147 (5), 1092-1103 (2011).
- Lombillo, V. A., Stewart, R. J., McIntosh, J. R. Minus-end-directed motion of kinesin-coated microspheres driven by microtubule depolymerization. Nature. 373, 161-164 (1995).
- Franck, A. D., Powers, A. F., Gestaut, D. R., Gonen, T., Davis, T. N., Asbury, C. L. Tension applied through the Dam1 complex promotes microtubule elongation providing a direct mechanism for length control in mitosis. Nat. Cell Biol. 9 (7), 832-837 (2007).
- Tran, P. T., Walker, R. A., Salmon, E. D. A metastable intermediate state of microtubule dynamic instability that differs significantly between plus and minus ends. J. Cell Biol. 138 (1), 105-117 (1997).
- Grishchuk, E. L., Molodtsov, M. I., Ataullakhanov, F. I., McIntosh, J. R. Force production by disassembling microtubules. Nature. 438, 384-388 Forthcoming.
- Coue, M., Lombillo, A., Richard, J. Microtubule Depolymerization Promotes Particle and Chromosome Movement In Vitro. J. Cell Biol. 112 (6), 1165-1175 (1991).
- Grishchuk, E. L., Spiridonov, I. S., et al. Different assemblies of the DAM1 complex follow shortening microtubules by distinct mechanisms. Proc. Natl. Acad. Sci. U.S.A. 105 (19), 6918-6923 (2008).
- Asbury, C. L., Gestaut, D. R., Powers, A. F., Franck, A. D., Davis, T. N. The Dam1 kinetochore complex harnesses microtubule dynamics to produce force and movement. Proc. Natl. Acad. Sci. U.S.A. 103 (26), 9873-9878 (2006).
- Westermann, S., Wang, H. -W., Avila-Sakar, A., Drubin, D. G., Nogales, E., Barnes, G. The Dam1 kinetochore ring complex moves processively on depolymerizing microtubule ends. Nature. 440 (7083), 565-569 (2006).
- Grissom, P. M., Fiedler, T., Grishchuk, E. L., Nicastro, D., West, R. R., Mcintosh, J. R. Kinesin-8 from Fission Yeast A Heterodimeric , Plus-End – directed Motor that Can Couple Microtubule Depolymerization to Cargo Movement. Mol. Biol. Cell. 20, 963-972 (2009).
- McIntosh, J. R., Volkov, V., Ataullakhanov, F. I., Grishchuk, E. L. Tubulin depolymerization may be an ancient biological motor. J. Sci. 123, 3425-3434 (2010).
- Grishchuk, E. L., McIntosh, J. R., Molodtsov, M. I., Ataullakhanov, F. I. Force generation by dynamic microtubule polymers. Compr. Biophys. 4, 93-117 (2012).
- Asbury, C. L., Tien, J. F., Davis, T. N. Kinetochores' gripping feat: conformational wave or biased diffusion. Trends Cell Biol. (1), 38-46 (2011).
- Tien, J. F., Umbreit, N. T., et al. Cooperation of the Dam1 and Ndc80 kinetochore complexes enhances microtubule coupling and is regulated by aurora B. Cell Biol. 189 (4), 713-723 (2010).
- Gestaut, D. R., Graczyk, B., et al. Phosphoregulation and depolymerization-driven movement of the Dam1 complex do not require ring formation. Nat. Biol. 10 (4), 407-414 (2008).
- Schmidt, J. C., Arthanari, H., et al. The Kinetochore-Bound Ska1 Complex Tracks Depolymerizing Microtubules and Binds to Curved Protofilaments. Dev. Cell. 23 (5), 968-980 (2012).
- Brouhard, G. J., Stear, J. H., et al. XMAP215 is a processive microtubule polymerase. Cell. 132 (1), 79-88 (2008).
- Stumpff, J., Du, Y., et al. A Tethering Mechanism Controls the Processivity and Kinetochore-Microtubule Plus-End Enrichment of the Kinesin-8 Kif18A. Mol. Cell. 43 (5), 764-775 (2011).
- Su, X., Qui, W., Gupta, M., Pereira-Leal, J., Reck-Peterson, S. L., Pellman, D. Mechanisms underlying the dual-mode regulation of microtubule dynamics by Kip3/kinesin-8. Mol. Cell. 43 (5), 751-763 (2011).
- Helenius, J., Brouhard, G., Kalaidzidis, Y., Diez, S., Howard, J. The depolymerizing kinesin MCAK uses lattice diffusion to rapidly target microtubule ends. Nature. 441 (7089), 115-119 (2006).
- Gudimchuk, N., Vitre, B., et al. Kinetochore kinesin CENP-E is a processive bi-directional tracker of dynamic microtubule tips. Nat. Cell Biol. 15 (9), 1079-1088 (2013).
- Akhmanova, A., Steinmetz, M. Microtubule +TIPs at a glance. J. Sci. 20 (Pt 20), 3415-3419 (2010).
- Dixit, R., Barnett, B., Lazarus, J., Tokito, M., Goldman, Y., Holzbaur, E. Microtubule plus-end tracking by CLIP-170 requires EB1. Proc. Natl. Acad. Sci. U.S.A. 106 (2), 492-497 (2009).
- Grishchuk, E. L., Efremov, A. K., et al. The Dam1 ring binds microtubules strongly enough to be a processive as well as energy-efficient coupler for chromosome motion. Proc. Natl. Acad. Sci. U.S.A. 105 (40), 15423-15428 (2008).
- Akiyoshi, B., Sarangapani, K. K., et al. Tension directly stabilizes reconstituted kinetochore-microtubule attachments. Nature. 468 (7323), 576-579 (2010).
- McIntosh, J. R., Grishchuk, E. L., et al. Fibrils Connect Microtubule Tips with Kinetochores A Mechanism to Couple Tubulin Dynamics to Chromosome Motion. Cell. 135 (2), 322-333 (2008).
- Powers, A. F., Franck, A. D., et al. The Ndc80 kinetochore complex forms load-bearing attachments to dynamic microtubule tips via biased diffusion. Cell. 136 (5), 865-875 (2009).
- Umbreit, N. T., Gestaut, D. R., et al. The Ndc80 kinetochore complex directly modulates microtubule dynamics. Proc. Natl. Acad. Sci. U.S.A. 109 (40), 16113-16118 (2012).
- Gell, C., Bormuth, V., et al. Microtubule Dynamics Reconstituted In Vitro and Imaged by Single-Molecule Fluorescence Microscopy. Methods Biol. 95, 221-245 (2010).
- Dixit, R., Ross, J. L. Studying Plus-End Tracking at Single Molecule Resolution Using TIRF Microscopy. Methods Cell Biol. 95, 543-554 (2010).
- Beausang, F. J., Sun, Y., Quinlan, E. M., Forkey, N. J., Goldman, Y. Construction of Flow Chambers for Polarized Total Internal Reflection Fluorescence Microscopy (polTIRFM). Cold Spring Harbour Protoc. 6, 712-715 (2012).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP Hydrolysis in Microtubule Dynamics: Information from a Slowly Hydrolyzable Analogue, GMPCPP. Mol. Biol. Cell. 3, 1155-1167 (1992).
- Grishchuk, E. L., Ataullakhanov, F. I. In Vitro Assays to Study the Tracking of Shortening Microtubule Ends and to Measure Associated Forces. Methods Cell Biol. 95, 657-676 (2010).
- Gutiérrez-Medina, B., Block, S. M. Visualizing individual microtubules by bright field microscopy. Am. J. Phys. 78 (11), 1152-1159 (2010).
- Volkov, V. A., Zaytsev, A. V., et al. Long tethers provide high-force coupling of the Dam1 ring to shortening microtubules. Proc. Natl. Acad. Sci. U.S.A. 110 (19), 7708-7713 (2013).
- Laan, L., Pavin, N., et al. Cortical dynein controls microtubule dynamics to generate pulling forces that position microtubule asters. Cell. 148 (3), 502-514 (2012).
- Myster, S. H., Knott, J. A., O'Toole, E., Porter, M. E. The Chlamydomonas Dhc1 gene encodes a dynein heavy chain subunit required for assembly of the I1 inner arm complex. Mol. Biol. Cell. 8, 607-620 (1997).
- Lombillo, V. A., Coue, M., McIntosh, J. R. In vitro motility assays using microtubules tethered to Tetrahymena pellicles. Methods Cell Biol. 39, 149-165 (1993).
- Hyman, A., Chrétien, D., Arnal, I., Wade, R. Structural changes accompanying GTP hydrolysis in microtubules: information from a slowly hydrolyzable analogue guanylyl-(alpha,beta)-methylene-diphosphonate. J. Cell Biol. 128 (1-2), 117-125 (1995).
- Park, M., Kim, H., Kim, D., Song, N. W. Counting the Number of Fluorophores Labeled in Biomolecules by Observing the Fluorescence-Intensity Transient of a Single Molecule. Bull. Chem. Soc. Jap. 78, 1612-1618 (2005).
- Welburn, J. P. I., Grishchuk, E. L., Backer, C. B., Wilson-Kubalek, E. M., Yates, J. R., Cheeseman, I. M. The human kinetochore Ska1 complex facilitates microtubule depolymerization-coupled motility. Dev. Cell. 16 (3), 374-385 (2009).
- Efremov, A., Grishchuk, E. L., Mcintosh, J. R., Ataullakhanov, F. I. In search of an optimal ring to couple microtubule depolymerization to processive chromosome motions. Natl. Acad. Sci. U.S.A. (48), 19017-19022 (2007).
- Itoh, T., Hisanaga, S., Hosoi, T., Kishimoto, T., Hotani, H. Phosphorylation states of microtubule-associated protein 2 (MAP2) determine the regulatory role of MAP2 in microtubule dynamics. Biochemistry. 36 (41), 12574-12582 (1997).
- Oguchi, Y., Uchimura, S., Ohki, T., Mikhailenko, S. V., Ishiwata, S. The bidirectional depolymerizer MCAK generates force by disassembling both microtubule ends. Nat. Biol. (6), 1-8 (2011).
- Kishino, A., Yanagida, T. Force measurements by micromanipulation of a single actin filament by glass needles. Nature. 334, 74-76 (1988).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann. NY Acad. Sci. 253, 107-132 (1975).
- Weingarten, M. D., Lockwood, A. H., Hwo, S., Kirschner, M. W. A Protein Factor Essential for Microtubule Assembly. Proc. Natl. Acad. Sci. U.S.A. 72 (5), 1858-1862 (1975).
- Widlund, P. O., Podolski, M., et al. One-step purification of assembly-competent tubulin from diverse eukaryotic sources. Mol. Biol. Cell. 23 (22), 4393-4401 (2012).
- Hyman, A., Drechsel, D., et al. Preparation of Modified Tubulins. Methods Enzymol. 196, 478-485 (1991).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved