A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس النفاذية في واحدة Microvessel المعزولة الجرذ إعداد الرئة perfused الدم
In This Article
Summary
ومعزولة إعداد الرئة perfused الدم يجعل من الممكن تصور شبكات microvessel على سطح الرئة. نحن هنا وصف نهج لقياس نفاذية microvessels واحد في الرئتين معزولة في الوقت الحقيقي باستخدام التصوير مضان.
Abstract
ويستخدم على نطاق واسع في إعداد معزولة الرئة perfused الدم لتصور وتحديد الإشارات في microvessels واحد. وذلك بربط هذا المستحضر مع التصوير في الوقت الحقيقي، يصبح من الممكن تحديد التغيرات في نفاذية microvessels الرئوي الفردية. هنا نحن تصف الخطوات لعزل الرئتين الفئران ويروي لهم الدم الذاتي. ثم، ونحن الخطوط العريضة خطوات للبث fluorophores أو عن طريق وكلاء microcatheter في منطقة الرئة الصغيرة. باستخدام هذه الإجراءات وصفها، وتحديد الزيادات النفاذية في الفئران الرئة microvessels ردا على دفعات من عديد السكاريد الشحمي البكتيرية. وكشفت البيانات التي زادت عديد السكاريد الشحمي تسرب السوائل عبر كل من وريدي وmicrovessel الشعرية القطاعات. وبالتالي، هذا الأسلوب يجعل من الممكن مقارنة استجابات نفاذية الأوعية الدموية بين شرائح وبالتالي، تحديد أي عدم التجانس في الاستجابة. بينما الأساليب المستخدمة عادة لتحديد نفاذية الرئة تتطلب تحليل نتائج عينات أنسجة الرئة، واستخدام التصوير في الوقت الحقيقي يغني هذا الشرط كما يتضح من الطريقة الحالية. وبالتالي، وإعداد الرئة معزولة جنبا إلى جنب مع التصوير في الوقت الحقيقي يوفر العديد من المزايا أكثر من الطرق التقليدية لتحديد نفاذية الاوعية الدموية الدقيقة في الرئة، ولكن هو وسيلة واضحة لتطوير وتنفيذ.
Introduction
زيادة نفاذية الاوعية الدموية الدقيقة في الرئتين يؤدي إلى تطوير وذمة سنخية وتبادل الغازات وخطر هو سمة رئيسية من إصابة الرئة الحاد (ALI) 1-3. وبالتالي، فإن تقديرات نفاذية الأوعية الدموية مهمة في تحديد مدى إصابة الرئة وفعالية التدخلات العلاجية المقترحة. وتستخدم التحليل الوزني مثل الرئة حرة نسبة الدم الرطب إلى الجاف ومعامل الترشيح الاوعية الدموية الدقيقة على نطاق واسع وسائل لتقدير نفاذية 4،5. وتشمل الأساليب الأخرى قياس الاحتفاظ تحقيقات المشعة أو الفلورية في أنسجة الرئة 6-8. ومع ذلك، فإن الأساليب المذكورة أعلاه تتطلب معالجة postexperiment من عينات أنسجة الرئة نحو توضيح البيانات النفاذية. علاوة على ذلك، منذ حيوان واحد يمكن أن تستخدم إلا لبروتوكول العلاج واحدة، قد تكون هناك حاجة إلى أعداد الحيوانات الكبيرة لدراسة كاملة. والقاسم المشترك بين الطرق أعلاه هو أنهم تحديد نفاذية الأوعية الدموية يعني لجميع الأوعية الدموية في عينة الأنسجة. ومع ذلك، فإنه من الثابت أيضا أن الرئوي سفن الكلي والجزئي تختلف ظاهريا 9. وبالتالي، قد تكون ردود النفاذية غير المتجانسة بين مختلف قطاعات السفينة فضلا 9،10. وبالتالي، قياس نفاذية متوسط جميع الأوعية الرئوية في عينة الأنسجة قد لا تعكس بشكل كاف هذا التجانس.
في عزلة إعداد الرئة perfused الدم، والأوعية الدموية على سطح الرئة يمكن تصور بواسطة المجهر تستقيم 4،11،12. وهذا يتيح تميز الردود في الأوعية واحدة، وبالتالي، ومعالجة أي تباين في ردود 13. بالإضافة إلى ذلك، من خلال الاستفادة من التصوير مضان من microvessels، يمكن إدراجها المقايسات مضان القائم. أبعد من ذلك، وmicrocatheter الأذين الأيسر يمكن استخدامها لتقديم وكلاء وتحقيقات مضان في الأوعية الدموية 11،14. وmicrocatheter يحد من التسليم لمنطقة الرئة الصغيرة، وبالتالي السابقينيطرح فقط في الأوعية الدموية في المنطقة إلى وكلاء غرست وfluorophores. وهذا يسمح مناطق صغيرة متعددة داخل نفس الرئة لاستخدامها في تجارب منفصلة، مما يؤدي إلى انخفاض عام في الحيوانات اللازمة للدراسة.
التصوير في الوقت الحقيقي تمكن من التقاط التغيرات الدينامية في الأوعية الدموية خارج الأوعية ومضان من microvessels واحد من إعداد الرئة معزولة. وبالتالي، لكل microvessel داخل حقل الصورة، يمكن تسجيل التغيرات في مضان خلال ضخ fluorophores وwashoff، وكميا حاليا 14. باستخدام قيم الحد الأقصى والأوعية الدموية المتبقية مضان، يمكن تحديد مؤشر نفاذية لكل microvessel داخل الحقل التصوير. لتحديد التغييرات نفاذية استجابة لعوامل التهابية أو الضارة، وكيل المطلوب يمكن أن تدار أولا ثم تحديد مؤشر النفاذية. بالإضافة إلى ذلك، يمكن تعيين حقل صورة في أي مكان داخل منطقة الرئة التي غرست من قبلmicrocatheter، وبالتالي توفير درجة عالية من المرونة في اختيار شبكة الأوعية الدموية المطلوب. وبالتالي، فإن معزولة إعداد الرئة perfused الدم جنبا إلى جنب مع التصوير في الوقت الحقيقي يوفر النموذج التجريبي جذابة لقياس النفاذية في microvessels رئة واحدة.
Protocol
وكانت جميع التجارب التي أجريت على الحيوانات التي وافقت عليها اللجنة المؤسسية رعاية الحيوان واستخدام جامعة تينيسي مركز علوم الصحة.
1. الأنابيب المستحضرات Perfusing الجرذ الرئة
- إعداد نظام أنابيب مع أنابيب Tygon (رقم 18) لنضح الدم كما هو مبين في الشكل 1. ربط محولات الضغط (P23XL) ووضع أنابيب على المسرح المجهر.
- ضبط درجة حرارة حمام الماء إلى 37 درجة مئوية.
- ربط مدخل ومخرج الرئة مؤقتا مع أنابيب Tygon.
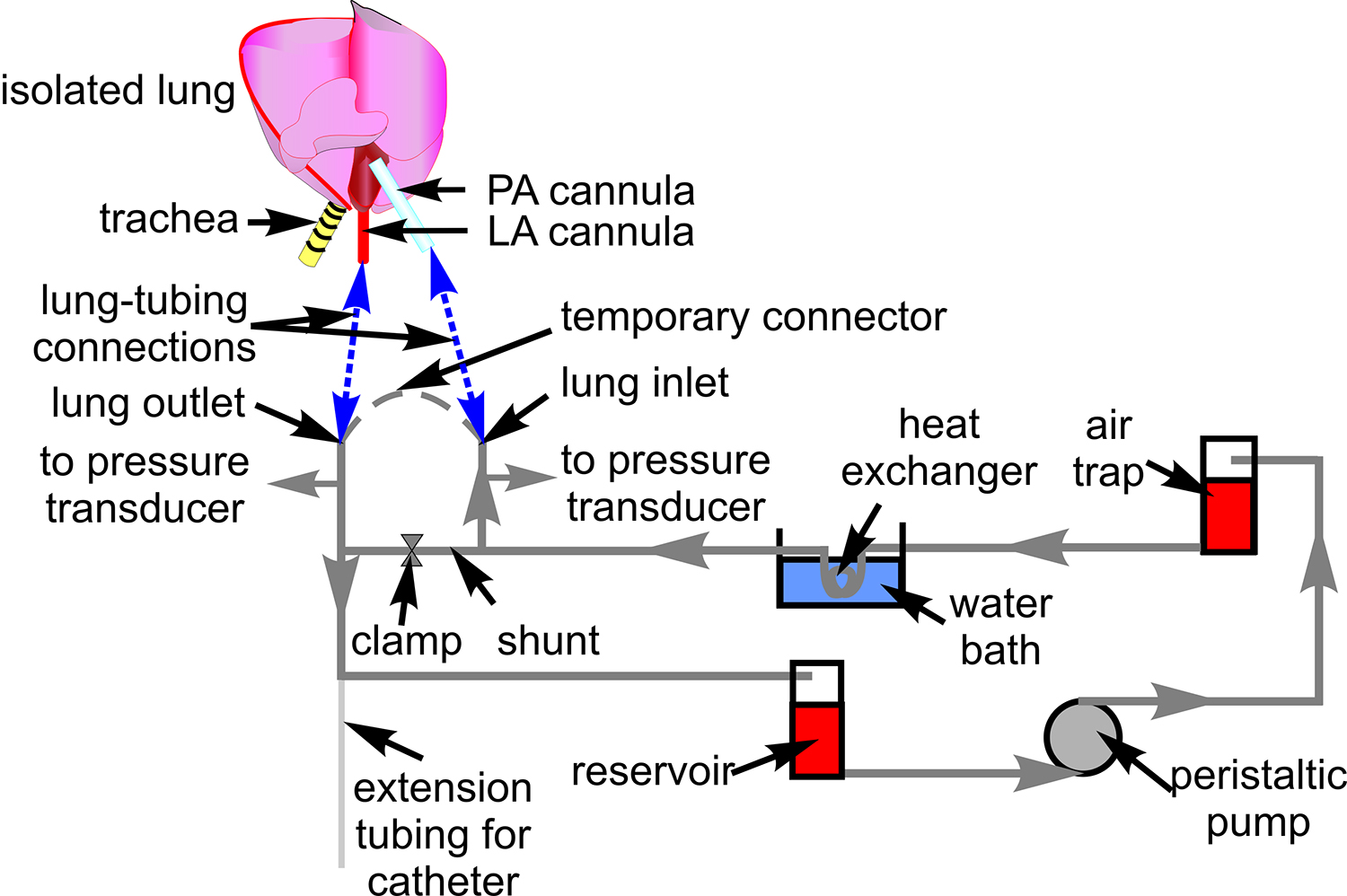
الشكل 1. نضح الدم أنابيب. ويبين التخطيطي الإعداد أنابيب تستخدم لتعميم الدم من خلال إعداد الرئة معزولة. وأشار أيضا هي مكونات المرتبطة التي من خلالها ط أنابيبو توجيهها. ويرد التخطيطي للقلب والرئة لإظهار مواقع الاتصال بين الأنابيب والشريان الرئوي (السلطة الفلسطينية)، وترك الأذيني (LA) قنية (الازرق الخطوط المتقطعة).
2. إعداد الرئتين الفئران المعزولة
- تخدير الفئران (ذكور الجرذان سبراج داولي؛ 250-300 ز) مع الكيتامين (80-100 ملغ / كلغ) ومع زيلازين (5-10 ملغ / كلغ). بعد التأكد من طائرة الجراحية للتخدير، ووضع الحيوان في موقف ضعيف.
- أداء القصبة الهوائية، إدراج قنية القصبة الهوائية (PE-90) وآمنة مع خياطة الجراحية.
- يبث الهيبارين (100-200 U) في القلب عن طريق ثقب في القلب (21 G فراشة إبرة)، وانتظر لمدة 60 ثانية والدم يستنزف (~ 12-15 مل من الدم).
- إعداد اثنين قنية (أنابيب Tygon، 3 مم، 4 سم طويلة؛ اندلعت في نهاية واحدة) وملء مع المياه المالحة.
- إجراء بضع الصدر. إجراء شق (3 ملم) على البطين الأيمن وحرك نهاية اندلعت من قنية في شق نحو الرئويالشريان. تأمين قنية إلى الشريان الرئوي مع الغرز الجراحية.
- شق (3 ملم) قمة البطين الأيسر وحرك نهاية اندلعت من قنية الثاني في شق. توجيه قنية في الأذين الأيسر. تأمين قنية إلى البطين الأيسر مع الشريط السري (2 ملم العرض).
- تشريح أي النسيج الضام، وإزالة الرئة والقلب معا مع قنية المرفقة. وضع الرئة والقلب على طبق بتري. إعادة الرئة بحيث سطح حجابي هو على القمة. ينبغي للقنية ثلاثة تواجه نفس الاتجاه.
- وضع إعداد الرئة على المرحلة التي يمكن التلاعب في الاتجاهات XY. أي المرحلة التي تأتي مع المجهر يمكن تعديلها لعقد أنابيب أو مرحلة حسب الطلب بني، إذا لزم الأمر.
3. الإرواء الدم من الرئتين الفئران المعزولة
- مزج الدم exsanguinated مع الزلال حجم مساو (5٪) حل وإضافة إلى الخزان. بدء ضخ تحوي وضبط تدفق صيأكلون إلى 14 مل / دقيقة. تسمح الدم لملء الأنابيب.
- مع تحويلة المفتوحة، وإزالة الرئة موصل مدخل-منفذ مؤقت. نعلق الشريان الرئوي وقنية الأذين الأيسر إلى مدخل ومخرج الرئة، على التوالي. ضمان عدم وجود فقاعات الهواء في الأنبوب.
- الاتصال قنية القصبة الهوائية إلى الضغط على المفاتيح الثالثة (P23XL). تضخيم الرئتين مع 30٪ الأكسجين عبر قنية القصبة الهوائية والحفاظ على الضغط في 5 سم H 2 O.
- إغلاق التحويلة مع المشبك لبدء نضح الرئة. الحفاظ على الشريان الرئوي والضغوط الأذيني الأيسر في ~ 10 و 3 سم H 2 O على التوالي.
4. إعداد الرئة لتسريب الاوعية الدموية الدقيقة
- رفع نهاية الجزء الخلفي من أنابيب التمديد للالقسطرة فوق مستوى الرئة وآمنة.
- إعداد القسطرة التسريب عن طريق إدخال حوالي 30 سم من أنابيب PE10 40 سنتيمترا في أنابيب PE90 ~ 30 سنتيمترا. ربط نهاية المكشوفة من أنابيب PE10 لإبرة (30 G) فيtached إلى حقنة (1 سم مكعب).
- إدراج مزيج قسطرة في مؤخرة أثار من أنابيب تمديد. توجيه القسطرة من خلال الجمع بين الأذين الأيسر وإلى الرئة حتى يلتقي المقاومة. ثم، ودفع القسطرة PE10 وحدها الى مزيد من الرئة حتى يلتقي المقاومة. لاحظ أن استخدام القوة المفرطة أثناء إدخال القسطرة سوف تجرح الرئة.
- ملء حقنة 1 سم مكعب مع الحل رينغر ونعلق على ضخ حقنة. تعيين معدل التسريب إلى 10 ميكرولتر / دقيقة.
- وسوف موقع التسريب تصبح شاحبة بالمقارنة مع بقية الرئة.
- بلل الرئة مع المياه المالحة وتغطية الرئة مع التفاف البلاستيك مع وجود ثقب كبير بما فيه الكفاية لمغادرة الموقع التسريب كشف.
- المسحة بعض الشحوم محبس على الجزء السفلي من الدائري O (حسب الطلب) ووضع ساترة الزجاج (# 1.5، 22 مم) على الجزء السفلي من يا الدائري. وضع بلطف يا الدائري مع ساترة على موقع التسريب. تأمين يا الدائري مع معيار اختبار أنبوب الحولدير. لا ساترة / مزيج يا الدائري لا تشوه هياكل السنخية تحته، كما ذكرت مؤخرا 15.
- ضع هدفا (20X) من المجهر مضان فوق يا الدائري والتركيز على سطح الرئة.
5. التصوير الفلورسنت ديكستران العبور من خلال Microvessels
- إعداد المجهر للFITC التصوير الإزهار.
- تحديد المنطقة المراد تصويرها والحصول على صور بمعدل 1/minute باستخدام برنامج الحصول على الصور.
- بدء ضخ FITC-ديكستران 20 دينار كويتي (0.5 ملغ / مل) باستخدام مضخة الحقنة. سوف مضان في الأوعية الدموية وتزيد تدريجيا الوصول إلى الحد الأقصى. مواصلة ضخ لمدة 60 دقيقة.
- ثم التبديل إلى ضخ رينغر ليغسل مضان اللمعية. الحفاظ على التسريب لأكثر من 10 دقيقة. مواصلة الحصول على الصور في 1/min أثناء غسل حالا.
6. تحليل الصور
- فتح ملف الحصول على الصور.
- المناطق مكانمن الفوائد على microvessels في إطار الصورة.
- تشغيل ملف صورة الإطار حسب الإطار وتسجيل كثافة مضان في كل منطقة من الفائدة لجميع الأطر.
- مؤامرة تغير في كثافة مضان لكل منطقة من الفائدة بوصفها وظيفة من الوقت.
- تحديد الحد الأقصى للكثافة مضان وكثافة مضان المتبقية بعد 10 دقيقة من washoff.
- حساب نسبة الحد الأقصى لكثافة مضان المتبقية في كل منطقة من الفائدة للحصول على مؤشر نفاذية لmicrovessels المرتبطة تلك المنطقة من الفائدة.
النتائج
ويرد على إعداد الرئة perfused معزولة الدم متصلا أنابيب التروية والمعدات ذات الصلة في الشكل 2. لأغراض العرض التوضيحي، استخدمنا الفئران سبراغ داولي، على الرغم من الإجراءات الموضحة في هذه الوثيقة يمكن استخدامها مع أي نوع الفئران. دفعات خلال microcatheter الأذين الأيسر ت...
Discussion
ومعزولة إعداد الرئة perfused الدم إلى جانب التصوير في الوقت الحقيقي يوفر أداة بسيطة لتحديد التغيرات في نفاذية microvessels رئة واحدة. طبقنا هذا الأسلوب لتحديد التغييرات نفاذية ردا على دفعات من LPS. وتشير البيانات المتوفرة لدينا بشكل واضح أن LPS ضخ تسبب زيادة في نفاذية الاوعية ال?...
Disclosures
والكتاب ليس لديهم ما يكشف.
Acknowledgements
وقد أيدت الدراسات التي NIH HL75503 لKP.
Materials
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
References
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved