Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İzole Kan-perfüze Sıçan Akciğer Hazırlık Tek Mikrodamar Geçirgenliği miktarının
Bu Makalede
Özet
İzole edilmiş perfüze akciğer kan hazırlama akciğer yüzeyindeki mikro damar ağları görselleştirmek için bu mümkün kılar. Burada, gerçek zamanlı flüoresan görüntüleme kullanılarak izole edilmiş akciğerlerde bir mikro damarların geçirgenliğini ölçmek için bir yaklaşımı tarif eder.
Özet
İzole edilmiş perfüze akciğer kan hazırlama yaygın görselleştirmek ve tek Mikro damarların içinde sinyal tanımlamak için kullanılır. Gerçek zamanlı görüntüleme ile bu hazırlık birleştirilmesi suretiyle, bireysel akciğer kılcal geçirgenlik değişiklikleri belirlemek için mümkün olur. Bu yazıda sıçan akciğerlerini yalıtmak ve otolog kan ile bunları serpmek için gereken adımları açıklar. Sonra, küçük bir akciğer bölgeye mikrokateter yoluyla florosforlar veya ajanlar demlenmeye adımları özetlemektedir. Bu tarif edilen prosedürler kullanılarak, bakteriyel lipopolisakkarid infüzyon tepki olarak sıçan akciğer kılcal geçirgenlik artışı tespit edilmiştir. Veri Lipopolisakkarit hem venüler ve kapiller mikrovasküler kesimleri arasında sıvı sızıntısı arttığını ortaya koydu. Bu yüzden, bu yöntem, bu mümkün damar kesimleri arasında geçirgenlik cevapları karşılaştırmak ve böylece, yanıt olarak bir heterojen tanımlamak için yapar. Akciğer geçirgenliğini tanımlamak için yaygın olarak kullanılan yöntemler akciğer doku örneklerinin postprocessing gerektiren ikengerçek zamanlı görüntüleme kullanımı, bu yöntem belirgin olarak, bu gereği ortadan kaldırır. Böylece, gerçek zamanlı görüntüleme ile birlikte izole akciğer hazırlık akciğer mikrovasküler geçirgenliği belirlemek için geleneksel yöntemler üzerinde çeşitli avantajlar sunuyor, henüz geliştirmek ve uygulamak için basit bir yöntemdir.
Giriş
Akciğerlerde artmış mikrovasküler geçirgenlik alveolar ödem ve bozulmuş gaz değişimi gelişimine yol açar ve akut akciğer hasarı (ALI) 1-3 önemli bir özelliğidir. Bu nedenle, vasküler geçirgenliğin tahminleri akciğer yaralanması ve önerilen terapötik müdahalelerin etkinlik derecesinin belirlenmesinde önemlidir. Bu tür kan serbest akciğer ıslak-kuru oranı ve mikrovasküler filtrasyon katsayısı olarak Gravimetrik analiz yaygın geçirgenliği, 4,5 tahmin yöntemleri kullanılır. Diğer yöntemler, akciğer dokusu, 6-8, radyoaktif ya da floresan probları miktarının tutulmasını içerir. Bununla birlikte, yukarıdaki yöntem geçirgenliği verileri açıklık doğru Akciğer doku örneklerinin postexperiment işlem gerektirir. Bir hayvan, tek bir tedavi protokolü sadece kullanılabilir Dahası, büyük hayvan sayısı tam bir çalışma için gerekli olabilir. Yukarıdaki yöntemlerin ortak bir özelliği, için ortalama damar geçirgenliğini belirler olmasıdırdoku numunesi içindeki tüm kan damarları. Ancak, iyi pulmoner mikro ve makro-gemiler 9 fenotipik farklı olduğu kurulmuştur. Bu nedenle, geçirgenlik yanıtları hem de 9,10 çeşitli damar kesimleri arasında heterojen olabilir. Böylece, bir doku örneğinin tüm pulmoner damarların geçirgenliği ortalama miktarının yeterince bu heterojenliğini yansıtmayabilir.
İzole kan perfüze akciğer hazırlık, akciğer yüzeyinde kan damarları dik bir mikroskop 4,11,12 tarafından görüntülenmiştir olabilir. Bu tepkiler 13 herhangi bir heterojen ele böylece tek damarlarda karakterize yanıtları etkinleştirir. Buna ek olarak, mikrokapların flüoresan görüntüleme kullanılarak, floresans bazlı deneyler dahil edilebilir. Bundan başka, bir sol atriyum mikrokateter kan damarlarının 11,14 içine maddeleri ve floresan probları sunmak için de kullanılabilir. Mikrokateter küçük bir akciğer bölgeye teslim sınırlar, böylece eskiinfüzyon maddeler ve florofor için bölge içinde sadece kan damarları poz. Bu, aynı akciğer içinde birden fazla küçük bölgeler, çalışma için gerekli hayvan genel bir azalmaya yol açan, ayrı deneyler için kullanılmasına olanak verir.
Gerçek zamanlı görüntüleme vasküler ve izole akciğer hazırlanması tek mikrodamarlar ekstravasküler floresan dinamik değişiklik yakalama sağlar. Bu nedenle, bir görüntü alanı içindeki her mikrodamar için, florofor ve yıkanmasına enfüzyonu esnasında floresanstaki değişimler kaydedilmiştir ve çevrimdışı 14 belirlenebilir. Maksimum ve kalıntı damar floresans değerleri kullanarak, görüntüleme alanı içinde her mikrodamar için bir geçirgenlik dizin belirlenebilir. Iltihaplı ya da zararlı ajanlara yanıt olarak geçirgenlik değişikliklerini belirlemek için, arzu edilen ajan ilk tatbik edilebilir ve daha sonra geçirgenliği indeksi belirlenir. Buna ek olarak, görüntü alanı ile aşılanmış akciğer bölgesi içinde herhangi bir değere ayarlanabilirmikrokateter, böylece istenen damar ağı seçiminde esneklik yüksek derecede olanak tanır. Dolayısıyla, gerçek zamanlı görüntüleme ile birlikte izole edilmiş kan perfüze akciğer preparat tek akciğer Mikro damarların içinde geçirgenliği ölçmek için çekici bir deneysel model sağlar.
Protokol
Tennessee Sağlık Bilimleri Merkezi Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Kurulu tarafından onaylanmış hayvanlar üzerinde gerçekleştirilen tüm deneyler vardı.
Perfüze Rat Akciğer Hazırlıkları 1. Boru
- Şekil 1 'de gösterildiği gibi, basınç dönüştürücüleri (P23XL) takın. Kan akışı için Tygon boru (# 18) ile bir boru sistemi hazırlamak ve mikroskop sahnede boru yerleştirin.
- 37 ° C su banyosu sıcaklığını ayarlama
- Akciğer girişini bağlayın ve Tygon boru ile geçici çıkış.
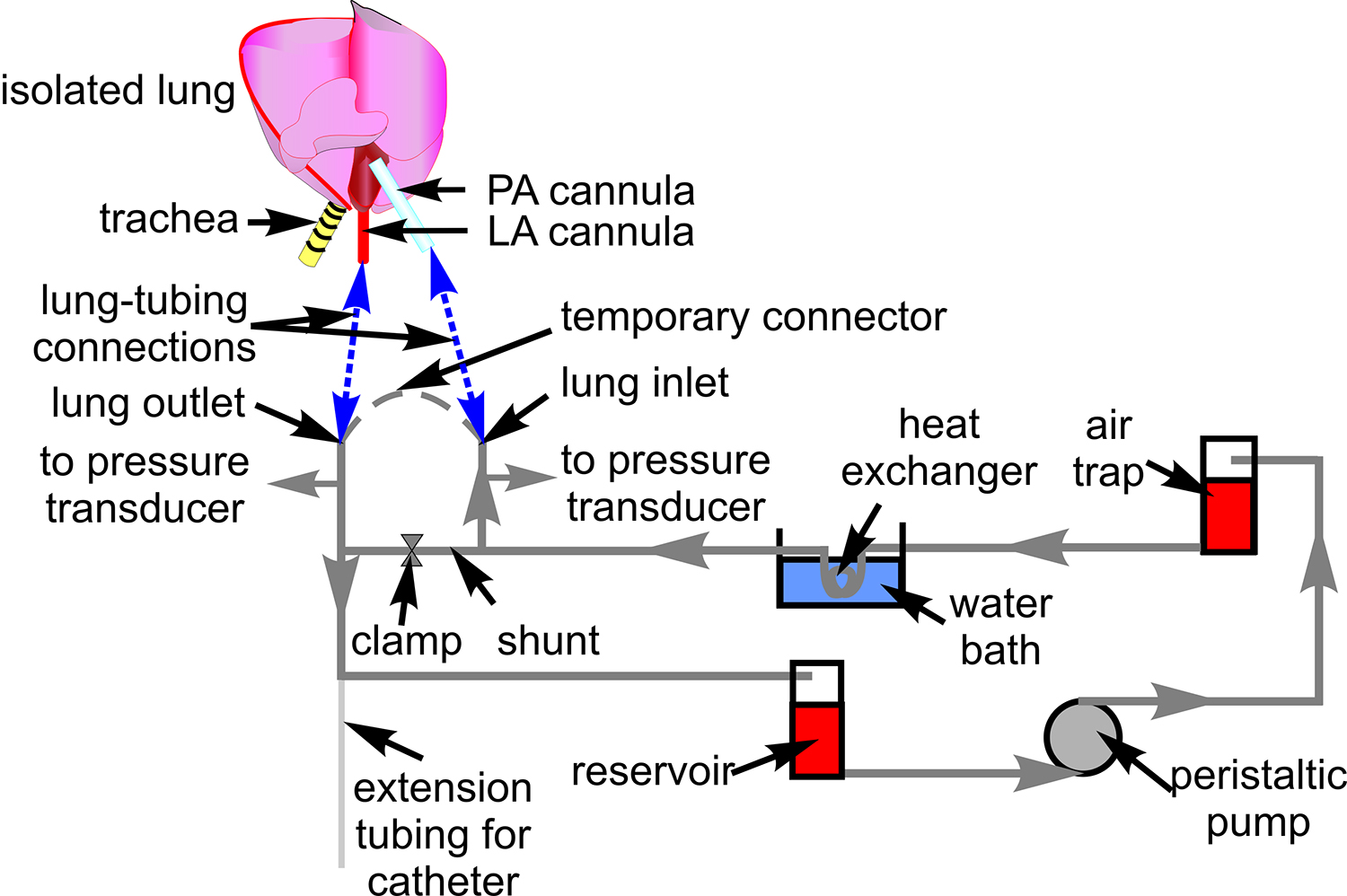
Şekil 1.. Kan perfüzyon hortum. Şematik izole akciğer hazırlık aracılığıyla kan sirkülasyonu için kullanılan boru kurulumunu göstermektedir. Ayrıca, ilişkili bileşenleri gösterilen, üzerinden boru is yönlendirilir. Kalp ve akciğer şematik boru ve pulmoner arter (PA) arasındaki bağlantı siteleri göstermek için dahil, ve atriyal (LA) kanül (mavi kesik çizgiler) bırakılır.
İzole Sıçan Akciğerler 2. Hazırlanması
- Ketamin (80-100 mg / kg) ve ksilazin (5-10 mg / kg) ile, sıçanlar (250-300 gr ağırlığında erkek Sprague-Davvley fareleri) anestezisi. Anestezi cerrahi bir uçak ettikten sonra, bir yatar pozisyonda hayvan.
- Trakeostomi gerçekleştirin, bir trakeal kanül (PE-90) takın ve cerrahi sütür ile sabitleyin.
- Kardiyak ponksiyon (21 G kelebek iğne) ile kalp içine heparin (100-200 U) demlendikten, 60 saniye ve asıl bulbus olfaktoryusları alındı kan (~ 12-15 ml kan) için bekleyin.
- İki kanüller (, 4 cm uzunluğunda, Tygon boru donanımı, 3 mm çap, bir ucunda genişleyen) hazırlamak ve tuzlu su ile doldurun.
- Bir torakotomi gerçekleştirin. Sağ ventrikül üzerinde bir kesik (3 mm) yapın ve pulmoner doğru kesi bir kanül geniş uç slaytarter. Cerrahi sütür ile pulmoner arter kanül güvenli.
- Sol ventrikül tepe (3 mm) ve İnsizyon kesi içine ikinci kanül geniş uç kaydırın. Sol atrium içine kanül yönlendirin. Göbek bandı (2 mm genişlik) ile sol ventrikül kanül güvenli.
- Herhangi bir bağ dokusu disseke ve ekli kanüller ile birlikte akciğer ve kalp kaldırmak. Bir petri üzerinde akciğer ve kalp yerleştirin. Diyafragma yüzey üstüne böylece akciğeri yerleştirin. Üç kanüller aynı yöne bakmalıdır.
- XY yönde manipüle edilebilir bir sahnede akciğer hazırlık yerleştirin. Bir mikroskop ile birlikte herhangi bir aşamada tüp veya gerekirse, yerleşik bir ısmarlama sahne tutmak için modifiye edilebilir.
İzole Sıçan Akciğerler 3. Kan Perfüzyon
- Eşit hacimde albumin (% 5) çözeltisi ile kandan arındırıldı kan karıştırın ve hazneye ekleyin. Peristaltik pompayı akış r'yi14 ml / dk 'ya yedi. Kan tüpünü doldurmak için izin.
- Şant açıkken, geçici akciğer giriş-çıkış fişini çekin. Sırasıyla, akciğer giriş ve çıkışına pulmoner arter ve sol atriyal kanül takın. Boru içinde hiçbir hava kabarcığı olmadığından emin olun.
- Üçüncü bir basınç transdüktörü (P23XL) için trakeal kanül bağlayın. Trakeal kanül yoluyla% 30 oksijen ile akciğerlerini şişirmek ve 5 cm H2O basıncı korumak
- Akciğer perfüzyon başlamak için bir kelepçe ile şant kapatın. Pulmoner arter ve sırasıyla 10 ve 3 cm H 2 O ~ at sol atriyal basıncı koruyun.
4. Mikrovasküler İnfüzyonluk Akciğer hazırlanıyor
- Akciğer ve güvenli seviyesinden kateter için ek boru arka ucunu yukarı kaldırın.
- A ~ 30 cm uzunluğunda PE90 boru içine 40 cm uzunluğunda PE10 boru, yaklaşık 30 cm sokulmasıyla bir enfüzyon kateterini hazırlayın. Bir iğne (30 g) at PE10 boru açıkta kalan ucunubir şırınga (1 cc) iliştirili.
- Uzatma tüpünün yükseltilmiş arka ucuna kateter kombinasyonu yerleştirin. Dirençle karşılaşana kadar sol atrium ve akciğer içine kateter kombinasyonu yönlendirin. Dirençle karşılaşana kadar sonra, akciğer içine daha fazla yalnız PE10 kateter itin. Kateterin yerleştirilmesi sırasında aşırı kuvvet uygulayarak akciğer zarar unutmayın.
- Ringer solüsyonu ile 1 cc şırınga doldurun ve bir şırınga pompasına ekleyin. 10 ul / dk infüzyon hızını ayarlayın.
- İnfüzyon yeri akciğer kalanına kıyasla soluk olacak.
- Tuzlu su ile ıslatın ve akciğer ortaya infüzyon siteyi terk yeterince büyük bir delik ile plastik wrap ile akciğer kapağı.
- Bir O-ring (ısmarlama) altındaki bir musluk yağ çubukla ve O-ring altında bir cam lamel (# 1.5, 22 mm çap) yerleştirin. Yavaşça infüzyon sitede lamel ile O-halkasını yerleştirin. Standart tüp hol ile O-halkasını Güvenlider. Son zamanlarda 15 rapor lamel / O-ring kombinasyonu, bunun altında alveol yapılarını bozmaz.
- O-halkası üzerinde bir floresan mikroskop bir objektif (20 X) yerleştirin ve akciğer yüzey üzerinde odaklanır.
Mikrodamarlar sayesinde 5.. Görüntüleme Floresan Dekstran Transit
- Görüntüleme FITC çiçeklenme için mikroskop hazırlayın.
- Yansıması için bir bölge seçin ve görüntü alma yazılımı kullanarak 1/minute hızında görüntü kazanır.
- Şırınga pompası kullanılarak FITC-dekstran 20 kD (0.5 mg / ml) infüzyonu başlayın. Kan damarlarında floresan giderek artırmak ve maksimum ulaşacaktır. 60 dakika boyunca infüzyon devam edin.
- Sonra lümen floresan yıkayın Ringer infüzyon geçmek. Üzerinde 10 dakika süreyle infüzyon koruyun. Yıkama-off sırasında 1/dk 'da görüntü alımı devam ediyor.
6.. Görüntü Analizi
- Görüntü elde etme dosyasını açın.
- Yeri bölgelergörüntü karesi içinde mikrodamarlar fazla ilgi.
- Görüntü dosyasını kare-kare oynamak ve tüm çerçeveler için ilgi her bölgede en floresan yoğunluğu kaydedin.
- Zamanın bir fonksiyonu olarak her bir ilgi bölgesi için floresan yoğunluğundaki değişim çizilir.
- Maksimum floresan yoğunluğu ve yıkanmasına 10 dakika sonra, artık floresan yoğunluğunu ölçmek.
- Ilgi bu bölgeyle bir arada kılcal için geçirgenlik endeksi elde etmek için, ilgi konusu her bölgesinde artık floresan yoğunluğu en fazla oranını hesaplar.
Sonuçlar
Perfüzyon tüpünün ve ilgili ekipmana bağlı bir izole edilmiş kan perfüze akciğer hazırlama Şekil 2 'de gösterilmiştir., Burada tarif edilen prosedürlerin herhangi bir fare türleri ile kullanılabilir ancak gösteri amacıyla, biz bir Sprague Dawley sıçan kullanılır. Bir sol atriyum yoluyla mikrokateter Modül akciğerin sadece küçük bir bölge ulaşır. Infüzyon bölge infüzyon kaynaklı renk (Şekil 3) tarafından tespit edilebilir. Gerçek zamanlı görünt...
Tartışmalar
Gerçek zamanlı görüntüleme ile birleştiğinde izole kan perfüze akciğer hazırlık tek akciğer kılcal geçirgenlik değişikliklerin belirlenmesi için basit bir araç sağlar. Bu LPS infüzyon tepki olarak geçirgenlik değişikliklerini belirlemek için bu yöntemi uygulanır. Bizim veri açıkça LPS infüzyon mikrovasküler geçirgenliği bir artışa neden olduğunu göstermektedir. Bundan başka, veriler aynı zamanda LPS ile uyarılan değişiklikler, geçirgenlik ve kılcal venüllerin hem de benzer ol...
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Çalışmalar KP NIH HL75503 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
Referanslar
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır