Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная Single микрососудов проницаемость в изолированном крови-перфузии Rat Подготовка легких
В этой статье
Резюме
Выделенный крови перфузии подготовка легких делает возможным визуализировать микрососудов сетей на поверхности легких. Здесь мы опишем подход к количественной проницаемость отдельных микрососудов в изолированных легких использованием изображений в режиме реального времени флуоресценции.
Аннотация
Выделенный крови перфузии подготовка легких широко используется для визуализации и определения сигналов в одиночных микрососудов. Объединяя этот препарат с изображениями в режиме реального времени, становится возможным определить изменения проницаемости в отдельных легочных микрососудов. Здесь мы опишем шаги, чтобы изолировать легких крыс и заливать их с аутологичной крови. Тогда, мы наметим шаги, чтобы вселить флуорофоры или агентов через микрокатетера в небольшой области легких. Используя эти методики, описанные, мы определили повышение проницаемости микрососудов в легких крыс в ответ на вливаний бактериального липополисахарида. Данные показали, что липополисахарид увеличился утечки жидкости через обе венулярный и капиллярная микрососудов сегментов. Таким образом, этот метод позволяет сравнить ответы проницаемости среди сосудистых сегментов и, таким образом, определить любое гетерогенность в ответе. В то время как часто используемые методы, чтобы определить проницаемость легких требуют постобработки образцов легочной ткани,Использование визуализации в реальном времени это требование исключает Как видно из настоящего способа. Таким образом, изолированные подготовка легких в сочетании с изображениями в реальном времени имеет ряд преимуществ перед традиционными методами для определения легких микрососудов проницаемость, но это простой способ для разработки и реализации.
Введение
Увеличение микрососудов проницаемость в легких приводит к развитию альвеолярного отека и скомпрометированной газообмена и является основной характеристикой острого повреждения легких (ALI) 1-3. Таким образом, оценки проницаемости сосудов играют важную роль в определении степени повреждения легких и эффективности предложенных терапевтических вмешательств. Гравиметрического анализа, таких как кровяное бесплатно легких мокрого на сухой отношение и коэффициента фильтрации микрососудов широко используются методы для оценки проницаемости 4,5. Другие способы включают количественное определение удержание радиоактивных или флуоресцентных зондов в легочной ткани 6-8. Однако, эти методы требуют postexperiment обработку образцов легочной ткани на выяснение данных проницаемости. Кроме того, поскольку одно животное может быть использован только для одного протокола лечения, большое количество животных могут быть необходимы для полного исследования. Общей характеристикой описанных выше способов является то, что они определяют среднюю сосудистую проницаемость длявсе кровеносные сосуды внутри образца ткани. Тем не менее, хорошо известно, что легочные микро-и макро-сосуды фенотипически отличается 9. Таким образом, ответы проницаемости может быть гетерогенным среди различных сегментов сосудов, а 9,10. Таким образом, количественного среднее проницаемость всех легочных сосудов в образце ткани не могут адекватно отражать эту неоднородность.
В изолированной перфузии кровью подготовки легких, кровеносных сосудов на поверхности легких могут быть визуализированы с помощью вертикального микроскопа, 4,11,12. Это позволяет, характеризующие ответы в одиночных судов и, таким образом, решения любых гетерогенность в ответах 13. Кроме того, с использованием флуоресцентной визуализации микрососудов, флуоресцентные анализы на основе могут быть включены. Кроме того, левого предсердия Микрокатетер могут быть использованы для доставки агентов и флуоресценции зондов в кровеносные сосуды 11,14. Микрокатетер ограничивает доставку в небольшой области легких, таким образом, экссоздает только кровеносные сосуды внутри региона к инфузии агентов и флуорофорами. Это позволяет использовать несколько небольших регионов в рамках одной легких, которые будут использоваться для отдельных экспериментов, что привело к общему снижению животных, необходимых для исследования.
Изображений в режиме реального времени позволяет захват динамических изменений в сосудистой и внесосудистой флуоресценции одиночных микрососудов изолированной подготовки легких. Таким образом, для каждого микрососудов в пределах области изображения, изменения флуоресценции во время инфузии флуорофоров и washoff могут быть записаны, и количественно в автономном режиме 14. Использование значений максимальной и остаточной флуоресценцией сосудов, индекс проницаемости для каждого микрососудов в области формирования изображения может быть определена. Для определения изменения проницаемости в ответ на воспалительные или вредных веществ, требуемый агент может быть введен, а затем индекс проницаемости определен. Кроме того, поле изображения может быть установлен в любом месте в пределах области легких учитывающеймикрокатетер, таким образом обеспечивая высокую степень гибкости в выборе нужную сеть сосудов. Таким образом, изолированные крови перфузии подготовка легких в тандеме с изображениями в реальном времени обеспечивает привлекательный экспериментальную модель для количественной проницаемость в единичных микрососудов легких.
протокол
Все эксперименты, проведенные на животных были одобрены Институциональные уходу и использованию животных комитета Университета Теннесси Научного центра здоровья на.
1. Шланги для препаратов перфузии легких крыс
- Подготовьте систему труб с Tygon трубки (# 18) для перфузии крови, как показано на рисунке 1. Подключите датчики давления (P23XL) и поместите трубку на столик микроскопа.
- Установите температуру водяной бане до 37 ° C.
- Подключите вход легких и выходе временно с Tygon трубки.
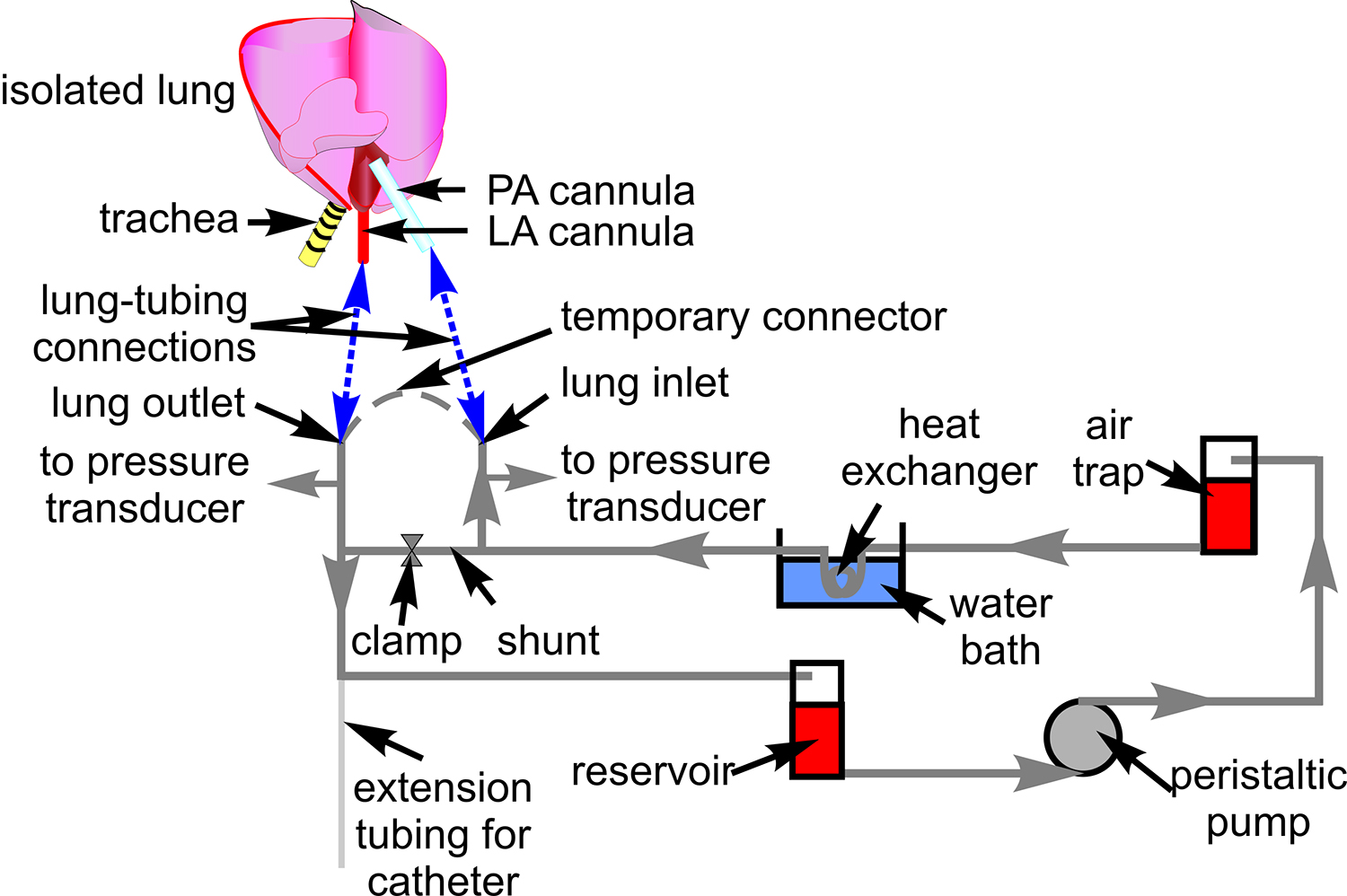
Рисунок 1. Перфузии трубки крови. Схема показывает установку труб используется для циркулирующей крови через изолированном препарате легких. Кроме того, указывается, связаны компоненты, через которые я трубкис разгромлены. Схематическое изображение сердца и легких входит показать сайты связи между НКТ и легочной артерии (ПА), и левого предсердия (LA) канюли (синий пунктир).
2. Подготовка изолированных легких крыс
- Обезболить крыс (самцов крыс Sprague-Dawley; 250-300 г) с кетамином (80-100 мг / кг) и с ксилазином (5-10 мг / кг). Убедившись, хирургическую плоскость анестезии, место животного в лежачем положении.
- Выполните трахеостомию, вставить трахеи канюли (PE-90) и закрепите хирургического шва.
- Настаивать гепарин (100-200 U) в сердце путем сердечной пункции (21 G бабочка иглы), ждать 60 секунд и обескровить крови (~ 12-15 мл крови).
- Приготовьте два канюли (Tygon трубок, диаметр 3 мм; длинные 4 см; расклешенные на одном конце) и залейте раствором.
- Выполните торакотомию. Сделайте надрез (3 мм) на правый желудочек и сдвиньте расширяющийся конец канюли в разрез по направлению к легочнымартерии. Безопасность канюли для легочной артерии с хирургических швов.
- Надрезать (3 мм) вершины левого желудочка и сдвиньте расширяющийся конец второго канюли в разрез. Руководство канюли в левое предсердие. Безопасность канюли для левого желудочка с пупочной ленты (2 мм ширина).
- Проанализируйте любой соединительной ткани, и удалить легкое и сердце вместе с прилагаемыми канюли. Наведите легких и сердце на чашке Петри. Установите на легких, так что диафрагмальная поверхность находится на вершине. Три канюли должны в том же направлении.
- Поместите подготовку легких на сцене, которой можно манипулировать в направлениях XY. Любой этап, который поставляется с микроскопом могут быть изменены, чтобы держать трубку или на заказ этап построен, если это необходимо.
3. Крови перфузии изолированных легких крыс
- Смешайте обескровлены кровь с равным объемом альбумина (5%) раствора и добавить в резервуаре. Запустите перистальтический насос и установить потока гели до 14 мл / мин. Разрешить крови, чтобы заполнить трубопровод.
- С шунт открыт, выньте разъем на входе-выходе временное легких. Прикрепите легочной артерии и левого предсердия канюли к входу легких и выходе, соответственно. Убедитесь, что нет никаких пузырьков воздуха в трубке.
- Подключите трахеи канюли с третьим датчиком давления (P23XL). Накачать легкие с 30% кислорода через трахеи канюли и поддержания давления в 5 см H 2 O.
- Закройте шунт с зажимом, чтобы начать легких перфузии. Поддерживать легочной артерии и левого предсердия давлений при ~ 10 и 3 см Н 2 О соответственно.
4. Подготовка Lung для микрососудистой инфузии
- Поднимите задний конец трубки расширения для выше уровня легких и безопасного катетера.
- Приготовить настой катетер, вставив около 30 см длинной 40 см ПЭ10 трубы в ~ 30 см длинной трубки PE90. Подключите подвергается конец трубки ПЭ10 к игле (30 г) приприсоединенной к шприцу (1 см).
- Вставьте комбинацию катетера в поднятом заднем конце удлинительной трубки. Руководство комбинацию катетера через левое предсердие и в легкие, пока он не встречает сопротивление. Затем нажмите на катетер PE10 одиночку дальше в легких, пока он не встречает сопротивление. Заметим, что применение чрезмерной силы во время установки катетера повредит легких.
- Заполните 1 куб шприц с раствором Рингера и приложить к шприцевой насос. Установить скорость инфузии до 10 мкл / мин.
- Настой сайт станет бледно по сравнению с остальной частью легких.
- Смочите легких физиологическим раствором и покрыть легких полиэтиленовой пленкой с отверстием достаточно большой, чтобы оставить место инфузии непокрытой.
- Тампон некоторое краном жир на нижней части уплотнительного кольца (заказ) и поместите стеклянную покровное (# 1.5, диаметр 22 мм) на дне уплотнительного кольца. Аккуратно поместите уплотнительное кольцо с покровного стекла на месте инфузии. Закрепите уплотнительное кольцо со стандартным пробирки праздникипроизводная Покровное / уплотнительное кольцо сочетание не искажает альвеолярные структуры под ним, как недавно сообщили 15.
- Установите цель (20X) из флуоресцентного микроскопа над уплотнительным кольцом и сосредоточиться на поверхности легких.
5. Изображений Люминесцентная Декстран транзитом через микрососудов
- Подготовьте микроскоп для визуализации FITC цветения.
- Выберите Ваш регион для включения в образ и получать изображения со скоростью 1/minute с помощью программного обеспечения захвата изображений.
- Начать вливание FITC-декстрана 20 кДа (0,5 мг / мл) с помощью шприца. Флуоресценции в кровеносных сосудах будет постепенно увеличиваться и достигнет максимума. Продолжить настой в течение 60 мин.
- Затем переключитесь на вливания Рингера смыть просвета флуоресценции. Поддерживать настой в течение более 10 мин. Продолжить получения изображений при 1/мин во смыва.
6. Анализ изображений
- Откройте файл получения изображений.
- Место регионыпредставляющего интерес, за микрососудов в кадре изображения.
- Играть файл изображения кадр за кадром и записывать интенсивность флуоресценции в каждой области интереса для всех кадров.
- Участок изменение интенсивности флуоресценции для каждой области, представляющей интерес как функции времени.
- Количественно максимальной интенсивности флуоресценции и интенсивность флуоресценции остаточного После 10 мин washoff.
- Рассчитать отношение максимум интенсивности остаточного флуоресценции при каждой интересующей области для получения индекса проницаемости для микрососудов, связанных с этим интересующей области.
Результаты
Изолированная крови перфузии легких препарат подключен к трубопроводу перфузии и соответствующего оборудования показан на рисунке 2. Для демонстрационных целей мы использовали крысу Sprague Dawley, хотя процедуры, описанные здесь, могут быть использованы с любым видам крыс. Настои...
Обсуждение
Выделенный крови перфузии подготовка легких в сочетании с изображениями в режиме реального времени предоставляет простой инструмент для определения изменений проницаемости в отдельных микрососудов легких. Мы применили этот метод для определения изменения проницаемости в ответ на ?...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Исследования были поддержаны NIH HL75503 в КП.
Материалы
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
Ссылки
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены