このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
単離された血液灌流ラットの肺の準備にシングル微小血管透過性を定量化する
要約
孤立した血液灌流肺準備が肺表面上の微小血管ネットワークを可視化することが実現可能になります。ここでは、リアルタイムの蛍光画像を用いて単離された肺における単一微小血管の透過性を定量化するためのアプローチを記載する。
要約
単離された血液灌流肺製剤が広く可視化し、単一の微小血管内シグナリングを定義するために使用される。リアルタイムイメージングにより、この調製物を結合することによって、個々の肺微小血管透過性における変化を決定することが可能となる。ここに我々は、ラットの肺を隔離し、自己血でそれらを灌流する手順について説明します。その後、我々は小さな肺領域にマイクロカテーテルを経由してフルオロフォアまたは薬剤を注入するための手順の概要を説明します。記載され、これらの手順を使用して、我々は、細菌のリポ多糖の注入を受けてラット肺微小血管内の透過性の増加を決定した。データは、リポ多糖の両方細静脈や毛細血管の微小血管セグメントにわたって流体の漏れを増加させたことを明らかにした。したがって、この方法は、血管透過性のセグメント間の応答を比較することが可能となり、従って、応答内の任意の不均一性を規定する。肺の透過性を定義するために一般的に使用される方法は、肺組織サンプルの後処理を必要としながら、リアルタイムイメージングの使用は、本方法から明らかなように、この要件を回避する。このように、リアルタイムで画像化と組み合わせた孤立性肺準備が肺微小血管透過性を決定するために、従来の方法に比べていくつかの利点を提供しています、まだ開発し、実装するための簡単な方法です。
概要
肺における微小血管透過性の増加は、浮腫および肺胞の妥協ガス交換の開発につながり、急性肺損傷(ALI)1-3の主要な特徴である。従って、血管透過性の推定値は、肺損傷および提案された治療的介入の有効性の範囲を定義する上で重要である。このような血中遊離肺のウェット対ドライ比と微小血管ろ過係数として重量分析は、広く浸透性4,5を推定するための方法を使用します。他の方法は、肺組織中の6-8放射性または蛍光プローブの保持を定量することが挙げられる。しかしながら、上記の方法は、透過性データを解明に向けて肺組織サンプルのpostexperiment処理を必要とする。一匹の動物は、単一の治療プロトコルに使用することができるので、大型動物番号は完全な研究のために必要とされ得る。上記の方法の共通の特徴は、彼らが平均血管透過性を決定するということです組織サンプル内の全ての血管。しかし、周知の肺ミクロおよびマクロ血管が表現型的に異なっている9ことが確立されている。このため、透過性の応答は、同様に9,10の様々な血管セグメントの中で異質かもしれません。このように、組織サンプル中のすべての肺血管の平均透過性を定量化することは十分にこの不均一性を反映しない場合があります。
単離された血液灌流肺製剤において、肺表面上の血管が正立顕微鏡4,11,12によって可視化することができる。これは、単一の容器内の応答を特徴づけるため、応答13内の任意の不均一性に対処することができます。また、微小血管の蛍光イメージングを利用して、蛍光ベースのアッセイは、組み込むことができる。また、左心房のマイクロカテーテルは、血管11,14内剤および蛍光プローブを送達するために使用することができる。マイクロカテーテルは、小さな肺領域への配信を制限し、このようにEX注入された薬剤と蛍光団にリージョン内でのみ血管を装った。これは、同じ肺内の複数の小領域は、研究に必要な動物の全体的な減少をもたらす、別々の実験のために使用することができる。
リアルタイムイメージングは、孤立した肺の準備の単一微小血管の血管および血管外蛍光の動的な変更の取得を可能にします。したがって、画像フィールド内の各微小血管のために、フルオロフォアおよびウォッシュオフの注入の間蛍光の変化を記録し、オフライン14を定量することができる。最大残留血管の蛍光値を用いて、撮像視野内の各微小血管の透過性指数を決定することができる。炎症性または有害な薬剤に応じて、透過性の変化を決定するために、所望の薬剤を最初に投与することができ、その後の透過性指数を決定した。また、画像フィールドには、注入によって肺の領域内のどこにでも設定することができるマイクロカテーテル、所望の血管網を選択する際の高度な柔軟性を可能にする。このように、リアルタイムで画像化と並行して孤立した血液灌流肺の準備は、単一の肺の微小血管内の透過性を定量化するための魅力的な実験モデルを提供しています。
プロトコル
テネシー大学健康科学センターの施設内動物管理使用委員会によって承認された動物で行われ、すべての実験であった。
灌流はラット肺の準備のための1。チューブ
- 図1に示すように、圧力変換器(P23XL)を接続します。血液灌流用タイゴンチューブ(#18)と配管システムを準備し、顕微鏡ステージ上にチューブを置きます。
- 37℃の水浴温度を設定する
- 肺の入口および出口はタイゴンチューブを一時的に接続する。
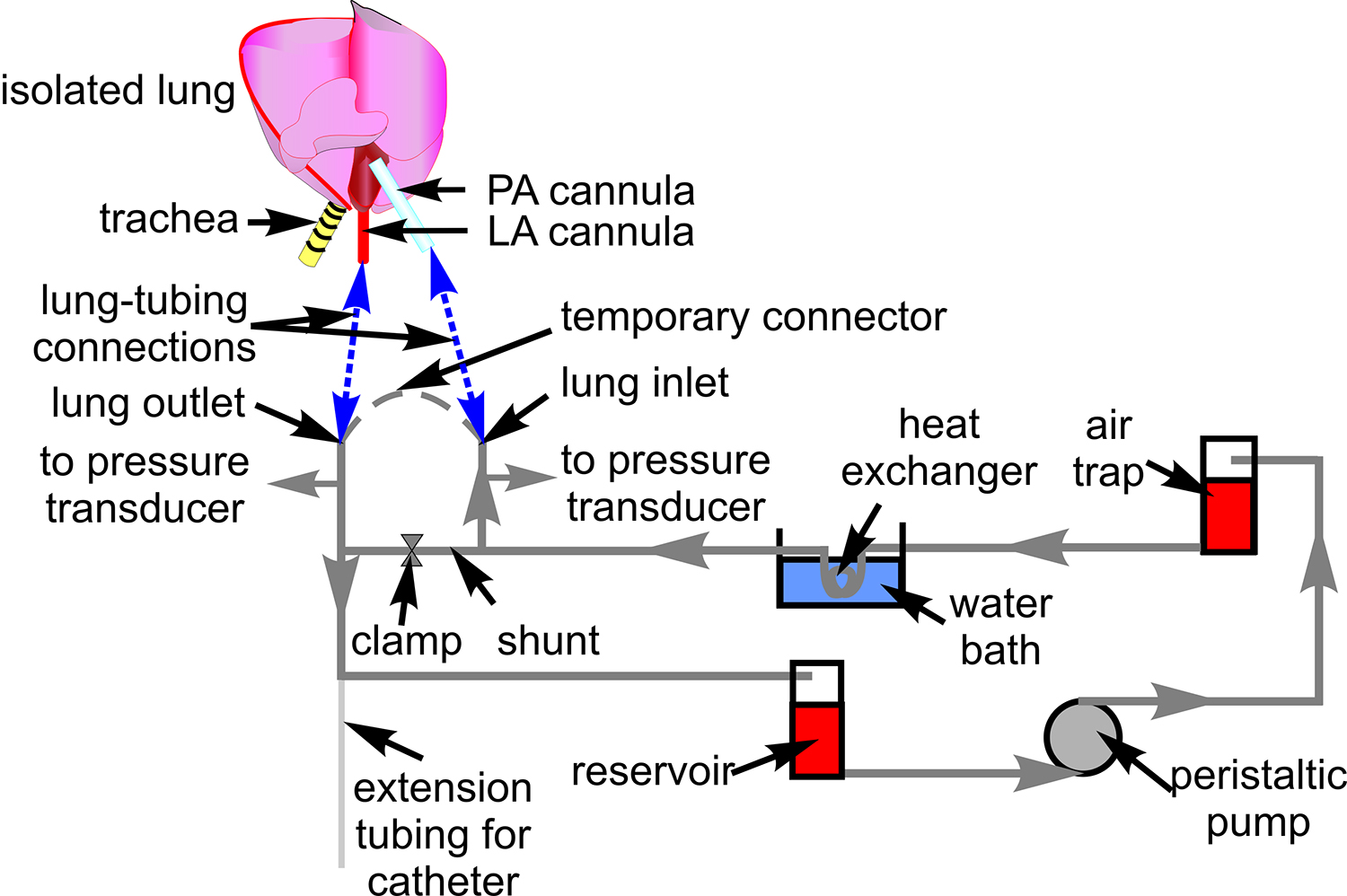
図1。血液灌流チューブ 。回路図は、孤立した肺の準備を通して血液を循環させるために使用される管のセットアップを示しています。また、示されたが、部品を通る配管I関連しているSがルーティングされた。心臓と肺の概略管および肺動脈(PA)、および左心房(LA)、カニューレ(青色破線)との接続部位を示すために含まれている。
ラット摘出肺の2。準備
- ケタミン(80〜100 mg / kg)を持つとキシラジン(5月10日mg / kg)を持つ、ラット(250〜300グラムのオスのSDラット)を麻酔。麻酔の外科的平面性を確保した後、仰臥位で動物を配置します。
- 気管切開を行い、気管カニューレ(PE-90)を挿入し、外科用縫合糸で固定します。
- 心臓穿刺(21のG翼状針)で心にヘパリン(100〜200 U)を注入、60秒、放血させる血液(〜12〜15ミリリットルの血液)を待つ。
- 2カニューレ(;長さ4cm、タイゴンチューブ、直径3mm一端にフレア)を準備し、生理食塩水で満たします。
- 開胸を行います。右心室に切開(3ミリメートル)を作成し、肺に向かって切開部にカニューレのフレア端部をスライドさせ動脈。手術用縫合糸で肺動脈にカニューレを固定します。
- (3ミリメートル)左心室の頂点を切開し、切開部に第二のカニューレのフレア端部をスライドさせます。左心房にカニューレをガイド。臍テープ(2ミリメートル幅)を左心室にカニューレを固定します。
- 任意の結合組織を解剖し、付属のカニューレと一緒に肺と心臓を取り出します。ペトリ皿に、肺や心臓を配置します。横隔膜面が上になるように、肺の位置を変更。 3カニューレは、同じ方向を向くようにします。
- XY方向に操作することができ、ステージ上の肺の準備を置く。顕微鏡に付属しているいずれかの段階では、チューブや、必要に応じて、構築されたカスタムメイドの段階を保持するように変更することができます。
ラット摘出肺の3。血液灌流
- 同体積のアルブミン(5%)溶液を用いて放血血液を混ぜてリザーバに追加します。蠕動ポンプを起動し、フローRを設定14ミリリットル/分に食べました。血液がチューブを埋めることができます。
- シャント開いて、一時的な肺の出入口コネクタを外します。それぞれ、肺の入口と出口に、肺動脈と左心房のカニューレを取り付けます。配管内に気泡がないことを確認してください。
- 第3の圧力トランスデューサー(P23XL)に気管カニューレを接続します。気管カニューレを介して30%の酸素で肺を膨張させ5cmのH 2 Oの圧力を維持する
- 肺灌流を開始するクランプでシャントを閉じます。 〜10で、肺動脈と左心房の圧力を維持し、3センチメートルH 2 Oであった。
4。微小血管注入のための肺の準備
- 肺で安全のレベルを超えてカテーテル用延長チューブの後端を持ち上げます。
- 約30センチPE90チューブに長さ40cmのPE10チューブを約30cmを挿入して注入カテーテルを準備します。針(30 G)のATにPE10チューブの露出端を接続注射器(1 CC)に取り付けられ。
- 延長チューブの隆起後端にカテーテルの組み合わせを挿入します。それは抵抗を受けるまで、左心房を通って肺にカテーテルの組み合わせを導く。それは抵抗を受けるまで、肺の中にさらに単独のPE10カテーテルを押してください。カテーテルを挿入しながら、無理な力を適用することは、肺を傷つけることに注意してください。
- リンゲル液で1ccの注射器を満たし、シリンジポンプに取り付けます。 10μL/分に注入速度を設定します。
- 注入部位は、肺の他の部分に比べて薄いとなります。
- 生理食塩水で肺を湿らし、明らかに注入部位を残すのに十分な大きさの穴をラップで肺をカバーしています。
- Oリング(オーダーメイド)の下にいくつかのストップコックグリースを綿棒&Oリングの底にガラスカバースリップ(#1.5、直径22mm)を配置します。優しく注入部位でのカバーガラスでOリングを配置。標準試験管HOLにOリングを固定しますデア。最近、15を報告したようにカバースリップ/ Oリングの組み合わせは、その下歯槽構造を歪曲していません。
- 位置Oリング、上記蛍光顕微鏡の対物レンズ(20X)および肺表面に焦点を当てる。
微小血管スルー5。イメージング蛍光デキストラントランジット
- FITCの蛍光を画像化するための顕微鏡を準備します。
- 撮像すべき領域を選択し、画像取得ソフトウェアを用いて1/minuteの速度で画像を取得する。
- シリンジポンプを使用してFITC-デキストラン20kDの(0.5 mg / ml)での注入を開始する。血管内の蛍光が徐々に増加し、最大値に達する。 60分間注入を続ける。
- その後、管腔の蛍光を洗い流しリンゲル輸液に切り替える。 10分かけて点滴用を維持する。洗い流し時の限界回転で画像収集を続ける。
6。画像解析
- 画像取得ファイルを開きます。
- 場所領域画像フレーム内の微小血管の上の関心の。
- イメージファイルフレームごとに再生すると、すべてのフレームのための関心の各領域での蛍光強度を記録。
- 時間の関数としての関心領域毎の蛍光強度の変化をプロットする。
- ウォッシュオフの10分後、最大蛍光強度と残留蛍光強度を定量化する。
- 関心のその領域に関連する微小血管の透過性の指標を得るために、関心の各領域での残留蛍光強度を最大の比率を計算します。
結果
灌流チューブおよび関連機器に接続された単離された血液灌流肺製剤が図2に示されている。本明細書に記載された手順は、任意のネズミ種を用いることができるが説明のために、我々は、スプラーグドーリーラットを使用した。左心房マイクロカテーテルを通して注入は、肺のわずかな領域に到達する。注入された領域は注入によって誘発される変色( 図3)によっ...
ディスカッション
リアルタイムイメージングと相まって孤立血液潅流肺標本は、単一の肺の微小血管内の透過性の変化を測定するためのシンプルなツールを提供しています。我々は、LPSの注入に応じて透過性の変化を定義するには、この方法を適用した。我々のデータは明らかに、LPS注入は、微小血管透過性の増加を引き起こしたことを示唆している。また、データも、LPSによって誘導された透過性の変化は?...
開示事項
著者らは、開示することは何もありません。
謝辞
研究は、KPにNIH HL75503によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
参考文献
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved