A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כימות יחיד כלי דם קטנים בחדירות מבודדת-perfused דם עכברוש ריאות הכנה
In This Article
Summary
הכנת ריאות perfused הדם המבודדת עושה את זה אפשרי לדמיין רשתות microvessel על פני הריאות. כאן אנו מתארים גישה לכמת חדירות של microvessels אחת ריאות מבודדות באמצעות דימות פלואורסצנטי זמן אמת.
Abstract
הכנת ריאות perfused דם המבודדת נעשתה שימוש נרחב כדי לחזות ולהגדיר איתות בmicrovessels אחת. על ידי צימוד הכנה זו עם הדמיה בזמן אמת, הוא הופך להיות אפשרי כדי להבחין בשינויים בחדירות microvessels ריאה בודד. במסמך זה אנו מתארים את שלבים לבודד את ריאות עכברוש וינקב אותם עם דם עצמי. לאחר מכן, אנו מתארים את צעדים להחדיר fluorophores או סוכנים באמצעות microcatheter לאזור ריאות קטן. שימוש בהליכים אלה תוארו, קבענו עליות חדירות בmicrovessels ריאות עכברוש בתגובה לחליטות של lipopolysaccharide חיידקים. נתוני המחקר מראה כי lipopolysaccharide מוגבר דליפת נוזל על פני שני מגזרי venular וmicrovessel נימים. לכן, שיטה זו מאפשרת להשוות בין מגזרי תגובות חדירות כלי דם ובכך, מגדיר את ההטרוגניות כל בתגובה. בעוד שיטות נפוצות המשמשות להגדרת חדירות ריאות דורשות postprocessing של דגימות רקמת ריאה,שימוש בהדמיה בזמן אמת מבטלת דרישה זו באה לידי ביטוי החל מהשיטה הנוכחית. לכן, הכנת הריאות המבודדת בשילוב עם הדמיה בזמן אמיתי מציעה מספר יתרונות על פני שיטות מסורתיות לקביעת חדירות כלי הדם ריאה, עדיין היא שיטה פשוטה כדי לפתח וליישם.
Introduction
חדירות כלי הדם מוגברות לריאות מובילה להתפתחות של בצקת מכתשיים וחילוף גזים שנפרצו והוא מאפיין עיקרי של פגיעה חריפה ריאות (עלי) 1-3. לפיכך, הערכות של חדירות כלי דם חשובות בהגדרת היקף פציעת ריאות ויעילות של התערבויות טיפוליות מוצעים. ניתוח gravimetric כגון יחס דם ריאה בחינם רטוב ליבשים ומקדם סינון כלי הדם נמצא בשימוש נרחב בשיטות להעריך 4,5 חדירות. שיטות אחרות כוללות כימותי השמירה של בדיקות רדיואקטיביים או ניאון ברקמת הריאה 6-8. עם זאת, השיטות הנ"ל דורשות עיבוד postexperiment של דגימות רקמת ריאה לכיוון הבהרת נתוני חדירות. יתר על כן, מאחר שבעל חיים אחד יכול לשמש רק לפרוטוקול טיפול יחיד, ייתכן שיהיו צורך מספרי חיה גדולים למחקר מלא. מאפיין משותף של השיטות הנ"ל הוא שהם קובעים את חדירות כלי דם הממוצעת שלכל כלי הדם בדגימת הרקמה. עם זאת, הוא מבוסס היטב כי כלי מאקרו מיקרו וריאה שונים 9 phenotypically. לפיכך, תגובות חדירות עשויות להיות הטרוגנית בין המגזרים השונים, כמו גם כלי 9,10. לפיכך, כימות חדירות ממוצעת של כל כלי ריאתי בדגימת רקמה עשוי שלא משקפת באופן נאות את ההטרוגניות הזאת.
בהכנת ריאות perfused דם המבודדת, ניתן דמיינו כלי דם על פני השטח הריאה על ידי מיקרוסקופ זקוף 4,11,12. זה מאפשר תגובות אפיון בכלי אחד, ולכן, פונה ההטרוגניות כל בתגובות 13. בנוסף לכך, על ידי ניצול דימות פלואורסצנטי של microvessels, ניתן לשלב מבחני הקרינה מבוססת. יתר על כן, microcatheter פרוזדורי שמאל יכול לשמש כדי לספק סוכנים ובדיקות הקרינה לכלי דם 11,14. Microcatheter מגביל את המשלוח לאזור ריאות קטן, ובכך לשעברפוזות רק את כלי דם באזור לסוכנים וfluorophores רוויי. זה מאפשר אזורים קטנים מרובים בתוך אותה הריאה שישמשו לניסויים נפרדים, מה שמוביל לירידה כוללת בבעלים החיים הנחוצים למחקר.
הדמיה בזמן אמת מאפשרת לכידה של שינויים דינמיים בכלי דם וקרינת extravascular של microvessels היחיד של הכנת הריאות המבודדת. לכן, עבור כל דם קטן בתוך שדה תמונה, שינויים בקרינה במהלך העירוי של fluorophores וwashoff יכולים להיות מוקלטים, ולכמת מחובר 14. שימוש בערכים של הקרינה כלי דם המרבית ושייר, ניתן לקבוע מדד חדירות לכל דם קטן בתחום ההדמיה. כדי לקבוע שינויי חדירות בתגובה לסוכנים דלקתיים או פוגעניים, הסוכן הרצוי יכול להינתן ראשון ולאחר מכן מדד החדירות נקבע. בנוסף, שדה התמונה ניתן להגדיר בכל מקום באזור הריאות רווי ידיmicrocatheter, ובכך מאפשר רמה גבוהה של גמישות בבחירת רשת כלי הדם הרצויה. לכן, ההכנה המבודדת-perfused דם הריאה בד בבד עם הדמיה בזמן אמת מספקת מודל ניסיוני אטרקטיבי לכמת חדירות בmicrovessels ריאה אחת.
Protocol
כל הניסויים שבוצעו בבעלי חיים כפי שאושרו על ידי הוועדה המוסדית טיפול בבעלי חיים ושימוש באוניברסיטת טנסי למדעי בריאות במרכז.
1. Tubing תכשירים מרוססים עכברוש ריאות
- הכן את מערכת צינורות עם צינורות Tygon (# 18) לזלוף דם כפי שמוצג באיור 1. חבר מתמרים ללחץ (P23XL) ולמקם את צינורות על הבמה מיקרוסקופ.
- הגדרת טמפרטורת אמבט מים עד 37 ° C.
- חבר את כניסת הריאות ולשקע באופן זמני עם צינור Tygon.
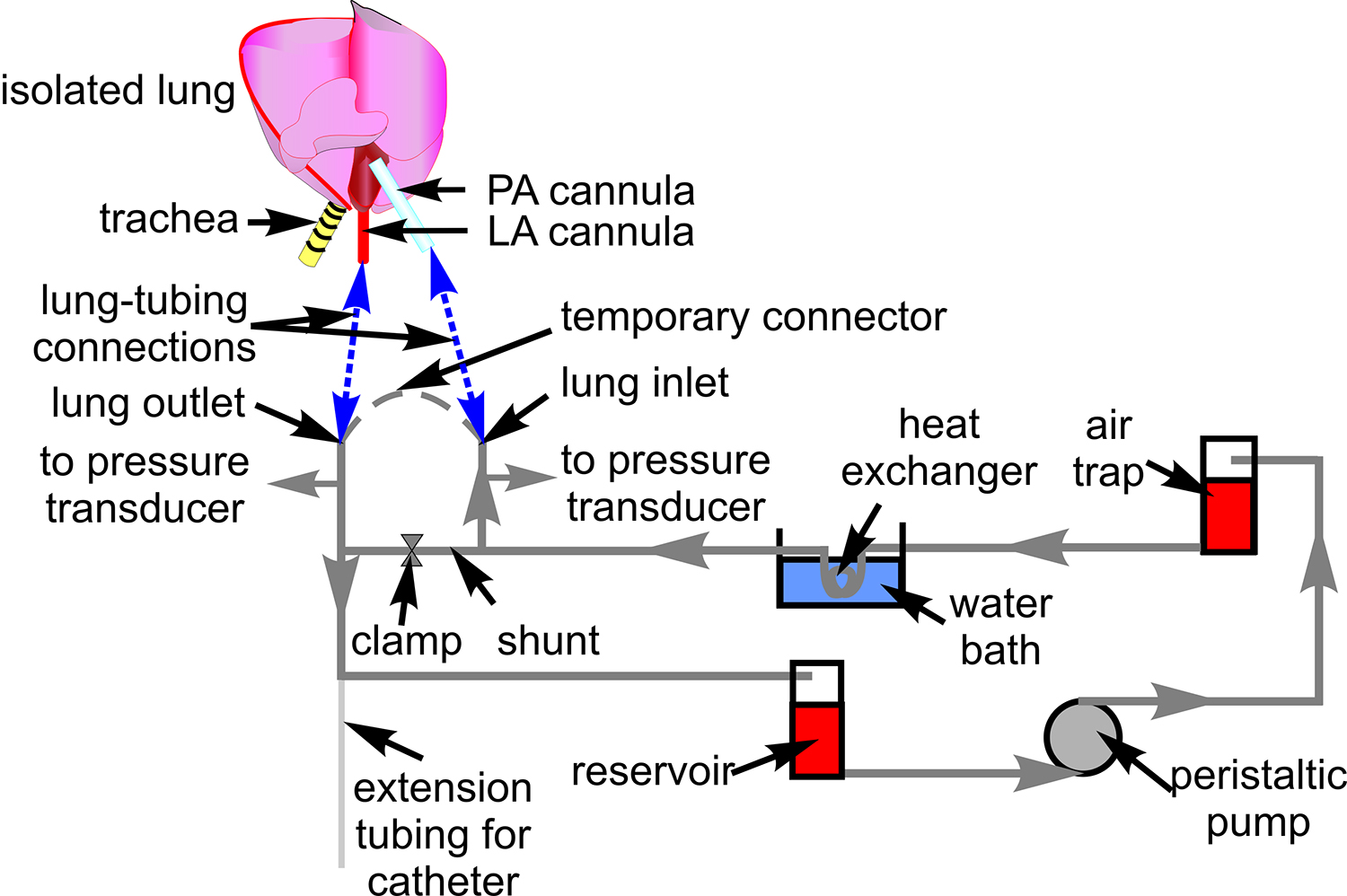
איור 1. צינורות טפטוף דם. סכמטית מציגה את התקנת צינורות המשמשת למחזור הדם דרך הכנת ריאות המבודדת. כמו כן ציינו הם הרכיבים הקשורים שדרכו אני צינורותשל מנותב. סכמטי של הלב והריאות כלול להראות אתרים של חיבור בין צינורות ועורק ריאה (הרשות הפלסטינית), והשאיר את פרוזדורי צינורית (LA) (כחול קווים מקווקווים).
2. הכנת ריאות חולדה מבודדות
- הרדימי חולדות (חולדות זכרים ספראג-Dawley; 250-300 גר ') עם קטמין (80-100 מ"ג / קילוגרם) ועם xylazine (5-10 מ"ג / קילוגרם). לאחר שווידאת מטוס של הרדמה כירורגית, מקום חי במצב שכיבה.
- לבצע ההנשמה, הכנס צינורית לקנה הנשימה (PE-90) ובטוח עם תפר כירורגית.
- להשרות הפרין (100-200 U) ללב על ידי לנקב לב (21 מחט פרפר G), לחכות ל60 שניות ודם לגרום לדימום מחודש (~ 12-15 מיליליטר דם).
- הכן שתי קנולה (צינור Tygon, בקוטר 3 מ"מ; ארוכה 4 סנטימטר; מתרחבת בקצה אחד) ולמלא עם מי מלח.
- לבצע פתיחת בית החזה. עושה חתך (3 מ"מ) בחדר ממני והחלק את הסוף התלקח של צינורית לתוך החתך לכיוון הריאותעורק. Secure צינורית לעורק ריאה עם תפרים כירורגית.
- לחתוך (3 מ"מ) את שיאו של החדר השמאלי והחלק את הקצה התלקח של הצינורית השנייה לתוך החתך. להנחות את הצינורית לתוך אטריום השמאל. Secure צינורית לחדר השמאלי עם קלטת טבור (2 מ"מ רוחב).
- לנתח את כל רקמת חיבור, ולהסיר את הריאות ולב, יחד עם קנולה המצורפת. הנח ריאות ולב בצלחת פטרי. למקם מחדש את הריאות, כך שמשטח סרעפתי הוא על העליונה. שלוש קנולה לצריכה להתמודד לאותו כיוון.
- מניחים את הכנת הריאות בשלב שניתן להשפיע בכיווני XY. כל שלב שמגיע עם מיקרוסקופ יכול להיות שונה כדי להחזיק את צינורות או שלב מחוייט שנבנה, במידת הצורך.
3. זלוף הדם של ריאות חולדה מבודדות
- מערבבים את דם exsanguinated עם אלבומין שווה נפח (5%) פתרון ולהוסיף למאגר. הפעל את משאבת peristaltic ולהגדיר זרימת rאכלתי ל14 מיליליטר / דקה. מאפשר לדם למלא את צינורות.
- עם המחלף פתוח, להסיר את מחבר כניסה-לשקע ריאות הזמנית. צרף את עורק הריאה וצינורית פרוזדורי שמאל לכניסת הריאות ולשקע, בהתאמה. ודא שאין בועות אוויר בצינור.
- חבר את הצינורית לקנה הנשימה למתמר לחץ שלישי (P23XL). לנפח את הריאות בחמצן 30% באמצעות הצינורית לקנה הנשימה ולשמור על לחץ ב5 סנטימטר H 2 O.
- סגור את המחלף עם מהדק להתחיל זלוף ריאות. לשמור על עורק ריאה ולחצי פרוזדורי שמאל ב ~ 10 ו3 ס"מ H 2 O, בהתאמה.
4. הכנת ריאות לכלי דם עירוי
- הרם את חלקו האחורי של צינור הארכה לקטטר מעל לרמה של הריאות ומאובטחות.
- הכן את צנתר עירוי על ידי הוספה כ 30 סנטימטר של צינורות PE10 ארוכים 40 סנטימטר לתוך צינורות PE90 ~ ארוכים 30 סנטימטר. חבר את הקצה החשוף של צינורות PE10 למחט (30 G) בשעהtached למזרק (1 סמ"ק).
- הכנס את שילוב קטטר לתוך חלק אחורי המורם של צינור הארכה. מדריך שילוב הצנתר דרך אטריום השמאל ולתוך הריאות עד שהוא פוגש את ההתנגדות. ואז, לדחוף את הקטטר PE10 לבד יותר לתוך הריאות עד שהוא פוגש את ההתנגדות. שים לב שהפעלת כוח מופרז בעת החדרת הצנתר תפגע הריאות.
- מלא את מזרק 1 סמ"ק עם הפתרון של רינגר ולצרף למשאבת מזרק. הגדרת קצב עירוי ל10 μl / min.
- אתר עירוי יהיה חיוור בהשוואה לשאר הריאה.
- ללחלח את הריאות עם מי מלח ולכסות את הריאות בניילון עם חור גדול מספיק כדי לעזוב את אתר העירוי נחשף.
- ספוגית קצת שומן ברזלים על החלק התחתון של O-Ring (מחוייט) ומקום coverslip זכוכית (# 1.5, 22 קוטר מ"מ) בחלק התחתון של טבעת O-. בעדינות עמדת O-הטבעת עם coverslip באתר העירוי. אבטח את O-הטבעת עם חול מבחנה סטנדרטידר. Coverslip / שילוב טבעת O לא לעוות את מבני מכתשיים מתחתיו, כפי שדיווח לאחרונה 15.
- מקם אובייקטיבי (20X) של מיקרוסקופ פלואורסצנטי מעל O-Ring ולהתמקד על פני הריאות.
5. ההדמיה פלורסנט Dextran מעבר דרך microvessels
- הכן את המיקרוסקופ לתפרחת FITC ההדמיה.
- בחר אזור להיות צילם ולרכוש תמונות בשיעור של 1/minute באמצעות תוכנת רכישת תמונה.
- להתחיל עירוי של 20 KD FITC-dextran (0.5 מ"ג / מיליליטר) באמצעות משאבת המזרק. הקרינה בכלי דם תעלה בהדרגה ולהגיע למקסימום. המשך עירוי ל60 דקות.
- ואז לעבור לעירוי של רינגר כדי לשטוף את הקרינה של אור. לשמור על עירוי במשך 10 דקות. המשך רכישת תמונה ב1/min במהלך לשטוף-off.
6. ניתוח תמונה
- פתח את קובץ תמונת רכישה.
- אזורי מקוםשל ריבית על פני microvessels בתוך מסגרת התמונה.
- נגן את קובץ תמונת מסגרת לפי מסגרת ולהקליט את עוצמת הקרינה בכל אזור של עניין לכל המסגרות.
- מגרש את השינוי בעוצמת הקרינה לכל אזור של עניין כפונקציה של זמן.
- לכמת את עוצמת הקרינה המרבית ואת עוצמת הקרינה שיורית לאחר 10 דקות של washoff.
- לחשב את היחס מרבי לעוצמת הקרינה שיורית בכל אזור של עניין כדי לקבל את מדד החדירות לmicrovessels הקשורים לאזור זה של ריבית.
תוצאות
הכנת ריאות מבודדת-perfused דם המחובר לצינורות טפטוף והציוד נלווה מוצגת באיור 2. למטרות הדגמה, השתמשנו עכברוש ספראג Dawley, אם כי ההליכים המתוארים במסמך זה יכול לשמש עם כל מיני עכברים. חליטות דרך microcatheter פרוזדורי שמאל להגיע לאזור קטן בלבד של הריאות. האזור רווי יכול לה...
Discussion
הכנת הריאות המבודדת-perfused הדם בשילוב עם הדמיה בזמן אמת מספקת כלי פשוט לקביעת שינויים בחדירות microvessels ריאה אחת. אנחנו מוחלים בשיטה זו כדי להגדיר שינויי חדירות בתגובה לחליטות של LPS. הנתונים שלנו מראים בבירור כי עירוי LPS גרם לעלייה בחדירות כלי הדם. יתר על כן, הנתונים גם מצב?...
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
המחקרים שנתמכו על ידי NIH HL75503 לתהליך קימברלי.
Materials
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
References
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved