Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Quantifier simple microvaisseaux perméabilité d'isolement de poumon de rat Préparation du sang perfusé
Dans cet article
Résumé
La préparation des poumons dans le sang perfusé isolé, il est possible de visualiser des réseaux microvasculaires à la surface du poumon. Ici, nous décrivons une méthode pour quantifier la perméabilité des microvaisseaux simples dans les poumons isolés en utilisant l'imagerie de fluorescence en temps réel.
Résumé
La préparation des poumons dans le sang perfusé isolé est largement utilisé pour visualiser et définir la signalisation dans les microvaisseaux simples. Par couplage de cette préparation avec une imagerie en temps réel, il devient possible de déterminer les changements de perméabilité dans les microvaisseaux pulmonaires individuels. Nous décrivons ici les étapes pour isoler les poumons de rats et de les perfuser avec du sang autologue. Ensuite, nous présentons des mesures pour insuffler fluorophores ou des agents via un micro-cathéter dans une petite région du poumon. L'utilisation de ces procédures décrites, nous avons déterminé perméabilité augmente chez le rat microvaisseaux pulmonaires en réponse aux perfusions de lipopolysaccharide bactérien. Les données ont révélé que le lipopolysaccharide augmenté fuite de fluide dans les deux segments de veinules et capillaires microvaisseaux. Ainsi, cette méthode permet de comparer les réponses de la perméabilité entre les segments vasculaires et ainsi, définir une hétérogénéité dans la réponse. Bien que les méthodes couramment utilisées pour définir la perméabilité pulmonaire post-traitement nécessitent des échantillons de tissus du poumon, leutilisation de l'imagerie en temps réel permet d'éviter que cette exigence évidente à partir de la présente méthode. Ainsi, la préparation du poumon isolé combinée avec l'imagerie en temps réel offre plusieurs avantages par rapport aux méthodes traditionnelles pour déterminer microvasculaire pulmonaire perméabilité, mais est une méthode simple à développer et à mettre en œuvre.
Introduction
Augmentation de la perméabilité microvasculaire dans les poumons entraîne l'apparition d'un œdème alvéolaire et l'échange de gaz compromis et est une caractéristique majeure de lésion pulmonaire aiguë (ALI) 1-3. Ainsi, les estimations de la perméabilité vasculaire sont importantes pour définir l'étendue des lésions pulmonaires et l'efficacité des interventions thérapeutiques proposées. Analyse gravimétrique comme le sang poumon libre rapport humide à sec et le coefficient de filtration microvasculaire sont largement utilisés méthodes pour estimer la perméabilité 4,5. D'autres procédés comprennent la quantification de la rétention de sondes radioactives ou fluorescentes dans le tissu du poumon 8.6. Cependant, les procédés ci-dessus nécessitent un traitement postexperiment d'échantillons de tissus pulmonaires vers l'élucidation des données de perméabilité. En outre, depuis un animal peut être utilisé pour un protocole de traitement unique, un grand nombre d'animaux peuvent être nécessaires pour une étude complète. Une caractéristique commune de ces méthodes est qu'elles déterminent la perméabilité vasculaire moyen pourtous les vaisseaux sanguins au sein de l'échantillon de tissu. Toutefois, il est bien établi que les micro-et macro-vaisseaux pulmonaires sont phénotypiquement différentes 9. Par conséquent, les réponses de la perméabilité peuvent être hétérogènes entre les différents segments de vaisseaux ainsi 9,10. Ainsi, la quantification de la perméabilité moyenne de tous les vaisseaux pulmonaires dans un échantillon de tissu peut ne pas refléter adéquatement cette hétérogénéité.
Dans la préparation des poumons dans le sang perfusé isolé, les vaisseaux sanguins à la surface du poumon peuvent être visualisées par un microscope droit 4,11,12. Cela permet réponses caractérisant dans les vaisseaux uniques et donc, aborder toute hétérogénéité dans les réponses 13. En outre, en utilisant l'imagerie de fluorescence des microvaisseaux, à base de fluorescence analyses peuvent être incorporés. De plus, un micro-cathéter auriculaire gauche peut être utilisé pour délivrer des agents et des sondes de fluorescence dans les vaisseaux sanguins 11,14. Microcathéter limite la livraison à une petite région du poumon, ainsi exposant seulement les vaisseaux sanguins dans la région des agents infusées et des fluorophores. Cela permet à plusieurs petites régions d'un même poumon à être utilisés pour des expériences séparées, conduisant à une réduction globale des animaux nécessaires pour une étude.
Imagerie en temps réel permet la capture de l'évolution dynamique vasculaire et fluorescence extravasculaire des microvaisseaux uniques de la préparation du poumon isolé. Ainsi, pour chaque microvaisseaux dans un champ d'image, les changements de fluorescence au cours de la perfusion de fluorophores et lessivage peuvent être enregistrées, et quantifiés en ligne 14. L'utilisation de valeurs de fluorescence maximale et résiduelle vasculaire, un indice de perméabilité pour chaque microvaisseaux dans le domaine de formation d'image peut être déterminé. Pour déterminer les changements de perméabilité en réponse à des agents anti-inflammatoires ou dommageables, l'agent désiré peut être administré en premier, puis l'indice de perméabilité déterminée. En outre, le champ d'image peut être réglée à l'intérieur de la région des poumons infusée par l'microcathéter, ce qui permet un degré élevé de flexibilité dans le choix du réseau vasculaire souhaitée. Ainsi, la préparation du poumon isolé perfusé de sang en tandem avec une imagerie en temps réel fournit un modèle expérimental attrayant pour quantifier la perméabilité dans les microvaisseaux pulmonaires uniques.
Protocole
Toutes les expériences réalisées sur des animaux ont été approuvés par le Comité institutionnel de protection et d'utilisation des animaux de l'Université du Tennessee Health Science Center.
1. Tubes pour les préparations de perfusion Rat poumon
- Préparer un système de tuyauterie avec un tube Tygon (# 18) pour la perfusion de sang comme le montre la Figure 1. Raccorder les capteurs de pression (P23XL) et placer le tube sur la platine du microscope.
- Régler la température du bain d'eau à 37 ° C.
- Connectez l'entrée du poumon et de sortie temporairement Tygon.
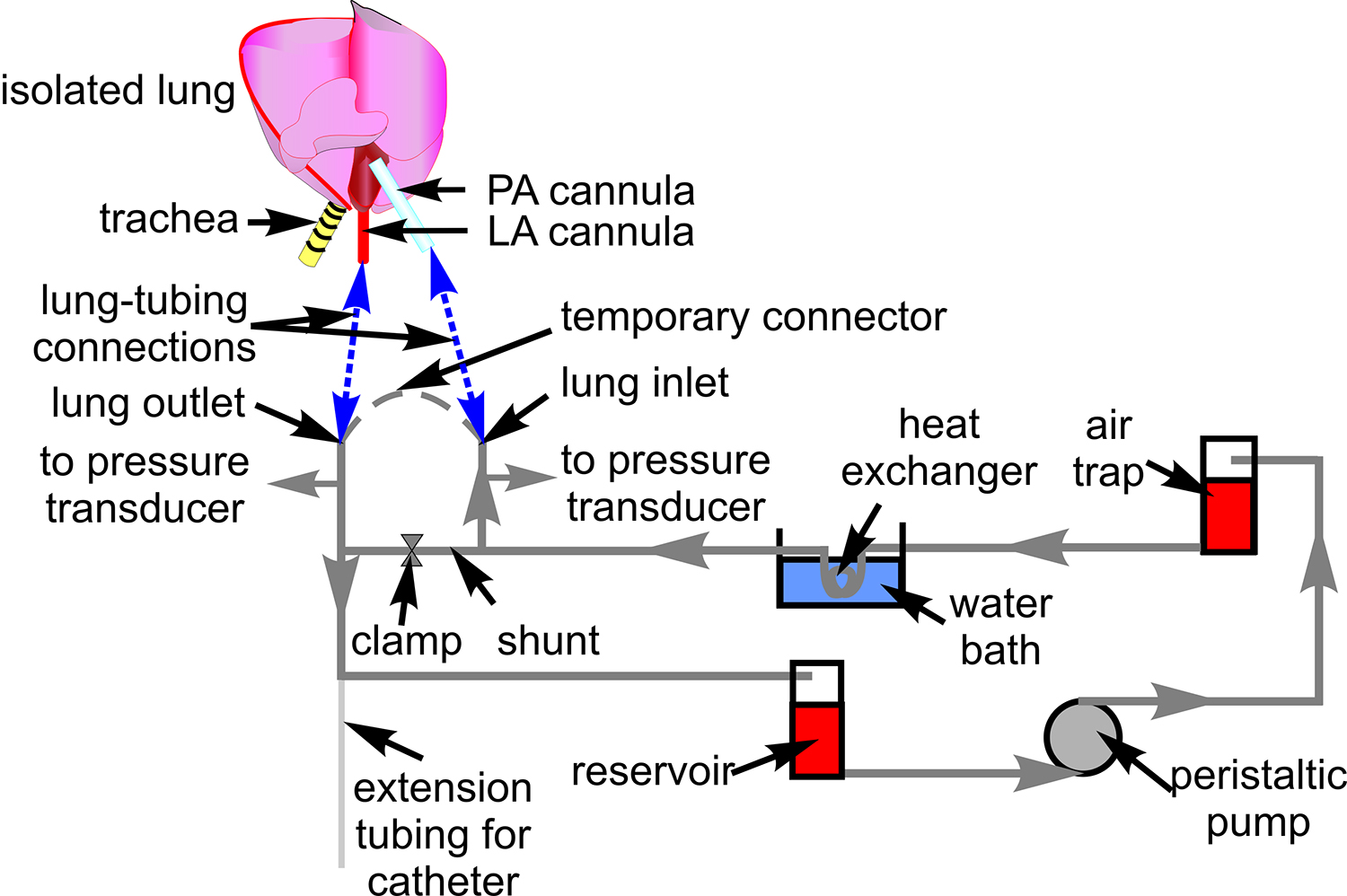
Figure 1. Tubulure de perfusion artérielle. Le schéma montre la configuration du tube utilisé pour faire circuler le sang à travers la préparation du poumon isolé. Également indiqué sont des éléments associés à travers lequel le tube is en déroute. Un schéma du cœur et des poumons est inclus pour montrer les sites de liaison entre le tube et l'artère pulmonaire (AP), et auriculaire (LA) de la canule (pointillés bleus) a quitté.
2. Préparation de poumons de rat isolés
- Anesthésier les rats (rats Sprague-Dawley, 250-300 g) avec de la kétamine (80-100 mg / kg) et avec la xylazine (5-10 mg / kg). Après s'être assuré d'un plan de l'anesthésie chirurgicale, placer l'animal dans une position couchée sur le dos.
- Effectuer une trachéotomie, insérer une canule trachéale (PE-90) et le fixer avec suture chirurgicale.
- Infuser héparine (100-200 U) dans le cœur par ponction cardiaque (21 G de l'aiguille de papillon), attendez 60 secondes et le sang exsanguinate (~ 12-15 ml de sang).
- Préparer deux canules (Tygon, 3 mm de diamètre, 4 cm de long; évasées à une extrémité) et remplir avec une solution saline.
- Effectuez une thoracotomie. Faire une incision (3 mm) sur le ventricule droit et faites glisser l'extrémité évasée d'une canule dans l'incision vers l'pulmonaireartère. Fixez la canule à l'artère pulmonaire avec des sutures chirurgicales.
- Inciser (3 mm) de l'apex du ventricule gauche et faire glisser l'extrémité évasée de la deuxième canule dans l'incision. Guide de la canule dans l'oreillette gauche. Fixer une canule dans le ventricule gauche avec un ruban ombilical (2 mm de large).
- Disséquer tout tissu conjonctif, et retirer le poumon et le cœur avec les canules attachés. Placez poumon et le cœur sur une boîte de Pétri. Repositionner le poumon de sorte que la surface diaphragmatique est sur le dessus. Les trois canules doivent faire face à la même direction.
- Placer la préparation du poumon sur une scène qui peut être manipulé dans les directions XY. Un stade qui est livré avec un microscope peut être modifié pour tenir le tuyau ou un stade construit sur mesure, si nécessaire.
3. Perfusion sanguine des poumons de rats isolés
- Mélanger le sang saigné avec un volume égal de l'albumine (5%) de la solution et d'ajouter au réservoir. Démarrer la pompe péristaltique et régler le débit rmangé à 14 ml / min. Laisser le sang pour remplir le tube.
- Avec le shunt ouvert, retirez le poumon connecteur temporaire entrée-sortie. Fixer l'artère pulmonaire et l'oreillette gauche canule à l'entrée et à la sortie du poumon, respectivement. Assurez-vous qu'il n'y a pas de bulles d'air dans le tube.
- Raccorder la canule trachéale à un troisième transducteur de pression (P23XL). Gonfler les poumons avec 30% d'oxygène par l'intermédiaire de la canule trachéale et maintenir la pression à 5 cm H 2 O.
- Fermez le shunt avec une pince pour commencer la perfusion du poumon. Maintenir l'artère pulmonaire et les pressions auriculaires gauches à ~ 10 cm et 3 respectivement H 2 O.
4. Préparation du poumon pour perfusion microvasculaire
- Soulever l'extrémité arrière du tube de prolongement pour le cathéter au-dessus du niveau du poumon et sûr.
- Préparer un cathéter de perfusion par l'insertion d'environ 30 cm d'un tube de PE10 40 cm de longueur dans un tube de PE90 ~ 30 cm de long. Connectez l'extrémité exposée du tube PE10 à une aiguille (30 G)attaché à une seringue (1 cc).
- Insérer la combinaison de cathéter dans l'extrémité arrière relevée du tube d'extension. Guide de la combinaison de cathéter dans l'oreillette gauche et dans les poumons jusqu'à ce qu'il rencontre une résistance. Ensuite, appuyez sur le cathéter PE10 seul plus loin dans les poumons jusqu'à ce qu'il rencontre une résistance. Notez que l'application d'une force excessive lors de l'insertion du cathéter blesser le poumon.
- Remplir la seringue de 1 ml avec une solution de Ringer et la joindre à une pompe à seringue. Réglez le débit de perfusion de 10 pi / min.
- au site de perfusion deviendra pâle par rapport à reste du poumon.
- Humidifiez le poumon avec une solution saline et couvrir le poumon d'une pellicule de plastique avec un trou assez grand pour quitter le site de perfusion découvert.
- Tamponner un peu de graisse à robinet d'arrêt sur la partie inférieure d'un joint torique (sur mesure), et placer une lamelle couvre-objet en verre (# 1,5, 22 mm de diamètre) sur le fond du joint torique. Positionnez délicatement le joint torique avec la lamelle sur le site de perfusion. Fixez le joint torique avec un hol-éprouvette normeder. Le / combinaison joint torique lamelle ne fausse pas les structures alvéolaires en dessous, comme rapporté récemment 15.
- Positionner un objectif (20X) d'un microscope de fluorescence au-dessus du joint torique et de se concentrer à la surface du poumon.
5. Imagerie fluorescente Dextran transiter microvaisseaux
- Préparer le microscope pour l'imagerie FITC floraison.
- Sélectionnez une région à imager et acquérir des images à la vitesse de 1/minute l'aide du logiciel d'acquisition d'image.
- Commencez perfusion de FITC-dextran 20 kDa (0,5 mg / ml) en utilisant la pompe à seringue. Fluorescence dans les vaisseaux sanguins va progressivement augmenter et atteindre un maximum. Continuer perfusion pendant 60 min.
- Puis passer à la perfusion de Ringer à laver fluorescence luminale. Maintenir la perfusion pendant plus de 10 min. Continuer acquisition d'image à 1/min pendant le lavage-off.
6. Analyse de l'image
- Ouvrez le fichier d'acquisition d'image.
- La place des régionsd'intérêt sur les microvaisseaux dans le cadre de l'image.
- Lire le fichier d'image, image par image et enregistrer l'intensité de fluorescence à chaque région d'intérêt pour tous les cadres.
- Tracer le changement de l'intensité de fluorescence pour chaque région d'intérêt en fonction du temps.
- Quantifier l'intensité de fluorescence maximale et l'intensité de fluorescence résiduelle après 10 min de lessivage.
- Calculer le rapport entre un maximum de l'intensité de fluorescence résiduelle au niveau de chaque région d'intérêt pour obtenir l'indice de perméabilité de microvaisseaux associées à cette région d'intérêt.
Résultats
Une préparation de poumon de sang perfusé isolé relié à la tubulure de perfusion et de l'équipement correspondant est représenté sur la figure 2. Des fins de démonstration, nous avons utilisé un rat Sprague Dawley, bien que les modes opératoires décrits ici peuvent être utilisés avec n'importe quelle espèce de rat. Infusions à travers un microcathéter auriculaire gauche atteignent seulement une petite région du poumon. La région infusé peut être identifié par la coloration ...
Discussion
La préparation du poumon sang perfusé isolé couplé avec l'imagerie en temps réel fournit un outil simple pour la détermination des changements de perméabilité dans les microvaisseaux pulmonaires simples. Nous avons appliqué cette méthode pour définir les changements de perméabilité en réponse aux perfusions de LPS. Nos données indiquent clairement que l'infusion de LPS a provoqué une augmentation de la perméabilité microvasculaire. En outre, les données indiquent également que les modificatio...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les études ont été soutenus par les NIH HL75503 à KP.
matériels
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
Références
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon