需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在离体血液灌注大鼠肺备量化单微血管通透性
摘要
孤立的血液灌注肺的准备,使可视化微血管网络上的肺表面是可行的。在这里,我们描述的方法用实时荧光成像量化单一微血管隔离肺的通透性。
摘要
分离的血液灌注的肺制剂被广泛用于可视化和单微血管定义信令。通过实时成像耦合此制备中,以确定在单个肺微血管通透性的改变成为可能。在这里,我们描述的步骤来隔离大鼠肺组织,并与自体血灌注他们。然后,我们概述的步骤注入通过微导管荧光团或代理人到一个小细胞肺癌区域。使用上述这些程序,我们确定通透性增加大鼠肺微血管针对细菌脂多糖注射。数据显示,脂多糖通过这两个小静脉和毛细血管微血管段增加液体泄漏。因此,该方法使得有可能以比较的血管段中的渗透性的反应,因此,限定在响应中的任何不均匀性。而常用的方法来定义肺通透性要求肺组织样品,进行后处理的使用实时成像消除这一要求作为显而易见的,从目前的方法。因此,隔离肺制剂结合实时成像提供了一些优于传统方法来确定肺微血管的通透性,又是一个简单的方法来制定和实施。
引言
在肺微血管通透性增加导致肺泡水肿和损害气体交换的发展,是急性肺损伤(ALI)1-3的一大特点。因此,血管通透性的估计是在确定肺损伤,并提出治疗措施疗效的程度很重要。重量分析诸如血液中的游离肺湿重与干重比和微血管过滤系数被广泛使用的方法来估算渗透性4,5。其它方法包括定量肺组织6-8中的放射性或荧光探针的保留。然而,上述方法需要肺组织样品的postexperiment加工朝向阐明的渗透率数据。此外,由于一动物只能用于单一治疗方案,大型动物数量,可能需要一个完整的研究。上述方法的一个共同特点是,它们确定平均血管通透性为所有的血管组织样本内。但是,它是公认的肺部微观和宏观血管表型不同9。因此,渗透性反应可能是异构的各种血管段以及9,10之间。因此,定量组织样本中的所有肺血管通透性均可能没有充分反映这种异质性。
在离体血液灌注肺标本,血管对肺表面可以通过一个堂堂正正的显微镜4,11,12可视化。这使得在单个容器的反应特征,因此,解决在应对13任异质性。此外,通过利用微血管的荧光成像,基于荧光测定法可并入。进一步,左心房微导管可被用于运载剂和荧光探针进入血管11,14。微导管限制了传递到小肺部区域,从而前冒充只有区域内的血管的灌注剂和荧光基团。这允许将用于单独的实验相同的肺中的多个小区域,导致所需的研究动物的整体减少。
即时成像能够在血管和微血管单隔离肺准备的荧光血管外动态变化的捕获。因此,对于像场中的每个微血管,输液荧光和冲刷的过程中发生变化的荧光可以被记录,并量化离线14。使用的最大和残余血管荧光值,摄像视场中的每个微血管通透性指数可以被确定。以确定响应于炎性或损害性药物的渗透性的变化,所需的剂可以首先给药,然后通透性指数来确定。此外,该图像字段可以设置为通过注入肺区域内微导管,从而使之在选择所需的血管网的高度灵活性。因此,孤立的血液灌注肺的准备以配合实时成像提供了一个有吸引力的实验模型来量化通透性单肺微血管。
研究方案
对动物进行的所有实验均批准的田纳西大学健康科学中心大学的机构动物护理和使用委员会。
1,油管灌注大鼠肺制剂
- 准备一个管道系统用聚乙烯管(#18),用于血液灌注, 如图1连接的压力传感器(P23XL),并放置在显微镜载物台上的管件。
- 设定水浴温度为37°C。
- 连接肺入口,并与聚乙烯管暂时出口。
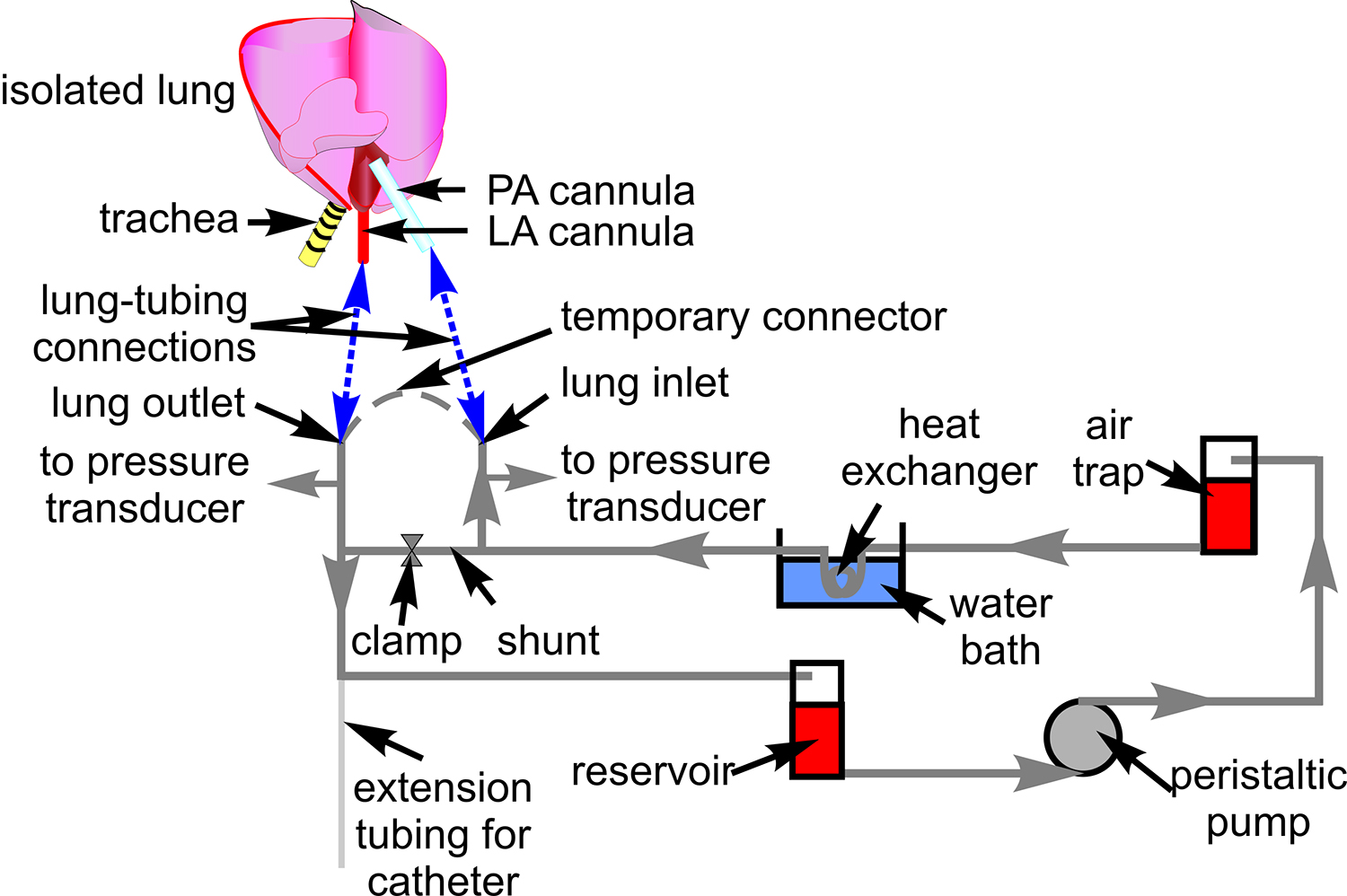
图1。血液灌注管 。该图显示了用于通过隔离肺制剂血液循环管路的设置。也表明是相关联的组件,通过该管子我s路由。心脏和肺的示意图包括显示管和肺动脉(PA)之间的连接部位,和左心房(LA)套管(蓝色虚线)。
2,制备离体大鼠肺
- 麻醉大鼠(雄性Sprague-Dawley大鼠; 250-300克)用氯胺酮(80〜100毫克/千克),并用甲苯噻嗪(5-10毫克/千克)。后确保手术的麻醉平面,将动物仰卧位置。
- 进行气管切开,插入气管插管(PE-90),并与手术缝合固定。
- 通过心脏穿刺(21克蝴蝶针)注入肝素(100-200 U)到心脏,等待60秒,抽血血(〜12-15毫升血)。
- 准备两个套管(聚乙烯管,直径3毫米,4厘米长,扩口的一端),并填充生理盐水。
- 进行开胸手术。做一个切口(3毫米),在右心室和套管的扩口端滑入朝向肺切口动脉。固定套管肺动脉与手术缝合线。
- 切割(3毫米),左心室心尖和第二套管的扩口端滑入切口。引导导管进入左心房。固定插管至左心室与脐带(2毫米宽)。
- 解剖任何结缔组织,并与所连接的插管取出肺和心脏在一起。将肺和心脏的培养皿。重新定位的肺,使膈面在上面。这三个套管应朝向同一方向。
- 放置在能够在XY方向上进行操作的一个阶段的肺制剂。附带显微镜任何阶段都可以进行修改,以保持管件或内置,如果需要一个特制的阶段。
3,血液离体大鼠肺灌注
- 混合放血血用等体积的白蛋白(5%)溶液,并添加到储存器。启动蠕动泵和设置流程R吃了14毫升/分钟。使血液填充管上。
- 与分流开,取出肺临时进出水口接头。附加肺动脉和左心房插管至肺入口和出口,分别。确保没有气泡在管。
- 气管插管连接到第三压力传感器(P23XL)。通过气管插管肺膨胀与30%氧气和压力保持5厘米高2 O。
- 关闭分流钳,开始灌注肺。维持肺动脉和〜分别为10 3厘米H 2 O的左心房压力。
4,准备对肺微血管灌注
- 提高对上面的肺和安全水平的导管延伸管的后端。
- 通过插入一个长40厘米PE10管材成约30厘米长的PE90管长约30厘米准备输液导管。在PE10管的外露端连接到一根针(30克)在上亦有一个注射器(1毫升)。
- 插入导管组合成延伸管的凸起尾部。通过左心房和进入肺引导导管组合,直到遇到阻力。然后,再独自推PE10导管进入肺部,直到它遇到阻力。需要注意的是用力过大,同时插入导管会损害肺。
- 填充1毫升注射器用林格氏溶液和附加到一个注射器泵。设置输液速度以10微升/分钟。
- 相比于肺的其余部分注射部位会变得苍白。
- 润肺用生理盐水,盖上保鲜膜,有孔大到足以离开输液部位发现的肺。
- 棉签上的O形环(定制)的底部部分旋塞润滑脂,并放置在玻璃盖玻片(#1.5,直径为22mm)上的O形环的底部。轻轻地用在输注部位的盖玻片放置O型圈。固定O形环与标准试管方荣景DER。盖玻片/ O型圈组合不变形的肺泡结构,它的下面,如最近报道15。
- 位置上方的O形环的荧光显微镜的物镜(20X),并集中于肺表面。
5,成像荧光葡聚糖过境微血管
- 准备显微镜成像FITC荧光。
- 选择要成像的区域,并利用图像采集软件在1/minute的速率采集图像。
- 使用注射泵开始输注FITC-葡聚糖20 KD(0.5毫克/毫升)的。荧光血管会逐渐增加,达到最大值。继续输注60分钟。
- 然后切换到林格氏输液洗掉管腔荧光。输液维持超过10分钟。在洗涤过的继续图像采集在1/min极限。
6,图像分析
- 打开图像采集文件。
- 地方区域利息在图像帧中的微血管。
- 播放的图像文件的帧接一帧并记录在感兴趣的所有帧的每个区域的荧光强度。
- 绘制荧光强度的变化的利息作为时间的函数的每个区域。
- 量化的最大荧光强度和冲刷10分钟后残留的荧光强度。
- 计算最大值之比,以在每个感兴趣的区域残留的荧光强度,以获得与所关注该区域相关联的微血管的渗透性指数。
结果
分离的血液灌注肺制剂连接到灌注管道和相关设备示于图2。出于演示的目的,我们使用了一个只SD大鼠,虽然本文所描述的程序,可以用任何鼠种使用。通过左心房微导管输注到达肺的一小区域。该注入区域可通过输注引起的变色( 图3)来识别。作为定位于实时成像的肺制剂示于图4。
讨论
孤立的血液灌注肺标本加上实时成像提供了确定在单肺微血管通透性改变一个简单的工具。我们采用该方法来定义响应于LPS输注渗透性的变化。我们的数据清楚地表明,脂多糖注射引起的增加微血管通透性。此外,数据还表明,LPS诱导的通透性的改变是相似的在两个小静脉和毛细血管。因此,这种技术的主要优点是定义单个微血管的泄漏,以及一个全局血管网络的能力。鉴于这种技术也产生全球?...
披露声明
作者什么都没有透露。
致谢
该研究是由美国国立卫生研究院HL75503以KP支持。
材料
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
参考文献
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。